血管免疫芽球性T細胞リンパ腫におけるRHOA遺伝子の変異
坂田 (柳元) 麻実子・榎並輝和・千葉 滋
(筑波大学医学医療系 血液腫瘍学研究室)
email:千葉 滋
DOI: 10.7875/first.author.2014.023
Somatic RHOA mutation in angioimmunoblastic T cell lymphoma.
Mamiko Sakata-Yanagimoto, Terukazu Enami, Kenichi Yoshida, Yuichi Shiraishi, Ryohei Ishii, Yasuyuki Miyake, Hideharu Muto, Naoko Tsuyama, Aiko Sato-Otsubo, Yusuke Okuno, Seiji Sakata, Yuhei Kamada, Rie Nakamoto-Matsubara, Nguyen Bich Tran, Koji Izutsu, Yusuke Sato, Yasunori Ohta, Junichi Furuta, Seiichi Shimizu, Takuya Komeno, Yuji Sato, Takayoshi Ito, Masayuki Noguchi, Emiko Noguchi, Masashi Sanada, Kenichi Chiba, Hiroko Tanaka, Kazumi Suzukawa, Toru Nanmoku, Yuichi Hasegawa, Osamu Nureki, Satoru Miyano, Naoya Nakamura, Kengo Takeuchi, Seishi Ogawa, Shigeru Chiba
Nature Genetics, 46, 171-175 (2014)
血管免疫芽球性T細胞リンパ腫は予後不良の悪性リンパ腫の一種であり,T細胞リンパ腫の約20%をしめる.血管免疫芽球性T細胞リンパ腫においても骨髄系の腫瘍の多くに認められるTET2遺伝子の変異などのゲノムの異常が見い出されていたが,この疾患に特異的なゲノムの異常は同定されていなかった.今回,筆者らは,3例の血管免疫芽球性T細胞リンパ腫を含む6例のT細胞性リンパ腫について全エキソン解析を行い,全例の血管免疫芽球性T細胞リンパ腫を含む4例においてRHOA遺伝子に変異を同定した.この発見にもとづき,72例の血管免疫芽球性T細胞リンパ腫および87例の分類不能型の末梢性T細胞リンパ腫においてRHOA遺伝子の塩基配列を決定した.その結果,血管免疫芽球性T細胞リンパ腫の71%,分類不能型の末梢性T細胞リンパ腫の17%において,RHOA遺伝子に変異が認められた.RHOA遺伝子に変異が検出された68例のうち66例では,17番目のGlyがValに置換するというまったく同じ変異が認められた.また,ほかのT細胞性リンパ腫,B細胞性リンパ腫,骨髄系腫瘍ではRHOA遺伝子に変異は検出されず,RHOA遺伝子の変異は血管免疫芽球性T細胞リンパ腫および分類不能型の末梢性T細胞リンパ腫に特異的であることがわかった.さらに,TET2遺伝子,IDH2遺伝子,DNMT3A遺伝子の塩基配列をあわせて決定した結果,TET2遺伝子の変異,RHOA遺伝子の変異,IDH2遺伝子の変異のあいだには階層的な重複が認められた.また,RHOA遺伝子の変異はリンパ腫細胞に特有であった一方,TET2遺伝子の変異の一部は腫瘍化していない造血前駆細胞において生じていると推察された.RHOAは低分子量Gタンパク質に属し,これに結合するGDPがGTPに変換されると下流のエフェクタータンパク質が活性化される.そののち,RHOAそれ自体のGTPase活性によりGTPはGDPに変換され不活化型にもどることで,RHOAは分子スイッチとして機能している.17番目のGlyがValに置換したRHOAはGTPとの結合能を失い分子スイッチとしての機能をはたせないだけでなく,野生型のRHOAの機能を阻害した.今回の発見は,血管免疫芽球性T細胞リンパ腫の分子病態に重要な知見をくわえ,その診断に有用な手段を提供すると期待される.さらに,変異RHOAをバイオマーカーとする新規の治療法の開発につながる可能性もある.
非ホジキンリンパ腫のおよそ80~85%はB細胞リンパ腫,残り15~20%はT/NK細胞リンパ腫に分類される.それらはさらに病理学的に細分類されており,治療法や予後も異なる.B細胞リンパ腫については分類された疾患ごとにゲノム解析が進展し,疾患に特異的な遺伝子の異常が同定されつつある.一方,T/NK細胞リンパ腫のゲノム解析は遅れていた.T/NK細胞リンパ腫の15~20%をしめる血管免疫芽球性T細胞性リンパ腫は,高齢者に多く,全身のリンパ節の腫脹と自己免疫異常をともなう予後不良の疾患である1,2).血管免疫芽球性T細胞リンパ腫の腫瘍細胞は濾胞性ヘルパーT細胞の特徴をもつ3-5).腫瘍組織における腫瘍細胞の比率は低く,腫瘍組織は腫瘍細胞のほか,多彩な細胞の浸潤や血管が増生した組織像により特徴づけられる.一方,T/NK細胞リンパ腫の約30%は分類不能型の末梢性T細胞リンパ腫がしめ,これらの相当数は血管免疫芽球性T細胞リンパ腫と類似した病理学的な特徴をもつ.これら2つのT細胞リンパ腫においては,TET2遺伝子,DNMT3A遺伝子,IDH2遺伝子といったエピジェネティクスに関連する遺伝子における変異がくり返し見い出されている6-8).ただし,これらの遺伝子の変異は骨髄異形成症候群や急性骨髄性白血病など多くの骨髄系腫瘍においても高頻度で見い出されており9-11),この疾患における特異性は低い.
3例の血管免疫芽球性T細胞リンパ腫および3例の分類不能型の末梢性T細胞リンパ腫において全エキソン解析を行った結果,合計で87のアミノ酸変異をともなう体細胞性変異が同定された.1試料あたりの変異数は4~27であった.変異アレル頻度は0.25未満が多く,病理学的に腫瘍細胞の比率が少ないことと合致する結果であった.このうち,くり返し変異が同定されたのはRHOA遺伝子のみで,いずれも17番目のGlyがValに置換する変異であった.
この発見にもとづき,72例の血管免疫芽球性T細胞リンパ腫および87例の分類不能型の末梢性T細胞リンパ腫においてRHOA遺伝子の塩基配列を決定した.その結果,血管免疫芽球性T細胞リンパ腫の71%,分類不能型の末梢性T細胞リンパ腫の17%においてRHOA遺伝子に変異が認められた.変異が認められた68例のうち66例では,17番目のGlyがValに置換するというまったく同じ変異が検出された.2例の例外は,17番目のGlyの欠失,および,161番目のAlaのGluへの置換であった.また,ほかのT細胞性リンパ腫11例,B細胞性リンパ腫92例,骨髄系腫瘍142例では,RHOA遺伝子の変異はまったく検出されなかったことから,造血器腫瘍のうち,血管免疫芽球性T細胞リンパ腫および分類不能型の末梢性T細胞リンパ腫にきわめて特異的な変異であることがわかった.
血管免疫芽球性T細胞リンパ腫の腫瘍細胞は濾胞性ヘルパーT細胞と類似した遺伝子発現の様式を示すことから,その腫瘍細胞の起源として濾胞性ヘルパーT細胞が想定されている3).一方,分類不能型の末梢性T細胞リンパ腫はさまざまな腫瘍の混在するグループであり,血管免疫芽球性T細胞リンパ腫の特徴をもつケースが相当の割合で含まれている.血管免疫芽球性T細胞リンパ腫に類似した病理学的な特徴により4,5),分類不能型の末梢性T細胞リンパ腫から血管免疫芽球性T細胞リンパ腫の特徴をもつ21例ともたない38例を抽出した.その結果,血管免疫芽球性T細胞リンパ腫の特徴をもつケースでは62%においてRHOA遺伝子に変異が検出されたのに対し,もたないケースではRHOA遺伝子に変異はまったく検出されなかった.以上から,RHOA遺伝子の変異は濾胞性ヘルパーT細胞の特徴をもつT細胞リンパ腫において特異的に頻度の高いことが明らかになった.
RHOA遺伝子の塩基配列の決定に用いた159例のうち,血管免疫芽球性T細胞リンパ腫46例,分類不能型の末梢性T細胞リンパ腫33例については,RHOA遺伝子のほか,TET2遺伝子,DNMT3A遺伝子,IDH2遺伝子についても塩基配列を決定した.その結果,全体の68%においてTET2遺伝子に,27%においてDNMT3A遺伝子に,18%においてIDH2遺伝子に,変異が認められた.TET2遺伝子の変異はタンパク質コード領域の全長にわたり認められたが,DNMT3A遺伝子の変異はメチル基転移酵素活性領域に,IDH2遺伝子の変異は172番目のArgに集中していた.これらの変異部位はこれまでの報告どおりであったが5-11),TET2遺伝子の変異の頻度はこれまでの報告に比べ顕著に高かった5-7,9,10).
興味深いことに,TET2遺伝子の変異,RHOA遺伝子の変異,IDH2遺伝子の変異にはヒエラルキーが認められ,IDH2遺伝子の変異をもつケースは1例を除きTET2遺伝子の変異およびRHOA遺伝子の変異が,RHOA遺伝子の変異をもつケースは全例においてTET2遺伝子の変異が認められた.DNMT3A遺伝子の変異には,RHOA遺伝子の変異やIDH2遺伝子の変異とは明確な関連が認められなかった.2つ以上の遺伝子に変異が認められたケースにおいてそれぞれの遺伝子の変異アレルの頻度を比較したところ,TET2遺伝子とDNMT3A遺伝子の変異アレルの頻度は同じ程度であり,RHOA遺伝子やIDH2遺伝子の変異アレルの頻度に比べ有意に高かった.この観察結果から,TET2遺伝子の変異およびDNMT3A遺伝子の変異のほうが,RHOA遺伝子の変異やIDH2遺伝子の変異よりさきに生じていると推察された.
全エキソン解析ではTET2遺伝子の変異は1例のみで検出され,DNMT3A遺伝子の変異は検出されなかった.しかし,標的シークエンス法ではそれぞれ6例のうち5例および2例において変異が同定された.全エキソン解析では対照に用いた骨髄や末梢血とは異なる配列をスクリーニングする.したがって,このように全エキソン解析と標的シークエンス法とで結果のくいちがう現象は,対照に用いた骨髄や末梢血においてもTET2遺伝子の変異やDNMT3A遺伝子の変異が存在していれば生じうる.この仮説を証明するため,病理学的には腫瘍細胞の浸潤がないと判断された骨髄や末梢血について標的シークエンス法により塩基配列を決定した.その結果,このような9つの試料のうち骨髄の4つの試料(全エキソン解析の対照に用いた4つの試料のうち2つの試料を含む)において,TET2遺伝子またはDNMT3A遺伝子,あるいは,その両方に変異が同定された.これらの変異は,それぞれのケースの腫瘍の試料において同定された変異と同一で,また,変異アレルの頻度も類似しており,複数のケースにおいて0.3をこえていた.これらのケースでは,骨髄の過半数の細胞がTET2遺伝子またはDNMT3A遺伝子,あるいは,その両方に変異をもつ細胞のクローンであると考えられ,これらの変異が腫瘍化していない造血前駆細胞において生じていることが示唆された.一方,RHOA遺伝子の変異やIDH2遺伝子の変異は腫瘍の試料においてのみ同定され,対照に用いた骨髄や末梢血において同定されることはなかった.
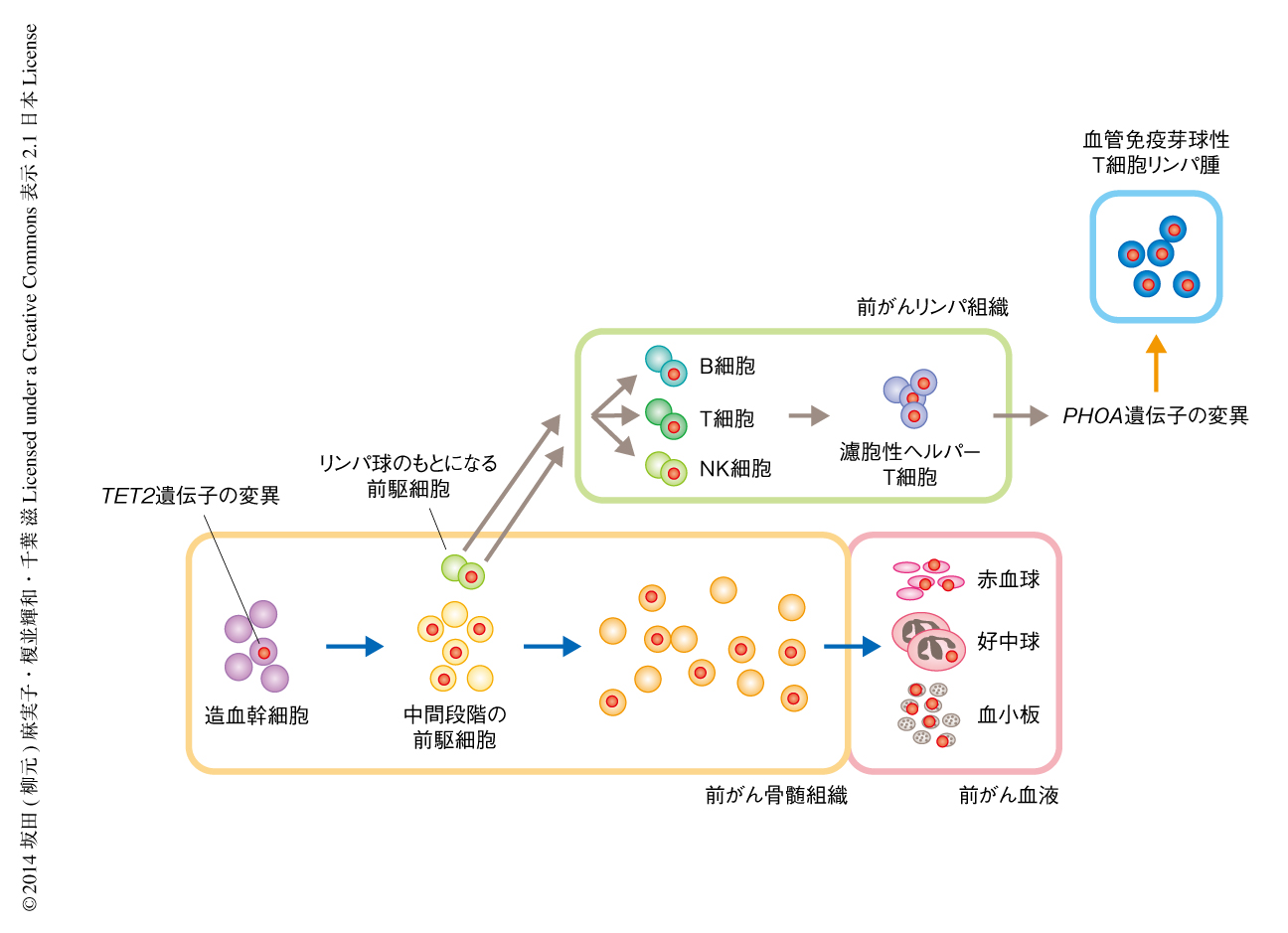
さらに,TET2遺伝子,DNMT3A遺伝子,RHOA遺伝子の3つに変異が同定された腫瘍組織からCD4陽性T細胞およびCD8陽性T細胞を分取し,それぞれの細胞ごとにDNAを増幅してSanger法およびディープシークエンス法により塩基配列を決定した.その結果,腫瘍細胞が濃縮されているCD4陽性T細胞の集団ではすべての変異が検出された一方,腫瘍細胞を含まないCD8陽性細胞の集団ではTET2遺伝子の変異とDNMT3A遺伝子の変異だけが同定され,RHOA遺伝子の変異は同定されなかった.この観察結果から,RHOA遺伝子の変異は腫瘍細胞だけに生じるが,TET2遺伝子の変異とDNMT3A遺伝子の変異はT細胞系列の細胞がCD4陽性細胞とCD8陽性細胞に分化する以前の腫瘍化していない段階ですでに生じており,クローン性に増幅していることが示唆された(図1).
RHOAはGTPase活性をもつグアニンヌクレオチド結合タンパク質であり低分子量Gタンパク質に属する.RHOAに結合したGDPがGEF(guanine nucleotide exchange factor,グアニンヌクレオチド交換因子)によりGTPに交換されるとRHOAは活性化型となりその下流のエフェクタータンパク質の機能をオンにし,そののち,RHOAそれ自体がもつGTPase活性がGAP(GTPase-activating protein,GTPase活性化タンパク質)により増強されてGTPをGDPに変換しRHOAは不活化型にもどる12,13).GTPと結合するRHOAだけに結合することのわかっているタンパク質Rhotekin 14) を用いることにより,17番目のGlyがValに置換したRHOAはGTPとの結合能を失っているだけでなく,野生型のRHOAがGTP結合型として存在することを阻害していることも明らかになった.17番目のGlyがValに置換したRHOAは野生型のRHOAより強くGEFと結合することからも,野生型RHOAの機能を阻害していることが支持された.さらに,17番目のGlyがValに置換したRHOAは野生型RHOAによるSRF-RE 15) のプロモーター活性の亢進を阻害し,また,線維芽細胞において野生型RHOAによるアクチンの重合の促進を阻害した.以上から,17番目のGlyがValに置換したRHOAは野生型RHOAの機能をドミナントネガティブに阻害すると考えられた(図2).
T細胞株であるJurkat細胞に野生型のRHOAを導入してこれを誘導性に発現させると,Jurkat細胞の増殖は抑制された.一方,17番目のGlyがValに置換したRHOAを導入し発現させてもJurkat細胞の増殖は抑制されなかった.この観察結果は,野生型RHOAはT細胞において腫瘍に対し抑制的にはたらいている可能性があり,17番目のGlyがValに置換したRHOAはそのような腫瘍抑制能を失っていることを示唆した.
この研究は,これまでゲノム解析が遅れていた末梢性T細胞リンパ腫のうち,とくに血管免疫芽球性T細胞リンパ腫およびその特徴をもつ分類不能型の末梢性T細胞リンパ腫において特異的,かつ,きわめて高頻度にRHOA遺伝子に変異の生じていることを示した.この変異のほとんどは17番目のGlyのValへの置換であった.17番目のGlyがValに置換したRHOAは野生型のRHOAがT細胞に対しもつ腫瘍抑制能をもたないばかりか,野生型のRHOAの機能を阻害した.ひとつの腫瘍の過半数において1遺伝子のホットスポットに変異が認められる事例は,いまだごく少数が同定されているにすぎない.このようなケースでは,変異を検出することによる診断的な価値が非常に高く,治療のバイオマーカーとしての有用性も明らかである.RHOA遺伝子の7番目のGlyがValに置換した変異はドミナントネガティブ型の変異であることから,治療薬の開発はこれまでの例とは異なる戦略が必要となるだろう.
この研究で示されたもうひとつの成果は,TET2遺伝子の変異あるいはDNMT3A遺伝子の変異だけをもつ細胞と,これらにくわえRHOA遺伝子の変異をもつ細胞とを識別できたことである.このことにより,TET2遺伝子の変異やDNMT3A遺伝子の変異は造血前駆細胞において生じているという以前の報告を6,7),より明瞭なかたちで示すことに成功した.変異により腫瘍にはいたらないまま緩徐なクローンの増殖をきたす前腫瘍の状態をいっそうクローズアップすることにより,がんの発生の過程をより明確にとらえた.
略歴:2007年 東京大学大学院医学系研究科博士課程 修了,同年 東京大学医学部附属病院 医員,2008年 筑波大学附属病院 医員,同年 筑波大学大学院人間総合科学研究科 講師を経て,2012年より筑波大学医学医療系 准教授.
研究テーマ:T細胞リンパ腫におけるゲノムおよびエピゲノムの異常.
榎並 輝和(Terukazu Enami)
筑波大学大学院人間総合科学研究科博士課程 在学中.
千葉 滋(Shigeru Chiba)
筑波大学医学医療系 教授.
研究室URL:http://www.ketsunai.com
© 2014 坂田 (柳元) 麻実子・榎並輝和・千葉 滋 Licensed under CC 表示 2.1 日本
(筑波大学医学医療系 血液腫瘍学研究室)
email:千葉 滋
DOI: 10.7875/first.author.2014.023
Somatic RHOA mutation in angioimmunoblastic T cell lymphoma.
Mamiko Sakata-Yanagimoto, Terukazu Enami, Kenichi Yoshida, Yuichi Shiraishi, Ryohei Ishii, Yasuyuki Miyake, Hideharu Muto, Naoko Tsuyama, Aiko Sato-Otsubo, Yusuke Okuno, Seiji Sakata, Yuhei Kamada, Rie Nakamoto-Matsubara, Nguyen Bich Tran, Koji Izutsu, Yusuke Sato, Yasunori Ohta, Junichi Furuta, Seiichi Shimizu, Takuya Komeno, Yuji Sato, Takayoshi Ito, Masayuki Noguchi, Emiko Noguchi, Masashi Sanada, Kenichi Chiba, Hiroko Tanaka, Kazumi Suzukawa, Toru Nanmoku, Yuichi Hasegawa, Osamu Nureki, Satoru Miyano, Naoya Nakamura, Kengo Takeuchi, Seishi Ogawa, Shigeru Chiba
Nature Genetics, 46, 171-175 (2014)
この論文に出現する遺伝子・タンパク質のUniprot ID
RHOA(P61586), TET2(Q6N021), IDH2(P48735), DNMT3A(Q9Y6K1), CD4(P01730), CD8, GEF, guanine nucleotide exchange factor, グアニンヌクレオチド交換因子, GAP, GTPase-activating protein, GTPase活性化タンパク質, Rhotekin
要 約
血管免疫芽球性T細胞リンパ腫は予後不良の悪性リンパ腫の一種であり,T細胞リンパ腫の約20%をしめる.血管免疫芽球性T細胞リンパ腫においても骨髄系の腫瘍の多くに認められるTET2遺伝子の変異などのゲノムの異常が見い出されていたが,この疾患に特異的なゲノムの異常は同定されていなかった.今回,筆者らは,3例の血管免疫芽球性T細胞リンパ腫を含む6例のT細胞性リンパ腫について全エキソン解析を行い,全例の血管免疫芽球性T細胞リンパ腫を含む4例においてRHOA遺伝子に変異を同定した.この発見にもとづき,72例の血管免疫芽球性T細胞リンパ腫および87例の分類不能型の末梢性T細胞リンパ腫においてRHOA遺伝子の塩基配列を決定した.その結果,血管免疫芽球性T細胞リンパ腫の71%,分類不能型の末梢性T細胞リンパ腫の17%において,RHOA遺伝子に変異が認められた.RHOA遺伝子に変異が検出された68例のうち66例では,17番目のGlyがValに置換するというまったく同じ変異が認められた.また,ほかのT細胞性リンパ腫,B細胞性リンパ腫,骨髄系腫瘍ではRHOA遺伝子に変異は検出されず,RHOA遺伝子の変異は血管免疫芽球性T細胞リンパ腫および分類不能型の末梢性T細胞リンパ腫に特異的であることがわかった.さらに,TET2遺伝子,IDH2遺伝子,DNMT3A遺伝子の塩基配列をあわせて決定した結果,TET2遺伝子の変異,RHOA遺伝子の変異,IDH2遺伝子の変異のあいだには階層的な重複が認められた.また,RHOA遺伝子の変異はリンパ腫細胞に特有であった一方,TET2遺伝子の変異の一部は腫瘍化していない造血前駆細胞において生じていると推察された.RHOAは低分子量Gタンパク質に属し,これに結合するGDPがGTPに変換されると下流のエフェクタータンパク質が活性化される.そののち,RHOAそれ自体のGTPase活性によりGTPはGDPに変換され不活化型にもどることで,RHOAは分子スイッチとして機能している.17番目のGlyがValに置換したRHOAはGTPとの結合能を失い分子スイッチとしての機能をはたせないだけでなく,野生型のRHOAの機能を阻害した.今回の発見は,血管免疫芽球性T細胞リンパ腫の分子病態に重要な知見をくわえ,その診断に有用な手段を提供すると期待される.さらに,変異RHOAをバイオマーカーとする新規の治療法の開発につながる可能性もある.
はじめに
非ホジキンリンパ腫のおよそ80~85%はB細胞リンパ腫,残り15~20%はT/NK細胞リンパ腫に分類される.それらはさらに病理学的に細分類されており,治療法や予後も異なる.B細胞リンパ腫については分類された疾患ごとにゲノム解析が進展し,疾患に特異的な遺伝子の異常が同定されつつある.一方,T/NK細胞リンパ腫のゲノム解析は遅れていた.T/NK細胞リンパ腫の15~20%をしめる血管免疫芽球性T細胞性リンパ腫は,高齢者に多く,全身のリンパ節の腫脹と自己免疫異常をともなう予後不良の疾患である1,2).血管免疫芽球性T細胞リンパ腫の腫瘍細胞は濾胞性ヘルパーT細胞の特徴をもつ3-5).腫瘍組織における腫瘍細胞の比率は低く,腫瘍組織は腫瘍細胞のほか,多彩な細胞の浸潤や血管が増生した組織像により特徴づけられる.一方,T/NK細胞リンパ腫の約30%は分類不能型の末梢性T細胞リンパ腫がしめ,これらの相当数は血管免疫芽球性T細胞リンパ腫と類似した病理学的な特徴をもつ.これら2つのT細胞リンパ腫においては,TET2遺伝子,DNMT3A遺伝子,IDH2遺伝子といったエピジェネティクスに関連する遺伝子における変異がくり返し見い出されている6-8).ただし,これらの遺伝子の変異は骨髄異形成症候群や急性骨髄性白血病など多くの骨髄系腫瘍においても高頻度で見い出されており9-11),この疾患における特異性は低い.
1.血管免疫芽球性T細胞リンパ腫におけるRHOA遺伝子の変異の同定
3例の血管免疫芽球性T細胞リンパ腫および3例の分類不能型の末梢性T細胞リンパ腫において全エキソン解析を行った結果,合計で87のアミノ酸変異をともなう体細胞性変異が同定された.1試料あたりの変異数は4~27であった.変異アレル頻度は0.25未満が多く,病理学的に腫瘍細胞の比率が少ないことと合致する結果であった.このうち,くり返し変異が同定されたのはRHOA遺伝子のみで,いずれも17番目のGlyがValに置換する変異であった.
2.RHOA遺伝子の変異の頻度および疾患における特異性
この発見にもとづき,72例の血管免疫芽球性T細胞リンパ腫および87例の分類不能型の末梢性T細胞リンパ腫においてRHOA遺伝子の塩基配列を決定した.その結果,血管免疫芽球性T細胞リンパ腫の71%,分類不能型の末梢性T細胞リンパ腫の17%においてRHOA遺伝子に変異が認められた.変異が認められた68例のうち66例では,17番目のGlyがValに置換するというまったく同じ変異が検出された.2例の例外は,17番目のGlyの欠失,および,161番目のAlaのGluへの置換であった.また,ほかのT細胞性リンパ腫11例,B細胞性リンパ腫92例,骨髄系腫瘍142例では,RHOA遺伝子の変異はまったく検出されなかったことから,造血器腫瘍のうち,血管免疫芽球性T細胞リンパ腫および分類不能型の末梢性T細胞リンパ腫にきわめて特異的な変異であることがわかった.
3.濾胞性ヘルパーT細胞の特徴をもつT細胞リンパ腫におけるRHOA遺伝子の変異
血管免疫芽球性T細胞リンパ腫の腫瘍細胞は濾胞性ヘルパーT細胞と類似した遺伝子発現の様式を示すことから,その腫瘍細胞の起源として濾胞性ヘルパーT細胞が想定されている3).一方,分類不能型の末梢性T細胞リンパ腫はさまざまな腫瘍の混在するグループであり,血管免疫芽球性T細胞リンパ腫の特徴をもつケースが相当の割合で含まれている.血管免疫芽球性T細胞リンパ腫に類似した病理学的な特徴により4,5),分類不能型の末梢性T細胞リンパ腫から血管免疫芽球性T細胞リンパ腫の特徴をもつ21例ともたない38例を抽出した.その結果,血管免疫芽球性T細胞リンパ腫の特徴をもつケースでは62%においてRHOA遺伝子に変異が検出されたのに対し,もたないケースではRHOA遺伝子に変異はまったく検出されなかった.以上から,RHOA遺伝子の変異は濾胞性ヘルパーT細胞の特徴をもつT細胞リンパ腫において特異的に頻度の高いことが明らかになった.
4.RHOA遺伝子の変異とほかの遺伝子の変異との関連
RHOA遺伝子の塩基配列の決定に用いた159例のうち,血管免疫芽球性T細胞リンパ腫46例,分類不能型の末梢性T細胞リンパ腫33例については,RHOA遺伝子のほか,TET2遺伝子,DNMT3A遺伝子,IDH2遺伝子についても塩基配列を決定した.その結果,全体の68%においてTET2遺伝子に,27%においてDNMT3A遺伝子に,18%においてIDH2遺伝子に,変異が認められた.TET2遺伝子の変異はタンパク質コード領域の全長にわたり認められたが,DNMT3A遺伝子の変異はメチル基転移酵素活性領域に,IDH2遺伝子の変異は172番目のArgに集中していた.これらの変異部位はこれまでの報告どおりであったが5-11),TET2遺伝子の変異の頻度はこれまでの報告に比べ顕著に高かった5-7,9,10).
興味深いことに,TET2遺伝子の変異,RHOA遺伝子の変異,IDH2遺伝子の変異にはヒエラルキーが認められ,IDH2遺伝子の変異をもつケースは1例を除きTET2遺伝子の変異およびRHOA遺伝子の変異が,RHOA遺伝子の変異をもつケースは全例においてTET2遺伝子の変異が認められた.DNMT3A遺伝子の変異には,RHOA遺伝子の変異やIDH2遺伝子の変異とは明確な関連が認められなかった.2つ以上の遺伝子に変異が認められたケースにおいてそれぞれの遺伝子の変異アレルの頻度を比較したところ,TET2遺伝子とDNMT3A遺伝子の変異アレルの頻度は同じ程度であり,RHOA遺伝子やIDH2遺伝子の変異アレルの頻度に比べ有意に高かった.この観察結果から,TET2遺伝子の変異およびDNMT3A遺伝子の変異のほうが,RHOA遺伝子の変異やIDH2遺伝子の変異よりさきに生じていると推察された.
5.腫瘍および骨髄においてRHOA遺伝子,TET2遺伝子,DNMT3A遺伝子に変異をもつ細胞の分布
全エキソン解析ではTET2遺伝子の変異は1例のみで検出され,DNMT3A遺伝子の変異は検出されなかった.しかし,標的シークエンス法ではそれぞれ6例のうち5例および2例において変異が同定された.全エキソン解析では対照に用いた骨髄や末梢血とは異なる配列をスクリーニングする.したがって,このように全エキソン解析と標的シークエンス法とで結果のくいちがう現象は,対照に用いた骨髄や末梢血においてもTET2遺伝子の変異やDNMT3A遺伝子の変異が存在していれば生じうる.この仮説を証明するため,病理学的には腫瘍細胞の浸潤がないと判断された骨髄や末梢血について標的シークエンス法により塩基配列を決定した.その結果,このような9つの試料のうち骨髄の4つの試料(全エキソン解析の対照に用いた4つの試料のうち2つの試料を含む)において,TET2遺伝子またはDNMT3A遺伝子,あるいは,その両方に変異が同定された.これらの変異は,それぞれのケースの腫瘍の試料において同定された変異と同一で,また,変異アレルの頻度も類似しており,複数のケースにおいて0.3をこえていた.これらのケースでは,骨髄の過半数の細胞がTET2遺伝子またはDNMT3A遺伝子,あるいは,その両方に変異をもつ細胞のクローンであると考えられ,これらの変異が腫瘍化していない造血前駆細胞において生じていることが示唆された.一方,RHOA遺伝子の変異やIDH2遺伝子の変異は腫瘍の試料においてのみ同定され,対照に用いた骨髄や末梢血において同定されることはなかった.
さらに,TET2遺伝子,DNMT3A遺伝子,RHOA遺伝子の3つに変異が同定された腫瘍組織からCD4陽性T細胞およびCD8陽性T細胞を分取し,それぞれの細胞ごとにDNAを増幅してSanger法およびディープシークエンス法により塩基配列を決定した.その結果,腫瘍細胞が濃縮されているCD4陽性T細胞の集団ではすべての変異が検出された一方,腫瘍細胞を含まないCD8陽性細胞の集団ではTET2遺伝子の変異とDNMT3A遺伝子の変異だけが同定され,RHOA遺伝子の変異は同定されなかった.この観察結果から,RHOA遺伝子の変異は腫瘍細胞だけに生じるが,TET2遺伝子の変異とDNMT3A遺伝子の変異はT細胞系列の細胞がCD4陽性細胞とCD8陽性細胞に分化する以前の腫瘍化していない段階ですでに生じており,クローン性に増幅していることが示唆された(図1).
6.17番目のGlyがValに置換したRHOAの機能
RHOAはGTPase活性をもつグアニンヌクレオチド結合タンパク質であり低分子量Gタンパク質に属する.RHOAに結合したGDPがGEF(guanine nucleotide exchange factor,グアニンヌクレオチド交換因子)によりGTPに交換されるとRHOAは活性化型となりその下流のエフェクタータンパク質の機能をオンにし,そののち,RHOAそれ自体がもつGTPase活性がGAP(GTPase-activating protein,GTPase活性化タンパク質)により増強されてGTPをGDPに変換しRHOAは不活化型にもどる12,13).GTPと結合するRHOAだけに結合することのわかっているタンパク質Rhotekin 14) を用いることにより,17番目のGlyがValに置換したRHOAはGTPとの結合能を失っているだけでなく,野生型のRHOAがGTP結合型として存在することを阻害していることも明らかになった.17番目のGlyがValに置換したRHOAは野生型のRHOAより強くGEFと結合することからも,野生型RHOAの機能を阻害していることが支持された.さらに,17番目のGlyがValに置換したRHOAは野生型RHOAによるSRF-RE 15) のプロモーター活性の亢進を阻害し,また,線維芽細胞において野生型RHOAによるアクチンの重合の促進を阻害した.以上から,17番目のGlyがValに置換したRHOAは野生型RHOAの機能をドミナントネガティブに阻害すると考えられた(図2).
7.T細胞における野生型RHOAおよび17番目のGlyがValに置換したRHOAの役割
T細胞株であるJurkat細胞に野生型のRHOAを導入してこれを誘導性に発現させると,Jurkat細胞の増殖は抑制された.一方,17番目のGlyがValに置換したRHOAを導入し発現させてもJurkat細胞の増殖は抑制されなかった.この観察結果は,野生型RHOAはT細胞において腫瘍に対し抑制的にはたらいている可能性があり,17番目のGlyがValに置換したRHOAはそのような腫瘍抑制能を失っていることを示唆した.
おわりに
この研究は,これまでゲノム解析が遅れていた末梢性T細胞リンパ腫のうち,とくに血管免疫芽球性T細胞リンパ腫およびその特徴をもつ分類不能型の末梢性T細胞リンパ腫において特異的,かつ,きわめて高頻度にRHOA遺伝子に変異の生じていることを示した.この変異のほとんどは17番目のGlyのValへの置換であった.17番目のGlyがValに置換したRHOAは野生型のRHOAがT細胞に対しもつ腫瘍抑制能をもたないばかりか,野生型のRHOAの機能を阻害した.ひとつの腫瘍の過半数において1遺伝子のホットスポットに変異が認められる事例は,いまだごく少数が同定されているにすぎない.このようなケースでは,変異を検出することによる診断的な価値が非常に高く,治療のバイオマーカーとしての有用性も明らかである.RHOA遺伝子の7番目のGlyがValに置換した変異はドミナントネガティブ型の変異であることから,治療薬の開発はこれまでの例とは異なる戦略が必要となるだろう.
この研究で示されたもうひとつの成果は,TET2遺伝子の変異あるいはDNMT3A遺伝子の変異だけをもつ細胞と,これらにくわえRHOA遺伝子の変異をもつ細胞とを識別できたことである.このことにより,TET2遺伝子の変異やDNMT3A遺伝子の変異は造血前駆細胞において生じているという以前の報告を6,7),より明瞭なかたちで示すことに成功した.変異により腫瘍にはいたらないまま緩徐なクローンの増殖をきたす前腫瘍の状態をいっそうクローズアップすることにより,がんの発生の過程をより明確にとらえた.
文 献
- Swerdlow, S. H., Campo, E., Harris, N. L. et al.: WHO Classification of Tumors of Haematopoietic and Lymphoid Tissues, 4th Ed. pp.306-311, IARC Press, Lyon (2008)
- de Leval, L., Gisselbrecht, C. & Gaulard, P.: Advances in the understanding and management of angioimmunoblastic T-cell lymphoma. Br. J. Haematol., 148, 673-689 (2010)[PubMed]
- de Leval, L., Rickman, D. S., Thielen, C. et al.: The gene expression profile of nodal peripheral T-cell lymphoma demonstrates a molecular link between angioimmunoblastic T-cell lymphoma (AITL) and follicular helper T (TFH) cells. Blood, 109, 4952-4963 (2007)[PubMed]
- Rodriguez-Pinilla, S. M., Atienza, L., Murillo, C. et al.: Peripheral T-cell lymphoma with follicular T-cell markers. Am. J. Surg. Pathol., 32, 1787-1799 (2008)[PubMed]
- Lemonnier, F., Couronne, L., Parrens, M. et al.: Recurrent TET2 mutations in peripheral T-cell lymphomas correlate with TFH-like features and adverse clinical parameters. Blood, 120, 1466-1469 (2012)[PubMed]
- Quivoron, C., Couronne, L., Della Valle, V. et al.: TET2 inactivation results in pleiotropic hematopoietic abnormalities in mouse and is a recurrent event during human lymphomagenesis. Cancer Cell, 20, 25-38 (2011)[PubMed]
- Couronne, L., Bastard, C. & Bernard, O. A.: TET2 and DNMT3A mutations in human T-cell lymphoma. N. Engl. J. Med., 366, 95-96 (2012)[PubMed]
- Cairns, R. A., Iqbal, J., Lemonnier, F. et al.: IDH2 mutations are frequent in angioimmunoblastic T-cell lymphoma. Blood, 119, 1901-1903 (2012)[PubMed]
- Delhommeau, F., Dupont, S., Della Valle, V. et al.: Mutation in TET2 in myeloid cancers. N. Engl. J. Med., 360, 2289-2301 (2009)[PubMed]
- Mardis, E. R., Ding, L., Dooling, D. J. et al.: Recurring mutations found by sequencing an acute myeloid leukemia genome. N. Engl. J. Med., 361, 1058-1066 (2009)[PubMed]
- Ley, T. J., Ding, L., Walter, M. J. et al.: DNMT3A mutations in acute myeloid leukemia. N. Engl. J. Med., 363, 2424-2433 (2010)[PubMed]
- Bustelo, X. R., Sauzeau, V. & Berenjeno, I. M.: GTP-binding proteins of the Rho/Rac family: regulation, effectors and functions in vivo. Bioessays, 29, 356-370 (2007)[PubMed]
- Etienne-Manneville, S. & Hall, A.: Rho GTPases in cell biology. Nature, 420, 629-635 (2002)[PubMed]
- Reid, T., Furuyashiki, T., Ishizaki, T. et al.: Rhotekin, a new putative target for Rho bearing homology to a serine/threonine kinase, PKN, and rhophilin in the rho-binding domain. J. Biol. Chem., 271, 13556-13560 (1996)[PubMed]
- Cheng, Z., Garvin, D., Paguio, A. et al.: Luciferase reporter assay system for deciphering GPCR pathways. Curr. Chem. Genomics, 4, 84-91 (2010)[PubMed]
著者プロフィール
略歴:2007年 東京大学大学院医学系研究科博士課程 修了,同年 東京大学医学部附属病院 医員,2008年 筑波大学附属病院 医員,同年 筑波大学大学院人間総合科学研究科 講師を経て,2012年より筑波大学医学医療系 准教授.
研究テーマ:T細胞リンパ腫におけるゲノムおよびエピゲノムの異常.
榎並 輝和(Terukazu Enami)
筑波大学大学院人間総合科学研究科博士課程 在学中.
千葉 滋(Shigeru Chiba)
筑波大学医学医療系 教授.
研究室URL:http://www.ketsunai.com
© 2014 坂田 (柳元) 麻実子・榎並輝和・千葉 滋 Licensed under CC 表示 2.1 日本