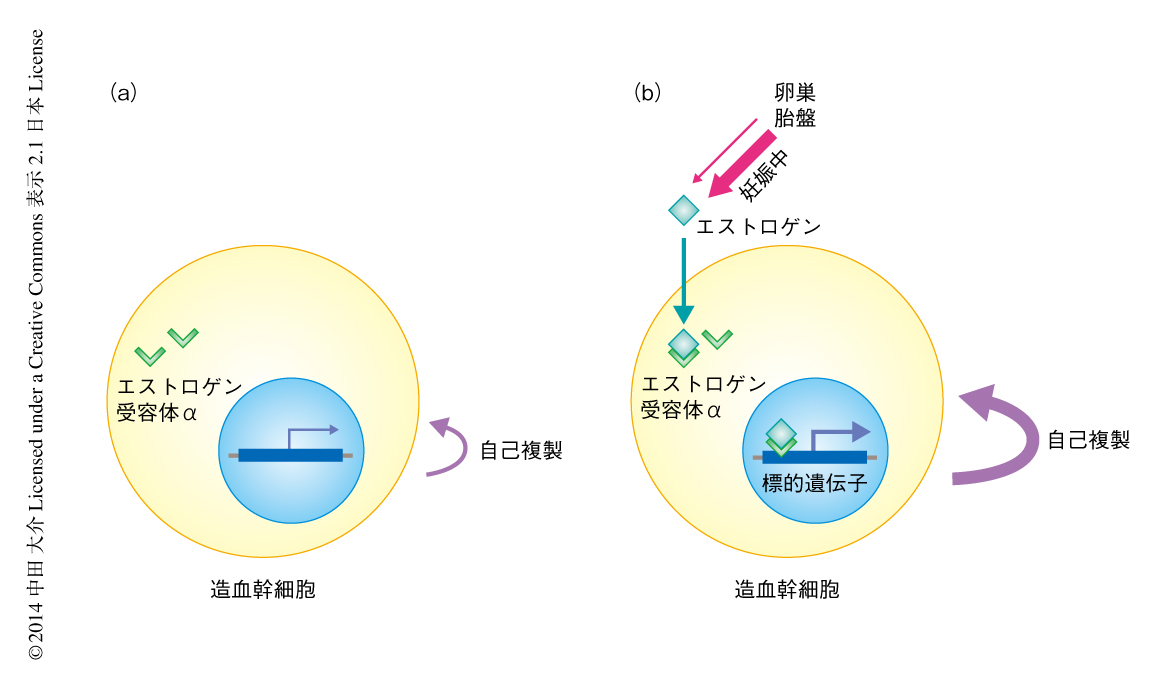
エストロゲンは妊娠中の造血幹細胞の自己複製を亢進する
中田 大介
(米国Baylor College of Medicine,Department of Molecular and Human Genetics)
email:中田大介
DOI: 10.7875/first.author.2014.021
Oestrogen increases haematopoietic stem-cell self-renewal in females and during pregnancy.
Daisuke Nakada, Hideyuki Oguro, Boaz P. Levi, Nicole Ryan, Ayumi Kitano, Yusuke Saitoh, Makiko Takeichi, George R. Wendt, Sean J. Morrison
Nature, 505, 555-558 (2014)
有性生殖を行う動物のさまざまな組織には雌雄差のあることが知られており,これら雌雄差を示す組織には性ホルモンにより直接的あるいは間接的に制御される組織幹細胞が存在する.しかしながら,形態的あるいは機能的に雌雄差を示さない組織の幹細胞の機能に雌雄差があるかどうかは不明である.造血器においてはリンパ球などの分化細胞において雌雄差が認められるが,造血幹細胞の機能に雌雄差があるかどうかは不明である.筆者らは,造血幹細胞においても雌雄差があり,その雌雄差が性ホルモンであるエストロゲンにより制御されていることを明らかにした.雌のマウスの造血幹細胞は雄のマウスの造血幹細胞よりも細胞分裂の頻度が高く,この違いは精巣ではなく卵巣により制御されており,さらには,卵巣において産生されるエストロゲンにより造血幹細胞の分裂が促進されることが見い出された.妊娠中はエストロゲンの量が増加し,造血幹細胞の数,造血幹細胞の分裂頻度,骨髄および脾臓の細胞数,脾臓における赤血球の産生がいずれも亢進した.造血幹細胞はエストロゲン受容体αを高く発現しており,造血幹細胞の分裂頻度の雌雄差,および,エストロゲンを投与したのちの造血幹細胞の分裂の亢進は,造血細胞において特異的にエストロゲン受容体αを欠損させることにより大きく減少した.さらに,妊娠したマウスにおいて造血細胞に特異的にエストロゲン受容体αを欠損させることにより,造血幹細胞の数,造血幹細胞の分裂頻度,赤血球の産生はいずれも低下した.これらの結果から,エストロゲンは造血幹細胞の発現するエストロゲン受容体αに直接に作用することにより造血幹細胞の自己複製および赤血球の産生を促進し,妊娠中における造血を制御していることが明らかになった.
動物のおのおのの組織に存在する組織幹細胞はどのような分子機構により個体における恒常性の変化を感知し応答するのかは,幹細胞生物学における根本的な疑問点であり多くの不明な点が残されている1).このような個体の恒常性と幹細胞の機能とをリンクする制御機構には浸透移行性の物質がかかわっていると考えられ,実際に,腸管,中枢神経系,生殖巣にある幹細胞は,インスリンあるいは栄養状態によりその量が調整される物質により制御されている2-5).造血器においては分化したリンパ球や骨髄球の分裂,分化,生存,サイトカインの産生が性ホルモンであるエストロゲンにより制御されており,エストロゲンの量の雌雄差のため免疫機能にも雌雄差が生じている.また,エストロゲンは赤血球系細胞のアポトーシスを誘導することも知られている.しかし,性ホルモンが造血幹細胞の機能を制御しているのかどうか,また,造血幹細胞の機能に雌雄差があるかどうかは明らかではない.そこで,この研究では,マウスの造血幹細胞は性ホルモンにより制御をうけて雌雄差を生じているのかどうか検討した.
マウスの造血幹細胞の骨髄における頻度および総数をフローサイトメーターを用いて解析したところ,造血幹細胞あるいは短期的に骨髄を再構築する多能性未分化細胞において雌雄差は認められなかった.そこで,造血幹細胞の分裂頻度に雌雄差があるかどうかをチミジンのアナログであるBrdUの取り込みにより検討した.マウスに10日間にわたりBrdUを投与し,全骨髄細胞,造血幹細胞,多能性未分化細胞におけるBrdUの取り込みを測定したところ,全骨髄細胞について雌雄差は認められなかったが,雌に由来する造血幹細胞および多能性未分化細胞においては,BrdU陽性細胞の割合が雄に由来する細胞と比較して有意に高かった.
この結果をさらに確認するためトランスジェニックマウスを用いた解析を行った.実験に用いたトランスジェニックマウスは,ドキソサイクリンを投与すると全身においてヒストンH2BとGFPとの融合タンパク質の発現が誘導され,ドキソサイクリンの投与を終了にすると細胞分裂ごとにGFPの蛍光強度が半減していくため,細胞の分裂頻度をBrdUによらずに解析できる.このマウスに6週間にわたりドキソサイクリンを投与し,ドキソサイクリンの投与を停止して12週間が経過したのち解析した.その結果,ほぼすべての全骨髄細胞は12週間のうちにGFPの蛍光を完全に失ったが,細胞分裂の頻度の低い造血幹細胞および多能性未分化細胞はGFPの蛍光を保持していた.さらに,雄に由来する造血幹細胞および多能性未分化細胞は,雌に由来する細胞と比較して,より高いGFPの蛍光を保持していた.以上の結果から,雌の造血幹細胞は雄の造血幹細胞と比較して,より分裂頻度の高いことが明らかになった.
この造血幹細胞の分裂頻度の雌雄差がどのように制御されているのかを検討するため,生殖巣を除去したときの造血幹細胞へのBrdUの取り込みについて解析した.その結果,精巣の除去は雄の造血幹細胞の分裂頻度になんら影響をあたえなかったが,卵巣の除去により,雌にみられた造血幹細胞の分裂頻度の亢進がみられなくなった.つまり,雌における造血幹細胞の分裂頻度の亢進は卵巣により制御されていることが明らかになった.
卵巣がどのように造血幹細胞の分裂を制御しているのかを解明するため,卵巣に由来する性ホルモンを投与する実験を行った.その結果,エストロゲンの投与により造血幹細胞の分裂が強く促進された.一方で,プロゲステロンやテストステロンは造血幹細胞の分裂に影響をあたえなかった.また,エストロゲンの投与は脾臓における赤血球の産生を促進することも見い出された.
エストロゲンの低下は造血幹細胞の分裂頻度の低下につながるのだろうか? エストロゲンの産生を抑制するアロマターゼ阻害剤のひとつであるアナストロゾールを投与する実験を行った.雌のマウスにアナストロゾールを投与したところ,造血幹細胞の分裂頻度の低下が認められたが,雄のマウスへの投与ではなんら影響は認められなかった.以上の結果から,造血幹細胞の分裂は卵巣に由来するエストロゲンの作用により促進されることが示された.
エストロゲンがどのように造血幹細胞に作用しているのかを解明するため,造血幹細胞における性ホルモンの受容体の発現を定量的PCR法により検討した.その結果,造血幹細胞はエストロゲン受容体αを高く発現していること,また,エストロゲン受容体β,プロゲステロン受容体,アンドロゲン受容体など,ほかの受容体は低くしか発現していないことが見い出された.そこでこれらの知見から,エストロゲン受容体αがエストロゲンに依存的な造血幹細胞の分裂を制御しているのではないかと仮定した.エストロゲン受容体αのノックアウトマウスを用いて,エストロゲン受容体αが造血幹細胞の分裂頻度の雌雄差を制御しているかどうか,BrdUの取り込みにより検討した.その結果,野生型マウスにおいてみられた造血幹細胞の分裂頻度の雌雄差は,エストロゲン受容体αノックアウトマウスではみられなかった.この結果から,エストロゲン受容体αが造血幹細胞の分裂を制御していることが示された.
エストロゲン受容体αノックアウトマウスは卵巣の機能がいちじるしく欠損しており不妊である.つまり,エストロゲン受容体αノックアウトマウスにおいてみられた造血幹細胞の分裂頻度の変化は,卵巣の機能の欠損による可能性が考えられた.そこで,エストロゲン受容体αを造血細胞において特異的に欠損したコンディショナルノックアウトマウスを作製した.このマウスを用いて造血幹細胞の分裂頻度の雌雄差について検討したところ,エストロゲン受容体αを造血細胞において特異的に欠損させることにより造血幹細胞の分裂頻度の雌雄差は消失した.さらに,エストロゲンを投与した際の造血幹細胞の分裂の亢進もまったくみられなった.また,造血幹細胞の培養の際にエストロゲンをくわえることにより造血幹細胞の分裂が亢進したことから,造血幹細胞はそれ自体が発現するエストロゲン受容体αを介してエストロゲンに応答し細胞分裂を亢進させていることが示された.
このようなエストロゲンによる造血幹細胞の制御には,どのような生理学的な意味があるのだろうか? 生理的な条件においてエストロゲンの量が増える場合として妊娠があげられる.そこで,妊娠中のマウスの造血機能および造血幹細胞の機能について評価した.その結果,妊娠中にはおもに赤血球系細胞の増加により脾臓がいちじるしく肥大することが認められた.さらに,妊娠中には骨髄および脾臓における造血幹細胞の数がいちじるしく増加し,造血幹細胞の分裂頻度も大きく亢進した.
この妊娠によりひき起こされる造血幹細胞および赤血球系細胞の応答はエストロゲン受容体αにより制御されているのかどうか検討するため,造血細胞に特異的なエストロゲン受容体αのコンディショナルノックアウトマウスを妊娠させて,その造血器を解析した.興味深いことに,妊娠により上昇した造血幹細胞の数,分裂頻度,赤血球系細胞の数は,いずれも造血細胞において特異的にエストロゲン受容体αを欠損させることにより大きく低下した.つまり,妊娠により起こる造血幹細胞の活性化および赤血球系細胞の増加は,エストロゲンが造血細胞に発現するエストロゲン受容体αに作用することによりひき起こされていることが示された.
この研究では,エストロゲンが造血細胞に発現するエストロゲン受容体αに作用することにより,雄と比較して雌の造血幹細胞の分裂頻度が亢進し,雌雄差の生じることをはじめて解明した(図1).エストロゲンの量が増加する妊娠中には,造血幹細胞の分裂の亢進および赤血球系細胞の増加が造血細胞に発現するエストロゲン受容体αに依存して誘導されていた.妊娠中は,血漿の増加に対し赤血球の増加が不足し慢性的な貧血の起こることが知られている6).造血幹細胞は妊娠という変化に対しエストロゲンを介して応答し,自己複製能を亢進させ赤血球の産生を誘導することにより,造血に対する需要の増加に応えていると考えられた.今後は,妊娠中に造血幹細胞がエストロゲンに応答することが,妊娠の維持や胎児の成長にどのような影響をあたえるのかを解明することが重要であると考えている.
略歴:2005年 名古屋大学大学院理学研究科 修了,2006年より米国Michigan大学 ポストドクトラルフェローを経て,2011年より米国Baylor College of Medicine助教.
研究テーマ:幹細胞の自己複製を制御する分子機構.
抱負:個体のなかの一細胞である造血幹細胞が,ほかの細胞あるいは組織とどのように相互作用することにより,造血器における恒常性を維持しているのかを解明したい.
© 2014 中田 大介 Licensed under CC 表示 2.1 日本
(米国Baylor College of Medicine,Department of Molecular and Human Genetics)
email:中田大介
DOI: 10.7875/first.author.2014.021
Oestrogen increases haematopoietic stem-cell self-renewal in females and during pregnancy.
Daisuke Nakada, Hideyuki Oguro, Boaz P. Levi, Nicole Ryan, Ayumi Kitano, Yusuke Saitoh, Makiko Takeichi, George R. Wendt, Sean J. Morrison
Nature, 505, 555-558 (2014)
要 約
有性生殖を行う動物のさまざまな組織には雌雄差のあることが知られており,これら雌雄差を示す組織には性ホルモンにより直接的あるいは間接的に制御される組織幹細胞が存在する.しかしながら,形態的あるいは機能的に雌雄差を示さない組織の幹細胞の機能に雌雄差があるかどうかは不明である.造血器においてはリンパ球などの分化細胞において雌雄差が認められるが,造血幹細胞の機能に雌雄差があるかどうかは不明である.筆者らは,造血幹細胞においても雌雄差があり,その雌雄差が性ホルモンであるエストロゲンにより制御されていることを明らかにした.雌のマウスの造血幹細胞は雄のマウスの造血幹細胞よりも細胞分裂の頻度が高く,この違いは精巣ではなく卵巣により制御されており,さらには,卵巣において産生されるエストロゲンにより造血幹細胞の分裂が促進されることが見い出された.妊娠中はエストロゲンの量が増加し,造血幹細胞の数,造血幹細胞の分裂頻度,骨髄および脾臓の細胞数,脾臓における赤血球の産生がいずれも亢進した.造血幹細胞はエストロゲン受容体αを高く発現しており,造血幹細胞の分裂頻度の雌雄差,および,エストロゲンを投与したのちの造血幹細胞の分裂の亢進は,造血細胞において特異的にエストロゲン受容体αを欠損させることにより大きく減少した.さらに,妊娠したマウスにおいて造血細胞に特異的にエストロゲン受容体αを欠損させることにより,造血幹細胞の数,造血幹細胞の分裂頻度,赤血球の産生はいずれも低下した.これらの結果から,エストロゲンは造血幹細胞の発現するエストロゲン受容体αに直接に作用することにより造血幹細胞の自己複製および赤血球の産生を促進し,妊娠中における造血を制御していることが明らかになった.
はじめに
動物のおのおのの組織に存在する組織幹細胞はどのような分子機構により個体における恒常性の変化を感知し応答するのかは,幹細胞生物学における根本的な疑問点であり多くの不明な点が残されている1).このような個体の恒常性と幹細胞の機能とをリンクする制御機構には浸透移行性の物質がかかわっていると考えられ,実際に,腸管,中枢神経系,生殖巣にある幹細胞は,インスリンあるいは栄養状態によりその量が調整される物質により制御されている2-5).造血器においては分化したリンパ球や骨髄球の分裂,分化,生存,サイトカインの産生が性ホルモンであるエストロゲンにより制御されており,エストロゲンの量の雌雄差のため免疫機能にも雌雄差が生じている.また,エストロゲンは赤血球系細胞のアポトーシスを誘導することも知られている.しかし,性ホルモンが造血幹細胞の機能を制御しているのかどうか,また,造血幹細胞の機能に雌雄差があるかどうかは明らかではない.そこで,この研究では,マウスの造血幹細胞は性ホルモンにより制御をうけて雌雄差を生じているのかどうか検討した.
1.造血幹細胞の分裂の頻度には雌雄差がある
マウスの造血幹細胞の骨髄における頻度および総数をフローサイトメーターを用いて解析したところ,造血幹細胞あるいは短期的に骨髄を再構築する多能性未分化細胞において雌雄差は認められなかった.そこで,造血幹細胞の分裂頻度に雌雄差があるかどうかをチミジンのアナログであるBrdUの取り込みにより検討した.マウスに10日間にわたりBrdUを投与し,全骨髄細胞,造血幹細胞,多能性未分化細胞におけるBrdUの取り込みを測定したところ,全骨髄細胞について雌雄差は認められなかったが,雌に由来する造血幹細胞および多能性未分化細胞においては,BrdU陽性細胞の割合が雄に由来する細胞と比較して有意に高かった.
この結果をさらに確認するためトランスジェニックマウスを用いた解析を行った.実験に用いたトランスジェニックマウスは,ドキソサイクリンを投与すると全身においてヒストンH2BとGFPとの融合タンパク質の発現が誘導され,ドキソサイクリンの投与を終了にすると細胞分裂ごとにGFPの蛍光強度が半減していくため,細胞の分裂頻度をBrdUによらずに解析できる.このマウスに6週間にわたりドキソサイクリンを投与し,ドキソサイクリンの投与を停止して12週間が経過したのち解析した.その結果,ほぼすべての全骨髄細胞は12週間のうちにGFPの蛍光を完全に失ったが,細胞分裂の頻度の低い造血幹細胞および多能性未分化細胞はGFPの蛍光を保持していた.さらに,雄に由来する造血幹細胞および多能性未分化細胞は,雌に由来する細胞と比較して,より高いGFPの蛍光を保持していた.以上の結果から,雌の造血幹細胞は雄の造血幹細胞と比較して,より分裂頻度の高いことが明らかになった.
2.雌において亢進した造血幹細胞の分裂頻度は卵巣に由来するエストロゲンにより制御される
この造血幹細胞の分裂頻度の雌雄差がどのように制御されているのかを検討するため,生殖巣を除去したときの造血幹細胞へのBrdUの取り込みについて解析した.その結果,精巣の除去は雄の造血幹細胞の分裂頻度になんら影響をあたえなかったが,卵巣の除去により,雌にみられた造血幹細胞の分裂頻度の亢進がみられなくなった.つまり,雌における造血幹細胞の分裂頻度の亢進は卵巣により制御されていることが明らかになった.
卵巣がどのように造血幹細胞の分裂を制御しているのかを解明するため,卵巣に由来する性ホルモンを投与する実験を行った.その結果,エストロゲンの投与により造血幹細胞の分裂が強く促進された.一方で,プロゲステロンやテストステロンは造血幹細胞の分裂に影響をあたえなかった.また,エストロゲンの投与は脾臓における赤血球の産生を促進することも見い出された.
エストロゲンの低下は造血幹細胞の分裂頻度の低下につながるのだろうか? エストロゲンの産生を抑制するアロマターゼ阻害剤のひとつであるアナストロゾールを投与する実験を行った.雌のマウスにアナストロゾールを投与したところ,造血幹細胞の分裂頻度の低下が認められたが,雄のマウスへの投与ではなんら影響は認められなかった.以上の結果から,造血幹細胞の分裂は卵巣に由来するエストロゲンの作用により促進されることが示された.
3.エストロゲン受容体αがエストロゲンに依存して造血幹細胞の分裂を制御する
エストロゲンがどのように造血幹細胞に作用しているのかを解明するため,造血幹細胞における性ホルモンの受容体の発現を定量的PCR法により検討した.その結果,造血幹細胞はエストロゲン受容体αを高く発現していること,また,エストロゲン受容体β,プロゲステロン受容体,アンドロゲン受容体など,ほかの受容体は低くしか発現していないことが見い出された.そこでこれらの知見から,エストロゲン受容体αがエストロゲンに依存的な造血幹細胞の分裂を制御しているのではないかと仮定した.エストロゲン受容体αのノックアウトマウスを用いて,エストロゲン受容体αが造血幹細胞の分裂頻度の雌雄差を制御しているかどうか,BrdUの取り込みにより検討した.その結果,野生型マウスにおいてみられた造血幹細胞の分裂頻度の雌雄差は,エストロゲン受容体αノックアウトマウスではみられなかった.この結果から,エストロゲン受容体αが造血幹細胞の分裂を制御していることが示された.
エストロゲン受容体αノックアウトマウスは卵巣の機能がいちじるしく欠損しており不妊である.つまり,エストロゲン受容体αノックアウトマウスにおいてみられた造血幹細胞の分裂頻度の変化は,卵巣の機能の欠損による可能性が考えられた.そこで,エストロゲン受容体αを造血細胞において特異的に欠損したコンディショナルノックアウトマウスを作製した.このマウスを用いて造血幹細胞の分裂頻度の雌雄差について検討したところ,エストロゲン受容体αを造血細胞において特異的に欠損させることにより造血幹細胞の分裂頻度の雌雄差は消失した.さらに,エストロゲンを投与した際の造血幹細胞の分裂の亢進もまったくみられなった.また,造血幹細胞の培養の際にエストロゲンをくわえることにより造血幹細胞の分裂が亢進したことから,造血幹細胞はそれ自体が発現するエストロゲン受容体αを介してエストロゲンに応答し細胞分裂を亢進させていることが示された.
4.妊娠により造血幹細胞の数および分裂頻度はエストロゲン受容体αに依存して増加する
このようなエストロゲンによる造血幹細胞の制御には,どのような生理学的な意味があるのだろうか? 生理的な条件においてエストロゲンの量が増える場合として妊娠があげられる.そこで,妊娠中のマウスの造血機能および造血幹細胞の機能について評価した.その結果,妊娠中にはおもに赤血球系細胞の増加により脾臓がいちじるしく肥大することが認められた.さらに,妊娠中には骨髄および脾臓における造血幹細胞の数がいちじるしく増加し,造血幹細胞の分裂頻度も大きく亢進した.
この妊娠によりひき起こされる造血幹細胞および赤血球系細胞の応答はエストロゲン受容体αにより制御されているのかどうか検討するため,造血細胞に特異的なエストロゲン受容体αのコンディショナルノックアウトマウスを妊娠させて,その造血器を解析した.興味深いことに,妊娠により上昇した造血幹細胞の数,分裂頻度,赤血球系細胞の数は,いずれも造血細胞において特異的にエストロゲン受容体αを欠損させることにより大きく低下した.つまり,妊娠により起こる造血幹細胞の活性化および赤血球系細胞の増加は,エストロゲンが造血細胞に発現するエストロゲン受容体αに作用することによりひき起こされていることが示された.
おわりに
この研究では,エストロゲンが造血細胞に発現するエストロゲン受容体αに作用することにより,雄と比較して雌の造血幹細胞の分裂頻度が亢進し,雌雄差の生じることをはじめて解明した(図1).エストロゲンの量が増加する妊娠中には,造血幹細胞の分裂の亢進および赤血球系細胞の増加が造血細胞に発現するエストロゲン受容体αに依存して誘導されていた.妊娠中は,血漿の増加に対し赤血球の増加が不足し慢性的な貧血の起こることが知られている6).造血幹細胞は妊娠という変化に対しエストロゲンを介して応答し,自己複製能を亢進させ赤血球の産生を誘導することにより,造血に対する需要の増加に応えていると考えられた.今後は,妊娠中に造血幹細胞がエストロゲンに応答することが,妊娠の維持や胎児の成長にどのような影響をあたえるのかを解明することが重要であると考えている.
文 献
- Nakada, D., Levi, B. P. & Morrison, S. J.: Integrating physiological regulation with stem cell and tissue homeostasis. Neuron, 70, 703-718 (2011)[PubMed]
- O'Brien, L. E., Soliman, S. S., Li, X. et al.: Altered modes of stem cell division drive adaptive intestinal growth. Cell, 147, 603-614 (2011)[PubMed]
- Yilmaz, O. H., Katajisto, P., Lamming, D. W. et al.: mTORC1 in the Paneth cell niche couples intestinal stem-cell function to calorie intake. Nature, 486, 490-495 (2012)[PubMed]
- Sousa-Nunes, R., Yee, L. L. & Gould, A. P.: Fat cells reactivate quiescent neuroblasts via TOR and glial insulin relays in Drosophila. Nature, 471, 508-512 (2011)[PubMed]
- Chell, J. M. & Brand, A. H.: Nutrition-responsive glia control exit of neural stem cells from quiescence. Cell, 143, 1161-1173 (2010)[PubMed]
- Sifakis, S. & Pharmakides, G.: Anemia in pregnancy. Ann. NY Acad. Sci., 900, 125-136 (2000)[PubMed]
著者プロフィール
略歴:2005年 名古屋大学大学院理学研究科 修了,2006年より米国Michigan大学 ポストドクトラルフェローを経て,2011年より米国Baylor College of Medicine助教.
研究テーマ:幹細胞の自己複製を制御する分子機構.
抱負:個体のなかの一細胞である造血幹細胞が,ほかの細胞あるいは組織とどのように相互作用することにより,造血器における恒常性を維持しているのかを解明したい.
© 2014 中田 大介 Licensed under CC 表示 2.1 日本