チロシンキナーゼBtk29Aはショウジョウバエの卵巣のニッチにおいてWntシグナル伝達系を増強することにより生殖幹細胞の増殖を停止させる
濱田 (川口) 典子・山元大輔
(東北大学大学院生命科学研究科 脳機能遺伝分野)
email:山元大輔
DOI: 10.7875/first.author.2014.019
Btk29A promotes Wnt4 signaling in the niche to terminate germ cell proliferation in Drosophila.
Noriko Hamada-Kawaguchi, Beston F. Nore, Yusuke Kuwada, C. I. Edvard Smith, Daisuke Yamamoto
Science, 343, 294-297 (2014)
幹細胞の増殖および分化の場はニッチとよばれる.卵巣の生殖幹細胞は体細胞により構成されるニッチからのシグナルをうけて自己複製しながら,同時に,卵細胞への分化を運命づけられた娘細胞を生み出す.この増殖と分化のバランスを失すると,幹細胞が消滅して生殖細胞ができなくなったり,逆に,幹細胞が過剰に形成されて腫瘍を生じたりすることになる.筆者らは,ニッチにおいてチロシンキナーゼBtk29Aのはたらきによりβカテニンがチロシンリン酸化されると,βカテニンの転写活性化能が上昇しpiwi遺伝子の発現が高まる結果,ニッチを起源とするPiwiに依存性のシグナルを介して2次生殖幹細胞の増殖が停止し,卵細胞への分化にむかうことを発見した.哺乳類細胞においても同様に,ヒトのBtkによりβカテニンのチロシンリン酸化と転写活性化能の上昇が生じたことから,これは進化的に保存された発生の過程におけるスイッチ機構であると考えられた.
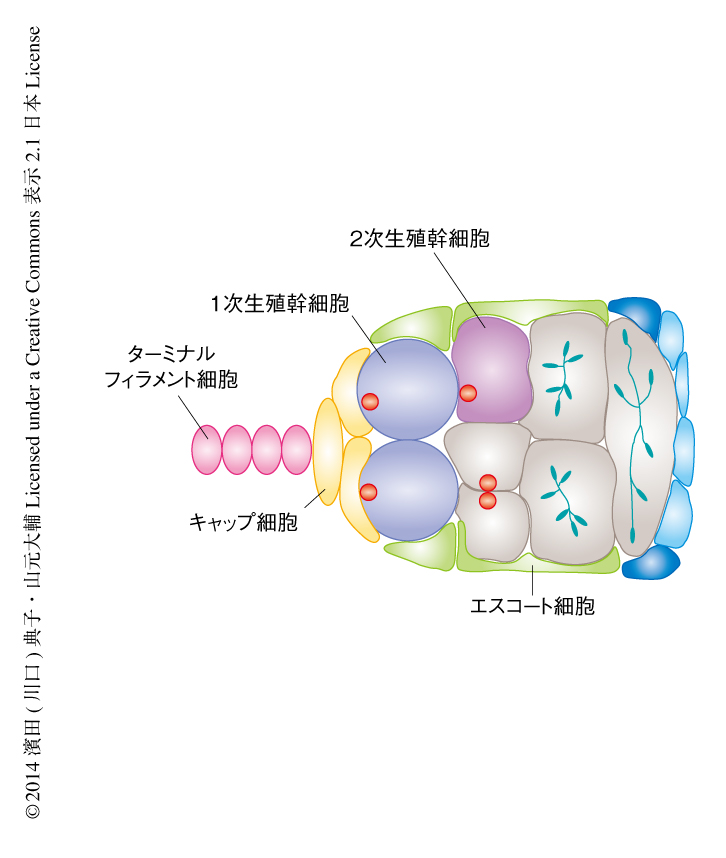
幹細胞の増殖と分化を制御する体細胞の“ゆりかご”はニッチとよばれる.ニッチの概念を生んだショウジョウバエの卵巣の形成細胞巣では,すべての生殖細胞群とニッチ構成細胞群とを個別に同定し操作することが可能であり,幹細胞の制御をin vivoにおいて研究する好個の系になっている(図1).卵巣は棒状の卵巣小管が両端で束ねられた構造をしており,形成細胞巣はこの卵巣小管の前端部に存在する.形成細胞巣の基部にはニッチの最前部を構成する体細胞であるターミナルフィラメント細胞が数個一列に並んでいる.つづいて,キャップ細胞とよばれるニッチの核心をなす体細胞が卵巣小管の外枠にはりつくように存在し,さらに,後部側にエスコート細胞という別の体細胞が位置する.1次生殖幹細胞は卵巣小管の中央(内部)にあり,つねにキャップ細胞と接している.1次生殖幹細胞は卵巣小管あたり通常2~3個である.そのすぐ後方には1次生殖幹細胞の娘細胞にあたる2次生殖幹細胞であるシストブラストが数個存在し,これらはすでにキャップ細胞との接触を断っている.そして,さらに後方におのおののシストブラストが4回の等分裂をへて形成されたシストがある.おのおののシストは16個のシストサイトからなるクローンで,シンシチウムをなし,それはやがてひとつの卵室を形成する.16個のシストサイトのうち,もっとも後方に位置する1個が卵細胞,残りは哺育細胞へと分化する.生殖系細胞はいずれもVasaを発現するので,このタンパク質の抗体陽性反応がよいマーカーとなる.生殖系細胞のうち1次生殖幹細胞とシストブラストは大型の細胞で,微小管に富んだ丸いスペクトロソームという構造体をもつことが特徴である.ひとつのシストブラストの分裂により生じたシストサイトは,スペクトロソームに由来するフュソームという繊維状の構造により互いにつながったやや小型の細胞である.スペクトロソームとフュソームはモノクローン抗体1B1に陽性であり,スペクトロソームをもつ細胞は幹細胞の特性を有し,フュソームをもつ細胞は卵細胞への分化経路に入った細胞であるとの見方ができる.
このような1次生殖幹細胞→シストブラスト→シストサイトという,増殖と分化の協調のとれた細胞活動がなぜ可能なのか,それを説明するために多くの研究が行われ,その結果,以下のようなモデルが提唱されている1).1)1次生殖幹細胞はデフォルト状態では増殖をくり返す.2)1次生殖幹細胞はカドヘリンに依存してキャップ細胞と接着しており,キャップ細胞から分泌されるDppの作用により分化が抑制されるため,自己保存的に分裂して増殖能を維持する.3)1次生殖幹細胞の前後軸の方向への分裂により生じたシストブラストは,後方に押し出されてキャップ細胞との接触を失い,その結果,Dppの作用から解放されて卵細胞への分化経路に入る.分化の引き金はbam遺伝子の転写開始であり,それはbam遺伝子の転写を直接に抑制するDppシグナルが作用しなくなったことの帰結である.
このモデルでは,“分化経路に入ること”と“増殖の停止”とが表裏一体の関係にあり,分離不可能であるかのようにとらえられている.ところが,筆者らは,この考えとはあいいれない表現型を呈する変異体を分離した.それは本来なら生殖細胞が分化へとむかいシストの形成が進む段階になっても増殖が停止せず卵巣に腫瘍を形成する変異体で,変異はBtk29A遺伝子というチロシンキナーゼをコードする遺伝子に生じていた.Btk29A遺伝子はヒトのBtk遺伝子のオルソログである.ヒトのBtk遺伝子は抗体産生細胞であるB細胞の分化に必須であるため,その変異はX連鎖無ガンマグロブリン血症として知られる先天性免疫不全を招来する.筆者らは,ショウジョウバエのBtk29A変異体における卵巣腫瘍の原因の究明を進めるなかで,2次生殖幹細胞の増殖を停止させるには,キャップ細胞から分泌されるDppのほか,ニッチに由来する別のシグナルが必要であること,このシグナルの生成のためにはニッチを構成する別の細胞であるエスコート細胞にPiwiが発現しなければならないこと,Btk29Aがβカテニンをチロシンリン酸化することによりpiwi遺伝子の転写が活性化され,それにより増殖を停止するシグナルが発せられること,そして,βカテニンはWntシグナル伝達系においてはたらいていること,を明らかにした.すなわち,1次生殖幹細胞における増殖と分化の切り換えはニッチのキャップ細胞から分泌されるDppにより,そして,2次生殖幹細胞における増殖の停止はニッチのエスコート細胞に由来するPiwiに依存性のシグナルにより,独立に制御されていることがはじめて解明された.
Btk29A遺伝子からは1型と2型の2つのアイソフォームを産生され,2型がヒトのBtkのオルソログである.この2型Btk29Aを特異的に欠失した変異体の形成細胞巣には,スペクトロソームをもつ生殖幹細胞が過剰に形成された.それらはキャップ細胞との接触をもたないことから2次生殖幹細胞であるシストブラストと考えられた(図2).このように,2型Btk29Aの欠失による異常は生殖系細胞に生じたが,この異常を救済するには正常なBtk29A遺伝子を生殖系細胞ではなく体細胞,すなわちニッチ,とくにエスコート細胞に強制発現させることが必要であった.また,RNAi法によりBtk29Aをノックダウンする実験でも,体細胞におけるノックダウンによりシストブラスト様細胞の過剰な形成がひき起こされた.したがって,Btk29Aは体細胞のニッチにおいて機能し生殖幹細胞の増殖を抑制すると結論された.
この結果は,ニッチから生殖幹細胞に作用して生殖幹細胞の増殖の制御にかかわる細胞間シグナルが存在することを暗示していた.さきに述べたとおり,ニッチに発する生殖幹細胞の制御シグナルとしてはDppがよく知られているが,2型Btk29A欠失変異体の卵巣ではその発現に異常はなく,また,その下流のタンパク質であるMadは1次生殖幹細胞において正常にリン酸化されていた.つまり,2型Btk29A欠失変異体に生じる生殖幹細胞の過剰な増殖にDppは関与していないと考えられた.じつは,ニッチにおいてはたらき生殖幹細胞を制御する第2のシグナル伝達系の存在は以前から指摘されていた.シグナルの本体は不明ながら,このシグナル伝達系が正常にはたらくためにはニッチに発現するPiwiが必要であることが知られていたのである.実際に,2型Btk29A欠失変異体の卵巣ではPiwiをコードするmRNAが著明に減少し,また,Piwiはニッチにおいて発現が低下していた.PiwiにはpiRNAとよばれる小分子RNAが結合し,この複合体にはトランスポゾンの発現を抑制する機能がある.2型Btk29A欠失変異体の卵巣の体細胞ではPiwiの発現の低下にともないトランスポゾンの活性が上昇していた.ただし,トランスポゾンの発現の抑制がPiwiによる生殖幹細胞の増殖の制御にどう関与するのか,あるいは,この2つの現象は同時並列的に生じているだけで相互に因果関係はないのか,この点はいまだ大きな謎として残っている2).
では,Btk29AとPiwiとはどう関係しているのであろうか.そのヒントを得るには,Btk29Aがリン酸化するのはどのタンパク質なのか,その探索がまず必要であった.Btk29Aは細胞接合部のアドヘレンスジャンクションに局在することからアドヘレンスジャンクションを構成するタンパク質に着目して精査したところ,2型Btk29A欠失変異体ではβカテニンがアドヘレンスジャンクションに過剰に集積することが免疫組織化学的に観察された.そこで,アドヘレンスジャンクションにおいてβカテニンに結合しているEカドヘリンを卵巣抽出物の免疫沈降により回収し,そこに含まれるβカテニンを野生型と2型Btk29A欠失変異体とで比較したところ,Eカドヘリンにより標準化したβカテニンの量は2型Btk29A欠失変異体において明らかに増加していた.くわえて,免疫沈降物に含まれるβカテニンのチロシンリン酸化は,野生型と比較して2型Btk29A欠失変異体においては顕著に低下していた.2型Btk29A欠失変異体から得たβカテニンに野生型に由来するBtk29Aをin vitroにおいて作用させると正常にチロシンリン酸化されたことから,βカテニンはin vivoにおいてBtk29Aにより直接にリン酸化されると考えられた.これらの観察事実は,βカテニンはBtk29Aによりチロシンリン酸化されると細胞接合部から細胞質へと遊離しやすくなることを意味した.βカテニンが核に移行すると転写因子として機能することはよく知られているので,Btk29Aによるチロシンリン酸化がβカテニンを介した転写制御を変化させる可能性が浮上してきた.
サルの腎臓に由来する株化細胞であるCOS-7細胞にヒトのBtkを発現させたところ,内在性のβカテニンにチロシンリン酸化が起こり,Btkのキナーゼドメインを失活させるとこの効果は失われた.また,Btk29Aを発現させた場合も同様に,COS-7細胞に内在的に発現しているβカテニンがチロシンリン酸化された.こうして,BtkあるいはBtk29Aによるβカテニンのチロシンリン酸化はショウジョウバエからヒトまで保存された一般性のある現象であり,発生の過程における分子スイッチとして広く機能する可能性が示された.
さきの結果から,βカテニンのチロシンリン酸化がβカテニンの細胞膜から細胞質への遊離を促進し,核への移行の可能なプールを増大させる可能性が示唆された.そこで,BtkあるいはBtk29Aによりチロシンリン酸化されることでβカテニンの転写活性化能に変化が生じるかどうかを検討した.COS-7細胞を用いてTCFレポーターアッセイを行ったところ,βカテニンによるレポーターの転写はBtkの共発現により約6倍に上昇した.つぎに,in vivoにおけるβカテニンの転写活性化能を評価するため,Ubx遺伝子のエンハンサー領域にlacZ遺伝子を接続したレポーターの活性をトランスジェニックショウジョウバエの胚中腸において観察した.すると,このレポーターの発現はBtk29Aのノックダウンによりいちじるしく抑制された.これらの結果から,βカテニンのチロシンリン酸化は,βカテニンの細胞内局在を変えるにとどまらず,転写活性化能を著明に上昇させるという,これまで看過されてきた機能修飾機構の存在が明らかになった.
細胞質のβカテニンはGSK3βによりセリン残基およびスレオニン残基がリン酸化されプロテアソームにおいて分解される.しかし,Wntシグナルの入力があるとGSK3βによるリン酸化が阻害され,細胞質にβカテニンが蓄積してその核への移行が可能になることが知られている3).そこで,生殖幹細胞の過剰な増殖をひき起こすWnt遺伝子群の変異体を探索した結果,Wnt4遺伝子が確かにここに関与することを見い出した.
まとめると,Btk29AはWntシグナル伝達系において機能するβカテニンをチロシンリン酸化し,これにより転写活性化能の上昇したβカテニンはPiwiの発現をひき起こして,その結果,ニッチから生殖幹細胞へ増殖を抑制するシグナルが発せられる(図3).
この研究により,卵巣のニッチはDppを介した1次生殖幹細胞の分化の抑制のほかに,Piwiに依存性のシグナルを介した2次生殖幹細胞の増殖の停止により,協調のとれた生殖細胞の持続的な産生を可能にしていることが明らかになった.そのなかで,Btk29AあるいはBtkによるβカテニンのチロシンリン酸化が,進化的に保存された分子スイッチとして生体の多くの機能制御に寄与している可能性をも見い出した.
さて,こうしてようやくその一端を現わしたニッチによる生殖幹細胞の増殖の抑制機構であるが,いまだ重要な多くの点が不明のまま残されている.チロシンリン酸化されたβカテニンはpiwi遺伝子の転写を直接に活性化するのかどうか,ニッチに由来するPiwiに依存性のシグナルの本体は何か,さらには,2次生殖幹細胞の増殖の停止をもたらす直接の機構はどのようなものか.これまでの研究から,2型Btk29A欠失変異体ではBamの結合パートナーをコードするbgcn遺伝子の転写が著しく亢進していることがわかっているほか,Bam-Bgcn複合体により翻訳を制御されるmei-P26遺伝子の欠損が,2型Btk29Aの欠失と非常に類似した生殖細胞の過剰な増殖をひき起こすことが知られていることから,ニッチに由来するシグナルの作用点はこのあたりにあるのではないかと推理している(図3).今後の解明が待たれる.
東北大学大学院生命科学研究科 研究員.
山元 大輔(Daisuke Yamamoto)
略歴:1981年 北海道大学大学院理学研究科にて博士号取得.三菱化成生命科学研究所,Northwestern大学School of Medicine博士研究員,1999年 早稲田大学人間科学部 教授を経て,2005年より東北大学大学院生命科学研究科 教授.
研究テーマ:性の生物学.
研究室URL:http://www.biology.tohoku.ac.jp/lab-www/yamamoto_lab/index.html
© 2014 濱田 (川口) 典子・山元大輔 Licensed under CC 表示 2.1 日本
(東北大学大学院生命科学研究科 脳機能遺伝分野)
email:山元大輔
DOI: 10.7875/first.author.2014.019
Btk29A promotes Wnt4 signaling in the niche to terminate germ cell proliferation in Drosophila.
Noriko Hamada-Kawaguchi, Beston F. Nore, Yusuke Kuwada, C. I. Edvard Smith, Daisuke Yamamoto
Science, 343, 294-297 (2014)
要 約
幹細胞の増殖および分化の場はニッチとよばれる.卵巣の生殖幹細胞は体細胞により構成されるニッチからのシグナルをうけて自己複製しながら,同時に,卵細胞への分化を運命づけられた娘細胞を生み出す.この増殖と分化のバランスを失すると,幹細胞が消滅して生殖細胞ができなくなったり,逆に,幹細胞が過剰に形成されて腫瘍を生じたりすることになる.筆者らは,ニッチにおいてチロシンキナーゼBtk29Aのはたらきによりβカテニンがチロシンリン酸化されると,βカテニンの転写活性化能が上昇しpiwi遺伝子の発現が高まる結果,ニッチを起源とするPiwiに依存性のシグナルを介して2次生殖幹細胞の増殖が停止し,卵細胞への分化にむかうことを発見した.哺乳類細胞においても同様に,ヒトのBtkによりβカテニンのチロシンリン酸化と転写活性化能の上昇が生じたことから,これは進化的に保存された発生の過程におけるスイッチ機構であると考えられた.
はじめに
幹細胞の増殖と分化を制御する体細胞の“ゆりかご”はニッチとよばれる.ニッチの概念を生んだショウジョウバエの卵巣の形成細胞巣では,すべての生殖細胞群とニッチ構成細胞群とを個別に同定し操作することが可能であり,幹細胞の制御をin vivoにおいて研究する好個の系になっている(図1).卵巣は棒状の卵巣小管が両端で束ねられた構造をしており,形成細胞巣はこの卵巣小管の前端部に存在する.形成細胞巣の基部にはニッチの最前部を構成する体細胞であるターミナルフィラメント細胞が数個一列に並んでいる.つづいて,キャップ細胞とよばれるニッチの核心をなす体細胞が卵巣小管の外枠にはりつくように存在し,さらに,後部側にエスコート細胞という別の体細胞が位置する.1次生殖幹細胞は卵巣小管の中央(内部)にあり,つねにキャップ細胞と接している.1次生殖幹細胞は卵巣小管あたり通常2~3個である.そのすぐ後方には1次生殖幹細胞の娘細胞にあたる2次生殖幹細胞であるシストブラストが数個存在し,これらはすでにキャップ細胞との接触を断っている.そして,さらに後方におのおののシストブラストが4回の等分裂をへて形成されたシストがある.おのおののシストは16個のシストサイトからなるクローンで,シンシチウムをなし,それはやがてひとつの卵室を形成する.16個のシストサイトのうち,もっとも後方に位置する1個が卵細胞,残りは哺育細胞へと分化する.生殖系細胞はいずれもVasaを発現するので,このタンパク質の抗体陽性反応がよいマーカーとなる.生殖系細胞のうち1次生殖幹細胞とシストブラストは大型の細胞で,微小管に富んだ丸いスペクトロソームという構造体をもつことが特徴である.ひとつのシストブラストの分裂により生じたシストサイトは,スペクトロソームに由来するフュソームという繊維状の構造により互いにつながったやや小型の細胞である.スペクトロソームとフュソームはモノクローン抗体1B1に陽性であり,スペクトロソームをもつ細胞は幹細胞の特性を有し,フュソームをもつ細胞は卵細胞への分化経路に入った細胞であるとの見方ができる.
このような1次生殖幹細胞→シストブラスト→シストサイトという,増殖と分化の協調のとれた細胞活動がなぜ可能なのか,それを説明するために多くの研究が行われ,その結果,以下のようなモデルが提唱されている1).1)1次生殖幹細胞はデフォルト状態では増殖をくり返す.2)1次生殖幹細胞はカドヘリンに依存してキャップ細胞と接着しており,キャップ細胞から分泌されるDppの作用により分化が抑制されるため,自己保存的に分裂して増殖能を維持する.3)1次生殖幹細胞の前後軸の方向への分裂により生じたシストブラストは,後方に押し出されてキャップ細胞との接触を失い,その結果,Dppの作用から解放されて卵細胞への分化経路に入る.分化の引き金はbam遺伝子の転写開始であり,それはbam遺伝子の転写を直接に抑制するDppシグナルが作用しなくなったことの帰結である.
このモデルでは,“分化経路に入ること”と“増殖の停止”とが表裏一体の関係にあり,分離不可能であるかのようにとらえられている.ところが,筆者らは,この考えとはあいいれない表現型を呈する変異体を分離した.それは本来なら生殖細胞が分化へとむかいシストの形成が進む段階になっても増殖が停止せず卵巣に腫瘍を形成する変異体で,変異はBtk29A遺伝子というチロシンキナーゼをコードする遺伝子に生じていた.Btk29A遺伝子はヒトのBtk遺伝子のオルソログである.ヒトのBtk遺伝子は抗体産生細胞であるB細胞の分化に必須であるため,その変異はX連鎖無ガンマグロブリン血症として知られる先天性免疫不全を招来する.筆者らは,ショウジョウバエのBtk29A変異体における卵巣腫瘍の原因の究明を進めるなかで,2次生殖幹細胞の増殖を停止させるには,キャップ細胞から分泌されるDppのほか,ニッチに由来する別のシグナルが必要であること,このシグナルの生成のためにはニッチを構成する別の細胞であるエスコート細胞にPiwiが発現しなければならないこと,Btk29Aがβカテニンをチロシンリン酸化することによりpiwi遺伝子の転写が活性化され,それにより増殖を停止するシグナルが発せられること,そして,βカテニンはWntシグナル伝達系においてはたらいていること,を明らかにした.すなわち,1次生殖幹細胞における増殖と分化の切り換えはニッチのキャップ細胞から分泌されるDppにより,そして,2次生殖幹細胞における増殖の停止はニッチのエスコート細胞に由来するPiwiに依存性のシグナルにより,独立に制御されていることがはじめて解明された.
1.Btk29Aはニッチのエスコート細胞において機能する
Btk29A遺伝子からは1型と2型の2つのアイソフォームを産生され,2型がヒトのBtkのオルソログである.この2型Btk29Aを特異的に欠失した変異体の形成細胞巣には,スペクトロソームをもつ生殖幹細胞が過剰に形成された.それらはキャップ細胞との接触をもたないことから2次生殖幹細胞であるシストブラストと考えられた(図2).このように,2型Btk29Aの欠失による異常は生殖系細胞に生じたが,この異常を救済するには正常なBtk29A遺伝子を生殖系細胞ではなく体細胞,すなわちニッチ,とくにエスコート細胞に強制発現させることが必要であった.また,RNAi法によりBtk29Aをノックダウンする実験でも,体細胞におけるノックダウンによりシストブラスト様細胞の過剰な形成がひき起こされた.したがって,Btk29Aは体細胞のニッチにおいて機能し生殖幹細胞の増殖を抑制すると結論された.
2.Btk29AはニッチにおけるPiwiの発現に必要である
この結果は,ニッチから生殖幹細胞に作用して生殖幹細胞の増殖の制御にかかわる細胞間シグナルが存在することを暗示していた.さきに述べたとおり,ニッチに発する生殖幹細胞の制御シグナルとしてはDppがよく知られているが,2型Btk29A欠失変異体の卵巣ではその発現に異常はなく,また,その下流のタンパク質であるMadは1次生殖幹細胞において正常にリン酸化されていた.つまり,2型Btk29A欠失変異体に生じる生殖幹細胞の過剰な増殖にDppは関与していないと考えられた.じつは,ニッチにおいてはたらき生殖幹細胞を制御する第2のシグナル伝達系の存在は以前から指摘されていた.シグナルの本体は不明ながら,このシグナル伝達系が正常にはたらくためにはニッチに発現するPiwiが必要であることが知られていたのである.実際に,2型Btk29A欠失変異体の卵巣ではPiwiをコードするmRNAが著明に減少し,また,Piwiはニッチにおいて発現が低下していた.PiwiにはpiRNAとよばれる小分子RNAが結合し,この複合体にはトランスポゾンの発現を抑制する機能がある.2型Btk29A欠失変異体の卵巣の体細胞ではPiwiの発現の低下にともないトランスポゾンの活性が上昇していた.ただし,トランスポゾンの発現の抑制がPiwiによる生殖幹細胞の増殖の制御にどう関与するのか,あるいは,この2つの現象は同時並列的に生じているだけで相互に因果関係はないのか,この点はいまだ大きな謎として残っている2).
3.βカテニンはBtk29Aのin vivoにおける基質である
では,Btk29AとPiwiとはどう関係しているのであろうか.そのヒントを得るには,Btk29Aがリン酸化するのはどのタンパク質なのか,その探索がまず必要であった.Btk29Aは細胞接合部のアドヘレンスジャンクションに局在することからアドヘレンスジャンクションを構成するタンパク質に着目して精査したところ,2型Btk29A欠失変異体ではβカテニンがアドヘレンスジャンクションに過剰に集積することが免疫組織化学的に観察された.そこで,アドヘレンスジャンクションにおいてβカテニンに結合しているEカドヘリンを卵巣抽出物の免疫沈降により回収し,そこに含まれるβカテニンを野生型と2型Btk29A欠失変異体とで比較したところ,Eカドヘリンにより標準化したβカテニンの量は2型Btk29A欠失変異体において明らかに増加していた.くわえて,免疫沈降物に含まれるβカテニンのチロシンリン酸化は,野生型と比較して2型Btk29A欠失変異体においては顕著に低下していた.2型Btk29A欠失変異体から得たβカテニンに野生型に由来するBtk29Aをin vitroにおいて作用させると正常にチロシンリン酸化されたことから,βカテニンはin vivoにおいてBtk29Aにより直接にリン酸化されると考えられた.これらの観察事実は,βカテニンはBtk29Aによりチロシンリン酸化されると細胞接合部から細胞質へと遊離しやすくなることを意味した.βカテニンが核に移行すると転写因子として機能することはよく知られているので,Btk29Aによるチロシンリン酸化がβカテニンを介した転写制御を変化させる可能性が浮上してきた.
4.ヒトのBtkもまたβカテニンをチロシンリン酸化する
サルの腎臓に由来する株化細胞であるCOS-7細胞にヒトのBtkを発現させたところ,内在性のβカテニンにチロシンリン酸化が起こり,Btkのキナーゼドメインを失活させるとこの効果は失われた.また,Btk29Aを発現させた場合も同様に,COS-7細胞に内在的に発現しているβカテニンがチロシンリン酸化された.こうして,BtkあるいはBtk29Aによるβカテニンのチロシンリン酸化はショウジョウバエからヒトまで保存された一般性のある現象であり,発生の過程における分子スイッチとして広く機能する可能性が示された.
5.チロシンリン酸化はβカテニンの転写活性化能を上昇させる
さきの結果から,βカテニンのチロシンリン酸化がβカテニンの細胞膜から細胞質への遊離を促進し,核への移行の可能なプールを増大させる可能性が示唆された.そこで,BtkあるいはBtk29Aによりチロシンリン酸化されることでβカテニンの転写活性化能に変化が生じるかどうかを検討した.COS-7細胞を用いてTCFレポーターアッセイを行ったところ,βカテニンによるレポーターの転写はBtkの共発現により約6倍に上昇した.つぎに,in vivoにおけるβカテニンの転写活性化能を評価するため,Ubx遺伝子のエンハンサー領域にlacZ遺伝子を接続したレポーターの活性をトランスジェニックショウジョウバエの胚中腸において観察した.すると,このレポーターの発現はBtk29Aのノックダウンによりいちじるしく抑制された.これらの結果から,βカテニンのチロシンリン酸化は,βカテニンの細胞内局在を変えるにとどまらず,転写活性化能を著明に上昇させるという,これまで看過されてきた機能修飾機構の存在が明らかになった.
6.ニッチの“Btk29A-βカテニン”スイッチはWntシグナル伝達系においてはたらく
細胞質のβカテニンはGSK3βによりセリン残基およびスレオニン残基がリン酸化されプロテアソームにおいて分解される.しかし,Wntシグナルの入力があるとGSK3βによるリン酸化が阻害され,細胞質にβカテニンが蓄積してその核への移行が可能になることが知られている3).そこで,生殖幹細胞の過剰な増殖をひき起こすWnt遺伝子群の変異体を探索した結果,Wnt4遺伝子が確かにここに関与することを見い出した.
まとめると,Btk29AはWntシグナル伝達系において機能するβカテニンをチロシンリン酸化し,これにより転写活性化能の上昇したβカテニンはPiwiの発現をひき起こして,その結果,ニッチから生殖幹細胞へ増殖を抑制するシグナルが発せられる(図3).
おわりに
この研究により,卵巣のニッチはDppを介した1次生殖幹細胞の分化の抑制のほかに,Piwiに依存性のシグナルを介した2次生殖幹細胞の増殖の停止により,協調のとれた生殖細胞の持続的な産生を可能にしていることが明らかになった.そのなかで,Btk29AあるいはBtkによるβカテニンのチロシンリン酸化が,進化的に保存された分子スイッチとして生体の多くの機能制御に寄与している可能性をも見い出した.
さて,こうしてようやくその一端を現わしたニッチによる生殖幹細胞の増殖の抑制機構であるが,いまだ重要な多くの点が不明のまま残されている.チロシンリン酸化されたβカテニンはpiwi遺伝子の転写を直接に活性化するのかどうか,ニッチに由来するPiwiに依存性のシグナルの本体は何か,さらには,2次生殖幹細胞の増殖の停止をもたらす直接の機構はどのようなものか.これまでの研究から,2型Btk29A欠失変異体ではBamの結合パートナーをコードするbgcn遺伝子の転写が著しく亢進していることがわかっているほか,Bam-Bgcn複合体により翻訳を制御されるmei-P26遺伝子の欠損が,2型Btk29Aの欠失と非常に類似した生殖細胞の過剰な増殖をひき起こすことが知られていることから,ニッチに由来するシグナルの作用点はこのあたりにあるのではないかと推理している(図3).今後の解明が待たれる.
文 献
- Losick, V. P., Morris, L. X., Fox, D. T. et al.: Drosophila stem cell niches: a decade of discovery suggests a unified view of stem cell regulation. Dev. Cell, 21, 159-171 (2011)[PubMed]
- Mani, S. R. & Juliano, C. E.: Untangling the web: the diverse functions of the PIWI/piRNA pathway. Mol. Reprod. Dev., 80, 632-664 (2013)[PubMed]
- Clevers, H. & Nusse, R.: Wnt/β-catenin signaling and disease. Cell, 149, 1192-1205 (2012)[PubMed]
著者プロフィール
東北大学大学院生命科学研究科 研究員.
山元 大輔(Daisuke Yamamoto)
略歴:1981年 北海道大学大学院理学研究科にて博士号取得.三菱化成生命科学研究所,Northwestern大学School of Medicine博士研究員,1999年 早稲田大学人間科学部 教授を経て,2005年より東北大学大学院生命科学研究科 教授.
研究テーマ:性の生物学.
研究室URL:http://www.biology.tohoku.ac.jp/lab-www/yamamoto_lab/index.html
© 2014 濱田 (川口) 典子・山元大輔 Licensed under CC 表示 2.1 日本