局所において起こるアポトーシスはモルフォゲンを産生する細胞の除去を介し哺乳類の発生の初期における脳の形成を制御する
野々村恵子・山口良文・三浦正幸
(東京大学大学院薬学系研究科 遺伝学教室)
email:野々村恵子,山口良文,三浦正幸
DOI: 10.7875/first.author.2014.012
Local apoptosis modulates early mammalian brain development through the elimination of morphogen-producing cells.
Keiko Nonomura, Yoshifumi Yamaguchi, Misato Hamachi, Masato Koike, Yasuo Uchiyama, Kenichi Nakazato, Atsushi Mochizuki, Asako Sakaue-Sawano, Atsushi Miyawaki, Hiroki Yoshida, Keisuke Kuida, Masayuki Miura
Developmental Cell, 27, 621-634 (2013)
脳の発生においては多数の細胞死が観察され,そのほとんどはアポトーシスである.アポトーシスは核の断片化と細胞質の凝集および分断を特徴する細胞死であり,ネクローシスなどのほかの細胞死と比べ細胞の組織からの除去がすばやく進行するとされる.これまで,アポトーシスは発生の初期において脳全体の細胞数を制限するのに必要であると考えられてきたが,筆者らは,アポトーシスを欠損したマウスの胎仔における脳形態の異常の原因は,細胞の過増殖ではなく神経管の閉鎖の異常とそののちの脳室の拡大の不全にあることを示した.また,脳の最前端に存在しモルフォゲンであるFGF8を産生することにより脳の発生において中心的な役割をはたす領域ANRに着目し,底板の側のANRにおいてFgf8遺伝子を発現する細胞がアポトーシスにより除去されており,この除去がFGF8の正常な分布と前脳腹側領域における神経上皮の正常な分化に必要であることを明らかにした.こうしたアポトーシスによるモルフォゲンを産生する細胞の除去はモルフォゲンの迅速な産生停止につながるため,限られた時間のなかでつぎつぎと誘導現象の進む発生の過程において,モルフォゲンの分布や量を制御するうえですぐれた方法であると考えられた.
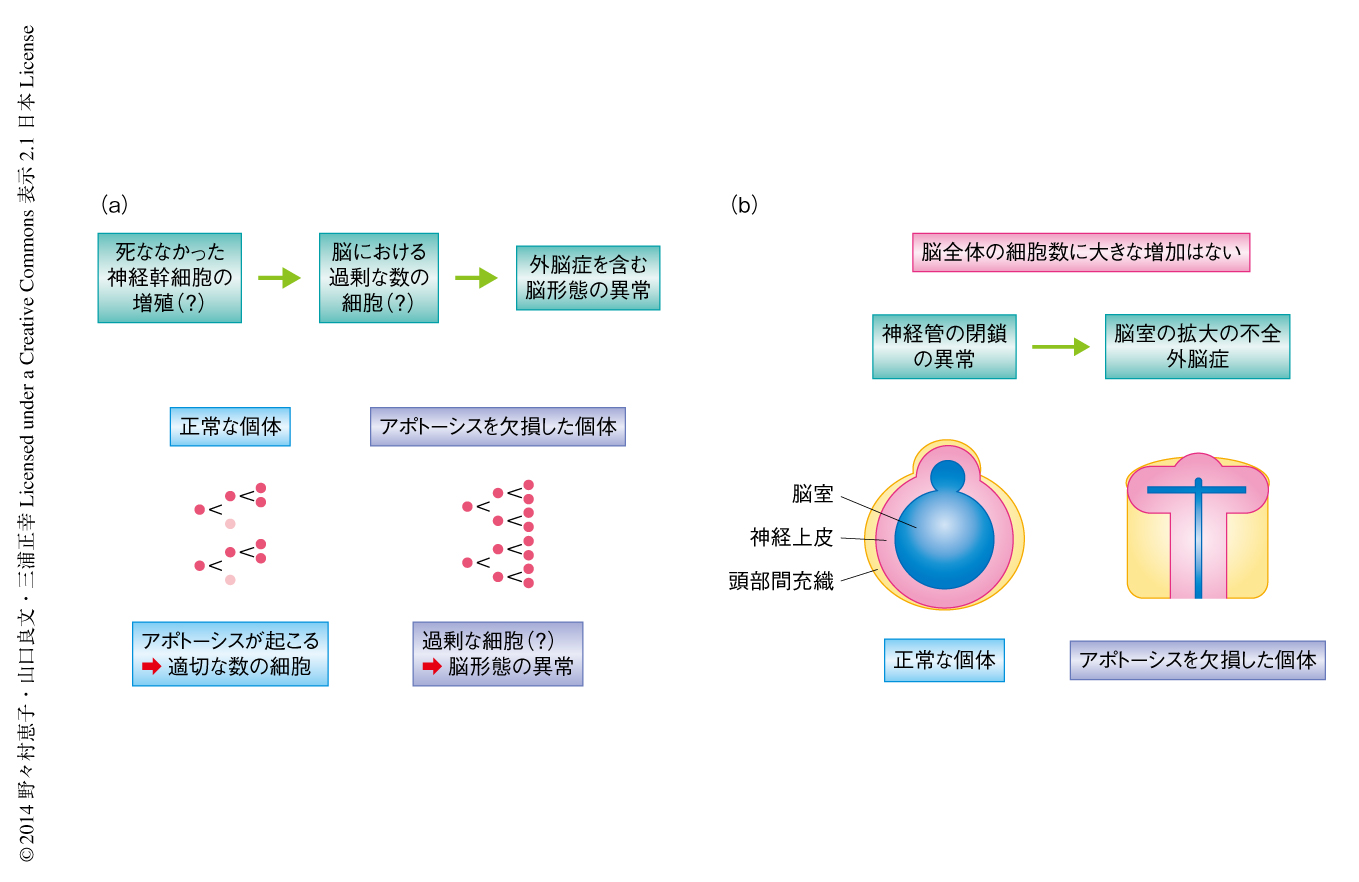
哺乳類の脳神経系の発生においては5~7割もの細胞が生まれては除去されていると考えられており,これらの細胞死の多くは生体のプログラムによりあらかじめスケジュールされたアポトーシスである.アポトーシスはシステインプロテアーゼであるカスパーゼの活性化によりひき起こされる細胞死であり,染色体の凝集および核の断片化と細胞質の凝集および分断化を特徴とする.カスパーゼの活性化から細胞の形態変化までにかかる時間は非常に短く,生体においても数十分以内である.さらに,アポトーシスを起こした細胞は周囲の細胞にすみやかに貪食される.このすみやかな貪食により,アポトーシスの際にはネクローシスに比べ細胞内容物の漏出が抑えられ周辺の組織の傷害が少ないとされる.これらの特徴から,アポトーシスは“すばやく”“きれいな”細胞除去システムといえる.哺乳類の脳の発生において観察されるアポトーシスは,カスパーゼ3,カスパーゼ9,Apaf-1,シトクロムcにより形成されるミトコンドリア経路に依存する.アポトーシスの実行に関与する遺伝子が欠損したマウスの胎仔では,アポトーシスが起こらず脳が頭蓋骨の外部に突出する外脳症などの形態異常を呈する1,2)(マウスにおいてみられる外脳症は,ヒトでは致死性の先天奇形である頭蓋と脳皮質が欠損した無脳症に相当すると考えられている.マウスに比べ妊娠期間のはるかに長いヒトでは,頭蓋の欠損により露出したニューロンが死滅してしまうからではないかと推察される).この外脳症の原因は,脳の発生においてニューロンのもとになる神経幹細胞が死なずに余分に増殖し,脳全体の細胞数が過剰になり脳が突出したためと推察されてきた3,4)(図1a).しかし,外脳症は脳の発生初期に生じる神経管の閉鎖の失敗により生じることも知られていた5).また,アポトーシスを欠損した胎仔の脳において実際に細胞数が増加しているのか,定量的に研究した報告もこれまで不足していた.このため,アポトーシスを欠損した胎仔において観察される脳の形態異常が本当に脳全体の細胞数の増加の結果であるかどうかは不明であった.
アポトーシスはANR(anterior neural ridge,前方神経隆起)とよばれる脳の最前端の領域(図2a)において神経管の閉鎖の前後にとくに大量に観察されるが,この領域に起こるアポトーシスの役割についても不明であった.ANRは腹側に存在する正中線領域である底板(floor plate),および,神経管の閉鎖により背側に形成される蓋板(roof plate)に隣接する.ANRからは拡散性の形態形成タンパク質であるモルフォゲンとしてFGF8が産生され,底板および蓋板からもやはり異なるモルフォゲンが産生されて,それらは神経上皮に拡散する.拡散したモルフォゲンの種類と勾配に応じ,神経上皮細胞は異なる種類の神経前駆細胞へと分化し異なる種類のニューロンを生み出すため,ANR,底板,蓋板は前脳の発生において中心的な役割をはたす領域である(シグナリングセンター).これまで多くの論文により,器官の発生におけるシグナリングセンターの役割が示されてきた.しかしながら,役割をおえたシグナリングセンターの細胞がどのような運命をたどるのかについてはあまりよくわかっていない.
この論文では,アポトーシスを欠損したマウスの脳全体の細胞数について定量的な手法により再検討し,アポトーシスは脳全体の細胞数の制御そのものには大きな影響をあたえないことを明らかにした(図1b).さらに,ANRにおけるアポトーシスは,この領域の神経管の閉鎖とそののちの脳室の拡大に必要であり,FGF8を産生する細胞を適切なタイミングで除去することでFGF8の正常な分布をもたらし,発生期の前脳腹側領域における神経上皮の正常な分化に必要であることを明らかにした.
胎生12.5日目のアポトーシスを欠損したマウスの胎仔の脳においては,脳室の狭小や神経上皮の変形といった重篤な形態異常が観察される.これらの形態異常は,神経上皮(あるいは,脳実質の全体)が脳室を押しつぶしているような印象をあたえたため,アポトーシスを欠損したマウスの脳では細胞数が劇的に増加しており,これが脳の形態異常をひき起こしていると解釈されてきた1,2)(図1a).しかし筆者らは,アポトーシスを欠損したマウスの脳の形態は正常なマウスとはいちじるしく異なっており,脳の一部の領域の断面図ではたしかにアポトーシスを欠損したマウスは正常なマウスに比べ神経上皮の断面積が大きくこれまでの報告結果と一致するが,ほかの領域ではアポトーシスを欠損したマウスの神経上皮の断面積は小さいことに気づいた.この結果は,アポトーシスを欠損した胎仔の脳の細胞数を検討する際には,特定の切片における比較ではなく,脳全体の細胞数そのものや神経上皮の全体の大きさを定量的に評価する必要のあることを意味した.そこで,脳の形態異常を呈する胎生12.5日目のアポトーシスを欠損した胎仔について詳細に解析したところ,脳全体の細胞数や神経上皮の体積は正常に発生した胎仔のものと差がないことが判明した.アポトーシスを欠損した胎仔の脳において,この時期の増殖や神経前駆細胞からニューロンへの分化も正常であった.アポトーシスを欠損した胎仔の神経上皮の形態異常は胎生10.5日目から顕著になるが,この時期においてもアポトーシスを欠損した胎仔の神経上皮の体積や細胞密度,細胞の増殖速度は正常な胎仔のものと変わらなかった.
この一方で,アポトーシスを欠損した胎仔では胎生9.5日目から10.5日目にかけて脳室がほとんど拡大しないことが判明した.脳室が拡大するには,脳室に脳脊髄液が貯留することが必要である6).アポトーシスを欠損した胎仔は神経管の閉鎖に異常を呈しており1,7),後脳領域と前脳腹側領域とのあいだの閉鎖が完了しないことにより,構造的に脳室に脳脊髄液を貯留できないことが確認された.これらの結果は,アポトーシスを欠損した胎仔の脳全体の形態異常の原因は,後脳領域および前脳腹側領域の神経管の閉鎖の異常に起因することを示唆した(図1b).
前脳腹側領域において神経管の閉鎖する部位はANRに相当する(図2a).アポトーシスの欠損はANRにおける神経管の閉鎖にどのように影響するのだろうか.まず,アポトーシスを起こした細胞が神経管の閉鎖の前後のANRにおいてどのようなタイミングあるいは分布で生じるかを詳細に調べた.ANRにおける神経管の閉鎖は胎生9.0日目ごろに開始し胎生9.5日目までに完了するが,アポトーシスを起こした細胞は胎生8.5日目から胎生9.5日目にかけてANRに限局して非常に大量に観察された.興味深いことに,アポトーシスを起こした細胞の出現は神経管の閉鎖の開始とほぼ同じ時期に起こった.神経管の閉鎖は短時間に劇的な形態変化の生じる過程であり,このような現象の解析にはタイムラプス生体イメージング法が有効である7,8).核を蛍光タンパク質EGFPにより標識したトランスジェニックマウスを用いて,正常なマウスの胎仔およびアポトーシスを欠損したマウスの胎仔における神経管の閉鎖の過程をタイムラプス生体イメージング法により比較したところ,正常な胎仔のANRでは左右のANRが平行に近接し癒合が進行するのに対し,アポトーシスを欠損した胎仔のANRではANRが近接せず閉鎖しない領域が残った.また,アポトーシスを欠損した胎仔のANRでは端の厚さが正常な胎仔のANRに比べ厚かった.これらの結果より,アポトーシスはANRにおける神経管の閉鎖においてANRの厚さを減少させ,それにより左右のANRの円滑な近接と融合とを可能にしていることが示唆された.
特定の組織や細胞種においては,アポトーシスを抑制した場合にアポトーシス以外の細胞死による細胞の除去の起こることが知られている9).しかしながら,胎生10.5日目のアポトーシスを欠損したマウスの胎仔の神経管の閉鎖していないANRを電子顕微鏡により観察したところ,非アポトーシス細胞死の特徴を示す細胞はごくわずかしか観察されなかった.一方,この領域の細胞の多くは増殖性の低いことが判明した.これらの結果から,アポトーシスを実行できなかったANRの細胞は非増殖性の死に損ない細胞としてANRに蓄積することが示唆された.
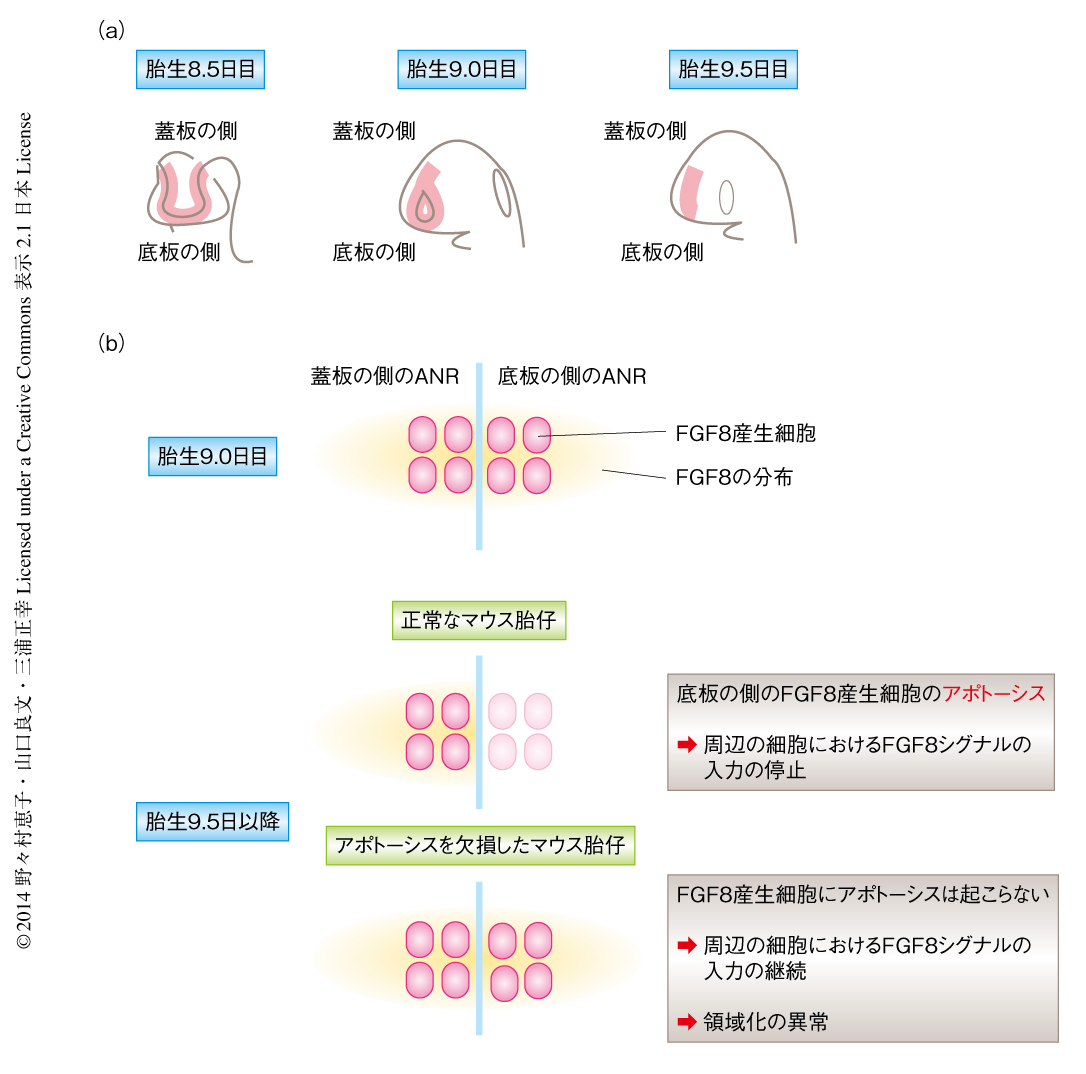
ANRにおいてはモルフォゲンとしてFGF8が産生されている.脳に拡散したFGF8は神経上皮細胞における遺伝子の発現を制御しており,ANRは前脳の発生を制御するシグナリングセンターのひとつである.Fgf8遺伝子をコードするmRNAのANRにおける発現は,発生の過程においてダイナミックに変化する.Fgf8 mRNAは胎生8.0日目からANRの全体に観察されたのち,頭部における神経管の閉鎖が完了した胎生9.75日目ごろに底板に近い領域からは消失し,蓋板の側に限局する10)(図2b).しかしながら,このようなFgf8 mRNAの底板の側からの消失がどのような分子機構により達成されるのか,また,脳の発生におけるFgf8 mRNAの消失の意義はなんなのか,これまで不明であった.ANRにおいては胎生8.5日目から9.5日目にかけて大量のアポトーシスが観察されることから,底板の側のANRに存在していたFgf8 mRNAを発現する細胞がアポトーシスを起こしている可能性が考えられた.
アポトーシスは短時間に完了する現象であり,正常なマウスの固定試料を用いて観察する場合,その瞬間にアポトーシスのマーカーに陽性を示す細胞はアポトーシスを起こす細胞のうちごく一部となり,アポトーシスの影響について過小評価されてしまうことが多い.そこで,アポトーシスを欠損したマウスの胎仔を解析することにより,Fgf8 mRNAの消失に対するアポトーシスの影響について調べた.その結果,アポトーシスを欠損したマウスの胎仔では胎生9.75日以降の底板の側のANRにおいてFgf8 mRNAが異所的に存在していることを見い出した(図2b).さらに,正常なマウスの胎仔においてFgf8 mRNAを発現する細胞が実際にアポトーシスを起こすことも,Fgf8 mRNAとアポトーシス陽性細胞との二重染色により確認された.これにくわえ,Fgf8 mRNAを発現した,あるいは,発現している細胞が遺伝学的な手法により標識される遺伝子改変マウスを用いることにより,胎生10.5日目の正常なマウスの胎仔において底板の側のANRには標識された細胞はほとんど存在しないことを確認し,この領域におけるFgf8 mRNAの消失がFgf8遺伝子の発現の抑制により起こる可能性を排除した.これらの結果から,胎生8.5日目から胎生9.75日目にかけて生じる底板の側のANRからのFgf8 mRNAの消失は,アポトーシスによるものであることが示された.
アポトーシスを欠損したマウスの胎仔ではFGF8を産生する細胞の異所的な残存にともない,本来は分布しない神経上皮腹側領域の内側基底核原基にまでFGF8が分布していた(図2b).この結果から,アポトーシスによるFGF8産生細胞の除去はFGF8が適切に分布するため必要であることが示唆された.アポトーシスを欠損したマウス胎仔においてFGF8が異常に分布した内側基底核原基では,FGFシグナルの下流において発現するSprouty2の発現も亢進しており,FGFシグナルの異所的な入力が生じていることが示唆された.さらに,SHHやNkx2.1といったこの領域の神経前駆細胞が介在ニューロンを産生するのに必要な遺伝子産物11) の発現は減弱していた一方で,Pea3やERMといった内側基底核原基より背側に位置する前方脳皮質のマーカー12) の発現が亢進するという,領域化の異常が認められた.これらの結果から,底板の側のANRにおけるアポトーシスによるFGF8発現細胞の除去が,脳の発生プログラムにおいて内側基底核原基に正常な分化をもたらすスイッチとしてはたらいていることが示唆された.
以上の結果より,脳の発生の初期においてANRという特定の領域で特定のタイミングで大量に起こるアポトーシスは,神経管の閉鎖においてすみやかな組織の形態変化をもたらし神経管の閉鎖の完了とそののちの脳室の拡大の過程を可能にし,また,モルフォゲンを産生する細胞を特定の領域から急速に除去することにより正常な領域化に寄与する,という2つの役割をもつことが示唆された.近年,アポトーシスのバックアップの機構として非アポトーシス細胞死が機能する場合のあることが知られている.アポトーシスを欠損したマウスの胎仔のANRにおいても少数ながら非アポトーシス細胞死が観察されたが,これらの非アポトーシス細胞死はANRにおける円滑な神経管の閉鎖をもたらしたり,FGF8を産生する細胞を適切な時期までに除去し内側基底核原基を正常に分化させたりするのには不十分であった.発生期の器官においてはさまざまな誘導現象が連続して生じている.今回の筆者らの研究から,局所におけるアポトーシスは組織に急速かつ的確な変化をもたらすことで,器官の発生を正常に進めるための分子機構として重要な役割をはたしていることが考えられた.
アポトーシスは組織から細胞をすばやく除去するのに適したシステムであるが,その性質から,解析にはつぎのような困難が存在する.1)アポトーシスは短時間で完遂されるため,固定試料を用いた解析では実際に生じたアポトーシスのうちの一部しか検出されない.2)アポトーシスにおいては活性化されたカスパーゼにより多くのタンパク質が切断をうけ構造変化が起こることにより,抗体に対する親和性が低下する場合が非常に多い.このため,アポトーシスを起こした細胞の同定に使用される細胞種マーカー抗体とアポトーシスのマーカーとの二重染色は,カスパーゼが活性化した直後のアポトーシス初期の細胞には有効でも,アポトーシス後期の細胞では機能しない場合が多い.3)アポトーシスを起こした細胞は複数のアポトーシス小体に断片化し周辺の細胞により貪食されるため,アポトーシスを起こした細胞のもとの位置や数を免疫染色から判定するのは困難な場合が多い.今回,筆者らは,アポトーシスを欠損したマウスの胎仔において残存した細胞をみつけだすという手法により,正常な発生においてアポトーシスにより除去される細胞集団の同定に成功した.発生の過程では非常に多くのアポトーシスが生じることは長年にわたり知られているものの,アポトーシスを起こす細胞の正確な種類やアポトーシスの周辺の組織あるいは発生への影響についてはいまだ不明な点が多く残されている.これらについても,アポトーシスを欠損したマウスを有効に活用することにより,今後,解明されていくものと期待する.
略歴:2012年 東京大学大学院薬学系研究科にて博士号取得,同年 同 特任研究員を経て,2013年より米国Scripps研究所Research Associate.
関心事:機能的な器官の構築に必要な細胞のふるまい.とくに,プログラム細胞死は個々の細胞の死により組織全体にメリットがもたらされることが多く,非常に合理的な機構と感じる.
山口 良文(Yoshifumi Yamaguchi)
東京大学大学院薬学系研究科 助教.
三浦 正幸(Masayuki Miura)
東京大学大学院薬学系研究科 教授.
研究室URL:http://www.f.u-tokyo.ac.jp/~genetics/
© 2014 野々村恵子・山口良文・三浦正幸 Licensed under CC 表示 2.1 日本
(東京大学大学院薬学系研究科 遺伝学教室)
email:野々村恵子,山口良文,三浦正幸
DOI: 10.7875/first.author.2014.012
Local apoptosis modulates early mammalian brain development through the elimination of morphogen-producing cells.
Keiko Nonomura, Yoshifumi Yamaguchi, Misato Hamachi, Masato Koike, Yasuo Uchiyama, Kenichi Nakazato, Atsushi Mochizuki, Asako Sakaue-Sawano, Atsushi Miyawaki, Hiroki Yoshida, Keisuke Kuida, Masayuki Miura
Developmental Cell, 27, 621-634 (2013)
要 約
脳の発生においては多数の細胞死が観察され,そのほとんどはアポトーシスである.アポトーシスは核の断片化と細胞質の凝集および分断を特徴する細胞死であり,ネクローシスなどのほかの細胞死と比べ細胞の組織からの除去がすばやく進行するとされる.これまで,アポトーシスは発生の初期において脳全体の細胞数を制限するのに必要であると考えられてきたが,筆者らは,アポトーシスを欠損したマウスの胎仔における脳形態の異常の原因は,細胞の過増殖ではなく神経管の閉鎖の異常とそののちの脳室の拡大の不全にあることを示した.また,脳の最前端に存在しモルフォゲンであるFGF8を産生することにより脳の発生において中心的な役割をはたす領域ANRに着目し,底板の側のANRにおいてFgf8遺伝子を発現する細胞がアポトーシスにより除去されており,この除去がFGF8の正常な分布と前脳腹側領域における神経上皮の正常な分化に必要であることを明らかにした.こうしたアポトーシスによるモルフォゲンを産生する細胞の除去はモルフォゲンの迅速な産生停止につながるため,限られた時間のなかでつぎつぎと誘導現象の進む発生の過程において,モルフォゲンの分布や量を制御するうえですぐれた方法であると考えられた.
はじめに
哺乳類の脳神経系の発生においては5~7割もの細胞が生まれては除去されていると考えられており,これらの細胞死の多くは生体のプログラムによりあらかじめスケジュールされたアポトーシスである.アポトーシスはシステインプロテアーゼであるカスパーゼの活性化によりひき起こされる細胞死であり,染色体の凝集および核の断片化と細胞質の凝集および分断化を特徴とする.カスパーゼの活性化から細胞の形態変化までにかかる時間は非常に短く,生体においても数十分以内である.さらに,アポトーシスを起こした細胞は周囲の細胞にすみやかに貪食される.このすみやかな貪食により,アポトーシスの際にはネクローシスに比べ細胞内容物の漏出が抑えられ周辺の組織の傷害が少ないとされる.これらの特徴から,アポトーシスは“すばやく”“きれいな”細胞除去システムといえる.哺乳類の脳の発生において観察されるアポトーシスは,カスパーゼ3,カスパーゼ9,Apaf-1,シトクロムcにより形成されるミトコンドリア経路に依存する.アポトーシスの実行に関与する遺伝子が欠損したマウスの胎仔では,アポトーシスが起こらず脳が頭蓋骨の外部に突出する外脳症などの形態異常を呈する1,2)(マウスにおいてみられる外脳症は,ヒトでは致死性の先天奇形である頭蓋と脳皮質が欠損した無脳症に相当すると考えられている.マウスに比べ妊娠期間のはるかに長いヒトでは,頭蓋の欠損により露出したニューロンが死滅してしまうからではないかと推察される).この外脳症の原因は,脳の発生においてニューロンのもとになる神経幹細胞が死なずに余分に増殖し,脳全体の細胞数が過剰になり脳が突出したためと推察されてきた3,4)(図1a).しかし,外脳症は脳の発生初期に生じる神経管の閉鎖の失敗により生じることも知られていた5).また,アポトーシスを欠損した胎仔の脳において実際に細胞数が増加しているのか,定量的に研究した報告もこれまで不足していた.このため,アポトーシスを欠損した胎仔において観察される脳の形態異常が本当に脳全体の細胞数の増加の結果であるかどうかは不明であった.
アポトーシスはANR(anterior neural ridge,前方神経隆起)とよばれる脳の最前端の領域(図2a)において神経管の閉鎖の前後にとくに大量に観察されるが,この領域に起こるアポトーシスの役割についても不明であった.ANRは腹側に存在する正中線領域である底板(floor plate),および,神経管の閉鎖により背側に形成される蓋板(roof plate)に隣接する.ANRからは拡散性の形態形成タンパク質であるモルフォゲンとしてFGF8が産生され,底板および蓋板からもやはり異なるモルフォゲンが産生されて,それらは神経上皮に拡散する.拡散したモルフォゲンの種類と勾配に応じ,神経上皮細胞は異なる種類の神経前駆細胞へと分化し異なる種類のニューロンを生み出すため,ANR,底板,蓋板は前脳の発生において中心的な役割をはたす領域である(シグナリングセンター).これまで多くの論文により,器官の発生におけるシグナリングセンターの役割が示されてきた.しかしながら,役割をおえたシグナリングセンターの細胞がどのような運命をたどるのかについてはあまりよくわかっていない.
この論文では,アポトーシスを欠損したマウスの脳全体の細胞数について定量的な手法により再検討し,アポトーシスは脳全体の細胞数の制御そのものには大きな影響をあたえないことを明らかにした(図1b).さらに,ANRにおけるアポトーシスは,この領域の神経管の閉鎖とそののちの脳室の拡大に必要であり,FGF8を産生する細胞を適切なタイミングで除去することでFGF8の正常な分布をもたらし,発生期の前脳腹側領域における神経上皮の正常な分化に必要であることを明らかにした.
1.アポトーシスの欠損は神経管の閉鎖の異常と脳室の拡大の不全をもたらす
胎生12.5日目のアポトーシスを欠損したマウスの胎仔の脳においては,脳室の狭小や神経上皮の変形といった重篤な形態異常が観察される.これらの形態異常は,神経上皮(あるいは,脳実質の全体)が脳室を押しつぶしているような印象をあたえたため,アポトーシスを欠損したマウスの脳では細胞数が劇的に増加しており,これが脳の形態異常をひき起こしていると解釈されてきた1,2)(図1a).しかし筆者らは,アポトーシスを欠損したマウスの脳の形態は正常なマウスとはいちじるしく異なっており,脳の一部の領域の断面図ではたしかにアポトーシスを欠損したマウスは正常なマウスに比べ神経上皮の断面積が大きくこれまでの報告結果と一致するが,ほかの領域ではアポトーシスを欠損したマウスの神経上皮の断面積は小さいことに気づいた.この結果は,アポトーシスを欠損した胎仔の脳の細胞数を検討する際には,特定の切片における比較ではなく,脳全体の細胞数そのものや神経上皮の全体の大きさを定量的に評価する必要のあることを意味した.そこで,脳の形態異常を呈する胎生12.5日目のアポトーシスを欠損した胎仔について詳細に解析したところ,脳全体の細胞数や神経上皮の体積は正常に発生した胎仔のものと差がないことが判明した.アポトーシスを欠損した胎仔の脳において,この時期の増殖や神経前駆細胞からニューロンへの分化も正常であった.アポトーシスを欠損した胎仔の神経上皮の形態異常は胎生10.5日目から顕著になるが,この時期においてもアポトーシスを欠損した胎仔の神経上皮の体積や細胞密度,細胞の増殖速度は正常な胎仔のものと変わらなかった.
この一方で,アポトーシスを欠損した胎仔では胎生9.5日目から10.5日目にかけて脳室がほとんど拡大しないことが判明した.脳室が拡大するには,脳室に脳脊髄液が貯留することが必要である6).アポトーシスを欠損した胎仔は神経管の閉鎖に異常を呈しており1,7),後脳領域と前脳腹側領域とのあいだの閉鎖が完了しないことにより,構造的に脳室に脳脊髄液を貯留できないことが確認された.これらの結果は,アポトーシスを欠損した胎仔の脳全体の形態異常の原因は,後脳領域および前脳腹側領域の神経管の閉鎖の異常に起因することを示唆した(図1b).
2.ANRにおける神経管の閉鎖において大量のアポトーシスが起こり左右のANRの近接を可能にする
前脳腹側領域において神経管の閉鎖する部位はANRに相当する(図2a).アポトーシスの欠損はANRにおける神経管の閉鎖にどのように影響するのだろうか.まず,アポトーシスを起こした細胞が神経管の閉鎖の前後のANRにおいてどのようなタイミングあるいは分布で生じるかを詳細に調べた.ANRにおける神経管の閉鎖は胎生9.0日目ごろに開始し胎生9.5日目までに完了するが,アポトーシスを起こした細胞は胎生8.5日目から胎生9.5日目にかけてANRに限局して非常に大量に観察された.興味深いことに,アポトーシスを起こした細胞の出現は神経管の閉鎖の開始とほぼ同じ時期に起こった.神経管の閉鎖は短時間に劇的な形態変化の生じる過程であり,このような現象の解析にはタイムラプス生体イメージング法が有効である7,8).核を蛍光タンパク質EGFPにより標識したトランスジェニックマウスを用いて,正常なマウスの胎仔およびアポトーシスを欠損したマウスの胎仔における神経管の閉鎖の過程をタイムラプス生体イメージング法により比較したところ,正常な胎仔のANRでは左右のANRが平行に近接し癒合が進行するのに対し,アポトーシスを欠損した胎仔のANRではANRが近接せず閉鎖しない領域が残った.また,アポトーシスを欠損した胎仔のANRでは端の厚さが正常な胎仔のANRに比べ厚かった.これらの結果より,アポトーシスはANRにおける神経管の閉鎖においてANRの厚さを減少させ,それにより左右のANRの円滑な近接と融合とを可能にしていることが示唆された.
3.アポトーシスの不全によりANRに増殖性のない細胞が蓄積する
特定の組織や細胞種においては,アポトーシスを抑制した場合にアポトーシス以外の細胞死による細胞の除去の起こることが知られている9).しかしながら,胎生10.5日目のアポトーシスを欠損したマウスの胎仔の神経管の閉鎖していないANRを電子顕微鏡により観察したところ,非アポトーシス細胞死の特徴を示す細胞はごくわずかしか観察されなかった.一方,この領域の細胞の多くは増殖性の低いことが判明した.これらの結果から,アポトーシスを実行できなかったANRの細胞は非増殖性の死に損ない細胞としてANRに蓄積することが示唆された.
4.アポトーシスはFGF8を発現する領域を発生の適切な時期に削除するのに必要である
ANRにおいてはモルフォゲンとしてFGF8が産生されている.脳に拡散したFGF8は神経上皮細胞における遺伝子の発現を制御しており,ANRは前脳の発生を制御するシグナリングセンターのひとつである.Fgf8遺伝子をコードするmRNAのANRにおける発現は,発生の過程においてダイナミックに変化する.Fgf8 mRNAは胎生8.0日目からANRの全体に観察されたのち,頭部における神経管の閉鎖が完了した胎生9.75日目ごろに底板に近い領域からは消失し,蓋板の側に限局する10)(図2b).しかしながら,このようなFgf8 mRNAの底板の側からの消失がどのような分子機構により達成されるのか,また,脳の発生におけるFgf8 mRNAの消失の意義はなんなのか,これまで不明であった.ANRにおいては胎生8.5日目から9.5日目にかけて大量のアポトーシスが観察されることから,底板の側のANRに存在していたFgf8 mRNAを発現する細胞がアポトーシスを起こしている可能性が考えられた.
アポトーシスは短時間に完了する現象であり,正常なマウスの固定試料を用いて観察する場合,その瞬間にアポトーシスのマーカーに陽性を示す細胞はアポトーシスを起こす細胞のうちごく一部となり,アポトーシスの影響について過小評価されてしまうことが多い.そこで,アポトーシスを欠損したマウスの胎仔を解析することにより,Fgf8 mRNAの消失に対するアポトーシスの影響について調べた.その結果,アポトーシスを欠損したマウスの胎仔では胎生9.75日以降の底板の側のANRにおいてFgf8 mRNAが異所的に存在していることを見い出した(図2b).さらに,正常なマウスの胎仔においてFgf8 mRNAを発現する細胞が実際にアポトーシスを起こすことも,Fgf8 mRNAとアポトーシス陽性細胞との二重染色により確認された.これにくわえ,Fgf8 mRNAを発現した,あるいは,発現している細胞が遺伝学的な手法により標識される遺伝子改変マウスを用いることにより,胎生10.5日目の正常なマウスの胎仔において底板の側のANRには標識された細胞はほとんど存在しないことを確認し,この領域におけるFgf8 mRNAの消失がFgf8遺伝子の発現の抑制により起こる可能性を排除した.これらの結果から,胎生8.5日目から胎生9.75日目にかけて生じる底板の側のANRからのFgf8 mRNAの消失は,アポトーシスによるものであることが示された.
5.アポトーシスを欠損したマウスの胎仔の前脳腹側の領域にはFGF8が異所的に分布する
アポトーシスを欠損したマウスの胎仔ではFGF8を産生する細胞の異所的な残存にともない,本来は分布しない神経上皮腹側領域の内側基底核原基にまでFGF8が分布していた(図2b).この結果から,アポトーシスによるFGF8産生細胞の除去はFGF8が適切に分布するため必要であることが示唆された.アポトーシスを欠損したマウス胎仔においてFGF8が異常に分布した内側基底核原基では,FGFシグナルの下流において発現するSprouty2の発現も亢進しており,FGFシグナルの異所的な入力が生じていることが示唆された.さらに,SHHやNkx2.1といったこの領域の神経前駆細胞が介在ニューロンを産生するのに必要な遺伝子産物11) の発現は減弱していた一方で,Pea3やERMといった内側基底核原基より背側に位置する前方脳皮質のマーカー12) の発現が亢進するという,領域化の異常が認められた.これらの結果から,底板の側のANRにおけるアポトーシスによるFGF8発現細胞の除去が,脳の発生プログラムにおいて内側基底核原基に正常な分化をもたらすスイッチとしてはたらいていることが示唆された.
おわりに
以上の結果より,脳の発生の初期においてANRという特定の領域で特定のタイミングで大量に起こるアポトーシスは,神経管の閉鎖においてすみやかな組織の形態変化をもたらし神経管の閉鎖の完了とそののちの脳室の拡大の過程を可能にし,また,モルフォゲンを産生する細胞を特定の領域から急速に除去することにより正常な領域化に寄与する,という2つの役割をもつことが示唆された.近年,アポトーシスのバックアップの機構として非アポトーシス細胞死が機能する場合のあることが知られている.アポトーシスを欠損したマウスの胎仔のANRにおいても少数ながら非アポトーシス細胞死が観察されたが,これらの非アポトーシス細胞死はANRにおける円滑な神経管の閉鎖をもたらしたり,FGF8を産生する細胞を適切な時期までに除去し内側基底核原基を正常に分化させたりするのには不十分であった.発生期の器官においてはさまざまな誘導現象が連続して生じている.今回の筆者らの研究から,局所におけるアポトーシスは組織に急速かつ的確な変化をもたらすことで,器官の発生を正常に進めるための分子機構として重要な役割をはたしていることが考えられた.
アポトーシスは組織から細胞をすばやく除去するのに適したシステムであるが,その性質から,解析にはつぎのような困難が存在する.1)アポトーシスは短時間で完遂されるため,固定試料を用いた解析では実際に生じたアポトーシスのうちの一部しか検出されない.2)アポトーシスにおいては活性化されたカスパーゼにより多くのタンパク質が切断をうけ構造変化が起こることにより,抗体に対する親和性が低下する場合が非常に多い.このため,アポトーシスを起こした細胞の同定に使用される細胞種マーカー抗体とアポトーシスのマーカーとの二重染色は,カスパーゼが活性化した直後のアポトーシス初期の細胞には有効でも,アポトーシス後期の細胞では機能しない場合が多い.3)アポトーシスを起こした細胞は複数のアポトーシス小体に断片化し周辺の細胞により貪食されるため,アポトーシスを起こした細胞のもとの位置や数を免疫染色から判定するのは困難な場合が多い.今回,筆者らは,アポトーシスを欠損したマウスの胎仔において残存した細胞をみつけだすという手法により,正常な発生においてアポトーシスにより除去される細胞集団の同定に成功した.発生の過程では非常に多くのアポトーシスが生じることは長年にわたり知られているものの,アポトーシスを起こす細胞の正確な種類やアポトーシスの周辺の組織あるいは発生への影響についてはいまだ不明な点が多く残されている.これらについても,アポトーシスを欠損したマウスを有効に活用することにより,今後,解明されていくものと期待する.
文 献
- Kuida, K., Haydar, T. F., Kuan, C. Y. et al.: Reduced apoptosis and cytochrome c-mediated caspase activation in mice lacking caspase 9. Cell, 94, 325-337 (1998)[PubMed]
- Yoshida, H., Kong, Y. Y., Yoshida, R. et al.: Apaf1 is required for mitochondrial pathways of apoptosis and brain development. Cell, 94, 739-750 (1998)[PubMed]
- Gilbert, S.: Developmental Biology, 10th Ed. p. 95, Sinauer Associates, Sunderland (2013)
- Kuan, C. Y., Roth, K. A., Flavell, R. A. et al.: Mechanisms of programmed cell death in the developing brain. Trends Neurosci., 23, 291-297 (2000)[PubMed]
- Copp, A. J.: Neurulation in the cranial region: normal and abnormal. J. Anat., 207, 623-635 (2005)[PubMed]
- Desmond, M. E. & Jacobson, A. G.: Embryonic brain enlargement requires cerebrospinal fluid pressure. Dev. Biol., 57, 188-198 (1977)[PubMed]
- Yamaguchi, Y. & Miura, M.: How to form and close the brain: insight into the mechanism of cranial neural tube closure in mammals. Cell. Mol. Life Sci., 70, 3171-3186 (2013)[PubMed]
- Yamaguchi, Y., Shinotsuka, N., Nonomura, K. et al.: Live imaging of apoptosis in a novel transgenic mouse highlights its role in neural tube closure. J. Cell Biol., 195, 1047-1060 (2011)[PubMed]
- Fuchs, Y. & Steller, H.: Programmed cell death in animal development and disease. Cell, 147, 742-758 (2011)[PubMed]
- Crossley, P., Martinez, S., Ohkubo, Y. et al.: Coordinate expression of Fgf8, Otx2, Bmp4, and Shh in the rostral prosencephalon during development of the telencephalic and optic vesicles. Neuroscience, 108, 183-206 (2001)[PubMed]
- Rubenstein, J. L., Shimamura, K., Martinez, S. et al.: Regionalization of the prosencephalic neural plate. Annu. Rev. Neurosci., 21, 445-477 (1998)[PubMed]
- Fukuchi-Shimogori, T. & Grove, E. A.: Emx2 patterns the neocortex by regulating FGF positional signaling. Nat. Neurosci., 6, 825-831 (2003)[PubMed]
著者プロフィール
略歴:2012年 東京大学大学院薬学系研究科にて博士号取得,同年 同 特任研究員を経て,2013年より米国Scripps研究所Research Associate.
関心事:機能的な器官の構築に必要な細胞のふるまい.とくに,プログラム細胞死は個々の細胞の死により組織全体にメリットがもたらされることが多く,非常に合理的な機構と感じる.
山口 良文(Yoshifumi Yamaguchi)
東京大学大学院薬学系研究科 助教.
三浦 正幸(Masayuki Miura)
東京大学大学院薬学系研究科 教授.
研究室URL:http://www.f.u-tokyo.ac.jp/~genetics/
© 2014 野々村恵子・山口良文・三浦正幸 Licensed under CC 表示 2.1 日本