Foxp3陽性T細胞から分化した病原性を示すTh17細胞の自己免疫性の関節炎における重要性
小松紀子・高柳 広
(東京大学大学院医学系研究科 免疫学)
email:高柳 広
DOI: 10.7875/first.author.2014.009
Pathogenic conversion of Foxp3+ T cells into TH17 cells in autoimmune arthritis.
Noriko Komatsu, Kazuo Okamoto, Shinichiro Sawa, Tomoki Nakashima, Masatsugu Oh-hora, Tatsuhiko Kodama, Sakae Tanaka, Jeffrey A. Bluestone, Hiroshi Takayanagi
Nature Medicine, 20, 62-68 (2014)
自己免疫疾患はしばしば制御性T細胞とTh17細胞のはたらきの不均衡により生じることが知られている.しかし,疾患の発症の過程におけるTh17細胞の分化の機構については不明な点が多い.一方で,転写因子Foxp3は制御性T細胞の抑制機能の発揮において重要であるが,炎症での制御性T細胞におけるFoxp3の安定性については議論の的になっている.筆者らは,この研究において,関節炎においてFoxp3陽性T細胞がFoxp3の発現を消失しTh17細胞へと分化することを見い出した.このexFoxp3 Th17細胞は,細胞系譜の解析により炎症を起こした関節に蓄積することが明らかになった.Foxp3陽性T細胞のexFoxp3 Th17細胞への分化は炎症を起こした関節に存在する滑膜線維芽細胞から産生したインターロイキン6によりひき起こされ,exFoxp3 Th17細胞はナイーブCD4陽性T細胞に由来するTh17細胞と比べ,破骨細胞の分化をより強力に促進することがわかった.興味深いことに,網羅的なトランスクリプトーム解析によりexFoxp3 Th17細胞はSox4,CCR6,CCL20,RANKLなどを高発現する,これまでに報告のない遺伝子発現パターンをもつTh17細胞であることが明らかになった.自己成分を認識する細胞を多く含むFoxp3陽性T細胞をマウスへ移入したのち関節炎を誘導すると,関節炎の発症の早期化と重症度の悪化が起こり,これは移入したT細胞におけるFoxp3の発現の消失と関連していた.疾患活動性の高い関節リウマチの患者の滑膜においてインターロイキン17陽性を示すFoxp3陽性T細胞が多く観察されたことから,分化可塑性をもつFoxp3陽性T細胞が関節リウマチの病因に関与することが示唆された.これらの知見は,自己免疫性の関節炎におけるFoxp3陽性T細胞の分化可塑性の病理学的な重要性を示すものであり,新規に同定された病原性を示すTh17細胞であるexFoxp3 Th17細胞は,自己免疫疾患の治療への道を拓くものと期待される.
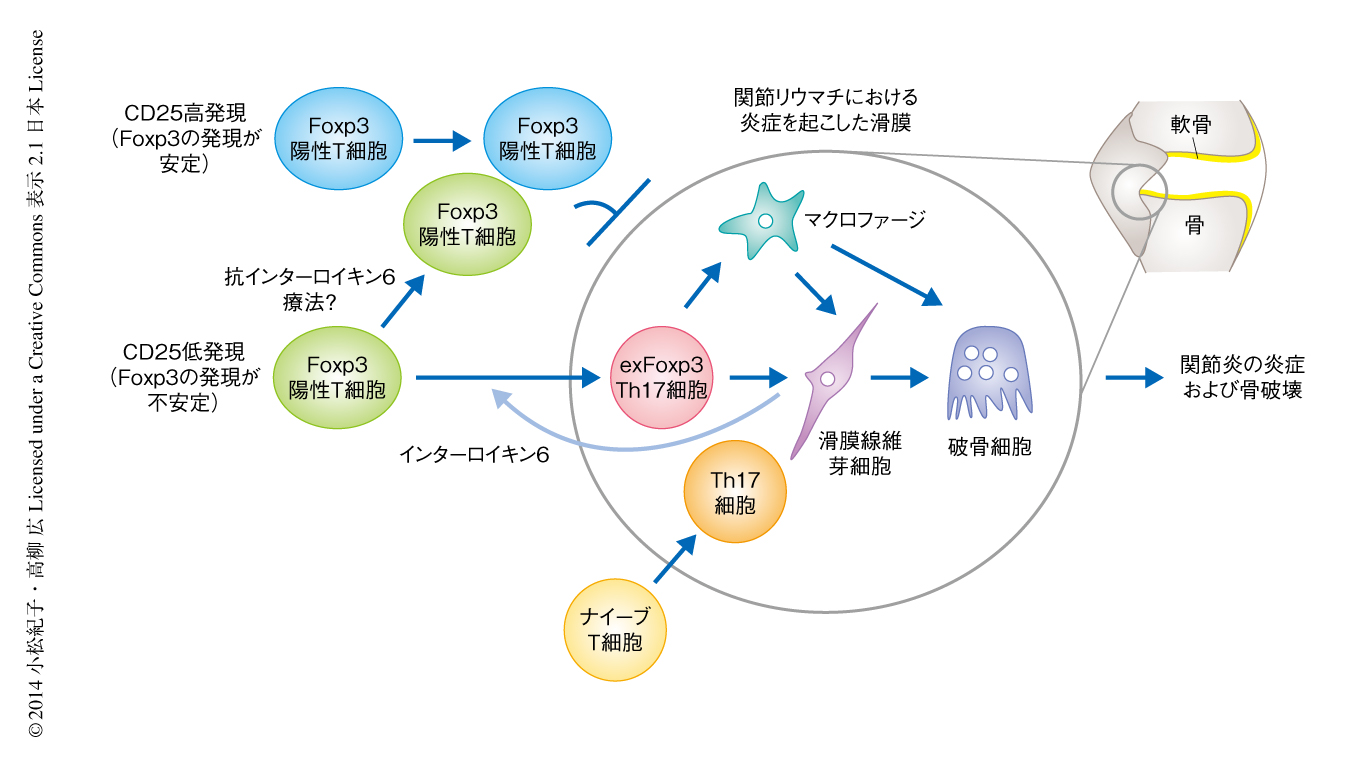
関節リウマチは関節の炎症および骨破壊をおもな症状とし,わが国では推定70~80万人が発症するもっとも頻度の高い自己免疫疾患のひとつである.関節リウマチの発症の機序には不明な点が多く,このため根本的な治療法もいまだ確立していない.近年,インターロイキン17を産生するTh17細胞とよばれるヘルパーT細胞が関節炎を含めた自己免疫疾患をひき起こすことが知られており,Th17細胞を標的とした治療法の開発が期待されている1).しかし,関節リウマチの発症する過程におけるTh17細胞の分化の分子機構はよくわかっていない.一方で,制御性T細胞は自己寛容の維持に必須であり,転写因子Foxp3の発現は制御性T細胞における免疫抑制能の発揮に重要であることが知られている2,3).また,制御性T細胞は自己成分を認識するT細胞受容体をもつことも知られており,そのような細胞が免疫抑制能をもつことは自己寛容を維持するための合理的なシステムであると考えられる.自己を認識する制御性T細胞が免疫抑制能を担う転写因子Foxp3の発現を消失すると自己免疫疾患をひき起こす細胞となる可能性が考えられることからも,炎症におけるFoxp3の安定性は議論の的になっている4-6).インターロイキン2は制御性T細胞の生存に必要なサイトカインであり,細胞表面タンパク質CD25はインターロイキン2受容体のα鎖に相当する.Foxp3陽性T細胞には正常な状態において,Foxp3の発現が安定なCD25の発現の高い集団と,Foxp3の発現が不安定なCD25の発現の低い集団が存在することが報告されているものの7),Foxp3陽性T細胞の分化可塑性の病理学的な意義は明らかではなかった.
なお,制御性T細胞については,濱口真英・坂口志文, 領域融合レビュー, 2, e005 (2013) も参照されたい.
自己免疫疾患を促進するTh17細胞は制御性T細胞が免疫抑制能を担う転写因子Foxp3の発現を消失することにより生じるという可能性をかんがみて,関節リウマチのモデルマウスであるコラーゲン誘導性関節炎マウスを用いてこの可能性の検証に取り組んだ.まず,Foxp3を発現するT細胞のうち,CD25を高発現する細胞と低発現する細胞とをマウスに移入して関節炎の発症を誘導し,移入したT細胞におけるFoxp3発現の安定性および関節炎の抑制効果について検討した.その結果,CD25高発現Foxp3陽性T細胞はFoxp3の発現を維持し関節の炎症および骨破壊を抑制した一方で,CD25低発現Foxp3陽性T細胞は一部がFoxp3の発現を消失してTh17細胞へ分化し,関節炎を抑制しないことが見い出された.Th17細胞はナイーブCD4陽性T細胞から分化することが知られているが,CD25低発現Foxp3陽性T細胞とナイーブCD4陽性T細胞とをマウスに共移入して関節炎の発症を誘導すると,関節炎を起こしたマウスではCD25低発現Foxp3陽性T細胞に由来するFoxp3陰性T細胞のほうが,ナイーブCD4陽性T細胞に由来するFoxp3陰性T細胞よりもTh17細胞へ分化しやすいことがわかった.以上の結果により,関節炎においてCD25低発現Foxp3陽性T細胞からTh17細胞が分化することが明らかになり,この細胞をexFoxp3 Th17細胞とよぶことにした.
Foxp3陽性T細胞の運命を追跡するためFoxp3のレポーターマウスを作製し,このマウスに関節炎を発症させたところ,Foxp3陽性T細胞から分化したexFoxp3 Th17細胞は炎症を起こした滑膜に多く集積することがわかった.また,Foxp3の発現を消失したT細胞は炎症の局所への集積に必要なケモカイン受容体CCR6および破骨細胞への分化誘導タンパク質であるRANKLの発現が高く,また,増殖がさかんであることがわかった.
炎症においてFoxp3の発現を消失したT細胞の起源は論争の的になっており,胸腺に由来する制御性T細胞,末梢から誘導された制御性T細胞,一過的にFoxp3を発現した制御性T細胞以外のT細胞,の3つの可能性が考えられている.胸腺に由来する制御性T細胞は,制御性T細胞のマーカーの高い発現およびそれらの遺伝子にDNA脱メチル化がみられる点で,制御性T細胞以外のT細胞と区別できることが報告されている8).関節炎を発症したFoxp3レポーターマウスにおいて検出されたFoxp3の発現を消失したT細胞は,制御性T細胞よりは低いものの制御性T細胞以外のT細胞よりは高い制御性T細胞のマーカーの発現がみられ,また,Foxp3遺伝子の部分的なDNA脱メチル化とCTLA-4遺伝子の高度なDNA脱メチル化が認められた.したがって,関節炎において見い出されたFoxp3の発現を消失したT細胞の起源は,胸腺に由来する制御性T細胞でも一過的にFoxp3を発現した制御性T細胞以外のT細胞でもなく,末梢から誘導された制御性T細胞であることが示唆された.正常な状態あるいは炎症における末梢から誘導された制御性T細胞の特徴にはいまだ不明な点が多いが,これを解明することは,炎症におけるexFoxp3 Th17細胞の起源の同定に貢献すると考えられる.とりわけ,関節炎における自己抗原に特異的なFoxp3の発現を消失したT細胞の存在の有無やその起源の同定は,今後の課題となると考えられる.
炎症を起こした滑膜にexFoxp3 Th17細胞が多く集積していたことから,この炎症を起こした滑膜を構成する細胞がFoxp3陽性T細胞からexFoxp3 Th17細胞への分化をひき起こすのではないかと考えた.この可能性を検証するため,炎症を起こした滑膜から滑膜マクロファージおよび滑膜線維芽細胞を単離し,in vitroにおいてFoxp3陽性T細胞と共培養したところ,滑膜線維芽細胞のみがexFoxp3 Th17細胞への分化をひき起こすことが明らかになった.一方で,ナイーブCD4陽性T細胞と滑膜線維芽細胞とを共培養してもTh17細胞への分化はほとんど認められなかった.また,滑膜線維芽細胞の培養上清や細胞間の接着のない条件でもexFoxp3 Th17細胞への分化が認められたことから,この分化には細胞間の接着を必要としないことが明らかになった.さらに,滑膜線維芽細胞はTNF,インターロイキン1,インターロイキン6などさまざまな炎症性サイトカインを多く発現していたが,インターロイキン6の中和抗体のみがexFoxp3 Th17細胞への分化を抑制した.このことから,Foxp3陽性T細胞からexFoxp3 Th17細胞への分化は,炎症を起こした滑膜において増殖する滑膜線維芽細胞がインターロイキン6を産生することによりひき起こされることが明らかになった(図1).
破骨細胞は関節リウマチにおいて骨破壊を担う細胞であり,RANKLにより前駆細胞から破骨細胞への分化が誘導されることが知られている.これまで,ナイーブCD4陽性T細胞から分化した通常のTh17細胞は単独では破骨細胞の分化を誘導できないが,インターロイキン17が間葉系細胞においてRANKLの発現を促進することにより間接的に破骨細胞の分化を誘導することが知られていた9).今回,新しく同定されたexFoxp3 Th17細胞は,滑膜線維芽細胞の存在のもとで通常のTh17細胞よりも強力に破骨細胞を誘導することが明らかになった.また,exFoxp3 Th17細胞は通常のTh17細胞よりもRANKLの発現が高く,滑膜線維芽細胞が存在しなくても単独で破骨細胞の分化を誘導できることが明らかになった.破骨細胞の分化においてexFoxp3 Th17細胞の産生するRANKLと滑膜線維芽細胞の産生するRANKLとの相対的な重要性を明らかにするため,RANKLを欠損したexFoxp3 Th17細胞および滑膜線維芽細胞をそれぞれ用いて,破骨細胞の分化について検討した.その結果,滑膜線維芽細胞に由来するRANKLの寄与はexFoxp3 Th17に由来するRANKLの寄与より大きいものの,滑膜線維芽細胞に由来するRANKLが存在しなくてもexFoxp3 Th17細胞に由来するRANKLのみで破骨細胞の分化の誘導が見い出された.以上の結果から,exFoxp3 Th17細胞が“最強”の破骨細胞の誘導性のT細胞であることが明らかになった.
興味深いことに,マイクロアレイを用いた網羅的なトランスクリプトーム解析の結果,exFoxp3 Th17細胞はSox4,CCR6,CCL20,インターロイキン23R,RANKLの遺伝子,および,関節炎の発症にかかわる遺伝子を高く発現していることが見い出された.また,exFoxp3 Th17細胞はこれまで知られていたTh17細胞とは異なるTh17関連遺伝子の発現パターンをもち,病原性を示す新規のTh17細胞サブセットであることが明らかになった10,11).
自己寛容は,自己成分を認識する胸腺に由来する制御性T細胞が免疫抑制能を獲得することにより維持されている.末梢から誘導された制御性T細胞も自己寛容の一端を担うと考えられているが,このような制御性T細胞が免疫抑制能を失えば自己を攻撃するT細胞となる可能性が考えられる.CD25低発現Foxp3陽性T細胞には自己を認識しうる末梢から誘導された制御性T細胞が多く含まれる可能性を考え,コラーゲンにより免疫したマウスから単離した,自己抗原であるコラーゲンを認識する細胞を含むCD25低発現Foxp3陽性T細胞を別のマウスに移入したうえで関節炎の発症を誘導した.その結果,移入されたCD25低発現Foxp3陽性T細胞はFoxp3の発現を消失し,関節炎,破骨細胞の分化の亢進,骨破壊の増悪をひき起こすことが明らかになった.この効果はエフェクターメモリーT細胞より強力であり,一方で,非自己の抗原を認識する細胞を含むCD25低発現Foxp3陽性T細胞は関節炎の増悪をひき起こさなかった.以上の結果から,CD25低発現Foxp3陽性T細胞から生じたFoxp3の発現を消失したT細胞による,生体レベルでの関節炎の発症の誘導が明らかになった.さらに,CD25低発現Foxp3陽性T細胞には自己を認識しうるような制御性T細胞が含まれており,炎症においてFoxp3の発現を消失することにより自己に対し反応性をもつT細胞へと分化することが示唆された.
以上はマウスを用いた実験結果であるが,疾患活動性の高い関節リウマチの患者において,炎症を起こした滑膜には,分化の過渡期と考えられるFoxp3およびインターロイキン17の両方を発現するT細胞が多く存在したことから,関節リウマチ患者においてもFoxp3陽性T細胞がexFoxp3 Th17細胞へと分化し,このような分化可塑性をもつFoxp3陽性T細胞が関節リウマチの病因に関与することが示唆された.
この研究は,健康な状態では自己寛容の維持にはたらく制御性T細胞が,炎症においては自己免疫疾患をひき起こすTh17細胞へと分化する可能性を示したものであり,自己免疫疾患の新しい発症機構を提唱するものである.したがって,分化可塑性をもつFoxp3陽性T細胞が,自己寛容の維持か自己免疫疾患の発症かという運命決定を担うことが考えられる.この細胞の機能制御を担うのが滑膜線維芽細胞である一方で,滑膜線維芽細胞もT細胞の存在により骨破壊能を獲得することから,部位特異的な自己免疫疾患の発症もしくは増悪において,微小環境を構成する非血球系細胞と分化可塑性をもつFoxp3陽性T細胞との相互作用が重要であることが示唆される.それでは,このような細胞にはどのような存在意義があるのだろうか.自己に対する免疫応答は抑制されるべきである一方で,病原体やがんなど非自己に対する免疫応答の促進は必要である.したがって,免疫応答の促進と抑制の両方の機能をあわせもつ細胞が存在することは,状況に応じて柔軟に免疫応答を制御できる点で生体においてメリットがあると考えられる.しかし,炎症を起こした関節の局所など,炎症性サイトカインの濃度がいちじるしく高い環境では,自己に対し抑制的にはたらくべき細胞が自己まで攻撃するという“非常事態”が起こってしまうのかもしれない.この機能的な“柔軟性”がT細胞受容体のレパトアと関連性をもつかどうか,今後の解析が待たれる.
今回,筆者らが発見した,関節炎において炎症および骨破壊をひき起こす病原性のTh17細胞であるexFoxp3 Th17細胞は,関節リウマチだけでなく多発性硬化症や全身性エリテマトーデスなど,さまざまな自己免疫疾患の治療の標的となる可能性をもつ.exFoxp3 Th17細胞の病原性をつかさどる分子基盤の解明により,関節リウマチをはじめとする自己免疫疾患の新しい治療薬や診断マーカーの確立に貢献することが期待される.
略歴:2008年 千葉大学大学院医学系研究科博士課程 修了,同年 理化学研究所 研究員,2009年 東京医科歯科大学 研究員を経て,2013年より東京大学大学院医学系研究科 客員研究員.
研究テーマ:自己免疫疾患の発症機構の解明とその制御法の開発.
高柳 広(Hiroshi Takayanagi)
東京大学大学院医学系研究科 教授.科学技術振興機構ERATO高柳オステオネットワークプロジェクト 研究総括 兼任.
研究室URL:http://osteoimmunology.com/
© 2014 小松紀子・高柳 広 Licensed under CC 表示 2.1 日本
(東京大学大学院医学系研究科 免疫学)
email:高柳 広
DOI: 10.7875/first.author.2014.009
Pathogenic conversion of Foxp3+ T cells into TH17 cells in autoimmune arthritis.
Noriko Komatsu, Kazuo Okamoto, Shinichiro Sawa, Tomoki Nakashima, Masatsugu Oh-hora, Tatsuhiko Kodama, Sakae Tanaka, Jeffrey A. Bluestone, Hiroshi Takayanagi
Nature Medicine, 20, 62-68 (2014)
要 約
自己免疫疾患はしばしば制御性T細胞とTh17細胞のはたらきの不均衡により生じることが知られている.しかし,疾患の発症の過程におけるTh17細胞の分化の機構については不明な点が多い.一方で,転写因子Foxp3は制御性T細胞の抑制機能の発揮において重要であるが,炎症での制御性T細胞におけるFoxp3の安定性については議論の的になっている.筆者らは,この研究において,関節炎においてFoxp3陽性T細胞がFoxp3の発現を消失しTh17細胞へと分化することを見い出した.このexFoxp3 Th17細胞は,細胞系譜の解析により炎症を起こした関節に蓄積することが明らかになった.Foxp3陽性T細胞のexFoxp3 Th17細胞への分化は炎症を起こした関節に存在する滑膜線維芽細胞から産生したインターロイキン6によりひき起こされ,exFoxp3 Th17細胞はナイーブCD4陽性T細胞に由来するTh17細胞と比べ,破骨細胞の分化をより強力に促進することがわかった.興味深いことに,網羅的なトランスクリプトーム解析によりexFoxp3 Th17細胞はSox4,CCR6,CCL20,RANKLなどを高発現する,これまでに報告のない遺伝子発現パターンをもつTh17細胞であることが明らかになった.自己成分を認識する細胞を多く含むFoxp3陽性T細胞をマウスへ移入したのち関節炎を誘導すると,関節炎の発症の早期化と重症度の悪化が起こり,これは移入したT細胞におけるFoxp3の発現の消失と関連していた.疾患活動性の高い関節リウマチの患者の滑膜においてインターロイキン17陽性を示すFoxp3陽性T細胞が多く観察されたことから,分化可塑性をもつFoxp3陽性T細胞が関節リウマチの病因に関与することが示唆された.これらの知見は,自己免疫性の関節炎におけるFoxp3陽性T細胞の分化可塑性の病理学的な重要性を示すものであり,新規に同定された病原性を示すTh17細胞であるexFoxp3 Th17細胞は,自己免疫疾患の治療への道を拓くものと期待される.
はじめに
関節リウマチは関節の炎症および骨破壊をおもな症状とし,わが国では推定70~80万人が発症するもっとも頻度の高い自己免疫疾患のひとつである.関節リウマチの発症の機序には不明な点が多く,このため根本的な治療法もいまだ確立していない.近年,インターロイキン17を産生するTh17細胞とよばれるヘルパーT細胞が関節炎を含めた自己免疫疾患をひき起こすことが知られており,Th17細胞を標的とした治療法の開発が期待されている1).しかし,関節リウマチの発症する過程におけるTh17細胞の分化の分子機構はよくわかっていない.一方で,制御性T細胞は自己寛容の維持に必須であり,転写因子Foxp3の発現は制御性T細胞における免疫抑制能の発揮に重要であることが知られている2,3).また,制御性T細胞は自己成分を認識するT細胞受容体をもつことも知られており,そのような細胞が免疫抑制能をもつことは自己寛容を維持するための合理的なシステムであると考えられる.自己を認識する制御性T細胞が免疫抑制能を担う転写因子Foxp3の発現を消失すると自己免疫疾患をひき起こす細胞となる可能性が考えられることからも,炎症におけるFoxp3の安定性は議論の的になっている4-6).インターロイキン2は制御性T細胞の生存に必要なサイトカインであり,細胞表面タンパク質CD25はインターロイキン2受容体のα鎖に相当する.Foxp3陽性T細胞には正常な状態において,Foxp3の発現が安定なCD25の発現の高い集団と,Foxp3の発現が不安定なCD25の発現の低い集団が存在することが報告されているものの7),Foxp3陽性T細胞の分化可塑性の病理学的な意義は明らかではなかった.
なお,制御性T細胞については,濱口真英・坂口志文, 領域融合レビュー, 2, e005 (2013) も参照されたい.
1.関節炎においてCD25低発現Foxp3陽性T細胞からTh17細胞が発生する
自己免疫疾患を促進するTh17細胞は制御性T細胞が免疫抑制能を担う転写因子Foxp3の発現を消失することにより生じるという可能性をかんがみて,関節リウマチのモデルマウスであるコラーゲン誘導性関節炎マウスを用いてこの可能性の検証に取り組んだ.まず,Foxp3を発現するT細胞のうち,CD25を高発現する細胞と低発現する細胞とをマウスに移入して関節炎の発症を誘導し,移入したT細胞におけるFoxp3発現の安定性および関節炎の抑制効果について検討した.その結果,CD25高発現Foxp3陽性T細胞はFoxp3の発現を維持し関節の炎症および骨破壊を抑制した一方で,CD25低発現Foxp3陽性T細胞は一部がFoxp3の発現を消失してTh17細胞へ分化し,関節炎を抑制しないことが見い出された.Th17細胞はナイーブCD4陽性T細胞から分化することが知られているが,CD25低発現Foxp3陽性T細胞とナイーブCD4陽性T細胞とをマウスに共移入して関節炎の発症を誘導すると,関節炎を起こしたマウスではCD25低発現Foxp3陽性T細胞に由来するFoxp3陰性T細胞のほうが,ナイーブCD4陽性T細胞に由来するFoxp3陰性T細胞よりもTh17細胞へ分化しやすいことがわかった.以上の結果により,関節炎においてCD25低発現Foxp3陽性T細胞からTh17細胞が分化することが明らかになり,この細胞をexFoxp3 Th17細胞とよぶことにした.
2.exFoxp3 Th17細胞は炎症を起こした関節に集積する
Foxp3陽性T細胞の運命を追跡するためFoxp3のレポーターマウスを作製し,このマウスに関節炎を発症させたところ,Foxp3陽性T細胞から分化したexFoxp3 Th17細胞は炎症を起こした滑膜に多く集積することがわかった.また,Foxp3の発現を消失したT細胞は炎症の局所への集積に必要なケモカイン受容体CCR6および破骨細胞への分化誘導タンパク質であるRANKLの発現が高く,また,増殖がさかんであることがわかった.
炎症においてFoxp3の発現を消失したT細胞の起源は論争の的になっており,胸腺に由来する制御性T細胞,末梢から誘導された制御性T細胞,一過的にFoxp3を発現した制御性T細胞以外のT細胞,の3つの可能性が考えられている.胸腺に由来する制御性T細胞は,制御性T細胞のマーカーの高い発現およびそれらの遺伝子にDNA脱メチル化がみられる点で,制御性T細胞以外のT細胞と区別できることが報告されている8).関節炎を発症したFoxp3レポーターマウスにおいて検出されたFoxp3の発現を消失したT細胞は,制御性T細胞よりは低いものの制御性T細胞以外のT細胞よりは高い制御性T細胞のマーカーの発現がみられ,また,Foxp3遺伝子の部分的なDNA脱メチル化とCTLA-4遺伝子の高度なDNA脱メチル化が認められた.したがって,関節炎において見い出されたFoxp3の発現を消失したT細胞の起源は,胸腺に由来する制御性T細胞でも一過的にFoxp3を発現した制御性T細胞以外のT細胞でもなく,末梢から誘導された制御性T細胞であることが示唆された.正常な状態あるいは炎症における末梢から誘導された制御性T細胞の特徴にはいまだ不明な点が多いが,これを解明することは,炎症におけるexFoxp3 Th17細胞の起源の同定に貢献すると考えられる.とりわけ,関節炎における自己抗原に特異的なFoxp3の発現を消失したT細胞の存在の有無やその起源の同定は,今後の課題となると考えられる.
3.Foxp3陽性T細胞からexFoxp3 Th17細胞への分化は滑膜線維芽細胞によりひき起こされる
炎症を起こした滑膜にexFoxp3 Th17細胞が多く集積していたことから,この炎症を起こした滑膜を構成する細胞がFoxp3陽性T細胞からexFoxp3 Th17細胞への分化をひき起こすのではないかと考えた.この可能性を検証するため,炎症を起こした滑膜から滑膜マクロファージおよび滑膜線維芽細胞を単離し,in vitroにおいてFoxp3陽性T細胞と共培養したところ,滑膜線維芽細胞のみがexFoxp3 Th17細胞への分化をひき起こすことが明らかになった.一方で,ナイーブCD4陽性T細胞と滑膜線維芽細胞とを共培養してもTh17細胞への分化はほとんど認められなかった.また,滑膜線維芽細胞の培養上清や細胞間の接着のない条件でもexFoxp3 Th17細胞への分化が認められたことから,この分化には細胞間の接着を必要としないことが明らかになった.さらに,滑膜線維芽細胞はTNF,インターロイキン1,インターロイキン6などさまざまな炎症性サイトカインを多く発現していたが,インターロイキン6の中和抗体のみがexFoxp3 Th17細胞への分化を抑制した.このことから,Foxp3陽性T細胞からexFoxp3 Th17細胞への分化は,炎症を起こした滑膜において増殖する滑膜線維芽細胞がインターロイキン6を産生することによりひき起こされることが明らかになった(図1).
4.exFoxp3 Th17細胞は“最強”の破骨細胞の誘導性のT細胞である
破骨細胞は関節リウマチにおいて骨破壊を担う細胞であり,RANKLにより前駆細胞から破骨細胞への分化が誘導されることが知られている.これまで,ナイーブCD4陽性T細胞から分化した通常のTh17細胞は単独では破骨細胞の分化を誘導できないが,インターロイキン17が間葉系細胞においてRANKLの発現を促進することにより間接的に破骨細胞の分化を誘導することが知られていた9).今回,新しく同定されたexFoxp3 Th17細胞は,滑膜線維芽細胞の存在のもとで通常のTh17細胞よりも強力に破骨細胞を誘導することが明らかになった.また,exFoxp3 Th17細胞は通常のTh17細胞よりもRANKLの発現が高く,滑膜線維芽細胞が存在しなくても単独で破骨細胞の分化を誘導できることが明らかになった.破骨細胞の分化においてexFoxp3 Th17細胞の産生するRANKLと滑膜線維芽細胞の産生するRANKLとの相対的な重要性を明らかにするため,RANKLを欠損したexFoxp3 Th17細胞および滑膜線維芽細胞をそれぞれ用いて,破骨細胞の分化について検討した.その結果,滑膜線維芽細胞に由来するRANKLの寄与はexFoxp3 Th17に由来するRANKLの寄与より大きいものの,滑膜線維芽細胞に由来するRANKLが存在しなくてもexFoxp3 Th17細胞に由来するRANKLのみで破骨細胞の分化の誘導が見い出された.以上の結果から,exFoxp3 Th17細胞が“最強”の破骨細胞の誘導性のT細胞であることが明らかになった.
興味深いことに,マイクロアレイを用いた網羅的なトランスクリプトーム解析の結果,exFoxp3 Th17細胞はSox4,CCR6,CCL20,インターロイキン23R,RANKLの遺伝子,および,関節炎の発症にかかわる遺伝子を高く発現していることが見い出された.また,exFoxp3 Th17細胞はこれまで知られていたTh17細胞とは異なるTh17関連遺伝子の発現パターンをもち,病原性を示す新規のTh17細胞サブセットであることが明らかになった10,11).
5.自己抗原に反応する細胞を含むexFoxp3 Th17細胞は関節炎の発症を早め重症化させる
自己寛容は,自己成分を認識する胸腺に由来する制御性T細胞が免疫抑制能を獲得することにより維持されている.末梢から誘導された制御性T細胞も自己寛容の一端を担うと考えられているが,このような制御性T細胞が免疫抑制能を失えば自己を攻撃するT細胞となる可能性が考えられる.CD25低発現Foxp3陽性T細胞には自己を認識しうる末梢から誘導された制御性T細胞が多く含まれる可能性を考え,コラーゲンにより免疫したマウスから単離した,自己抗原であるコラーゲンを認識する細胞を含むCD25低発現Foxp3陽性T細胞を別のマウスに移入したうえで関節炎の発症を誘導した.その結果,移入されたCD25低発現Foxp3陽性T細胞はFoxp3の発現を消失し,関節炎,破骨細胞の分化の亢進,骨破壊の増悪をひき起こすことが明らかになった.この効果はエフェクターメモリーT細胞より強力であり,一方で,非自己の抗原を認識する細胞を含むCD25低発現Foxp3陽性T細胞は関節炎の増悪をひき起こさなかった.以上の結果から,CD25低発現Foxp3陽性T細胞から生じたFoxp3の発現を消失したT細胞による,生体レベルでの関節炎の発症の誘導が明らかになった.さらに,CD25低発現Foxp3陽性T細胞には自己を認識しうるような制御性T細胞が含まれており,炎症においてFoxp3の発現を消失することにより自己に対し反応性をもつT細胞へと分化することが示唆された.
以上はマウスを用いた実験結果であるが,疾患活動性の高い関節リウマチの患者において,炎症を起こした滑膜には,分化の過渡期と考えられるFoxp3およびインターロイキン17の両方を発現するT細胞が多く存在したことから,関節リウマチ患者においてもFoxp3陽性T細胞がexFoxp3 Th17細胞へと分化し,このような分化可塑性をもつFoxp3陽性T細胞が関節リウマチの病因に関与することが示唆された.
おわりに
この研究は,健康な状態では自己寛容の維持にはたらく制御性T細胞が,炎症においては自己免疫疾患をひき起こすTh17細胞へと分化する可能性を示したものであり,自己免疫疾患の新しい発症機構を提唱するものである.したがって,分化可塑性をもつFoxp3陽性T細胞が,自己寛容の維持か自己免疫疾患の発症かという運命決定を担うことが考えられる.この細胞の機能制御を担うのが滑膜線維芽細胞である一方で,滑膜線維芽細胞もT細胞の存在により骨破壊能を獲得することから,部位特異的な自己免疫疾患の発症もしくは増悪において,微小環境を構成する非血球系細胞と分化可塑性をもつFoxp3陽性T細胞との相互作用が重要であることが示唆される.それでは,このような細胞にはどのような存在意義があるのだろうか.自己に対する免疫応答は抑制されるべきである一方で,病原体やがんなど非自己に対する免疫応答の促進は必要である.したがって,免疫応答の促進と抑制の両方の機能をあわせもつ細胞が存在することは,状況に応じて柔軟に免疫応答を制御できる点で生体においてメリットがあると考えられる.しかし,炎症を起こした関節の局所など,炎症性サイトカインの濃度がいちじるしく高い環境では,自己に対し抑制的にはたらくべき細胞が自己まで攻撃するという“非常事態”が起こってしまうのかもしれない.この機能的な“柔軟性”がT細胞受容体のレパトアと関連性をもつかどうか,今後の解析が待たれる.
今回,筆者らが発見した,関節炎において炎症および骨破壊をひき起こす病原性のTh17細胞であるexFoxp3 Th17細胞は,関節リウマチだけでなく多発性硬化症や全身性エリテマトーデスなど,さまざまな自己免疫疾患の治療の標的となる可能性をもつ.exFoxp3 Th17細胞の病原性をつかさどる分子基盤の解明により,関節リウマチをはじめとする自己免疫疾患の新しい治療薬や診断マーカーの確立に貢献することが期待される.
文 献
- Korn, T., Bettelli, E., Oukka, M. et al.: IL-17 and Th17 cells. Annu. Rev. Immunol., 27, 485-517 (2009)[PubMed]
- Sakaguchi, S.: Naturally arising CD4+ regulatory T cells for immunologic self-tolerance and negative control of immune responses. Annu. Rev. Immunol., 22, 531-562 (2004)[PubMed]
- Hori, S., Nomura, T. & Sakaguchi, S.: Control of regulatory T cell development by the transcription factor Foxp3. Science, 299, 1057-1061 (2003)[PubMed]
- Zhou, X., Bailey-Bucktrout, S. L., Jeker, L. T. et al.: Instability of the transcription factor Foxp3 leads to the generation of pathogenic memory T cells in vivo. Nat. Immunol., 10, 1000-1007 (2009)[PubMed]
- Rubtsov, Y. P., Niec, R. E., Josefowicz, S. et al.: Stability of the regulatory T cell lineage in vivo. Science, 329, 1667-1671 (2010)[PubMed]
- Sakaguchi, S., Vignali, D. A., Rudensky, A. Y. et al.: The plasticity and stability of regulatory T cells. Nat. Rev. Immunol., 13, 461-467 (2013)[PubMed]
- Miyao, T., Floess, S., Setoguchi, R. et al.: Plasticity of Foxp3+ T cells reflects promiscuous Foxp3 expression in conventional T cells but not reprogramming of regulatory T cells. Immunity, 36, 262-275 (2012)[PubMed] [新着論文レビュー]
- Ohkura, N., Hamaguchi, M., Morikawa, H. et al.: T cell receptor stimulation-induced epigenetic changes and Foxp3 expression are independent and complementary events required for Treg cell development. Immunity, 37, 785-799 (2012)[PubMed]
- Takayanagi, H.: Osteoimmunology: shared mechanisms and crosstalk between the immune and bone systems. Nat. Rev. Immunol., 7, 292-304 (2007)[PubMed]
- Ghoreschi, K., Laurence, A., Yang, X. P. et al.: Generation of pathogenic TH17 cells in the absence of TGF-β signalling. Nature, 467, 967-971 (2010)[PubMed]
- Lee, Y., Awasthi, A., Yosef, N. et al.: Induction and molecular signature of pathogenic TH17 cells. Nat. Immunol., 13, 991-999 (2012)[PubMed]
著者プロフィール
略歴:2008年 千葉大学大学院医学系研究科博士課程 修了,同年 理化学研究所 研究員,2009年 東京医科歯科大学 研究員を経て,2013年より東京大学大学院医学系研究科 客員研究員.
研究テーマ:自己免疫疾患の発症機構の解明とその制御法の開発.
高柳 広(Hiroshi Takayanagi)
東京大学大学院医学系研究科 教授.科学技術振興機構ERATO高柳オステオネットワークプロジェクト 研究総括 兼任.
研究室URL:http://osteoimmunology.com/
© 2014 小松紀子・高柳 広 Licensed under CC 表示 2.1 日本