線虫のArgonauteのひとつCSR-1は自己遺伝子を記憶することによりpiRNAに対し拮抗的にはたらく
白山 昌樹
(米国Massachusetts大学Medical School,RNA Therapeutics Institute)
email:白山昌樹
DOI: 10.7875/first.author.2014.007
The C. elegans CSR-1 Argonaute pathway counteracts epigenetic silencing to promote germline gene expression.
Meetu Seth, Masaki Shirayama, Weifeng Gu, Takao Ishidate, Darryl Conte, Craig C. Mello
Developmental Cell, 27, 656-663 (2013)
原始的な適応免疫系として進化してきた小分子RNAは,病原微生物のもつ塩基情報を記憶し,それにマッチした標的遺伝子の発現を抑制する.線虫においては小分子RNAの一種であるpiRNAがArgonauteのひとつPIWIのガイド役となり,RNA依存性RNAポリメラーゼを標的RNAへと誘導し,病原微生物のもつ遺伝子の情報を小分子RNAのかたちで増幅し記憶することにより,標的遺伝子の発現を半永久的に抑制する.興味深いことに,線虫は病原微生物など外来の遺伝子情報(非自己RNA)のみならず,生殖細胞において発現しているすべての遺伝子情報(自己RNA)をも記憶している.今回,筆者らは,自己RNAの情報の把握は,piRNAに依存したゲノム全域にわたる監視から自己RNAがのがれるために必要であることを明らかにした.自己RNAの情報は非自己RNAと同様に,RNA依存性RNAポリメラーゼにより増幅されたのち小分子RNAのかたちで保存され,世代をこえて受け継がれていった.自己RNAの情報のカタログであるこの小分子RNAは,ArgonauteのひとつCSR-1と結合しており,csr-1変異株では自己RNAの情報はしだいに失われた.外来の遺伝子が自己遺伝子と認識されるには,発現しているだけでは不十分であり,線虫は長い時間をかけて新たな自己遺伝子の情報を構築しているものと考えられた.
小分子RNA(small RNA)とよばれる20~30塩基長の非コードRNAは,標的RNAをサーチすることによりRNAi(RNA interference,RNA干渉)において中心的な役割を担う.しかしながら,小分子RNAのもつ役割はRNAiにとどまらず,ヒトを含む多くの生物において個体の発生や分化,がん化など多彩な生命現象に関与している1).そこで中心的な役割をはたしているのがArgonauteとよばれるタンパク質であるが,今回,筆者らは,ArgonauteのひとつであるCSR-1が自己RNAを記憶し,自己RNAが小分子RNAの一種であるpiRNAによるゲノム全域におよぶ監視から除外されるよう機能していることを発見した.なお,CSR-1の機能に関しては,筆者らの論文を含め3報が同時に発表されているが,それぞれがまったく異なったアプローチをとりながらも同様な結論にいたっているため,ここでは,おもに筆者らの視点にたちCSR-1の機能について解説する.また,今回,筆者らが発表した論文は前回の論文の続編であるため,よりくわしい背景などについてはそちらを参照されたい2)(新着論文レビュー でも掲載).
なお,Argonauteの構造とその機能については,佐々木 浩・泊 幸秀, 領域融合レビュー, 1, e001 (2012) も参照されたい.
これまで,筆者らを含めたグループは,線虫のpiRNAは以前に侵入をうけたことのない新規の病原微生物のもつRNAであってもそれらを認識し,その発現を抑制することを明らかにしていた.これは,piRNAが未知の病原微生物のRNAの侵入に備えすべての塩基配列の組合せを準備しているためではなく(piRNAはほかの遺伝子と同じくゲノムにコードされているため,piRNAのもつ21塩基ですべての塩基配列をカバーするためには最大で421種類のpiRNAが必要となるが,これだけのゲノムサイズをもつ生物は存在しない),piRNAが標的RNAをミスマッチ配列を含み認識できることによる.線虫は約3万種ある既存のpiRNAのプールを使い,ミスマッチ配列を大胆に許容することにより,どのようなRNAでも認識できるようにしているのである.ところが当然ながら,このような機構では自己のRNAも認識されその発現が抑制されてしまう.piRNAと自己のRNAはともに生殖細胞において発現しているため,進化の過程において,piRNAの塩基配列が自己のRNAの塩基配列をさける,あるいは,自己のRNAの塩基配列がpiRNAの塩基配列をさけるような力がはたらいていることが予想された.実際に,そのような進化における力が線虫の生殖細胞においてはたらいていることは統計学的に証明されているが3,4),それを考慮にいれても,ほとんどの自己のRNAは理論上,piRNAにより認識されてしまう.同様な問題はmiRNAとその標的遺伝子とのあいだでも論じられており,両者のあいだになにか接点があるのか興味深い.筆者らは,この問題を解決するにあたり,自己RNAがpiRNAによる発現の抑制から能動的に保護されているのではないかという仮説をたてた.
Argonauteのなかでも線虫のCSR-1は非常に興味深いタンパク質である.CSR-1に結合するすべての小分子RNAは生殖細胞において発現する遺伝子を認識しているにもかかわらず,csr-1変異株は標的遺伝子の発現レベルが変化することなく死にいたる5).csr-1変異株では初期胚の有糸分裂においてセントロメアにてキネトコアが正常に形成されず染色体の分配に異常が観察されることから,csr-1変異株の致死性は細胞分裂の異常によりもたらされることが指摘されているが,そのくわしい分子機構は明らかにされていない.CSR-1は生殖細胞において発現するすべての遺伝子を認識できることから,CSR-1がゲノム全域にわたるきわめて興味深い機能をもつことは早い段階から疑われていた.しかし,染色体の分配による致死性のため,いくら当たると大きい“ホームラン”型の仮説が研究室の内部で議論されても,それを実際に検証することが技術的に困難であるため机上の空論にすぎなかった.タンパク質の新たな機能をみつけるには,単純に致死となる表現型を解析するだけなく,なんらかのアッセイ系の確立が必要とされることがある.今回,CSR-1のもつ多機能性は,対立遺伝子どうしの相互作用を用いた系から,思いがけず解きほぐされることになった.
組換え遺伝子,たとえば,gfp::cdk-1を1コピー,線虫のゲノムに導入すると,gfp::cdk-1のgfp遺伝子の部分はpiRNAにより非自己として認識されその発現が抑制されるのに対し,gfp遺伝子の位置を変えたcdk-1::gfpではなんらかの理由によりその発現が許容される(おそらく,自己遺伝子がgfp遺伝子の5’側にあるため).発現の抑制されたgfp::cdk-1(-) 株と発現の許容されたcdk-1::gfp(+) 株とを交雑すると次世代においてgfp遺伝子の発現はすべて抑制されたことから,gfp::cdk-1(-) 株の表現型が優性であることがわかった.そこで,gfp::cdk-1(-) をgfp遺伝子の表現型において優性を示すRNAe対立遺伝子とし(RNAe:RNA epigenetic silencing),gfp::cdk-1(RNAe) と表記する2).興味深いことに,gfp::cdk-1(RNAe) により発現の抑制されたcdk-1::gfp(-) は,さらなる交雑によりgfp::cdk-1(RNAe) を取り除いたのちもその発現は抑制された.したがって,cdk-1::gfpはまったく同じ塩基配列をもつにもかかわらず,逆の表現型を示すことができることになる.ここで,発現の抑制されたcdk-1::gfp(-) 株を,発現の許容されたもとのcdk-1::gfp(+) 株と交雑させると,やはりcdk-1::gfp(-) の表現型が優性となり両方のgfp遺伝子の発現が抑制されたことから,cdk-1::gfp(-) をcdk-1::gfp(RNAe) と書き直す.
RNAe対立遺伝子はすべてのgfp遺伝子に対し優性であると思われたが,すぐにいくつかの例外が観察された.gfp::cdk-1(RNAe) 株あるいはcdk-1::gfp(RNAe) 株をgfp遺伝子の発現しているoma-1::gfp(+) 株あるいはgfp::wrm-1(+) 株と交雑させると,不思議なことに,両方のgfp遺伝子が発現したのである.このことは,oma-1::gfp(+) あるいはgfp::wrm-1(+) がRNAe対立遺伝子に対し優性であることを示し,同じようにgfp遺伝子の発現しているcdk-1::gfp(+) とは性格が異なることを意味した.そこで,RNAe対立遺伝子に対し劣性であるcdk-1::gfp(+) などと区別するため,oma-1::gfp(+) あるいはgfp::wrm-1(+) を新たにRNAa対立遺伝子とし(RNAa:RNA epigenetic activation),oma-1::gfp(RNAa) あるいはgfp::wrm-1(RNAa) と表記することにした.発現していた対立遺伝子を優性的に抑制するRNAeについてはその分子機構の一端が明らかにされているが,RNAeの発現抑制を優性的に解除するRNAaの分子機構とはどのようなものなのだろうか.
RNAeによる遺伝子の発現抑制が確立するためには,まずpiRNAが標的RNAを認識し,RNA依存性RNAポリメラーゼを標的RNAに誘導することにより,標的RNAに相補的な小分子RNAを産生することが必要である.この小分子RNAはほかのArgonauteと結合してクロマチンを修飾し,標的遺伝子の発現を世代をこえてエピジェネティックに抑制する.RNAa対立遺伝子はRNAe対立遺伝子に対し優性であることから,RNAeと同様に小分子RNAの関与がまず疑われた.この時点で,だれでもCSR-1の関与を思いうかべるのではないだろうか.そこでまず,csr-1遺伝子に対しRNAiを施した条件においてoma-1::gfp(RNAa) 株をgfp::cdk-1(RNAe) 株と交雑し,gfp::cdk-1の発現が誘導されるかどうかを調べた.csr-1変異は致死であるため生き残ったF1において調べた結果,すべての場合でgfp遺伝子の発現はみられず,oma-1::gfpがRNAa能を失っていることがわかった.この実験はCSR-1がRNAaに必須であることの最初の証明であったが,さらに重要なことは,CSR-1が自己遺伝子の情報を記憶するという長年のモデルを証明するための突破口となったことであった.RNAaの発見によりCSR-1の機能があぶりだされたといえる.CSR-1のRNAaへの関与は,RNAiのもとだけではなくcsr-1変異株においても確認された.csr-1変異株はその致死性のため同じ交雑実験は行えないが,CSR-1のRNAaへの関与はハプロ不全(1対の対立遺伝子のうち一方の対立遺伝子の不活性化により起こる表現型の変異)を示したことから可能になった.つまり,いっけん野生型とは区別のつかない野生型csr-1およびcsr-1(-) をもつ株において,RNAa能が完全に失われたのである.
同じようにgfp遺伝子を発現していても,なぜcdk-1::gfp(+) はRNAa能をもたず,oma-1::gfp(RNAa) はRNAa能をもつのか.小分子RNAの遺伝子クローニングの実験から,oma-1::gfp(RNAa) のgfp遺伝子の領域には,ほかの自己遺伝子と同様にCSR-1と結合する小分子RNAであるCSR-1 22Gが蓄積されていたが,cdk-1::gfp(+) のgfp遺伝子の領域にはCSR-1 22Gの蓄積はあまりみられなかった.つまり,RNAa能はCSR-1に結合する小分子RNAにより付加されていたのである.また,この実験結果は,線虫の自己遺伝子はCSR-1により認識されることによりpiRNAによる遺伝子の発現抑制からのがれているという筆者らのモデルと一致した(図1).cdk-1::gfp(+) は発現が許容されているものの,まだCSR-1 22Gの蓄積が不十分なため自己遺伝子であるとは完全に認められず,いわば“仮免許”の状態であると考えられた.それでは,同じgfp遺伝子でありながら,なぜCSR-1 22Gはoma-1::gfp(RNAa) のgfp遺伝子を強く認識し,cdk-1::gfp(+) のgfp遺伝子を弱くしか認識しないのであろうか.このことは,新規の遺伝子がどのようにしてCSR-1 22Gにより認識されはじめ,しだいに自己遺伝子へと昇格していくのかにつながる大事な問題である.oma-1遺伝子のプロモーターと3’側非翻訳領域のみではRNAa能を付与することができず,タンパク質をコードする領域が重要であることから(筆者ら,未発表データ),oma-1遺伝子のコード領域を認識するCSR-1 22GがRNA依存性RNAポリメラーゼを利用してgfp遺伝子の領域に拡散していることが考えられたが,cdk-1遺伝子ではなぜこの現象が起こらないのかについては説明できず,この問題は現時点で未解決である.
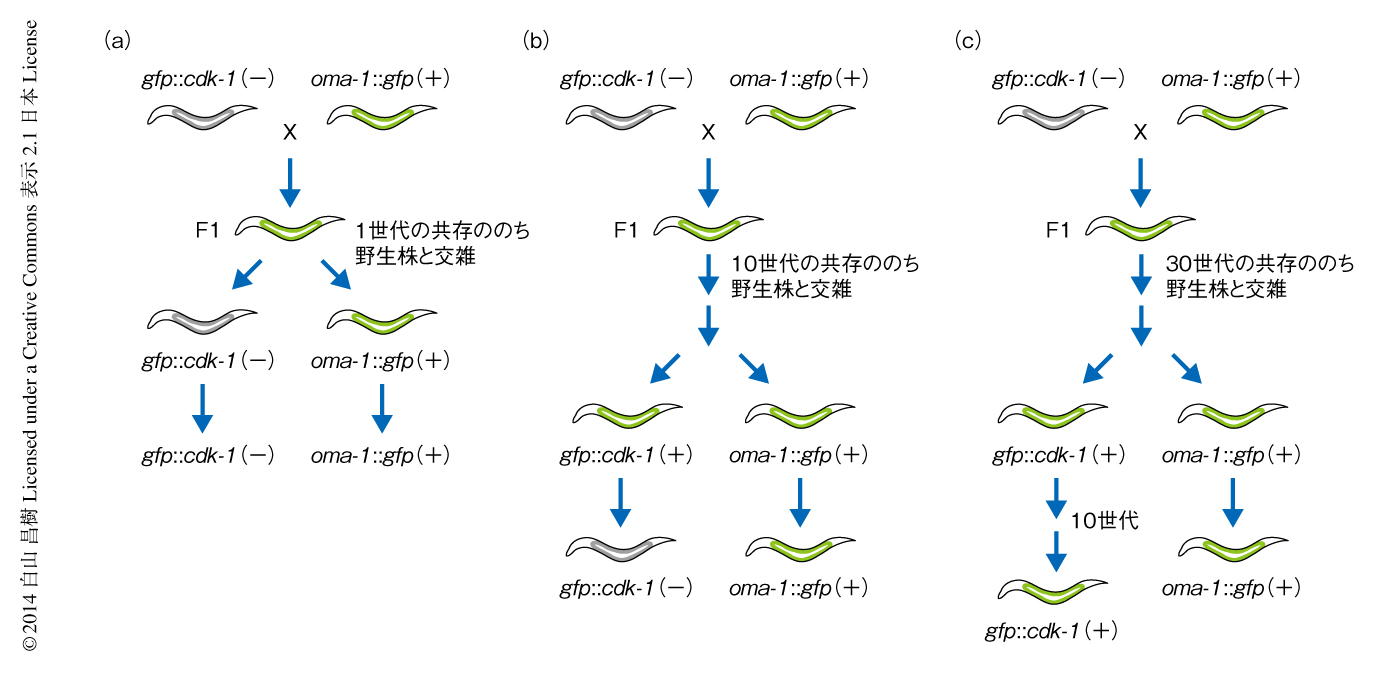
いったんRNAe対立遺伝子と判断された遺伝子が,自己遺伝子と認められることがあるのだろうか.RNAe対立遺伝子であろうとRNAa対立遺伝子であろうと,gfp遺伝子のもつ塩基配列はまったく同じである.RNAe対立遺伝子とRNAa対立遺伝子とを共存させるとRNAe対立遺伝子の発現が維持されるが,交雑によりRNAa対立遺伝子を除くとその発現は抑制されてしまう(図2a).そこで,RNAe対立遺伝子とRNAa対立遺伝子を長期間にわたり共存させることにより,RNAe対立遺伝子をRNAa対立遺伝子へと変換できるかどうか調べた.10世代(約1カ月)にわたり共存させたのちに両方の対立遺伝子を分離してRNAe対立遺伝子の発現が維持されるかどうか調べたところ,1世代目では発現がみられたが,2世代目では発現は抑制されてしまった(図2b).そこでつぎに,30世代(約3カ月)にわたり共存させたのちに両方の対立遺伝子を分離してRNAe対立遺伝子の発現が維持されるかどうか調べたところ,少なくとも10世代にわたりその発現は維持されることがわかった(図2c).このことは,線虫が非自己遺伝子の発現を容認するには世代をこえた長い期間が必要で,ゆっくりとした分子機構による変化(おそらく,クロマチンの修飾など)が関与していることを示唆した.線虫が非自己の遺伝子の発現に対し慎重であることは,生殖細胞の恒常性を維持するうえで当然のことではあるが,非自己の遺伝子の発現を(一時的であれ)許容することにより環境の変化への柔軟な適応に寄与していることも想像できる.30世代のちに分離されたRNAe対立遺伝子はその発現が維持されていたが,RNAa対立遺伝子(つまり,自己遺伝子)となることはなかった.線虫がいったん非自己と判断した遺伝子を自己遺伝子と認識するためには30世代にわたり発現しているだけでは不十分であり,さらに長期間の“観察期間”を必要とするのかもしれない.
筆者らのモデルでは,生殖細胞において発現する線虫のすべての遺伝子はCSR-1により保護(ライセンシング)されている.そして,このライセンスは遺伝子が長期間にわたり発現したという履歴をもとにあたえられるものである.ここで,筆者らのモデルが正しいとすると,csr-1変異株では世代をへるごとに徐々に自己遺伝子の発現が失われ致死にいたることが想像されるが,残念ながら,csr-1変異株は即座に致死となるためそのような実験を行うことは不可能であった.ところが,このモデルをサポートするようなデータが,筆者らの研究室から偶然にも得られた6).ここで鍵となった発見は2つある.ひとつは,csr-1変異株は雌雄同体の株では自己遺伝子の発現が変化するまえに1世代で致死となるが,雄では致死とならないことである.このため,雄を使いcsr-1変異の影響について世代をこえて観察することが可能となり,実際に,csr-1変異をもつ雄は自己遺伝子の発現が徐々に失われることにより5~6世代で不妊となることが明らかになった.さらに,もうひとつの発見として,雄の精子において雌に特異的な遺伝子は発現していないにもかかわらず,雄の精子に存在するCSR-1 22Gは,雄に特異的な遺伝子のみならず,雌に特異的な遺伝子をもすべて認識したことである.このことは,CSR-1 22Gが自己遺伝子のカタログとして機能するという仮説と一致した.さらに,筆者らの実験から,oma-1::gfpは雄では発現していないにもかかわらず,oma-1::gfpのもつRNAa能は雄からでも伝達しうることが確かめられた.
ここで紹介したArgonauteのひとつCSR-1は,自己RNAの発現記憶として機能するユニークな例である.筆者らは,Argonauteおよび小分子RNAは,単純に標的RNAを切断するだけでなく,特異的な酵素活性をもつさまざまなタンパク質複合体のガイドとしてはたらくことにより,その細胞での役割において無限の可能性をもつと想像している.さらに,小分子RNAを利用したガイドの機構は生物種をこえた人工的な利用が可能である.最近,細菌において発見されたCRISPR(clustered regularly interspaced short palindromic repeat)は,Argonauteと同様に,小分子の非コードRNAをガイドとして利用するゲノムの防御機構である7).CRISPRはRNAと相補的な塩基配列をもつDNAをみつけだし切断するが,切断されたDNAは遺伝子組換え能が非常に高いため,現在,DNAを編集するためのツールとして非常に高い関心をあつめている.小分子の非コードRNAをガイドとして利用した系は臨床への応用が期待されるため,現在,多くの大学や企業がその開発にしのぎをけずっており,今後,さらなる革命的な発見が期待される.
略歴:1995年 東京大学大学院理学系研究科 修了,2007年より米国Massachusetts大学Medical School助教授.
研究テーマ:興味深い生命現象を遺伝学的な手法により解明する.
関心事:小分子RNAをガイドとしたさまざまな実験系の確立.
© 2014 白山 昌樹 Licensed under CC 表示 2.1 日本
(米国Massachusetts大学Medical School,RNA Therapeutics Institute)
email:白山昌樹
DOI: 10.7875/first.author.2014.007
The C. elegans CSR-1 Argonaute pathway counteracts epigenetic silencing to promote germline gene expression.
Meetu Seth, Masaki Shirayama, Weifeng Gu, Takao Ishidate, Darryl Conte, Craig C. Mello
Developmental Cell, 27, 656-663 (2013)
要 約
原始的な適応免疫系として進化してきた小分子RNAは,病原微生物のもつ塩基情報を記憶し,それにマッチした標的遺伝子の発現を抑制する.線虫においては小分子RNAの一種であるpiRNAがArgonauteのひとつPIWIのガイド役となり,RNA依存性RNAポリメラーゼを標的RNAへと誘導し,病原微生物のもつ遺伝子の情報を小分子RNAのかたちで増幅し記憶することにより,標的遺伝子の発現を半永久的に抑制する.興味深いことに,線虫は病原微生物など外来の遺伝子情報(非自己RNA)のみならず,生殖細胞において発現しているすべての遺伝子情報(自己RNA)をも記憶している.今回,筆者らは,自己RNAの情報の把握は,piRNAに依存したゲノム全域にわたる監視から自己RNAがのがれるために必要であることを明らかにした.自己RNAの情報は非自己RNAと同様に,RNA依存性RNAポリメラーゼにより増幅されたのち小分子RNAのかたちで保存され,世代をこえて受け継がれていった.自己RNAの情報のカタログであるこの小分子RNAは,ArgonauteのひとつCSR-1と結合しており,csr-1変異株では自己RNAの情報はしだいに失われた.外来の遺伝子が自己遺伝子と認識されるには,発現しているだけでは不十分であり,線虫は長い時間をかけて新たな自己遺伝子の情報を構築しているものと考えられた.
はじめに
小分子RNA(small RNA)とよばれる20~30塩基長の非コードRNAは,標的RNAをサーチすることによりRNAi(RNA interference,RNA干渉)において中心的な役割を担う.しかしながら,小分子RNAのもつ役割はRNAiにとどまらず,ヒトを含む多くの生物において個体の発生や分化,がん化など多彩な生命現象に関与している1).そこで中心的な役割をはたしているのがArgonauteとよばれるタンパク質であるが,今回,筆者らは,ArgonauteのひとつであるCSR-1が自己RNAを記憶し,自己RNAが小分子RNAの一種であるpiRNAによるゲノム全域におよぶ監視から除外されるよう機能していることを発見した.なお,CSR-1の機能に関しては,筆者らの論文を含め3報が同時に発表されているが,それぞれがまったく異なったアプローチをとりながらも同様な結論にいたっているため,ここでは,おもに筆者らの視点にたちCSR-1の機能について解説する.また,今回,筆者らが発表した論文は前回の論文の続編であるため,よりくわしい背景などについてはそちらを参照されたい2)(新着論文レビュー でも掲載).
なお,Argonauteの構造とその機能については,佐々木 浩・泊 幸秀, 領域融合レビュー, 1, e001 (2012) も参照されたい.
1.piRNAのパラドックス
これまで,筆者らを含めたグループは,線虫のpiRNAは以前に侵入をうけたことのない新規の病原微生物のもつRNAであってもそれらを認識し,その発現を抑制することを明らかにしていた.これは,piRNAが未知の病原微生物のRNAの侵入に備えすべての塩基配列の組合せを準備しているためではなく(piRNAはほかの遺伝子と同じくゲノムにコードされているため,piRNAのもつ21塩基ですべての塩基配列をカバーするためには最大で421種類のpiRNAが必要となるが,これだけのゲノムサイズをもつ生物は存在しない),piRNAが標的RNAをミスマッチ配列を含み認識できることによる.線虫は約3万種ある既存のpiRNAのプールを使い,ミスマッチ配列を大胆に許容することにより,どのようなRNAでも認識できるようにしているのである.ところが当然ながら,このような機構では自己のRNAも認識されその発現が抑制されてしまう.piRNAと自己のRNAはともに生殖細胞において発現しているため,進化の過程において,piRNAの塩基配列が自己のRNAの塩基配列をさける,あるいは,自己のRNAの塩基配列がpiRNAの塩基配列をさけるような力がはたらいていることが予想された.実際に,そのような進化における力が線虫の生殖細胞においてはたらいていることは統計学的に証明されているが3,4),それを考慮にいれても,ほとんどの自己のRNAは理論上,piRNAにより認識されてしまう.同様な問題はmiRNAとその標的遺伝子とのあいだでも論じられており,両者のあいだになにか接点があるのか興味深い.筆者らは,この問題を解決するにあたり,自己RNAがpiRNAによる発現の抑制から能動的に保護されているのではないかという仮説をたてた.
2.CSR-1の不思議
Argonauteのなかでも線虫のCSR-1は非常に興味深いタンパク質である.CSR-1に結合するすべての小分子RNAは生殖細胞において発現する遺伝子を認識しているにもかかわらず,csr-1変異株は標的遺伝子の発現レベルが変化することなく死にいたる5).csr-1変異株では初期胚の有糸分裂においてセントロメアにてキネトコアが正常に形成されず染色体の分配に異常が観察されることから,csr-1変異株の致死性は細胞分裂の異常によりもたらされることが指摘されているが,そのくわしい分子機構は明らかにされていない.CSR-1は生殖細胞において発現するすべての遺伝子を認識できることから,CSR-1がゲノム全域にわたるきわめて興味深い機能をもつことは早い段階から疑われていた.しかし,染色体の分配による致死性のため,いくら当たると大きい“ホームラン”型の仮説が研究室の内部で議論されても,それを実際に検証することが技術的に困難であるため机上の空論にすぎなかった.タンパク質の新たな機能をみつけるには,単純に致死となる表現型を解析するだけなく,なんらかのアッセイ系の確立が必要とされることがある.今回,CSR-1のもつ多機能性は,対立遺伝子どうしの相互作用を用いた系から,思いがけず解きほぐされることになった.
3.RNAaの発見
組換え遺伝子,たとえば,gfp::cdk-1を1コピー,線虫のゲノムに導入すると,gfp::cdk-1のgfp遺伝子の部分はpiRNAにより非自己として認識されその発現が抑制されるのに対し,gfp遺伝子の位置を変えたcdk-1::gfpではなんらかの理由によりその発現が許容される(おそらく,自己遺伝子がgfp遺伝子の5’側にあるため).発現の抑制されたgfp::cdk-1(-) 株と発現の許容されたcdk-1::gfp(+) 株とを交雑すると次世代においてgfp遺伝子の発現はすべて抑制されたことから,gfp::cdk-1(-) 株の表現型が優性であることがわかった.そこで,gfp::cdk-1(-) をgfp遺伝子の表現型において優性を示すRNAe対立遺伝子とし(RNAe:RNA epigenetic silencing),gfp::cdk-1(RNAe) と表記する2).興味深いことに,gfp::cdk-1(RNAe) により発現の抑制されたcdk-1::gfp(-) は,さらなる交雑によりgfp::cdk-1(RNAe) を取り除いたのちもその発現は抑制された.したがって,cdk-1::gfpはまったく同じ塩基配列をもつにもかかわらず,逆の表現型を示すことができることになる.ここで,発現の抑制されたcdk-1::gfp(-) 株を,発現の許容されたもとのcdk-1::gfp(+) 株と交雑させると,やはりcdk-1::gfp(-) の表現型が優性となり両方のgfp遺伝子の発現が抑制されたことから,cdk-1::gfp(-) をcdk-1::gfp(RNAe) と書き直す.
RNAe対立遺伝子はすべてのgfp遺伝子に対し優性であると思われたが,すぐにいくつかの例外が観察された.gfp::cdk-1(RNAe) 株あるいはcdk-1::gfp(RNAe) 株をgfp遺伝子の発現しているoma-1::gfp(+) 株あるいはgfp::wrm-1(+) 株と交雑させると,不思議なことに,両方のgfp遺伝子が発現したのである.このことは,oma-1::gfp(+) あるいはgfp::wrm-1(+) がRNAe対立遺伝子に対し優性であることを示し,同じようにgfp遺伝子の発現しているcdk-1::gfp(+) とは性格が異なることを意味した.そこで,RNAe対立遺伝子に対し劣性であるcdk-1::gfp(+) などと区別するため,oma-1::gfp(+) あるいはgfp::wrm-1(+) を新たにRNAa対立遺伝子とし(RNAa:RNA epigenetic activation),oma-1::gfp(RNAa) あるいはgfp::wrm-1(RNAa) と表記することにした.発現していた対立遺伝子を優性的に抑制するRNAeについてはその分子機構の一端が明らかにされているが,RNAeの発現抑制を優性的に解除するRNAaの分子機構とはどのようなものなのだろうか.
4.CSR-1はRNAaの活性に必須である
RNAeによる遺伝子の発現抑制が確立するためには,まずpiRNAが標的RNAを認識し,RNA依存性RNAポリメラーゼを標的RNAに誘導することにより,標的RNAに相補的な小分子RNAを産生することが必要である.この小分子RNAはほかのArgonauteと結合してクロマチンを修飾し,標的遺伝子の発現を世代をこえてエピジェネティックに抑制する.RNAa対立遺伝子はRNAe対立遺伝子に対し優性であることから,RNAeと同様に小分子RNAの関与がまず疑われた.この時点で,だれでもCSR-1の関与を思いうかべるのではないだろうか.そこでまず,csr-1遺伝子に対しRNAiを施した条件においてoma-1::gfp(RNAa) 株をgfp::cdk-1(RNAe) 株と交雑し,gfp::cdk-1の発現が誘導されるかどうかを調べた.csr-1変異は致死であるため生き残ったF1において調べた結果,すべての場合でgfp遺伝子の発現はみられず,oma-1::gfpがRNAa能を失っていることがわかった.この実験はCSR-1がRNAaに必須であることの最初の証明であったが,さらに重要なことは,CSR-1が自己遺伝子の情報を記憶するという長年のモデルを証明するための突破口となったことであった.RNAaの発見によりCSR-1の機能があぶりだされたといえる.CSR-1のRNAaへの関与は,RNAiのもとだけではなくcsr-1変異株においても確認された.csr-1変異株はその致死性のため同じ交雑実験は行えないが,CSR-1のRNAaへの関与はハプロ不全(1対の対立遺伝子のうち一方の対立遺伝子の不活性化により起こる表現型の変異)を示したことから可能になった.つまり,いっけん野生型とは区別のつかない野生型csr-1およびcsr-1(-) をもつ株において,RNAa能が完全に失われたのである.
5.自己遺伝子はRNAa対立遺伝子である
同じようにgfp遺伝子を発現していても,なぜcdk-1::gfp(+) はRNAa能をもたず,oma-1::gfp(RNAa) はRNAa能をもつのか.小分子RNAの遺伝子クローニングの実験から,oma-1::gfp(RNAa) のgfp遺伝子の領域には,ほかの自己遺伝子と同様にCSR-1と結合する小分子RNAであるCSR-1 22Gが蓄積されていたが,cdk-1::gfp(+) のgfp遺伝子の領域にはCSR-1 22Gの蓄積はあまりみられなかった.つまり,RNAa能はCSR-1に結合する小分子RNAにより付加されていたのである.また,この実験結果は,線虫の自己遺伝子はCSR-1により認識されることによりpiRNAによる遺伝子の発現抑制からのがれているという筆者らのモデルと一致した(図1).cdk-1::gfp(+) は発現が許容されているものの,まだCSR-1 22Gの蓄積が不十分なため自己遺伝子であるとは完全に認められず,いわば“仮免許”の状態であると考えられた.それでは,同じgfp遺伝子でありながら,なぜCSR-1 22Gはoma-1::gfp(RNAa) のgfp遺伝子を強く認識し,cdk-1::gfp(+) のgfp遺伝子を弱くしか認識しないのであろうか.このことは,新規の遺伝子がどのようにしてCSR-1 22Gにより認識されはじめ,しだいに自己遺伝子へと昇格していくのかにつながる大事な問題である.oma-1遺伝子のプロモーターと3’側非翻訳領域のみではRNAa能を付与することができず,タンパク質をコードする領域が重要であることから(筆者ら,未発表データ),oma-1遺伝子のコード領域を認識するCSR-1 22GがRNA依存性RNAポリメラーゼを利用してgfp遺伝子の領域に拡散していることが考えられたが,cdk-1遺伝子ではなぜこの現象が起こらないのかについては説明できず,この問題は現時点で未解決である.
6.発現のみでは自己RNAとは認められない
いったんRNAe対立遺伝子と判断された遺伝子が,自己遺伝子と認められることがあるのだろうか.RNAe対立遺伝子であろうとRNAa対立遺伝子であろうと,gfp遺伝子のもつ塩基配列はまったく同じである.RNAe対立遺伝子とRNAa対立遺伝子とを共存させるとRNAe対立遺伝子の発現が維持されるが,交雑によりRNAa対立遺伝子を除くとその発現は抑制されてしまう(図2a).そこで,RNAe対立遺伝子とRNAa対立遺伝子を長期間にわたり共存させることにより,RNAe対立遺伝子をRNAa対立遺伝子へと変換できるかどうか調べた.10世代(約1カ月)にわたり共存させたのちに両方の対立遺伝子を分離してRNAe対立遺伝子の発現が維持されるかどうか調べたところ,1世代目では発現がみられたが,2世代目では発現は抑制されてしまった(図2b).そこでつぎに,30世代(約3カ月)にわたり共存させたのちに両方の対立遺伝子を分離してRNAe対立遺伝子の発現が維持されるかどうか調べたところ,少なくとも10世代にわたりその発現は維持されることがわかった(図2c).このことは,線虫が非自己遺伝子の発現を容認するには世代をこえた長い期間が必要で,ゆっくりとした分子機構による変化(おそらく,クロマチンの修飾など)が関与していることを示唆した.線虫が非自己の遺伝子の発現に対し慎重であることは,生殖細胞の恒常性を維持するうえで当然のことではあるが,非自己の遺伝子の発現を(一時的であれ)許容することにより環境の変化への柔軟な適応に寄与していることも想像できる.30世代のちに分離されたRNAe対立遺伝子はその発現が維持されていたが,RNAa対立遺伝子(つまり,自己遺伝子)となることはなかった.線虫がいったん非自己と判断した遺伝子を自己遺伝子と認識するためには30世代にわたり発現しているだけでは不十分であり,さらに長期間の“観察期間”を必要とするのかもしれない.
7.自己RNAのライセンスは失われるか
筆者らのモデルでは,生殖細胞において発現する線虫のすべての遺伝子はCSR-1により保護(ライセンシング)されている.そして,このライセンスは遺伝子が長期間にわたり発現したという履歴をもとにあたえられるものである.ここで,筆者らのモデルが正しいとすると,csr-1変異株では世代をへるごとに徐々に自己遺伝子の発現が失われ致死にいたることが想像されるが,残念ながら,csr-1変異株は即座に致死となるためそのような実験を行うことは不可能であった.ところが,このモデルをサポートするようなデータが,筆者らの研究室から偶然にも得られた6).ここで鍵となった発見は2つある.ひとつは,csr-1変異株は雌雄同体の株では自己遺伝子の発現が変化するまえに1世代で致死となるが,雄では致死とならないことである.このため,雄を使いcsr-1変異の影響について世代をこえて観察することが可能となり,実際に,csr-1変異をもつ雄は自己遺伝子の発現が徐々に失われることにより5~6世代で不妊となることが明らかになった.さらに,もうひとつの発見として,雄の精子において雌に特異的な遺伝子は発現していないにもかかわらず,雄の精子に存在するCSR-1 22Gは,雄に特異的な遺伝子のみならず,雌に特異的な遺伝子をもすべて認識したことである.このことは,CSR-1 22Gが自己遺伝子のカタログとして機能するという仮説と一致した.さらに,筆者らの実験から,oma-1::gfpは雄では発現していないにもかかわらず,oma-1::gfpのもつRNAa能は雄からでも伝達しうることが確かめられた.
おわりに
ここで紹介したArgonauteのひとつCSR-1は,自己RNAの発現記憶として機能するユニークな例である.筆者らは,Argonauteおよび小分子RNAは,単純に標的RNAを切断するだけでなく,特異的な酵素活性をもつさまざまなタンパク質複合体のガイドとしてはたらくことにより,その細胞での役割において無限の可能性をもつと想像している.さらに,小分子RNAを利用したガイドの機構は生物種をこえた人工的な利用が可能である.最近,細菌において発見されたCRISPR(clustered regularly interspaced short palindromic repeat)は,Argonauteと同様に,小分子の非コードRNAをガイドとして利用するゲノムの防御機構である7).CRISPRはRNAと相補的な塩基配列をもつDNAをみつけだし切断するが,切断されたDNAは遺伝子組換え能が非常に高いため,現在,DNAを編集するためのツールとして非常に高い関心をあつめている.小分子の非コードRNAをガイドとして利用した系は臨床への応用が期待されるため,現在,多くの大学や企業がその開発にしのぎをけずっており,今後,さらなる革命的な発見が期待される.
文 献
- Ghildiyal, M. & Zamore, P. D.: Small silencing RNAs: an expanding universe. Nat. Rev. Genet., 10, 94-108 (2009)[PubMed]
- Shirayama, M., Seth, M., Lee, H. C. et al.: piRNAs initiate an epigenetic memory of nonself RNA in the C. elegans germline. Cell, 150, 65-77 (2012)[PubMed] [新着論文レビュー]
- Lee, H. C., Gu, W., Shirayama, M. et al.: C. elegans piRNAs mediate the genome-wide surveillance of germline transcripts. Cell, 150, 78-87 (2012)[PubMed]
- Ashe, A., Sapetschnig, A., Weick, E. M. et al.: piRNAs can trigger a multigenerational epigenetic memory in the germline of C. elegans. Cell, 150, 88-99 (2012)[PubMed]
- Claycomb, J. M., Batista, P. J., Pang, K. M. et al.: The Argonaute CSR-1 and its 22G-RNA cofactors are required for holocentric chromosome segregation. Cell, 139, 123-134 (2009)[PubMed]
- Conine, C. C., Moresco, J. J., Gu, W. et al.: Argonautes promote male fertility and provide a paternal memory of germline gene expression in C. elegans. Cell, 155, 1532-1544 (2013)[PubMed]
- Mali, P., Esvelt, K. M. & Church, G. M.: Cas9 as a versatile tool for engineering biology. Nat. Methods, 10, 957-963 (2013)[PubMed]
著者プロフィール
略歴:1995年 東京大学大学院理学系研究科 修了,2007年より米国Massachusetts大学Medical School助教授.
研究テーマ:興味深い生命現象を遺伝学的な手法により解明する.
関心事:小分子RNAをガイドとしたさまざまな実験系の確立.
© 2014 白山 昌樹 Licensed under CC 表示 2.1 日本