ヒトのES細胞から腎臓の構造を自発的に組織構築する腎臓前駆細胞への分化の誘導
高里 実
(オーストラリアQueensland大学Institute for Molecular Bioscience)
email:高里 実
DOI: 10.7875/first.author.2014.004
Directing human embryonic stem cell differentiation towards a renal lineage generates a self-organizing kidney.
M. Takasato, P. X. Er, M. Becroft, J. M. Vanslambrouck, E. G. Stanley, A. G. Elefanty, M. H. Little
Nature Cell Biology, 16, 118-126 (2014)
全世界における末期の腎不全の有病率は年間8%の割合で増加しており,腎臓の再生医療の実現が急がれている.腎臓は中胚葉系の臓器であり,中間中胚葉を経由したのち,尿管芽と後腎間葉とが相互作用することにより発生する.腎臓の機能の最小の構成組織であるネフロンは,この後腎間葉に由来するネフロン前駆細胞から発生する.一方,中間中胚葉は後部原条から発生する.このように,腎臓の発生の機序は明らかになっているものの,ヒトではネフロン前駆細胞は出生前に消失するため,出生ののちに失われたネフロンが自然に再生されることはない.筆者らは,この論文において,ヒトのES細胞を化学的に明確な培養条件において2次元培養し,後部原条をへて中間中胚葉への分化を誘導することに成功した.さらに,この中間中胚葉から尿管芽および後腎間葉への分化を誘導し,双方が自発的に腎臓の構造を構築しネフロンが形成されることを確認した.このヒトのES細胞に由来する腎臓の構造は腎臓の種々の組織を含んでおり,幹細胞による腎臓の再生医療の今後に光をあてる可能性がある.
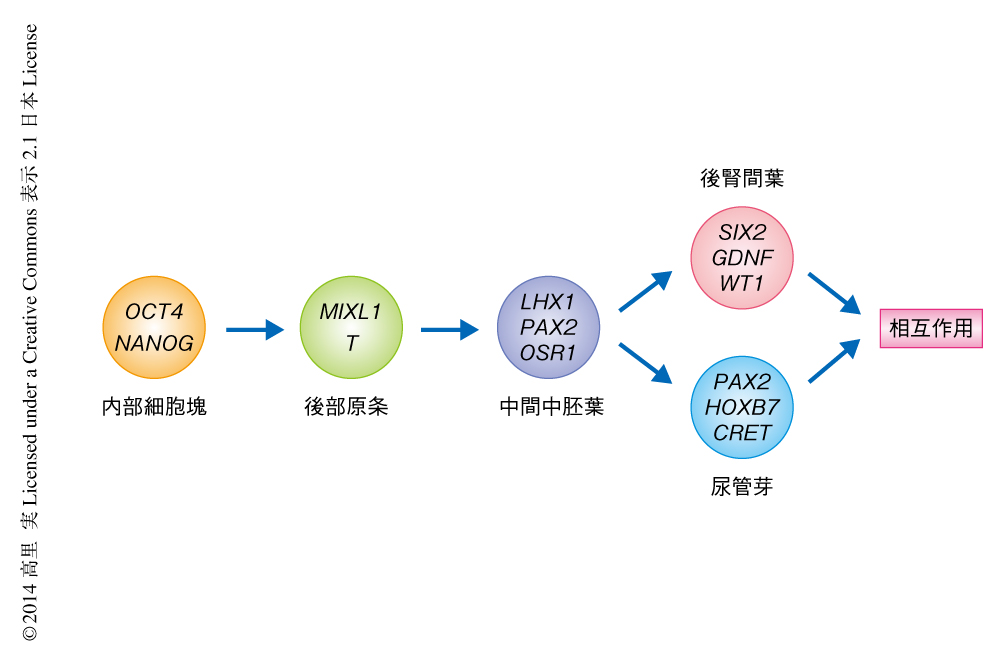
細胞のもつ自発的な組織構築(self-organizing)の能力に関する記載は,ニワトリの胎生期の中腎を解離し再集合させ,再集合体の内部に中腎の管を再現させたという,1955年の報告が最初である1).自発的な組織構築の過程では,種々の細胞がそれぞれの役割を担い相互に作用しあうことにより,最終的に実際の臓器の内部に存在するような複雑な構造の組織を構築する.そのためには,細胞のあいだで互いを認識する手段が必要であり,それはおもに,リガンドと受容体とのあいだのシグナル伝達や,細胞と細胞間マトリックスとのあいだの相互作用であると考えられている.さらに近年になり,ヒトのES細胞から,眼杯,脳下垂体,腸の組織を“自発的な組織構築”により3次元的に形成したという報告がでてきた.一方,ヒトES細胞から腎臓の細胞系譜への分化に関しては,中間中胚葉,足細胞,近位尿細管などへの分化誘導系が報告されているが,尿管芽および後腎間葉の両方を同時に誘導したという報告,また,腎臓の構造について自発的な組織構築を達成したという報告もなかった.腎臓の発生は上皮細胞である尿管芽と間葉細胞である後腎間葉との相互作用により進行する.そして,この2種類の腎臓前駆細胞はともに,中間中胚葉という発生の初期に胎児の体幹部分に発生する中胚葉組織から生じる(図1).筆者らは,この論文において,実際の腎臓の発生の過程をなぞってヒトのES細胞を段階的に分化させて2種類の腎臓前駆細胞への分化を同時に誘導し,さらに,分化を誘導した腎臓前駆細胞を用いた腎臓の構造の“自発的な組織構築”を世界ではじめて報告した.
原条は中胚葉および内胚葉の前駆段階であり,マウスのES細胞を用いた研究の報告によると,アクチビンAおよびBMP4を処理することにより分化の誘導が可能である2).このとき,アクチビンAはのちに内胚葉へと分化する前部原条への分化を誘導し,BMP4は中胚葉へと分化する後部原条への分化を誘導する.また,古典的なWntシグナルも原条への分化を誘導することが,ヒトおよびマウスのES細胞の研究により知られている3).中間中胚葉は後部原条から発生するので,まずこれらのモルフォゲンがヒトのES細胞にどのように作用するかを確かめた.原条のマーカーであるMIXL1遺伝子の遺伝子座にGFPの遺伝子をノックインしたヒトのES細胞では,20 ng/mlのBMP4および100 ng/mlのアクチビンAによりGFPの発現が誘導されると報告されているが4),このレポーター細胞に対し,複数のBMP4濃度および複数のアクチビンA濃度の組合せ,あるいは,古典的なWntシグナルのアゴニストであるCHIR99021を複数の濃度で処理し,後部原条への分化を誘導する至適な条件を検討した.その結果,高濃度(30 ng/ml)のBMP4および低濃度(10 ng/ml)のアクチビンAの組合せ,あるいは,高濃度のCHIR99021を処理した場合に,2~3日目に後部原条への分化が効率的に誘導されることがわかった.どちらの条件においても,およそ90%の細胞がGFP陽性を示した.
後部原条のつぎのステップは中間中胚葉への分化の誘導である.個体の発生においては,原腸陥入ののち,中胚葉のなかから沿軸中胚葉,中間中胚葉,側板中胚葉が発生する.高濃度のBMP4および低濃度のアクチビンAにより分化の誘導された後部原条は,そののち,側板中胚葉のマーカーを発現する細胞へと自発的に分化したが,中間中胚葉のマーカーを発現することはなかった.この事実は,後部原条に分化したのち,中間中胚葉への分化を特異的に誘導するなんらかの因子が必要であることを示唆した.
そのひとつの候補として,FGFシグナルに注目した.事実,発生の過程において,FGF8は原条から後部の体幹中胚葉にいたるまで発現しており,FGF9は沿軸中胚葉および中間中胚葉において発現している.また,FGF2およびFGF9はin vitroにおいて後腎間葉の生存および維持をサポートするタンパク質としても知られている5,6).分化を誘導することにより得られた後部原条に対しFGF2,FGF8,FGF9を4日間にわたり処理したところ,FGF2の存在下およびFGF9存在下においてのみ後部原条は中間中胚葉へと分化し,その効率は80%超に達した.初期の中胚葉の発生においては,BMP4が内軸と外軸のパターンを制御するモルフォゲンであることが知られている7).つまり,高濃度のBMP4が側板中胚葉を,低濃度のBMP4が中間中胚葉を,そして,NOGによるBMPシグナルの抑制が沿軸中胚葉への分化を誘導している.この知見をもとに,実際にヒトのES細胞からの中間中胚葉への分化を誘導するとき,FGF9と同時にBMP4を処理したところ,中間中胚葉のマーカーの発現が低下するとともに,側板中胚葉のマーカーの発現が上昇した.以上の結果から,FGFシグナルが後部原条から中間中胚葉への分化を特異的に誘導するのに十分な役割をもつことがわかった.
哺乳類の個体発生においては,中間中胚葉は中腎管(上皮細胞)および腎節(間葉細胞)へと分化し,頭部から尾部にそって前腎,中腎,後腎が発生するが,出生ののちには後腎だけが残り発達する.マウスの個体発生の研究から,レチノイン酸はこの中腎管の発生に必須であることが知られている8).また,FGF9およびBMP7はin vitroにおける後腎間葉の生存および維持に必須であることも知られている6).これらの知見から,BMP4およびアクチビンAにより分化を誘導した中間中胚葉に対しレチノイン酸,FGF9,BMP7を処理し,上皮系および間葉系の2種類の腎臓前駆細胞への分化の誘導を試みた.経時的なRT-PCR法により遺伝子発現の変化を調べたところ,原条のマーカーの発現につづき,中間中胚葉のマーカーが発現し,そののち,後腎間葉のマーカーおよび中腎管のマーカーが発現し,ヒトのES細胞から腎臓前駆細胞への段階的な分化の誘導が確認された.経時的な免疫蛍光染色によると,中腎管のマーカーに陽性を示す中腎管様の構造が誘導14日目に形成され,しかも,この構造の形成はレチノイン酸の用量に依存的に誘導された.後腎間葉のマーカーに陽性を示す細胞は中腎管のマーカーに陰性を示す間葉細胞として,中腎管様の構造と同時に誘導されることも確認された.これら分化の誘導により得られた腎臓前駆細胞を誘導22日目まで2次元培養したところ,糸球体足細胞のマーカー,近位尿細管のマーカー,集合管のマーカーなど,腎臓への分化の最終地点のマーカーの発現がRT-PCR法により確認された.これらの結果は,腎臓の発生に必要な複数の細胞が相互作用しつつ分化が誘導されたことを示唆するものであったが,後腎間葉のマーカーであるSIX2に陽性を示す細胞が凝集せず散在するかたちで誘導されたことや,SIX2陽性細胞において本来は陽性を示すはずのPAX2が陰性であったことなど,腎臓への分化誘導系としては不完全な部分が存在した.
一方,CHIR99021により分化を誘導した中間中胚葉に対しFGF9のみを処理した場合も,RT-PCR法により腎臓前駆細胞への段階的な分化の誘導が確認された.しかし,BMP4およびアクチビンAによる分化誘導系と比較すると,間葉細胞が中腎管様の構造の周囲に凝集して発生し,それらは後腎間葉のマーカーであるSIX2およびWT1のみならずPAX2についても陽性を示したことから,CHIR99021による分化誘導系のほうが腎臓の細胞系譜への分化をより強力に誘導できることがわかった.また,間質系細胞のマーカーが誘導されていたこと,そして,後腎領域の特異的なマーカーであるHOXD11が後腎間葉のマーカーであるWT1に陰性を示す細胞および陽性を示す細胞の両方に発現していたことから,後腎の間質系細胞への分化も同時に誘導されたことがわかった.
後腎の形成の鍵となる開始点は,中腎管に由来する尿管芽と腎節に由来する後腎間葉との相互作用である.後腎間葉はGDNFを分泌して尿管芽の増殖を制御し,尿管芽はFGF9やWNTを分泌して後腎間葉の自己再生や分化を制御している.ネフロンの発生の過程では,この間葉と上皮との相互作用の結果,まず,腎胞が形成される.ここまでの実験により,間葉系および上皮系の2種類の腎臓前駆細胞への分化が誘導されたことがわかったが,これは同時に,ひきつづき細胞間の相互作用をへて腎臓の構造が自発的に構築される可能性を示唆した.この可能性を検証するため,CHIR99021による分化誘導系により腎臓前駆細胞を誘導し,そののち,成長因子を取り除き腎臓の構造の自発的な組織構築を観察した.その結果,誘導18日目までに後腎間葉のマーカーに陽性を示す間葉細胞が,中腎管のマーカーに陽性を示す伸長した尿管芽様の構造をつつんだのち,腎胞のマーカーに陽性を示す胞状の構造を形成した.さらに,実際の腎臓の発生過程においてみられる現象と同じく,この腎胞とみられる組織が尿管芽様の構造と結合する状態も観察された.この腎胞様の組織は尿管芽様の構造の周辺でのみ発生し,尿管芽様の構造からはなれた地点ではいっさい観察されなかった.これらの結果は,2種類の腎臓前駆細胞の相互作用の結果,腎胞が形成されたことを強く示唆した.
腎胞の形成ののち,ネフロンの発生は複雑な分化制御をへて,糸球体,近位尿細管,遠位尿細管などへの最終分化にいたる.分化を誘導した腎臓前駆細胞が本物の腎臓の組織に組み込まれるかどうかを検証するため,解離再集合実験を行った.この実験系では,胎性マウスの腎臓を1細胞まで解離したのち,遠心分離機を用いて再集合体を形成すると,再集合体の内部でマウスの腎臓の構造が自発的に構築される9).この解離再集合体に少数のヒトのES細胞に由来する腎臓前駆細胞を混合し,4日間にわたり培養した.ヒトのES細胞に由来する細胞はヒトのミトコンドリアに特異的な抗体により検出した.その結果,解離再集合体の内部で自発的に構築されたマウスの集合管,後腎間葉,腎胞の組織に,ヒトのES細胞に由来する腎臓前駆細胞が取り込まれることがわかった.一方,未分化な状態のヒトのES細胞を混合した実験ではこのような取り込みはいっさい検出されず,代わりに,再集合体の内部にヒトのES細胞に由来する巨大な嚢胞が形成された.
実際の個体発生では,腎臓の発生はすべて3次元で進行する.今回の分化誘導系では,ヒトのES細胞を2次元培養により分化させているため,腎臓の構造の自発的な組織構築を達成する際に不利となる可能性があった.また,胎性マウスの腎臓の解離再集合実験で証明されたように,必要な種類の機能しうる腎臓前駆細胞がそろっていれば,3次元培養において腎臓の構造を自発的に組織構築することができる.そこで,ヒトのES細胞から分化を誘導した腎臓前駆細胞が,胎性マウスの腎臓と同様に3次元培養において腎臓の構造を自発的に組織構築できるかどうかを検証するため,ヒトのES細胞に由来する細胞のみを用いて解離再集合実験を行った.その結果,解離再集合体の内部で,尿管芽,それをとりかこむ後腎間葉,腎胞,集合管,近位尿細管の組織が構築されることが観察された.しかも,これらの組織の形状は,胎性マウスの腎臓のみを用いた解離再集合体の内部で自発的に組織構築された腎臓の組織の形状と非常に近いものであった.以上の結果から,この研究においてヒトのES細胞より分化の誘導された腎臓前駆細胞は,腎臓の構造を自発的に組織構築する機能をもつことが示された.
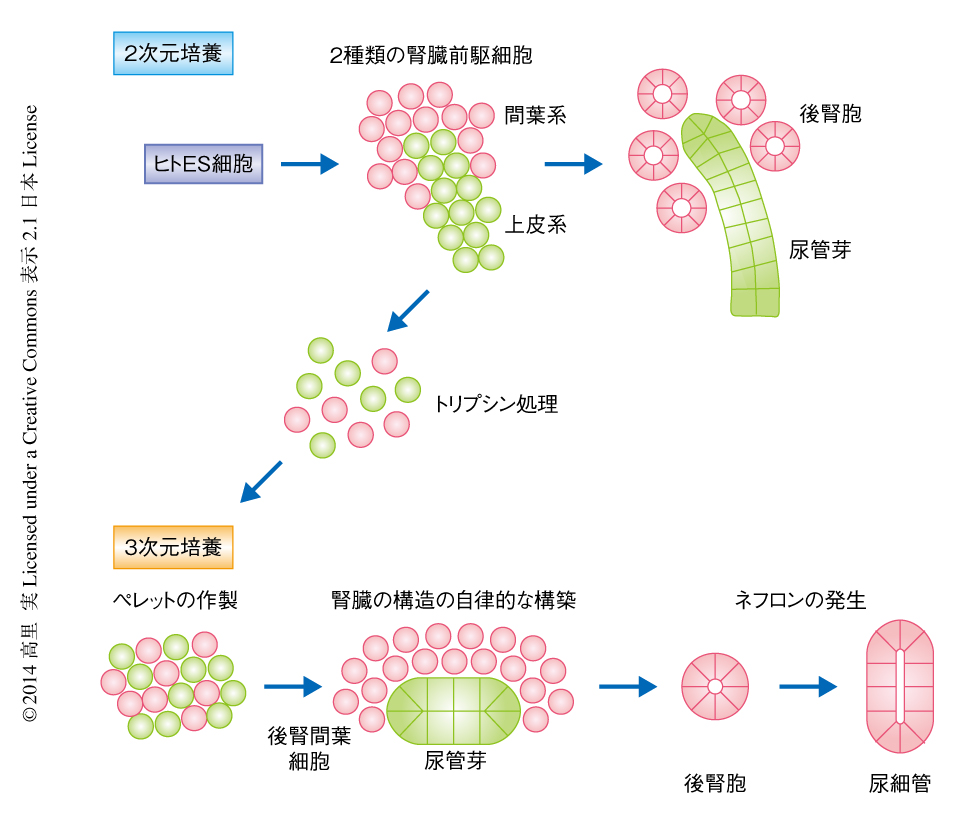
筆者らは,この論文において,ヒトのES細胞から腎臓の発生に重要な腎臓前駆細胞への分化を誘導し,それらが互いの相互作用をへて腎臓の構造を自発的に組織構築するのに必要な能力をもつことを示した(図2).構築された腎臓の構造はまだ小さいが,今後は培養条件を最適化し,より大きな腎臓の構造を構築することが課題である.将来的には,このようなin vitroにおいて自発的に組織構築を行う腎臓前駆細胞の開発は,臓器バイオエンジニアリングの分野において有用な技術となる可能性がある.さらには,分化を誘導した腎臓の組織を,薬剤の腎臓における毒性を調べるスクリーニングや,in vitroにおける遺伝子疾患モデルの再現に利用することもできるほか,究極的には,損耗した腎臓の機能をおぎなえる移植の可能な器官の開発につなげていきたい.
略歴:2008年 東京大学大学院理学系研究科博士課程 修了,同年 同 研究員を経て,2009年よりオーストラリアQueensland大学 研究員.
研究テーマ:腎臓の発生における分子機構の解明からはじまり,現在は,ヒトの幹細胞を用いた腎臓の分化誘導系の開発.
関心事:基礎研究の成果をいかに医療応用へとつなげるか,を模索中.
© 2014 高里 実 Licensed under CC 表示 2.1 日本
(オーストラリアQueensland大学Institute for Molecular Bioscience)
email:高里 実
DOI: 10.7875/first.author.2014.004
Directing human embryonic stem cell differentiation towards a renal lineage generates a self-organizing kidney.
M. Takasato, P. X. Er, M. Becroft, J. M. Vanslambrouck, E. G. Stanley, A. G. Elefanty, M. H. Little
Nature Cell Biology, 16, 118-126 (2014)
要 約
全世界における末期の腎不全の有病率は年間8%の割合で増加しており,腎臓の再生医療の実現が急がれている.腎臓は中胚葉系の臓器であり,中間中胚葉を経由したのち,尿管芽と後腎間葉とが相互作用することにより発生する.腎臓の機能の最小の構成組織であるネフロンは,この後腎間葉に由来するネフロン前駆細胞から発生する.一方,中間中胚葉は後部原条から発生する.このように,腎臓の発生の機序は明らかになっているものの,ヒトではネフロン前駆細胞は出生前に消失するため,出生ののちに失われたネフロンが自然に再生されることはない.筆者らは,この論文において,ヒトのES細胞を化学的に明確な培養条件において2次元培養し,後部原条をへて中間中胚葉への分化を誘導することに成功した.さらに,この中間中胚葉から尿管芽および後腎間葉への分化を誘導し,双方が自発的に腎臓の構造を構築しネフロンが形成されることを確認した.このヒトのES細胞に由来する腎臓の構造は腎臓の種々の組織を含んでおり,幹細胞による腎臓の再生医療の今後に光をあてる可能性がある.
はじめに
細胞のもつ自発的な組織構築(self-organizing)の能力に関する記載は,ニワトリの胎生期の中腎を解離し再集合させ,再集合体の内部に中腎の管を再現させたという,1955年の報告が最初である1).自発的な組織構築の過程では,種々の細胞がそれぞれの役割を担い相互に作用しあうことにより,最終的に実際の臓器の内部に存在するような複雑な構造の組織を構築する.そのためには,細胞のあいだで互いを認識する手段が必要であり,それはおもに,リガンドと受容体とのあいだのシグナル伝達や,細胞と細胞間マトリックスとのあいだの相互作用であると考えられている.さらに近年になり,ヒトのES細胞から,眼杯,脳下垂体,腸の組織を“自発的な組織構築”により3次元的に形成したという報告がでてきた.一方,ヒトES細胞から腎臓の細胞系譜への分化に関しては,中間中胚葉,足細胞,近位尿細管などへの分化誘導系が報告されているが,尿管芽および後腎間葉の両方を同時に誘導したという報告,また,腎臓の構造について自発的な組織構築を達成したという報告もなかった.腎臓の発生は上皮細胞である尿管芽と間葉細胞である後腎間葉との相互作用により進行する.そして,この2種類の腎臓前駆細胞はともに,中間中胚葉という発生の初期に胎児の体幹部分に発生する中胚葉組織から生じる(図1).筆者らは,この論文において,実際の腎臓の発生の過程をなぞってヒトのES細胞を段階的に分化させて2種類の腎臓前駆細胞への分化を同時に誘導し,さらに,分化を誘導した腎臓前駆細胞を用いた腎臓の構造の“自発的な組織構築”を世界ではじめて報告した.
1.後部原条への分化の誘導
原条は中胚葉および内胚葉の前駆段階であり,マウスのES細胞を用いた研究の報告によると,アクチビンAおよびBMP4を処理することにより分化の誘導が可能である2).このとき,アクチビンAはのちに内胚葉へと分化する前部原条への分化を誘導し,BMP4は中胚葉へと分化する後部原条への分化を誘導する.また,古典的なWntシグナルも原条への分化を誘導することが,ヒトおよびマウスのES細胞の研究により知られている3).中間中胚葉は後部原条から発生するので,まずこれらのモルフォゲンがヒトのES細胞にどのように作用するかを確かめた.原条のマーカーであるMIXL1遺伝子の遺伝子座にGFPの遺伝子をノックインしたヒトのES細胞では,20 ng/mlのBMP4および100 ng/mlのアクチビンAによりGFPの発現が誘導されると報告されているが4),このレポーター細胞に対し,複数のBMP4濃度および複数のアクチビンA濃度の組合せ,あるいは,古典的なWntシグナルのアゴニストであるCHIR99021を複数の濃度で処理し,後部原条への分化を誘導する至適な条件を検討した.その結果,高濃度(30 ng/ml)のBMP4および低濃度(10 ng/ml)のアクチビンAの組合せ,あるいは,高濃度のCHIR99021を処理した場合に,2~3日目に後部原条への分化が効率的に誘導されることがわかった.どちらの条件においても,およそ90%の細胞がGFP陽性を示した.
2.中間中胚葉への分化の誘導
後部原条のつぎのステップは中間中胚葉への分化の誘導である.個体の発生においては,原腸陥入ののち,中胚葉のなかから沿軸中胚葉,中間中胚葉,側板中胚葉が発生する.高濃度のBMP4および低濃度のアクチビンAにより分化の誘導された後部原条は,そののち,側板中胚葉のマーカーを発現する細胞へと自発的に分化したが,中間中胚葉のマーカーを発現することはなかった.この事実は,後部原条に分化したのち,中間中胚葉への分化を特異的に誘導するなんらかの因子が必要であることを示唆した.
そのひとつの候補として,FGFシグナルに注目した.事実,発生の過程において,FGF8は原条から後部の体幹中胚葉にいたるまで発現しており,FGF9は沿軸中胚葉および中間中胚葉において発現している.また,FGF2およびFGF9はin vitroにおいて後腎間葉の生存および維持をサポートするタンパク質としても知られている5,6).分化を誘導することにより得られた後部原条に対しFGF2,FGF8,FGF9を4日間にわたり処理したところ,FGF2の存在下およびFGF9存在下においてのみ後部原条は中間中胚葉へと分化し,その効率は80%超に達した.初期の中胚葉の発生においては,BMP4が内軸と外軸のパターンを制御するモルフォゲンであることが知られている7).つまり,高濃度のBMP4が側板中胚葉を,低濃度のBMP4が中間中胚葉を,そして,NOGによるBMPシグナルの抑制が沿軸中胚葉への分化を誘導している.この知見をもとに,実際にヒトのES細胞からの中間中胚葉への分化を誘導するとき,FGF9と同時にBMP4を処理したところ,中間中胚葉のマーカーの発現が低下するとともに,側板中胚葉のマーカーの発現が上昇した.以上の結果から,FGFシグナルが後部原条から中間中胚葉への分化を特異的に誘導するのに十分な役割をもつことがわかった.
3.尿管芽および後腎間葉への分化の誘導
哺乳類の個体発生においては,中間中胚葉は中腎管(上皮細胞)および腎節(間葉細胞)へと分化し,頭部から尾部にそって前腎,中腎,後腎が発生するが,出生ののちには後腎だけが残り発達する.マウスの個体発生の研究から,レチノイン酸はこの中腎管の発生に必須であることが知られている8).また,FGF9およびBMP7はin vitroにおける後腎間葉の生存および維持に必須であることも知られている6).これらの知見から,BMP4およびアクチビンAにより分化を誘導した中間中胚葉に対しレチノイン酸,FGF9,BMP7を処理し,上皮系および間葉系の2種類の腎臓前駆細胞への分化の誘導を試みた.経時的なRT-PCR法により遺伝子発現の変化を調べたところ,原条のマーカーの発現につづき,中間中胚葉のマーカーが発現し,そののち,後腎間葉のマーカーおよび中腎管のマーカーが発現し,ヒトのES細胞から腎臓前駆細胞への段階的な分化の誘導が確認された.経時的な免疫蛍光染色によると,中腎管のマーカーに陽性を示す中腎管様の構造が誘導14日目に形成され,しかも,この構造の形成はレチノイン酸の用量に依存的に誘導された.後腎間葉のマーカーに陽性を示す細胞は中腎管のマーカーに陰性を示す間葉細胞として,中腎管様の構造と同時に誘導されることも確認された.これら分化の誘導により得られた腎臓前駆細胞を誘導22日目まで2次元培養したところ,糸球体足細胞のマーカー,近位尿細管のマーカー,集合管のマーカーなど,腎臓への分化の最終地点のマーカーの発現がRT-PCR法により確認された.これらの結果は,腎臓の発生に必要な複数の細胞が相互作用しつつ分化が誘導されたことを示唆するものであったが,後腎間葉のマーカーであるSIX2に陽性を示す細胞が凝集せず散在するかたちで誘導されたことや,SIX2陽性細胞において本来は陽性を示すはずのPAX2が陰性であったことなど,腎臓への分化誘導系としては不完全な部分が存在した.
一方,CHIR99021により分化を誘導した中間中胚葉に対しFGF9のみを処理した場合も,RT-PCR法により腎臓前駆細胞への段階的な分化の誘導が確認された.しかし,BMP4およびアクチビンAによる分化誘導系と比較すると,間葉細胞が中腎管様の構造の周囲に凝集して発生し,それらは後腎間葉のマーカーであるSIX2およびWT1のみならずPAX2についても陽性を示したことから,CHIR99021による分化誘導系のほうが腎臓の細胞系譜への分化をより強力に誘導できることがわかった.また,間質系細胞のマーカーが誘導されていたこと,そして,後腎領域の特異的なマーカーであるHOXD11が後腎間葉のマーカーであるWT1に陰性を示す細胞および陽性を示す細胞の両方に発現していたことから,後腎の間質系細胞への分化も同時に誘導されたことがわかった.
4.間葉と上皮とのあいだの相互作用の確認
後腎の形成の鍵となる開始点は,中腎管に由来する尿管芽と腎節に由来する後腎間葉との相互作用である.後腎間葉はGDNFを分泌して尿管芽の増殖を制御し,尿管芽はFGF9やWNTを分泌して後腎間葉の自己再生や分化を制御している.ネフロンの発生の過程では,この間葉と上皮との相互作用の結果,まず,腎胞が形成される.ここまでの実験により,間葉系および上皮系の2種類の腎臓前駆細胞への分化が誘導されたことがわかったが,これは同時に,ひきつづき細胞間の相互作用をへて腎臓の構造が自発的に構築される可能性を示唆した.この可能性を検証するため,CHIR99021による分化誘導系により腎臓前駆細胞を誘導し,そののち,成長因子を取り除き腎臓の構造の自発的な組織構築を観察した.その結果,誘導18日目までに後腎間葉のマーカーに陽性を示す間葉細胞が,中腎管のマーカーに陽性を示す伸長した尿管芽様の構造をつつんだのち,腎胞のマーカーに陽性を示す胞状の構造を形成した.さらに,実際の腎臓の発生過程においてみられる現象と同じく,この腎胞とみられる組織が尿管芽様の構造と結合する状態も観察された.この腎胞様の組織は尿管芽様の構造の周辺でのみ発生し,尿管芽様の構造からはなれた地点ではいっさい観察されなかった.これらの結果は,2種類の腎臓前駆細胞の相互作用の結果,腎胞が形成されたことを強く示唆した.
5.解離再集合実験系を用いた実際の腎臓の組織への同化能の検証
腎胞の形成ののち,ネフロンの発生は複雑な分化制御をへて,糸球体,近位尿細管,遠位尿細管などへの最終分化にいたる.分化を誘導した腎臓前駆細胞が本物の腎臓の組織に組み込まれるかどうかを検証するため,解離再集合実験を行った.この実験系では,胎性マウスの腎臓を1細胞まで解離したのち,遠心分離機を用いて再集合体を形成すると,再集合体の内部でマウスの腎臓の構造が自発的に構築される9).この解離再集合体に少数のヒトのES細胞に由来する腎臓前駆細胞を混合し,4日間にわたり培養した.ヒトのES細胞に由来する細胞はヒトのミトコンドリアに特異的な抗体により検出した.その結果,解離再集合体の内部で自発的に構築されたマウスの集合管,後腎間葉,腎胞の組織に,ヒトのES細胞に由来する腎臓前駆細胞が取り込まれることがわかった.一方,未分化な状態のヒトのES細胞を混合した実験ではこのような取り込みはいっさい検出されず,代わりに,再集合体の内部にヒトのES細胞に由来する巨大な嚢胞が形成された.
6.3次元培養における腎臓の構造の自発的な組織構築
実際の個体発生では,腎臓の発生はすべて3次元で進行する.今回の分化誘導系では,ヒトのES細胞を2次元培養により分化させているため,腎臓の構造の自発的な組織構築を達成する際に不利となる可能性があった.また,胎性マウスの腎臓の解離再集合実験で証明されたように,必要な種類の機能しうる腎臓前駆細胞がそろっていれば,3次元培養において腎臓の構造を自発的に組織構築することができる.そこで,ヒトのES細胞から分化を誘導した腎臓前駆細胞が,胎性マウスの腎臓と同様に3次元培養において腎臓の構造を自発的に組織構築できるかどうかを検証するため,ヒトのES細胞に由来する細胞のみを用いて解離再集合実験を行った.その結果,解離再集合体の内部で,尿管芽,それをとりかこむ後腎間葉,腎胞,集合管,近位尿細管の組織が構築されることが観察された.しかも,これらの組織の形状は,胎性マウスの腎臓のみを用いた解離再集合体の内部で自発的に組織構築された腎臓の組織の形状と非常に近いものであった.以上の結果から,この研究においてヒトのES細胞より分化の誘導された腎臓前駆細胞は,腎臓の構造を自発的に組織構築する機能をもつことが示された.
おわりに
筆者らは,この論文において,ヒトのES細胞から腎臓の発生に重要な腎臓前駆細胞への分化を誘導し,それらが互いの相互作用をへて腎臓の構造を自発的に組織構築するのに必要な能力をもつことを示した(図2).構築された腎臓の構造はまだ小さいが,今後は培養条件を最適化し,より大きな腎臓の構造を構築することが課題である.将来的には,このようなin vitroにおいて自発的に組織構築を行う腎臓前駆細胞の開発は,臓器バイオエンジニアリングの分野において有用な技術となる可能性がある.さらには,分化を誘導した腎臓の組織を,薬剤の腎臓における毒性を調べるスクリーニングや,in vitroにおける遺伝子疾患モデルの再現に利用することもできるほか,究極的には,損耗した腎臓の機能をおぎなえる移植の可能な器官の開発につなげていきたい.
文 献
- Trinkaus, J. P. & Groves, P. W.: Differentiation in culture of mixed aggregates of dissociated tissue cells. Proc. Natl Acad. Sci. USA, 41, 787-795 (1955)[PubMed]
- Gadue, P., Huber, T. L., Paddison, P. J. et al.: Wnt and TGF-β signaling are required for the induction of an in vitro model of primitive streak formation using embryonic stem cells. Proc. Natl Acad. Sci. USA, 103, 16806-16811 (2006)[PubMed]
- Sumi, T., Tsuneyoshi, N., Nakatsuji, N. et al.: Defining early lineage specification of human embryonic stem cells by the orchestrated balance of canonical Wnt/β-catenin, Activin/Nodal and BMP signaling. Development, 135, 2969-2979 (2008)[PubMed]
- Davis, R. P., Ng, E. S., Costa, M. et al.: Targeting a GFP reporter gene to the MIXL1 locus of human embryonic stem cells identifies human primitive streak-like cells and enables isolation of primitive hematopoietic precursors. Blood, 111, 1876-1884 (2008)[PubMed]
- Dudley, A. T., Godin, R. E. & Robertson, E. J.: Interaction between FGF and BMP signaling pathways regulates development of metanephric mesenchyme. Genes Dev., 13, 1601-1613 (1999)[PubMed]
- Barak, H., Huh, S. H., Chen, S. et al.: FGF9 and FGF20 maintain the stemness of nephron progenitors in mice and man. Dev. Cell, 22, 1191-1207 (2012)[PubMed]
- James, R. G. & Schultheiss, T. M.: Bmp signaling promotes intermediate mesoderm gene expression in a dose-dependent, cell-autonomous and translation-dependent manner. Dev. Biol., 288, 113-125 (2005)[PubMed]
- Niederreither, K., Subbarayan, V., Dolle, P. et al.: Embryonic retinoic acid synthesis is essential for early mouse post-implantation development. Nat. Genet., 21, 444-448 (1999)[PubMed]
- Hendry, C. E., Vanslambrouck, J. M., Ineson, J. et al.: Direct transcriptional reprogramming of adult cells to embryonic nephron progenitors. J. Am. Soc. Nephrol., 24, 1424-1434 (2013)[PubMed]
著者プロフィール
略歴:2008年 東京大学大学院理学系研究科博士課程 修了,同年 同 研究員を経て,2009年よりオーストラリアQueensland大学 研究員.
研究テーマ:腎臓の発生における分子機構の解明からはじまり,現在は,ヒトの幹細胞を用いた腎臓の分化誘導系の開発.
関心事:基礎研究の成果をいかに医療応用へとつなげるか,を模索中.
© 2014 高里 実 Licensed under CC 表示 2.1 日本