副腎におけるオピオイドペプチド-CXCR7系は血中のグルココルチコイド濃度の概日変動を変化させ情動行動を制御する
池田祐一・柳沢正史
(米国Texas大学Southwestern Medical Center,Department of Molecular Genetics)
email:池田祐一
DOI: 10.7875/first.author.2014.001
Modulation of circadian glucocorticoid oscillation via adrenal opioid-CXCR7 signaling alters emotional behavior.
Yuichi Ikeda, Hidetoshi Kumagai, Amber Skach, Makito Sato, Masashi Yanagisawa
Cell, 155, 1323-1336 (2013)
グルココルチコイドは副腎皮質から産生されるステロイドホルモンであり,脳をはじめとするさまざまな臓器において重要なはたらきをしている.グルココルチコイドの基礎分泌は生体に存在する概日時計により支配されているため,血中のグルココルチコイド濃度はストレスのない通常の状態においては約1日の周期で増減する.このグルココルチコイド濃度の概日変動の存在は以前からよく知られていたが,その生理学的な意義についてはいまだ不明な点が多い.筆者らは,グルココルチコイド濃度の概日変動の振幅を増大させると抗不安作用が惹起されることを明らかにした.副腎皮質に生じる被膜下細胞の過形成は加齢にともないしばしば認められる機能不明の組織学的な変化であり,その発達には大きな個体差がある.今回,この被膜下細胞の過形成の個体差に着目し,被膜下細胞の過形成のあるマウスはないマウスに比べより強い抗不安行動を示すことを見い出した.興味深いことに,この行動変化の原因はグルココルチコイド濃度の概日変動の振幅が被膜下細胞の過形成に依存して増大することにあった.その分子機序について調べたところ,被膜下細胞の過形成から分泌される中間体オピオイドペプチドが,副腎皮質に発現するβアレスチンバイアスドGタンパク質共役受容体CXCR7のリガンドとしてはたらき,グルココルチコイド濃度の概日変動の振幅を増大していることがわかった.また,CXCR7に作用する低分子化合物を被膜下細胞の過形成のないマウスに投与したところ,被膜下細胞の過形成のあるマウスの表現型を再現することができた.以上の結果より,副腎皮質に発現するβアレスチンバイアスドGタンパク質共役受容体を標的とすることにより,グルココルチコイド濃度の概日変動および情動行動を制御できる可能性が示唆された.
グルココルチコイドは視床下部-下垂体-副腎系の最終産物として副腎皮質から分泌されるステロイドホルモンである.脳がストレスを感知すると視床下部-下垂体-副腎系が活性化され,グルココルチコイドが血中に放出される.放出されたグルココルチコイドはすぐさま視床下部および下垂体に対しフィードバック制御を起こし,視床下部-下垂体-副腎系の持続的な活性化を抑制する.グルココルチコイドは血液脳関門を容易に通過するため,脳のさまざまな神経核に直接に作用し,脳の高次機能に影響を及ぼす.実際,視床下部-下垂体-副腎系の機能不全,あるいは,脳におけるグルココルチコイドの異常な作用は,不安障害,うつ病,心的外傷後ストレス障害など,ストレス関連障害をもつ患者においてよく認められる所見である1).
一方,視床下部-下垂体-副腎系はストレスのない状況においては概日時計の制御をうけるため,グルココルチコイドの基礎分泌を反映する血中のグルココルチコイド濃度は概日変動を示す2).概日時計は代謝や行動のリズムを外界の明暗の周期に同調させるのに必須の生体システムであり,その破綻は代謝の異常や情動行動の異常などさまざまな疾患をひき起こす3).哺乳類において,概日時計システムの中枢は視床下部の視交差上核に存在し,そこから発信される時刻の情報は全身に存在する末梢時計へと伝達される.その濃度が概日変動するグルココルチコイドは視交差上核にある中枢時計が全身の末梢時計を同調する際に利用する内因性シグナルのひとつであると考えられており,すでに,脳のいくつかの神経核に存在する末梢時計はグルココルチコイドに依存して中枢時計に同調することが知られている4,5).以上より,グルココルチコイドのシグナルは脳のさまざまな部位において遺伝子発現の位相を調節することにより脳の高次機能を制御するとの作業仮説は,きわめて妥当なものであろう.興味深いことに,うつ病の患者の約半数が健常者とは異なるグルココルチコイド濃度の概日変動のパターンを示すという観察の結果もある6).ところが意外なことに,位相,周期,振幅により規定されるグルココルチコイド濃度の概日変動のパターンを変化させると,個体のレベルにおいてどのような行動変化が起こるのかについてはほとんど知られていない.
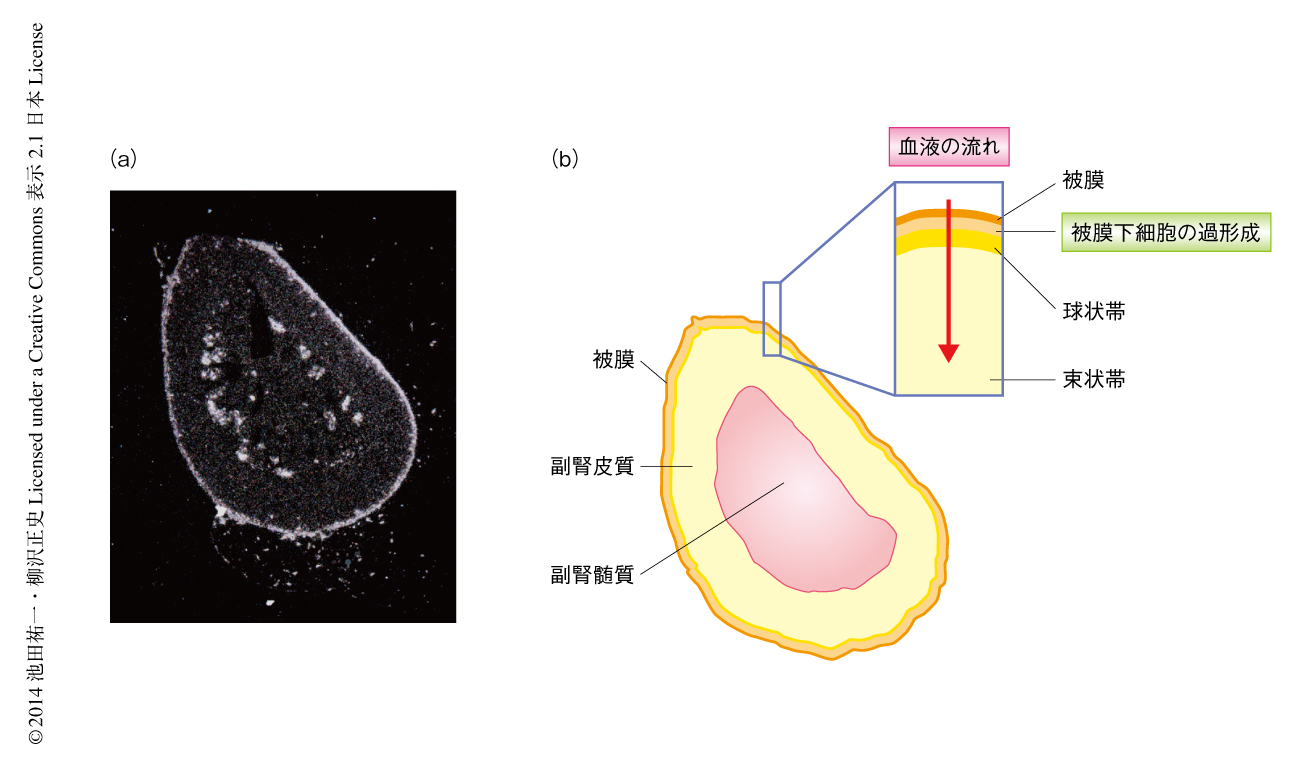
副腎髄質はさまざまな生理活性ペプチドを産生する神経内分泌組織である.筆者らは,副腎髄質から分泌されるペプチドを調べている過程において,偶然にも,オピオイドペプチドをコードするプロエンケファリンAの遺伝子が副腎髄質のみならず被膜下細胞の過形成においても強く発現していることを発見した(図1a).プロエンケファリンAの発現は被膜下細胞の過形成の加齢にともなう発達とよく相関しており,雄では4カ月齢,雌では6カ月齢より認められた.ペプチド前駆体分解酵素の発現パターンより,被膜下細胞の過形成において発現するプロエンケファリンAからはおもに中間体オピオイドペプチドが産生されることが予想され,実際に,マウスの副腎より抽出したペプチド画分を調べたところ,予想どおり,いくつかの中間体オピオイドペプチドが検出された.
副腎では外側から内側へ,被膜,皮質,髄質の順に血液が流れるので,被膜下細胞の過形成から分泌されるペプチドは副腎皮質のステロイド産生細胞に作用することが解剖学的に可能である(図1b).そこで,被膜下細胞の過形成より分泌されるプロエンケファリンAに由来するペプチドは,副腎皮質におけるグルココルチコイドの産生に影響を及ぼすと仮定した.この仮説を検証するため,被膜下細胞の過形成の発達には大きな個体差があることに着目し,6カ月齢の被膜下細胞の過形成のあるマウスとないマウスにおいて,視床下部-下垂体-副腎系の機能および血中のグルココルチコイド濃度について調べた.マウスのグループ分けは,すべての実験がおわったのちに副腎を取り出し,被膜下細胞の過形成の有無を組織学的に判定することにより行った.まず,急性ストレス負荷試験およびデキサメサゾン抑制試験により視床下部-下垂体-副腎系の機能を評価したが,両方のグループのあいだで有意な差はなく,被膜下細胞の過形成が存在しても視床下部-下垂体-副腎系は正常に機能することがわかった.つぎに,血中のグルココルチコイド濃度を1日のさまざまな時間帯において測定した.両方のグループのあいだで,グルココルチコイド濃度の概日変動における位相および周期,また,1日のグルココルチコイドの総分泌量に違いは認められなかったものの,被膜下細胞の過形成のある雌のマウスは被膜下細胞の過形成のない雌のマウスに比べ,グルココルチコイド濃度の概日変動においてより大きな振幅を示した.雄のマウスにおいて,この差は認められなかった.また,プロエンケファリンAのノックアウトマウスでは被膜下細胞の過形成の有無によりグルココルチコイド濃度の概日変動の振幅に違いは認められなかった.以上の結果より,被膜下細胞の過形成は雌のマウスにおいてプロエンケファリンAに依存して血中のグルココルチコイド濃度の概日変動の振幅を増大させることがわかった.
被膜下細胞の過形成によるグルココルチコイド濃度の概日変動のパターンの変化が情動行動に及ぼす影響について検討した.オープンフィールド試験,高架式十字迷路試験,明暗箱試験の3つの行動実験を施行したところ,被膜下細胞の過形成のある雌のマウスは被膜下細胞の過形成のない雌のマウスに比べより強い抗不安行動を示すことがわかった.この被膜下細胞の過形成に依存性の行動変化は雄のマウスにおいては認められず,また,グルココルチコイド受容体の拮抗薬を雌のマウスに投与することにより消失した.さらに,雌のプロエンケファリンAノックアウトマウスを用いて同様の行動実験を施行したが,被膜下細胞の過形成による抗不安作用は観察されなかった.以上より,被膜下細胞の過形成は雌のマウスにおいて血中のグルココルチコイド濃度の概日変動の振幅を増大させることにより抗不安作用を惹起することがわかった.
被膜下細胞の過形成より産生されるプロエンケファリンAに由来するペプチドがこのような内分泌学的な変化を誘発することがわかったので,生理活性をもつペプチド断片の特定を試みた.プロエンケファリンAより生じうるさまざまなペプチド断片を人工的に合成し,副腎皮質刺激ホルモンの存在下においてこれらのペプチド断片を用いて副腎皮質より樹立された細胞株を刺激した.このスクリーニングの結果,中間体オピオイドペプチドであるBAM22およびペプチドEが副腎皮質刺激ホルモンに依存してグルココルチコイドの産生を促進することがわかった.
つぎに,これらのペプチドに対する受容体を探索した.生理活性ペプチドはGタンパク質共役受容体に結合することが知られている.そこで,副腎皮質に発現しペプチドをリガンドとして認識すると予測されるすべてのGタンパク質共役受容体を遺伝子クローニングし,それらのBAM22に対する反応性をβアレスチンアッセイによりスクリーニングした.その結果,驚くべきことに,すでにケモカイン受容体として知られていたCXCR7がBAM22により特異的に活性化された.薬理学的な検討により,BAM22のCXCR7に対する結合親和性は高く,CXCR7のケモカインリガンドとして知られているSDF1あるいはI-TACとほぼ同等であることがわかった.さらに,BAM22に関連するペプチドのCXCR7に対する構造活性相関について調べたところ,BAM22やペプチドEなどの中間体オピオイドペプチドはCXCR7を活性化したが,メチオニンエンケファリンやロイシンエンケファリンといった成熟型オピオイドペプチドはCXCR7を活性化できなかった.CXCR7はβアレスチンバイアスドGタンパク質共役受容体であるので,既知のリガンドであるSDF1およびI-TACはCXCR7をつうじGタンパク質に依存性のシグナルを活性化せず,βアレスチンを介したシグナルのみを選択的に活性化することが知られている7,8).SDF1あるいはI-TACと同様に,BAM22およびペプチドEなどの中間体オピオイドペプチドもβアレスチンを介したシグナルのみを選択的に活性化することが確認された.
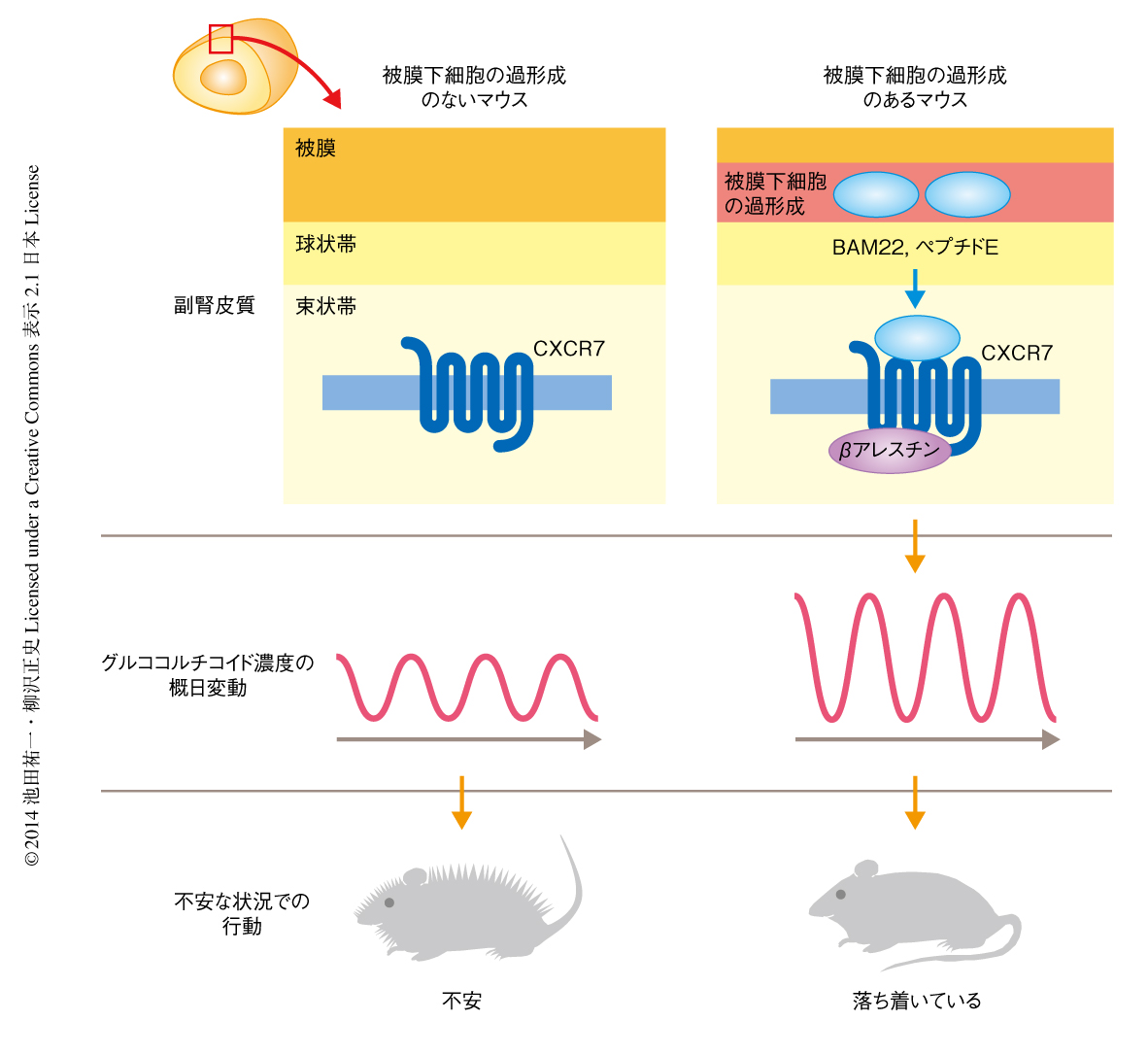
in vitroにおける受容体スクリーニングによりCXCR7が中間体オピオイドペプチドの新規の受容体であることがわかったので,グルココルチコイド濃度の概日変動に対する被膜下細胞の過形成の作用を実際にCXCR7が仲介しているかどうか検討した.まず,CXCR7の副腎皮質における発現をin situハイブリダイゼーション法により調べたところ,予想どおり,CXCR7は6カ月齢のマウスの副腎皮質において強く発現していた.興味深いことに,CXCR7の発現は雌のマウスではグルココルチコイド産生細胞層の全層にわたっていたが,雄のマウスでは副腎皮質と副腎髄質との境目に限局しており,その発現量も雌のマウスに比べ有意に低かった.被膜下細胞の過形成の生物学的な作用が雌のマウスにおいてのみ認められることの原因は,このCXCR7の発現パターンの性差にあると考えられた.また,6カ月齢の雌のマウスにCXCR7に対する中和抗体を投与したところ,グルココルチコイド濃度の概日変動に対する被膜下細胞の過形成の作用は消失した.これらの実験の結果より,被膜下細胞の過形成より分泌される中間体オピオイドペプチドが副腎皮質に発現するCXCR7を活性化し,グルココルチコイド濃度の概日変動のパターンを変化させることが証明された(図2).
CXCR7を活性化する低分子化合物は米国ChemoCentryx社により開発されており,そのin vivoにおける使用についてもすでに確立されている9,10).そこで,この低分子化合物をマウスに投与し被膜下細胞の過形成による作用が再現できるかどうか試みた.6カ月齢の被膜下細胞の過形成のない雌のマウスにこの低分子化合物を1日2回,3日間にわたり皮下投与したところ,グルココルチコイド濃度の概日変動のパターンは変化し,抗不安行動が惹起された.以上より,副腎皮質に発現するβアレスチンバイアスドGタンパク質共役受容体を標的とすることにより,グルココルチコイド濃度の概日変動のパターンおよび情動行動を制御できる可能性が示唆された.
副腎髄質において生理活性ペプチドについて調べている過程で,偶然にも,プロエンケファリンAが被膜下細胞の過形成において強く発現していることに気づき,そこから,被膜下細胞の過形成がグルココルチコイド濃度の概日変動および情動行動に及ぼす予想外の作用を見い出した.その分子機序を調べた結果,被膜下細胞の過形成から分泌される中間体オピオイドペプチドがCXCR7の内在性のリガンドとしてはたらくことがわかり,オピオイド系とケモカイン系との意外なるクロストークを発見した.さらに,この成果にもとづき,CXCR7を活性化する低分子化合物をマウスに投与したところ,グルココルチコイド濃度の概日変動のパターンおよび情動行動を制御することができた.この研究は,グルココルチコイド濃度の概日変動のパターンを変化させると個体のレベルでどのような行動変化が起こるのかという興味深い問いに答えただけでなく,内在するホルモン系を利用することにより,末梢組織に発現する受容体を標的として脳の高次機能を制御できる可能性を提示した.近年,脳による末梢組織の制御,また逆に,末梢組織による脳機能の制御といった中枢と末梢とをつなぐ機能的な連関が注目されている.この研究は,中枢と末梢との機能的な連関の重要性を示す新たな一例といえるだろう.
略歴:2003年 東京大学大学院医学系研究科にて博士号取得.米国Texas大学Southwestern Medical Center 博士研究員.
研究テーマ:Gタンパク質共役受容体のリガンドの探索とその生理機能の解明.
柳沢 正史(Masashi Yanagisawa)
米国Texas大学Southwestern Medical Center教授.筑波大学国際統合睡眠医科学研究機構 機構長 兼任.
© 2014 池田祐一・柳沢正史 Licensed under CC 表示 2.1 日本
(米国Texas大学Southwestern Medical Center,Department of Molecular Genetics)
email:池田祐一
DOI: 10.7875/first.author.2014.001
Modulation of circadian glucocorticoid oscillation via adrenal opioid-CXCR7 signaling alters emotional behavior.
Yuichi Ikeda, Hidetoshi Kumagai, Amber Skach, Makito Sato, Masashi Yanagisawa
Cell, 155, 1323-1336 (2013)
要 約
グルココルチコイドは副腎皮質から産生されるステロイドホルモンであり,脳をはじめとするさまざまな臓器において重要なはたらきをしている.グルココルチコイドの基礎分泌は生体に存在する概日時計により支配されているため,血中のグルココルチコイド濃度はストレスのない通常の状態においては約1日の周期で増減する.このグルココルチコイド濃度の概日変動の存在は以前からよく知られていたが,その生理学的な意義についてはいまだ不明な点が多い.筆者らは,グルココルチコイド濃度の概日変動の振幅を増大させると抗不安作用が惹起されることを明らかにした.副腎皮質に生じる被膜下細胞の過形成は加齢にともないしばしば認められる機能不明の組織学的な変化であり,その発達には大きな個体差がある.今回,この被膜下細胞の過形成の個体差に着目し,被膜下細胞の過形成のあるマウスはないマウスに比べより強い抗不安行動を示すことを見い出した.興味深いことに,この行動変化の原因はグルココルチコイド濃度の概日変動の振幅が被膜下細胞の過形成に依存して増大することにあった.その分子機序について調べたところ,被膜下細胞の過形成から分泌される中間体オピオイドペプチドが,副腎皮質に発現するβアレスチンバイアスドGタンパク質共役受容体CXCR7のリガンドとしてはたらき,グルココルチコイド濃度の概日変動の振幅を増大していることがわかった.また,CXCR7に作用する低分子化合物を被膜下細胞の過形成のないマウスに投与したところ,被膜下細胞の過形成のあるマウスの表現型を再現することができた.以上の結果より,副腎皮質に発現するβアレスチンバイアスドGタンパク質共役受容体を標的とすることにより,グルココルチコイド濃度の概日変動および情動行動を制御できる可能性が示唆された.
はじめに
グルココルチコイドは視床下部-下垂体-副腎系の最終産物として副腎皮質から分泌されるステロイドホルモンである.脳がストレスを感知すると視床下部-下垂体-副腎系が活性化され,グルココルチコイドが血中に放出される.放出されたグルココルチコイドはすぐさま視床下部および下垂体に対しフィードバック制御を起こし,視床下部-下垂体-副腎系の持続的な活性化を抑制する.グルココルチコイドは血液脳関門を容易に通過するため,脳のさまざまな神経核に直接に作用し,脳の高次機能に影響を及ぼす.実際,視床下部-下垂体-副腎系の機能不全,あるいは,脳におけるグルココルチコイドの異常な作用は,不安障害,うつ病,心的外傷後ストレス障害など,ストレス関連障害をもつ患者においてよく認められる所見である1).
一方,視床下部-下垂体-副腎系はストレスのない状況においては概日時計の制御をうけるため,グルココルチコイドの基礎分泌を反映する血中のグルココルチコイド濃度は概日変動を示す2).概日時計は代謝や行動のリズムを外界の明暗の周期に同調させるのに必須の生体システムであり,その破綻は代謝の異常や情動行動の異常などさまざまな疾患をひき起こす3).哺乳類において,概日時計システムの中枢は視床下部の視交差上核に存在し,そこから発信される時刻の情報は全身に存在する末梢時計へと伝達される.その濃度が概日変動するグルココルチコイドは視交差上核にある中枢時計が全身の末梢時計を同調する際に利用する内因性シグナルのひとつであると考えられており,すでに,脳のいくつかの神経核に存在する末梢時計はグルココルチコイドに依存して中枢時計に同調することが知られている4,5).以上より,グルココルチコイドのシグナルは脳のさまざまな部位において遺伝子発現の位相を調節することにより脳の高次機能を制御するとの作業仮説は,きわめて妥当なものであろう.興味深いことに,うつ病の患者の約半数が健常者とは異なるグルココルチコイド濃度の概日変動のパターンを示すという観察の結果もある6).ところが意外なことに,位相,周期,振幅により規定されるグルココルチコイド濃度の概日変動のパターンを変化させると,個体のレベルにおいてどのような行動変化が起こるのかについてはほとんど知られていない.
1.副腎皮質の被膜下細胞の過形成にはプロエンケファリンAが強く発現している
副腎髄質はさまざまな生理活性ペプチドを産生する神経内分泌組織である.筆者らは,副腎髄質から分泌されるペプチドを調べている過程において,偶然にも,オピオイドペプチドをコードするプロエンケファリンAの遺伝子が副腎髄質のみならず被膜下細胞の過形成においても強く発現していることを発見した(図1a).プロエンケファリンAの発現は被膜下細胞の過形成の加齢にともなう発達とよく相関しており,雄では4カ月齢,雌では6カ月齢より認められた.ペプチド前駆体分解酵素の発現パターンより,被膜下細胞の過形成において発現するプロエンケファリンAからはおもに中間体オピオイドペプチドが産生されることが予想され,実際に,マウスの副腎より抽出したペプチド画分を調べたところ,予想どおり,いくつかの中間体オピオイドペプチドが検出された.
2.被膜下細胞の過形成はプロエンケファリンAに依存して血中のグルココルチコイド濃度の概日変動の振幅を増大させる
副腎では外側から内側へ,被膜,皮質,髄質の順に血液が流れるので,被膜下細胞の過形成から分泌されるペプチドは副腎皮質のステロイド産生細胞に作用することが解剖学的に可能である(図1b).そこで,被膜下細胞の過形成より分泌されるプロエンケファリンAに由来するペプチドは,副腎皮質におけるグルココルチコイドの産生に影響を及ぼすと仮定した.この仮説を検証するため,被膜下細胞の過形成の発達には大きな個体差があることに着目し,6カ月齢の被膜下細胞の過形成のあるマウスとないマウスにおいて,視床下部-下垂体-副腎系の機能および血中のグルココルチコイド濃度について調べた.マウスのグループ分けは,すべての実験がおわったのちに副腎を取り出し,被膜下細胞の過形成の有無を組織学的に判定することにより行った.まず,急性ストレス負荷試験およびデキサメサゾン抑制試験により視床下部-下垂体-副腎系の機能を評価したが,両方のグループのあいだで有意な差はなく,被膜下細胞の過形成が存在しても視床下部-下垂体-副腎系は正常に機能することがわかった.つぎに,血中のグルココルチコイド濃度を1日のさまざまな時間帯において測定した.両方のグループのあいだで,グルココルチコイド濃度の概日変動における位相および周期,また,1日のグルココルチコイドの総分泌量に違いは認められなかったものの,被膜下細胞の過形成のある雌のマウスは被膜下細胞の過形成のない雌のマウスに比べ,グルココルチコイド濃度の概日変動においてより大きな振幅を示した.雄のマウスにおいて,この差は認められなかった.また,プロエンケファリンAのノックアウトマウスでは被膜下細胞の過形成の有無によりグルココルチコイド濃度の概日変動の振幅に違いは認められなかった.以上の結果より,被膜下細胞の過形成は雌のマウスにおいてプロエンケファリンAに依存して血中のグルココルチコイド濃度の概日変動の振幅を増大させることがわかった.
3.被膜下細胞の過形成は血中のグルココルチコイド濃度の概日変動の振幅を増大させることにより抗不安作用を惹起する
被膜下細胞の過形成によるグルココルチコイド濃度の概日変動のパターンの変化が情動行動に及ぼす影響について検討した.オープンフィールド試験,高架式十字迷路試験,明暗箱試験の3つの行動実験を施行したところ,被膜下細胞の過形成のある雌のマウスは被膜下細胞の過形成のない雌のマウスに比べより強い抗不安行動を示すことがわかった.この被膜下細胞の過形成に依存性の行動変化は雄のマウスにおいては認められず,また,グルココルチコイド受容体の拮抗薬を雌のマウスに投与することにより消失した.さらに,雌のプロエンケファリンAノックアウトマウスを用いて同様の行動実験を施行したが,被膜下細胞の過形成による抗不安作用は観察されなかった.以上より,被膜下細胞の過形成は雌のマウスにおいて血中のグルココルチコイド濃度の概日変動の振幅を増大させることにより抗不安作用を惹起することがわかった.
4.CXCR7はプロエンケファリンAに由来する中間体オピオイドペプチドの高親和性の受容体である
被膜下細胞の過形成より産生されるプロエンケファリンAに由来するペプチドがこのような内分泌学的な変化を誘発することがわかったので,生理活性をもつペプチド断片の特定を試みた.プロエンケファリンAより生じうるさまざまなペプチド断片を人工的に合成し,副腎皮質刺激ホルモンの存在下においてこれらのペプチド断片を用いて副腎皮質より樹立された細胞株を刺激した.このスクリーニングの結果,中間体オピオイドペプチドであるBAM22およびペプチドEが副腎皮質刺激ホルモンに依存してグルココルチコイドの産生を促進することがわかった.
つぎに,これらのペプチドに対する受容体を探索した.生理活性ペプチドはGタンパク質共役受容体に結合することが知られている.そこで,副腎皮質に発現しペプチドをリガンドとして認識すると予測されるすべてのGタンパク質共役受容体を遺伝子クローニングし,それらのBAM22に対する反応性をβアレスチンアッセイによりスクリーニングした.その結果,驚くべきことに,すでにケモカイン受容体として知られていたCXCR7がBAM22により特異的に活性化された.薬理学的な検討により,BAM22のCXCR7に対する結合親和性は高く,CXCR7のケモカインリガンドとして知られているSDF1あるいはI-TACとほぼ同等であることがわかった.さらに,BAM22に関連するペプチドのCXCR7に対する構造活性相関について調べたところ,BAM22やペプチドEなどの中間体オピオイドペプチドはCXCR7を活性化したが,メチオニンエンケファリンやロイシンエンケファリンといった成熟型オピオイドペプチドはCXCR7を活性化できなかった.CXCR7はβアレスチンバイアスドGタンパク質共役受容体であるので,既知のリガンドであるSDF1およびI-TACはCXCR7をつうじGタンパク質に依存性のシグナルを活性化せず,βアレスチンを介したシグナルのみを選択的に活性化することが知られている7,8).SDF1あるいはI-TACと同様に,BAM22およびペプチドEなどの中間体オピオイドペプチドもβアレスチンを介したシグナルのみを選択的に活性化することが確認された.
5.副腎皮質に発現するCXCR7を標的として血中のグルココルチコイド濃度の概日変動および情動行動を制御できる
in vitroにおける受容体スクリーニングによりCXCR7が中間体オピオイドペプチドの新規の受容体であることがわかったので,グルココルチコイド濃度の概日変動に対する被膜下細胞の過形成の作用を実際にCXCR7が仲介しているかどうか検討した.まず,CXCR7の副腎皮質における発現をin situハイブリダイゼーション法により調べたところ,予想どおり,CXCR7は6カ月齢のマウスの副腎皮質において強く発現していた.興味深いことに,CXCR7の発現は雌のマウスではグルココルチコイド産生細胞層の全層にわたっていたが,雄のマウスでは副腎皮質と副腎髄質との境目に限局しており,その発現量も雌のマウスに比べ有意に低かった.被膜下細胞の過形成の生物学的な作用が雌のマウスにおいてのみ認められることの原因は,このCXCR7の発現パターンの性差にあると考えられた.また,6カ月齢の雌のマウスにCXCR7に対する中和抗体を投与したところ,グルココルチコイド濃度の概日変動に対する被膜下細胞の過形成の作用は消失した.これらの実験の結果より,被膜下細胞の過形成より分泌される中間体オピオイドペプチドが副腎皮質に発現するCXCR7を活性化し,グルココルチコイド濃度の概日変動のパターンを変化させることが証明された(図2).
CXCR7を活性化する低分子化合物は米国ChemoCentryx社により開発されており,そのin vivoにおける使用についてもすでに確立されている9,10).そこで,この低分子化合物をマウスに投与し被膜下細胞の過形成による作用が再現できるかどうか試みた.6カ月齢の被膜下細胞の過形成のない雌のマウスにこの低分子化合物を1日2回,3日間にわたり皮下投与したところ,グルココルチコイド濃度の概日変動のパターンは変化し,抗不安行動が惹起された.以上より,副腎皮質に発現するβアレスチンバイアスドGタンパク質共役受容体を標的とすることにより,グルココルチコイド濃度の概日変動のパターンおよび情動行動を制御できる可能性が示唆された.
おわりに
副腎髄質において生理活性ペプチドについて調べている過程で,偶然にも,プロエンケファリンAが被膜下細胞の過形成において強く発現していることに気づき,そこから,被膜下細胞の過形成がグルココルチコイド濃度の概日変動および情動行動に及ぼす予想外の作用を見い出した.その分子機序を調べた結果,被膜下細胞の過形成から分泌される中間体オピオイドペプチドがCXCR7の内在性のリガンドとしてはたらくことがわかり,オピオイド系とケモカイン系との意外なるクロストークを発見した.さらに,この成果にもとづき,CXCR7を活性化する低分子化合物をマウスに投与したところ,グルココルチコイド濃度の概日変動のパターンおよび情動行動を制御することができた.この研究は,グルココルチコイド濃度の概日変動のパターンを変化させると個体のレベルでどのような行動変化が起こるのかという興味深い問いに答えただけでなく,内在するホルモン系を利用することにより,末梢組織に発現する受容体を標的として脳の高次機能を制御できる可能性を提示した.近年,脳による末梢組織の制御,また逆に,末梢組織による脳機能の制御といった中枢と末梢とをつなぐ機能的な連関が注目されている.この研究は,中枢と末梢との機能的な連関の重要性を示す新たな一例といえるだろう.
文 献
- de Kloet, E. R., Joels, M. & Holsboer, F.: Stress and the brain: from adaptation to disease. Nat. Rev. Neurosci., 6, 463-475 (2005)[PubMed]
- Chung, S., Son, G. H., & Kim, K.: Circadian rhythm of adrenal glucocorticoid: its regulation and clinical implications. Biochim. Biophys. Acta, 1812, 581-591 (2011)[PubMed]
- Bass, J.: Circadian topology of metabolism. Nature, 491, 348-356 (2012)[PubMed]
- Balsalobre, A., Brown, S. A., Marcacci, L. et al.: Resetting of circadian time in peripheral tissues by glucocorticoid signaling. Science, 289, 2344-2347 (2000)[PubMed]
- Malek, Z. S., Sage, D., Pevet, P. et al.: Daily rhythm of tryptophan hydroxylase-2 messenger ribonucleic acid within raphe neurons is induced by corticoid daily surge and modulated by enhanced locomotor activity. Endocrinology, 148, 5165-5172 (2007)[PubMed]
- Keller, J., Flores, B., Gomez, R. G. et al.: Cortisol circadian rhythm alterations in psychotic major depression. Biol. Psychiatry, 60, 275-281 (2006)[PubMed]
- Rajagopal, S., Kim, J., Ahn, S. et al.: β-arrestin- but not G protein-mediated signaling by the "decoy" receptor CXCR7. Proc. Natl. Acad. Sci. USA, 107, 628-632 (2010)[PubMed]
- DeWire, S. M., Ahn, S., Lefkowitz, R. J. et al.: β-arrestins and cell signaling. Annu. Rev. Physiol., 69, 483-510 (2007)[PubMed]
- Zabel, B. A., Wang, Y., Lewen, S. et al.: Elucidation of CXCR7-mediated signaling events and inhibition of CXCR4-mediated tumor cell transendothelial migration by CXCR7 ligands. J. Immunol., 183, 3204-3211 (2009)[PubMed]
- Cruz-Orengo, L., Holman, D. W., Dorsey, D. et al.: CXCR7 influences leukocyte entry into the CNS parenchyma by controlling abluminal CXCL12 abundance during autoimmunity. J. Exp. Med., 208, 327-339 (2011)[PubMed]
著者プロフィール
略歴:2003年 東京大学大学院医学系研究科にて博士号取得.米国Texas大学Southwestern Medical Center 博士研究員.
研究テーマ:Gタンパク質共役受容体のリガンドの探索とその生理機能の解明.
柳沢 正史(Masashi Yanagisawa)
米国Texas大学Southwestern Medical Center教授.筑波大学国際統合睡眠医科学研究機構 機構長 兼任.
© 2014 池田祐一・柳沢正史 Licensed under CC 表示 2.1 日本