中胚葉において発現する転写因子Tが生殖細胞系列への分化を決定する機構
荒牧伸弥・斎藤通紀
(京都大学大学院医学研究科 機能微細形態学)
email:荒牧伸弥,斎藤通紀
DOI: 10.7875/first.author.2014.002
A mesodermal factor, T, specifies mouse germ cell fate by directly activating germline determinants.
Shinya Aramaki, Katsuhiko Hayashi, Kazuki Kurimoto, Hiroshi Ohta, Yukihiro Yabuta, Hiroko Iwanari, Yasuhiro Mochizuki, Takao Hamakubo, Yuki Kato, Katsuhiko Shirahige, Mitinori Saitou
Developmental Cell, 27, 516-529 (2013)
生殖細胞は次世代への遺伝情報の伝達を担う唯一の細胞系列である.哺乳類の代表的な実験モデルであるマウスにおいて,生殖細胞系列は精子および卵子の前駆細胞である始原生殖細胞として,胚発生の初期の段階において多能性をもつエピブラストの一部から形成されることが知られているが,その詳細な分子機構は不明であった.今回,筆者らは,in vitroにおける始原生殖細胞の分化の誘導系を用いて,シグナル伝達タンパク質であるBMP4およびWNT3の下流にて発現の誘導される転写因子Tが,始原生殖細胞への分化に必須の転写因子をコードするBlimp1遺伝子およびPrdm14遺伝子の発現を直接に制御しており,生殖細胞への分化において必須の役割をはたしていることを証明した.
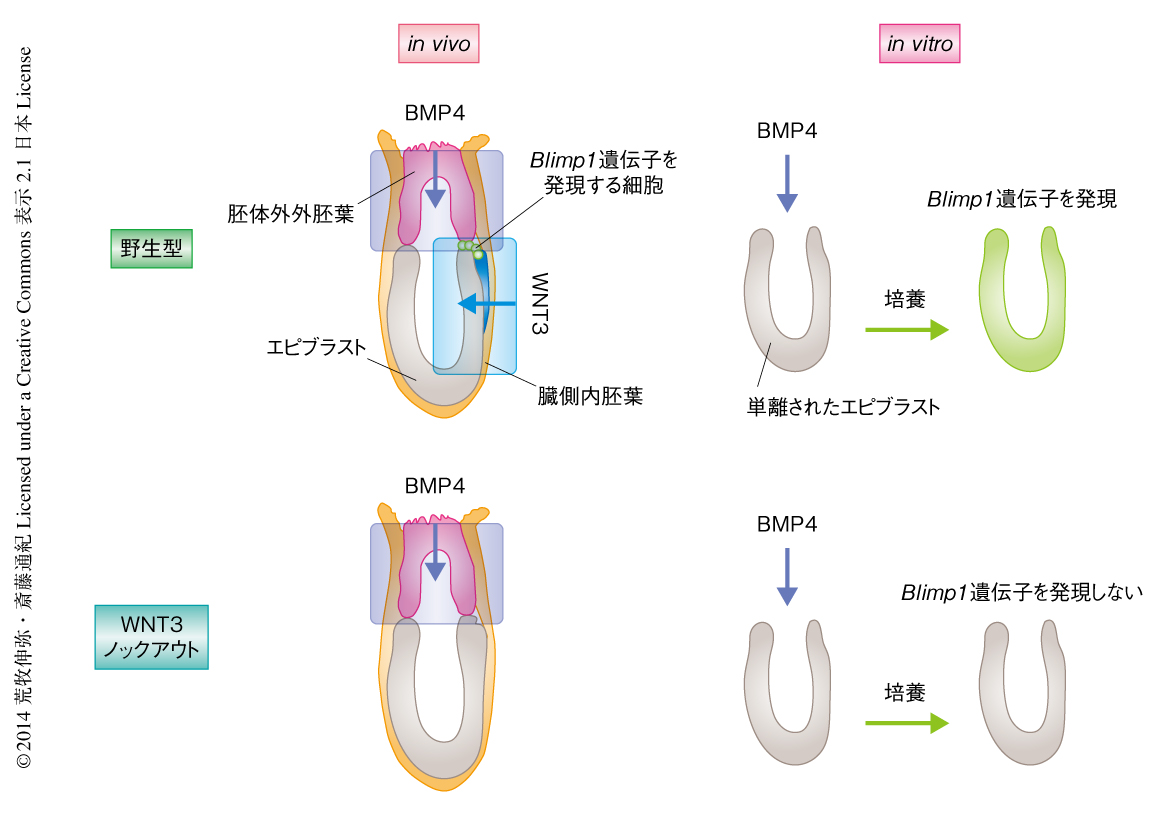
マウスにおいて,生殖細胞は胚発生の初期に多能性をもつエピブラスト(原始外胚葉)から“後生的”に形成されることが知られている.すなわち,原腸陥入が開始した直後に,生殖細胞の形成に必須の転写因子をコードするBlimp1遺伝子およびPrdm14遺伝子などの発現が開始することにより生殖細胞の前駆細胞がはじめて認められ,そののち,胚体外中胚葉領域において始原生殖細胞として確立する1).これまで,変異マウスを用いた分子遺伝学的な研究により,生殖細胞の形成にはシグナル伝達タンパク質の関与が知られていた.具体的には,胚体外外胚葉に由来するシグナル伝達タンパク質であるBMP4,および,その細胞内シグナル伝達タンパク質であるSMAD1またはSMAD5の機能を破壊した変異マウスにおいて始原生殖細胞の形成が阻害されたことから,マウスにおける生殖細胞系列への分化の決定には,BMP4-SMAD1シグナル伝達経路あるいはBMP4-SMAD5シグナル伝達経路が必須であることが報告されている2-5)(図1).
一方,筆者らの以前の研究により,BMP4と同様に分泌型のシグナル伝達タンパク質であるWNT3を欠損したエピブラストでは始原生殖細胞への分化が起こらず,さらに,野生型のエピブラストにおいて観察される,in vitroにおけるBMP4に応答したBlimp1遺伝子の発現とそれにつづく始原生殖細胞への分化も起こらないことから,WNT3はBMP4に依存した生殖細胞の形成能の獲得に必須であることが明らかになっていた6)(図1).そこで,この研究では,BMP4およびWNT3がどのように多能性をもつエピブラストから始原生殖細胞への分化を制御するのか,その分子機序を明らかにすることを目的とした.そして,in vitroにおける始原生殖細胞の再構築系6,7) を用いることにより,BMP4およびWNT3の下流にて中胚葉において発現する転写因子T(Brachyury)が,Blimp1遺伝子およびPrdm14遺伝子など始原生殖細胞への分化の決定にはたらく遺伝子の発現を誘導することにより,生殖細胞系列への分化を制御する機構を明らかにした.
野生型のエピブラストはin vitroにおいてBMP4に依存してBlimp1遺伝子の発現が誘導されるが,WNT3を欠損したエピブラストではBlimp1遺伝子の発現は起こらない.しかし,この系にWNT3Aを添加してWNTシグナルを外因的に再活性化すると,WNT3を欠損したエピブラストにおいてBMP4に応答したBlimp1遺伝子の発現の回復が確認された.よって,WNTシグナル伝達経路の活性化が始原生殖細胞への分化において必要かつ十分であることが示された.同様の結果は,多能性幹細胞であるES細胞からエピブラスト様細胞への分化を誘導する系7) においても確認されたことから,この系はエピブラストの始原生殖細胞への分化をよく再現しており,エピブラスト様細胞を用いたより詳細な分子生物学的な解析が可能であることが示された.
この系を用いてWNTシグナル伝達経路の下流において安定化されることの知られているβカテニン8) のタンパク質量を調べたところ,WNT3を欠損したエピブラスト様細胞では野生型のエピブラスト様細胞に比べ核におけるβカテニンの量が減少しており,βカテニンが標的とする遺伝子の発現も低下していることが明らかになった.一方,別の細胞種においてWNTシグナル伝達経路により制御されていることが報告されているSMAD1 9) の量には顕著な変化は認められず,SMAD1が標的とする遺伝子の発現にも影響は確認されなかった.WNT3を欠損したエピブラスト様細胞においてβカテニンシグナル伝達系の破たんが明らかになり,βカテニンの始原生殖細胞への分化への関与が示唆されたことから,βカテニンを欠損したマウスの胚を解析した.その結果,WNT3の欠損と同様に,βカテニンを欠損したエピブラストでは野生型のエピブラストにおいて認められるBlimp1遺伝子の発現の誘導は起こらず,始原生殖細胞の形成においてβカテニンが必須であることが示された.さらに,in vitroにおいてβカテニンを欠損したエピブラストあるいはエピブラスト様細胞をBMP4により刺激してもBlimp1遺伝子の発現は認められず,BMP4のほかWNT3Aを添加してもBlimp1遺伝子の発現は回復しなかった.このことより,WNT3のシグナル伝達タンパク質として,βカテニンが始原生殖細胞への分化において必須であることが示された.
βカテニンがWNT3の下流にて獲得される始原生殖細胞の形成能において十分であるかどうかを検証するため,βカテニンの代謝酵素であるGSK3に耐性をもつ活性型βカテニン変異体の発現を薬剤に依存して誘導できる,WNT3を欠損したES細胞株を樹立した.このES細胞をエピブラスト様細胞へと分化したのち,薬剤により活性型βカテニン変異体の発現を誘導すると,WNT3Aを添加したときと同様に,BMP4に依存的なBlimp1遺伝子およびPrdm14遺伝子の発現の回復が認められた.以上の結果から,WNTの下流において安定化されるβカテニンが,始原生殖細胞の形成能の獲得において十分であることが明らかになった.
野生型のエピブラストおよびエピブラスト様細胞において認められるBMP4に応答したBlimp1遺伝子およびPrdm14遺伝子の発現をより詳細に解析するため,BMP4による刺激ののちの転写レベルにおける発現のダイナミクスをエピブラスト様細胞の系を用いて解析した.すると,BMP4の直接の標的遺伝子として知られるId1遺伝子10),あるいは,WNT3の直接の標的遺伝子として知られるT遺伝子11) は,BMP4で刺激したのち12時間という早い段階から顕著な発現の上昇が確認されたのに対し,Blimp1遺伝子およびPrdm14遺伝子の発現の上昇はそれよりも遅く,BMP4による刺激から24時間以上のちに発現が上昇することが明らかになった.
このことから,生殖細胞への分化を決定するBlimp1遺伝子およびPrdm14遺伝子の発現はBMP4およびWNT3の直接の標的遺伝子を介した2次的なものであるとの仮説をたて,これらの下流において発現の誘導される遺伝子をマイクロアレイにより探索した.その結果,転写因子をコードし,中胚葉において初期から発現することの知られているT(Brachyury)遺伝子が,BMP4およびWNT3の下流において発現のもっとも大きく変化している遺伝子として同定された.Tは多くの生物種のあいだで保存されたTボックスファミリーのひとつであり,マウスの胚発生において,初期の中胚葉の移動,尿膜など胚体外中胚葉の形成,後極の脊索の形成などにおいて重要であることが報告されていたが12),これまで,始原生殖細胞への分化への関与は報告されていなかった.そこで,転写因子Tを欠損した胚の解析に着手した.
Tを欠損した胚において,生殖細胞への分化を決定する遺伝子であるBlimp1遺伝子およびPrdm14遺伝子の発現を解析した.野生型のエピブラストにおいてはじめてBlimp1遺伝子の発現の観察される胎生6.5日の段階で,Tを欠損したエピブラストにおいてもBlimp1遺伝子の発現が確認されたことから,Blimp1遺伝子の発現の開始はTに非依存的なシグナル伝達経路により誘導されていることが示された.しかし,胎生7.0日以降,野生型の胚において認められるBlimp1遺伝子の発現上昇は起こらず,始原生殖細胞の形成には顕著な異常が認められた.一方で,Prdm14遺伝子の発現は野生型のエピブラストでは胎生6.5日以降に検出されるが,Tを欠損したエピブラストでは検出されなかった.以上のことから,マウスの胚において,転写因子TがBlimp1遺伝子およびPrdm14遺伝子の発現の誘導を介し生殖細胞の形成をより上流で制御している可能性が示唆された.
TがBlimp1遺伝子およびPrdm14遺伝子の発現を直接に制御している可能性が示唆されたため,始原生殖細胞の形成能をもたないWNT3を欠損したエピブラスト様細胞においてTを薬剤に依存的に過剰発現した.その結果,BMP4の非存在下でもTの発現に依存してBlimp1遺伝子およびPrdm14遺伝子の発現が誘導されることが確認された.さらに,このTに依存的なBlimp1遺伝子およびPrdm14遺伝子の発現は,BMP4の添加により強まることがわかった.
エピブラスト様細胞において,クロマチン免疫沈降-シークエンシング法によりTの結合するゲノム領域を網羅的に解析した結果,Blimp1遺伝子およびPrdm14遺伝子の近傍にTの結合が確認され,Tがこれらの遺伝子を直接に制御している可能性が示唆された.一方で,BMP4のシグナルを伝達する転写因子SMAD1,および,WNT3のシグナルを伝達する転写因子TCF1の結合するゲノム領域についても同様に,クロマチン免疫沈降-シークエンシング法により解析した.その結果,すでにこれらの転写因子による直接的な制御の報告されているId1遺伝子10) およびT遺伝子11) などの近傍には結合が確認されたものの,Blimp1遺伝子およびPrdm14遺伝子の近傍にはTにおいて確認されたような顕著な結合は確認されなかった.このことは,Blimp1遺伝子およびPrdm14遺伝子はBMP4シグナル伝達経路あるいはWNT3シグナル伝達経路の直接的な標的遺伝子ではないとするさきの仮説を支持する結果であった.さらに,クロマチン免疫沈降-シークエンシング法により確認されたTの結合するゲノム領域は,実際にBlimp1遺伝子およびPrdm14遺伝子の転写活性の上昇に寄与するゲノム領域であることがルシフェラーゼアッセイにより確認された.以上の結果から,転写因子TがBlimp1遺伝子およびPrdm14遺伝子という生殖細胞への分化を決定する遺伝子の発現を直接に制御していることが示された.
ここまでの結果から,TによるBlimp1遺伝子およびPrdm14遺伝子の直接的な制御経路が明らかになった.その一方で,なぜTの発現を誘導するWNTシグナル伝達経路の活性化のみではBlimp1遺伝子およびPrdm14遺伝子の発現の誘導には十分ではなく,BMPシグナル伝達経路の活性化も必要であるのかという問題が残った.そこで,WNTシグナル伝達経路の下流においては,Tのほかにも,体細胞系列への分化に重要であることが報告されているさまざまなタンパク質の発現が誘導されていることに注目した.BMP4がそのような生殖細胞系列への分化を阻害しうるタンパク質の発現を抑制することにより,TによりBlimp1遺伝子およびPrdm14遺伝子の発現を制御する環境を許容しているのではないかと考え,WNTシグナル伝達経路を活性化させたエピブラスト様細胞において,TによるBlimp1遺伝子およびPrdm14遺伝子の発現の誘導が阻害されるかどうかを検証した.その結果,WNT3Aを添加した時間に比例して,TによるBlimp1遺伝子およびPrdm14遺伝子の発現の誘導が阻害される傾向のあることが判明した.このことから,BMP4の機能のひとつとして,転写因子Tによる生殖細胞への分化を決定する遺伝子の発現制御の許容が示唆された.
この研究において,筆者らは,生殖細胞への分化の決定においてBMP4およびWNT3の下流にて,中胚葉において発現することの知られていた転写因子Tが,始原生殖細胞への分化に必須の転写因子をコードするBlimp1遺伝子およびPrdm14遺伝子の発現を誘導する機構を見い出した(図2).Tは生物種のあいだで広く保存されているため,生殖細胞への分化において後生的なシステムをとるほかの種,あるいは,マウスと同様に哺乳類であるヒトにおいて,同じ機構が用いられているかどうかは,今後,明らかにされるべき課題である.一方で,生殖細胞への分化の決定において不可欠であるBMP4シグナル伝達経路の意義については,なお解明すべき部分が多い.今回の実験では,TがBlimp1遺伝子およびPrdm14遺伝子の近傍のゲノム領域に結合することを確認した一方で,BMPシグナルを伝達する転写因子SMAD1のそれらのゲノム領域への明確な結合は確認されなかった.予想しうるBMP4の機能の仮説として“WNTに依存して発現の誘導される阻害タンパク質への拮抗作用”(図2)を提唱したが,実際に,エピブラスト様細胞の系におけるマイクロアレイ解析により,WNTシグナルにより発現の誘導される遺伝子のうち,Foxa2遺伝子,Hoxb1遺伝子,Hoxa1遺伝子など,体細胞系列への分化において重要な遺伝子の発現がBMP4により抑制されることが明らかになった.さらに,エピブラスト様細胞においてTの強制発現により誘導されるBlimp1遺伝子およびPrdm14遺伝子の発現が,BMP4の存在下においては強められたことから,BMP4-SMADシグナル伝達経路の下流においてTによる制御をおぎなう共役タンパク質の発現が誘導されているという別の可能性も考えられる(図2).Tを欠損したマウスを用いた解析ではエピブラストにおけるBlimp1遺伝子の発現が認められたことから,BMP4およびWNT3の下流においてTのほかにもBlimp1遺伝子の発現を制御するタンパク質の存在が示唆された.筆者らは,これに関して,エピブラスト様細胞を用いた系において,Tと同じくTボックスファミリーに属するEOMESがBlimp1遺伝子の発現を促進することを明らかにしており,これは,Tのほかにも初期の中胚葉において発現する転写因子が生殖細胞系列への分化の決定に関与している可能性を示唆している.最近では,哺乳類とは進化的に大きく離れたコオロギを用いた研究において,中胚葉において機能する転写因子をコードするTwist遺伝子が始原生殖細胞の形成に重要であるとの報告もあり13),今後,進化的な観点からも中胚葉の形成と生殖細胞の形成との関係がさらに明らかにされていくことを期待する.
略歴:2009年 九州大学大学院生物資源環境科学府 修了,同年より京都大学大学院医学研究科 研究員.
研究テーマ:生殖細胞の発生生物学.
関心事:生命現象の本質をとらえること.
斎藤 通紀(Mitinori Saitou)
京都大学大学院医学研究科 教授.科学技術振興機構ERATO全能性エピゲノムプロジェクト 研究総括 兼任.
© 2014 荒牧伸弥・斎藤通紀 Licensed under CC 表示 2.1 日本
(京都大学大学院医学研究科 機能微細形態学)
email:荒牧伸弥,斎藤通紀
DOI: 10.7875/first.author.2014.002
A mesodermal factor, T, specifies mouse germ cell fate by directly activating germline determinants.
Shinya Aramaki, Katsuhiko Hayashi, Kazuki Kurimoto, Hiroshi Ohta, Yukihiro Yabuta, Hiroko Iwanari, Yasuhiro Mochizuki, Takao Hamakubo, Yuki Kato, Katsuhiko Shirahige, Mitinori Saitou
Developmental Cell, 27, 516-529 (2013)
要 約
生殖細胞は次世代への遺伝情報の伝達を担う唯一の細胞系列である.哺乳類の代表的な実験モデルであるマウスにおいて,生殖細胞系列は精子および卵子の前駆細胞である始原生殖細胞として,胚発生の初期の段階において多能性をもつエピブラストの一部から形成されることが知られているが,その詳細な分子機構は不明であった.今回,筆者らは,in vitroにおける始原生殖細胞の分化の誘導系を用いて,シグナル伝達タンパク質であるBMP4およびWNT3の下流にて発現の誘導される転写因子Tが,始原生殖細胞への分化に必須の転写因子をコードするBlimp1遺伝子およびPrdm14遺伝子の発現を直接に制御しており,生殖細胞への分化において必須の役割をはたしていることを証明した.
はじめに
マウスにおいて,生殖細胞は胚発生の初期に多能性をもつエピブラスト(原始外胚葉)から“後生的”に形成されることが知られている.すなわち,原腸陥入が開始した直後に,生殖細胞の形成に必須の転写因子をコードするBlimp1遺伝子およびPrdm14遺伝子などの発現が開始することにより生殖細胞の前駆細胞がはじめて認められ,そののち,胚体外中胚葉領域において始原生殖細胞として確立する1).これまで,変異マウスを用いた分子遺伝学的な研究により,生殖細胞の形成にはシグナル伝達タンパク質の関与が知られていた.具体的には,胚体外外胚葉に由来するシグナル伝達タンパク質であるBMP4,および,その細胞内シグナル伝達タンパク質であるSMAD1またはSMAD5の機能を破壊した変異マウスにおいて始原生殖細胞の形成が阻害されたことから,マウスにおける生殖細胞系列への分化の決定には,BMP4-SMAD1シグナル伝達経路あるいはBMP4-SMAD5シグナル伝達経路が必須であることが報告されている2-5)(図1).
一方,筆者らの以前の研究により,BMP4と同様に分泌型のシグナル伝達タンパク質であるWNT3を欠損したエピブラストでは始原生殖細胞への分化が起こらず,さらに,野生型のエピブラストにおいて観察される,in vitroにおけるBMP4に応答したBlimp1遺伝子の発現とそれにつづく始原生殖細胞への分化も起こらないことから,WNT3はBMP4に依存した生殖細胞の形成能の獲得に必須であることが明らかになっていた6)(図1).そこで,この研究では,BMP4およびWNT3がどのように多能性をもつエピブラストから始原生殖細胞への分化を制御するのか,その分子機序を明らかにすることを目的とした.そして,in vitroにおける始原生殖細胞の再構築系6,7) を用いることにより,BMP4およびWNT3の下流にて中胚葉において発現する転写因子T(Brachyury)が,Blimp1遺伝子およびPrdm14遺伝子など始原生殖細胞への分化の決定にはたらく遺伝子の発現を誘導することにより,生殖細胞系列への分化を制御する機構を明らかにした.
1.WNT3-βカテニンシグナル伝達経路は始原生殖細胞の形成能の獲得に必要かつ十分である
野生型のエピブラストはin vitroにおいてBMP4に依存してBlimp1遺伝子の発現が誘導されるが,WNT3を欠損したエピブラストではBlimp1遺伝子の発現は起こらない.しかし,この系にWNT3Aを添加してWNTシグナルを外因的に再活性化すると,WNT3を欠損したエピブラストにおいてBMP4に応答したBlimp1遺伝子の発現の回復が確認された.よって,WNTシグナル伝達経路の活性化が始原生殖細胞への分化において必要かつ十分であることが示された.同様の結果は,多能性幹細胞であるES細胞からエピブラスト様細胞への分化を誘導する系7) においても確認されたことから,この系はエピブラストの始原生殖細胞への分化をよく再現しており,エピブラスト様細胞を用いたより詳細な分子生物学的な解析が可能であることが示された.
この系を用いてWNTシグナル伝達経路の下流において安定化されることの知られているβカテニン8) のタンパク質量を調べたところ,WNT3を欠損したエピブラスト様細胞では野生型のエピブラスト様細胞に比べ核におけるβカテニンの量が減少しており,βカテニンが標的とする遺伝子の発現も低下していることが明らかになった.一方,別の細胞種においてWNTシグナル伝達経路により制御されていることが報告されているSMAD1 9) の量には顕著な変化は認められず,SMAD1が標的とする遺伝子の発現にも影響は確認されなかった.WNT3を欠損したエピブラスト様細胞においてβカテニンシグナル伝達系の破たんが明らかになり,βカテニンの始原生殖細胞への分化への関与が示唆されたことから,βカテニンを欠損したマウスの胚を解析した.その結果,WNT3の欠損と同様に,βカテニンを欠損したエピブラストでは野生型のエピブラストにおいて認められるBlimp1遺伝子の発現の誘導は起こらず,始原生殖細胞の形成においてβカテニンが必須であることが示された.さらに,in vitroにおいてβカテニンを欠損したエピブラストあるいはエピブラスト様細胞をBMP4により刺激してもBlimp1遺伝子の発現は認められず,BMP4のほかWNT3Aを添加してもBlimp1遺伝子の発現は回復しなかった.このことより,WNT3のシグナル伝達タンパク質として,βカテニンが始原生殖細胞への分化において必須であることが示された.
βカテニンがWNT3の下流にて獲得される始原生殖細胞の形成能において十分であるかどうかを検証するため,βカテニンの代謝酵素であるGSK3に耐性をもつ活性型βカテニン変異体の発現を薬剤に依存して誘導できる,WNT3を欠損したES細胞株を樹立した.このES細胞をエピブラスト様細胞へと分化したのち,薬剤により活性型βカテニン変異体の発現を誘導すると,WNT3Aを添加したときと同様に,BMP4に依存的なBlimp1遺伝子およびPrdm14遺伝子の発現の回復が認められた.以上の結果から,WNTの下流において安定化されるβカテニンが,始原生殖細胞の形成能の獲得において十分であることが明らかになった.
2.BMP4およびWNT3の下流における遺伝子発現の変化の解析
野生型のエピブラストおよびエピブラスト様細胞において認められるBMP4に応答したBlimp1遺伝子およびPrdm14遺伝子の発現をより詳細に解析するため,BMP4による刺激ののちの転写レベルにおける発現のダイナミクスをエピブラスト様細胞の系を用いて解析した.すると,BMP4の直接の標的遺伝子として知られるId1遺伝子10),あるいは,WNT3の直接の標的遺伝子として知られるT遺伝子11) は,BMP4で刺激したのち12時間という早い段階から顕著な発現の上昇が確認されたのに対し,Blimp1遺伝子およびPrdm14遺伝子の発現の上昇はそれよりも遅く,BMP4による刺激から24時間以上のちに発現が上昇することが明らかになった.
このことから,生殖細胞への分化を決定するBlimp1遺伝子およびPrdm14遺伝子の発現はBMP4およびWNT3の直接の標的遺伝子を介した2次的なものであるとの仮説をたて,これらの下流において発現の誘導される遺伝子をマイクロアレイにより探索した.その結果,転写因子をコードし,中胚葉において初期から発現することの知られているT(Brachyury)遺伝子が,BMP4およびWNT3の下流において発現のもっとも大きく変化している遺伝子として同定された.Tは多くの生物種のあいだで保存されたTボックスファミリーのひとつであり,マウスの胚発生において,初期の中胚葉の移動,尿膜など胚体外中胚葉の形成,後極の脊索の形成などにおいて重要であることが報告されていたが12),これまで,始原生殖細胞への分化への関与は報告されていなかった.そこで,転写因子Tを欠損した胚の解析に着手した.
3.転写因子Tは生殖細胞の形成において必須である
Tを欠損した胚において,生殖細胞への分化を決定する遺伝子であるBlimp1遺伝子およびPrdm14遺伝子の発現を解析した.野生型のエピブラストにおいてはじめてBlimp1遺伝子の発現の観察される胎生6.5日の段階で,Tを欠損したエピブラストにおいてもBlimp1遺伝子の発現が確認されたことから,Blimp1遺伝子の発現の開始はTに非依存的なシグナル伝達経路により誘導されていることが示された.しかし,胎生7.0日以降,野生型の胚において認められるBlimp1遺伝子の発現上昇は起こらず,始原生殖細胞の形成には顕著な異常が認められた.一方で,Prdm14遺伝子の発現は野生型のエピブラストでは胎生6.5日以降に検出されるが,Tを欠損したエピブラストでは検出されなかった.以上のことから,マウスの胚において,転写因子TがBlimp1遺伝子およびPrdm14遺伝子の発現の誘導を介し生殖細胞の形成をより上流で制御している可能性が示唆された.
4.転写因子TはBlimp1遺伝子およびPrdm14遺伝子の発現を直接に制御する
TがBlimp1遺伝子およびPrdm14遺伝子の発現を直接に制御している可能性が示唆されたため,始原生殖細胞の形成能をもたないWNT3を欠損したエピブラスト様細胞においてTを薬剤に依存的に過剰発現した.その結果,BMP4の非存在下でもTの発現に依存してBlimp1遺伝子およびPrdm14遺伝子の発現が誘導されることが確認された.さらに,このTに依存的なBlimp1遺伝子およびPrdm14遺伝子の発現は,BMP4の添加により強まることがわかった.
エピブラスト様細胞において,クロマチン免疫沈降-シークエンシング法によりTの結合するゲノム領域を網羅的に解析した結果,Blimp1遺伝子およびPrdm14遺伝子の近傍にTの結合が確認され,Tがこれらの遺伝子を直接に制御している可能性が示唆された.一方で,BMP4のシグナルを伝達する転写因子SMAD1,および,WNT3のシグナルを伝達する転写因子TCF1の結合するゲノム領域についても同様に,クロマチン免疫沈降-シークエンシング法により解析した.その結果,すでにこれらの転写因子による直接的な制御の報告されているId1遺伝子10) およびT遺伝子11) などの近傍には結合が確認されたものの,Blimp1遺伝子およびPrdm14遺伝子の近傍にはTにおいて確認されたような顕著な結合は確認されなかった.このことは,Blimp1遺伝子およびPrdm14遺伝子はBMP4シグナル伝達経路あるいはWNT3シグナル伝達経路の直接的な標的遺伝子ではないとするさきの仮説を支持する結果であった.さらに,クロマチン免疫沈降-シークエンシング法により確認されたTの結合するゲノム領域は,実際にBlimp1遺伝子およびPrdm14遺伝子の転写活性の上昇に寄与するゲノム領域であることがルシフェラーゼアッセイにより確認された.以上の結果から,転写因子TがBlimp1遺伝子およびPrdm14遺伝子という生殖細胞への分化を決定する遺伝子の発現を直接に制御していることが示された.
5.BMP4は転写因子TによるBlimp1遺伝子およびPrdm14遺伝子の発現制御を許容する
ここまでの結果から,TによるBlimp1遺伝子およびPrdm14遺伝子の直接的な制御経路が明らかになった.その一方で,なぜTの発現を誘導するWNTシグナル伝達経路の活性化のみではBlimp1遺伝子およびPrdm14遺伝子の発現の誘導には十分ではなく,BMPシグナル伝達経路の活性化も必要であるのかという問題が残った.そこで,WNTシグナル伝達経路の下流においては,Tのほかにも,体細胞系列への分化に重要であることが報告されているさまざまなタンパク質の発現が誘導されていることに注目した.BMP4がそのような生殖細胞系列への分化を阻害しうるタンパク質の発現を抑制することにより,TによりBlimp1遺伝子およびPrdm14遺伝子の発現を制御する環境を許容しているのではないかと考え,WNTシグナル伝達経路を活性化させたエピブラスト様細胞において,TによるBlimp1遺伝子およびPrdm14遺伝子の発現の誘導が阻害されるかどうかを検証した.その結果,WNT3Aを添加した時間に比例して,TによるBlimp1遺伝子およびPrdm14遺伝子の発現の誘導が阻害される傾向のあることが判明した.このことから,BMP4の機能のひとつとして,転写因子Tによる生殖細胞への分化を決定する遺伝子の発現制御の許容が示唆された.
おわりに
この研究において,筆者らは,生殖細胞への分化の決定においてBMP4およびWNT3の下流にて,中胚葉において発現することの知られていた転写因子Tが,始原生殖細胞への分化に必須の転写因子をコードするBlimp1遺伝子およびPrdm14遺伝子の発現を誘導する機構を見い出した(図2).Tは生物種のあいだで広く保存されているため,生殖細胞への分化において後生的なシステムをとるほかの種,あるいは,マウスと同様に哺乳類であるヒトにおいて,同じ機構が用いられているかどうかは,今後,明らかにされるべき課題である.一方で,生殖細胞への分化の決定において不可欠であるBMP4シグナル伝達経路の意義については,なお解明すべき部分が多い.今回の実験では,TがBlimp1遺伝子およびPrdm14遺伝子の近傍のゲノム領域に結合することを確認した一方で,BMPシグナルを伝達する転写因子SMAD1のそれらのゲノム領域への明確な結合は確認されなかった.予想しうるBMP4の機能の仮説として“WNTに依存して発現の誘導される阻害タンパク質への拮抗作用”(図2)を提唱したが,実際に,エピブラスト様細胞の系におけるマイクロアレイ解析により,WNTシグナルにより発現の誘導される遺伝子のうち,Foxa2遺伝子,Hoxb1遺伝子,Hoxa1遺伝子など,体細胞系列への分化において重要な遺伝子の発現がBMP4により抑制されることが明らかになった.さらに,エピブラスト様細胞においてTの強制発現により誘導されるBlimp1遺伝子およびPrdm14遺伝子の発現が,BMP4の存在下においては強められたことから,BMP4-SMADシグナル伝達経路の下流においてTによる制御をおぎなう共役タンパク質の発現が誘導されているという別の可能性も考えられる(図2).Tを欠損したマウスを用いた解析ではエピブラストにおけるBlimp1遺伝子の発現が認められたことから,BMP4およびWNT3の下流においてTのほかにもBlimp1遺伝子の発現を制御するタンパク質の存在が示唆された.筆者らは,これに関して,エピブラスト様細胞を用いた系において,Tと同じくTボックスファミリーに属するEOMESがBlimp1遺伝子の発現を促進することを明らかにしており,これは,Tのほかにも初期の中胚葉において発現する転写因子が生殖細胞系列への分化の決定に関与している可能性を示唆している.最近では,哺乳類とは進化的に大きく離れたコオロギを用いた研究において,中胚葉において機能する転写因子をコードするTwist遺伝子が始原生殖細胞の形成に重要であるとの報告もあり13),今後,進化的な観点からも中胚葉の形成と生殖細胞の形成との関係がさらに明らかにされていくことを期待する.
文 献
- Saitou, M. & Yamaji, M.: Primordial germ cells in mice. Cold Spring Harb. Perspect. Biol., 4, a008375 (2012)[PubMed]
- Chang, H. & Matzuk, M. M.: Smad5 is required for mouse primordial germ cell development. Mech. Dev., 104, 61-67 (2001)[PubMed]
- Hayashi, K., Kobayashi, T., Umino, T. et al.: SMAD1 signaling is critical for initial commitment of germ cell lineage from mouse epiblast. Mech. Dev., 118, 99-109 (2002)[PubMed]
- Lawson, K. A., Dunn, N. R., Roelen, B. A. et al.: Bmp4 is required for the generation of primordial germ cells in the mouse embryo. Genes Dev., 13, 424-436 (1999)[PubMed]
- Tremblay, K. D., Dunn, N. R. & Robertson, E. J.: Mouse embryos lacking Smad1 signals display defects in extra-embryonic tissues and germ cell formation. Development, 128, 3609-3621 (2001)[PubMed]
- Ohinata, Y., Ohta, H., Shigeta, M. et al.: A signaling principle for the specification of the germ cell lineage in mice. Cell 137, 571-584 (2009)[PubMed]
- Hayashi, K., Ohta, H., Kurimoto, K. et al.: Reconstitution of the mouse germ cell specification pathway in culture by pluripotent stem cells. Cell, 146, 519-532 (2011)[PubMed]
- MacDonald, B. T., Tamai, K. & He, X.: Wnt/β-catenin signaling: components, mechanisms, and diseases. Dev. Cell, 17, 9-26 (2009)[PubMed]
- Fuentealba, L. C., Eivers, E., Ikeda, A. et al.: Integrating patterning signals: Wnt/GSK3 regulates the duration of the BMP/Smad1 signal. Cell, 131, 980-993 (2007)[PubMed]
- Korchynskyi, O. & ten Dijke, P.: Identification and functional characterization of distinct critically important bone morphogenetic protein-specific response elements in the Id1 promoter. J. Biol. Chem., 277, 4883-4891 (2002)[PubMed]
- Arnold, S. J., Stappert, J., Bauer, A. et al.: Brachyury is a target gene of the Wnt/β-catenin signaling pathway. Mech. Dev., 91, 249-258 (2000)[PubMed]
- Naiche, L. A., Harrelson, Z., Kelly, R. G. et al.: T-box genes in vertebrate development. Annu. Rev. Genet., 39, 219-239 (2005)[PubMed]
- Ewen-Campen, B., Donoughe, S., Clarke, D. N. et al.: Germ cell specification requires zygotic mechanisms rather than germ plasm in a basally branching insect. Curr. Biol., 23, 835-842 (2013)[PubMed]
著者プロフィール
略歴:2009年 九州大学大学院生物資源環境科学府 修了,同年より京都大学大学院医学研究科 研究員.
研究テーマ:生殖細胞の発生生物学.
関心事:生命現象の本質をとらえること.
斎藤 通紀(Mitinori Saitou)
京都大学大学院医学研究科 教授.科学技術振興機構ERATO全能性エピゲノムプロジェクト 研究総括 兼任.
© 2014 荒牧伸弥・斎藤通紀 Licensed under CC 表示 2.1 日本