XIAPのトランスニトロシル化が神経細胞死を制御する
中村智尋・Stuart A. Lipton
(米国Sanford-Burnham Medical Research Institute,Neuroscience, Aging and Stem Cell Research Center)
email:中村智尋
DOI: 10.7875/first.author.2010.012
Transnitrosylation of XIAP regulates caspase-dependent neuronal cell death.
Tomohiro Nakamura, Lei Wang, Catherine C.L. Wong, Fiona L. Scott, Brendan P. Eckelman, Xuemei Han, Christos Tzitzilonis, Fanjun Meng, Zezong Gu, Emily A. Holland, Arjay T. Clemente, Shu-ichi Okamoto, Guy S. Salvesen, Roland Riek, John R. Yates, Stuart A. Lipton
Molecular Cell, 39, 184-195 (2010)
XIAPは,カスパーゼに直接に結合してそのプロテアーゼ活性を阻害すると同時に,ユビキチンリガーゼ活性によってカスパーゼの分解を促進することで,その高いアポトーシス抑制活性を発揮するタンパク質である.しかしながら,XIAPのアポトーシス抑制活性がどのように制御されているのか,その分子機構は不明であった.筆者らは,最近,一酸化窒素がXIAPのRINGドメインをS-ニトロシル化することでユビキチンリガーゼ活性を抑制することを示した.さらに,アルツハイマー病,パーキンソン病,ハンチントン病の死後脳において,S-ニトロシル化されたXIAPが顕著に増加していた.また,予期せぬことに,S-ニトロシル化されたカスパーゼからXIAPへとNOが転移することも明らかになった.以上の結果は,S-ニトロシル化されたXIAPが神経変性疾患の発症に関与していることを示唆している.
パーキンソン病やアルツハイマー病に代表される神経変性疾患は,中枢神経系に存在する神経細胞の傷害や変性が原因となりひき起こされる神経難病である.神経変性疾患発症の分子機構にはいまだ不明な点が多いが,少なくともそのプロセスの一部には,アポトーシス性細胞死の関与が疑われている1).一般に,アポトーシスはシステインプロテアーゼであるカスパーゼファミリーに依存して起こり,実際に,アルツハイマー病では,カスパーゼによるアミロイド前駆体やタウタンパク質の切断が発症に寄与していることが示唆されている.一方,活性型のカスパーゼ-3,カスパーゼ-7,カスパーゼ-9を選択的に阻害するXIAPは,神経細胞をアポトーシスから効率的に保護することから,神経変性疾患発症の重要な制御タンパク質のひとつとみられている.XIAPには3つのBIRドメインとC末端にひとつのRINGドメインがある.BIRドメインの周辺領域はカスパーゼとの直接の相互作用に重要であり,RINGドメインはユビキチンリガーゼ活性をもちカスパーゼのユビキチン化および分解にかかわっている2).
一方,一酸化窒素(NO)が神経細胞の生死を制御していることが知られている.NO(もしくは,類似の窒素酸化物)は,cGMPの生成,または,タンパク質のシステイン残基のS-ニトロシル化などを介して,その生理活性を発揮している3).NOの生理活性には両面性があり,たとえば,NMDA受容体やカスパーゼのS-ニトロシル化はタンパク質の活性を阻害し神経細胞死を抑制するが,Parkin,PDI,Drp1,GAPDHなどがS-ニトロシル化されると異常タンパク質の凝集・蓄積やミトコンドリア異常などを起こしアポトーシスが促進される4-9).
今回,筆者らは,XIAPのRINGドメインがS-ニトロシル化されるとカスパーゼ依存性の神経細胞死が促進されるという知見を得た.さらに,S-ニトロシル化されたカスパーゼがXIAPをS-ニトロシル化するという興味深い現象を発見したので,紹介したい.
近年,筆者らを含めた複数のグループが,ParkinのRINGドメインがS-ニトロシル化されることを報告した5,9).そこで,同様にRINGドメインをもつXIAPの活性もS-ニトロシル化により制御されているものと仮定し,解析を行うことにした.まず,精製したXIAP組換え体タンパク質を用い,in vitro系でS-ニトロシル化XIAPの検出を試みたところ,RINGドメインを含む組換え体にのみS-ニトロシル化のシグナルが検出された.つづいて,細胞内や組織内でS-ニトロシル化タンパク質を検出することのできるビオチンスイッチ法を用いたところ,RINGドメインを欠損したXIAP変異体はS-ニトロシル化をうけないことがわかった.以上の結果は,XIAPのRINGドメインに存在するシステイン残基がS-ニトロシル化のおもな標的であることを示していた.さらに,順次,NMR,質量分析,ビオチンスイッチ法を取り入れて解析を行った結果,RINGドメインにある450番目のシステイン残基がS-ニトロシル化修飾をうけていることを突き止めた.
さらに,アルツハイマー病,パーキンソン病,ハンチントン病の死後脳の組織をビオチンスイッチ法にて解析したところ,いずれの疾患においてもS-ニトロシル化XIAPが顕著に増加していた.これは,S-ニトロシル化XIAPがこれら疾患の発症にかかわっていることを強く示唆している.
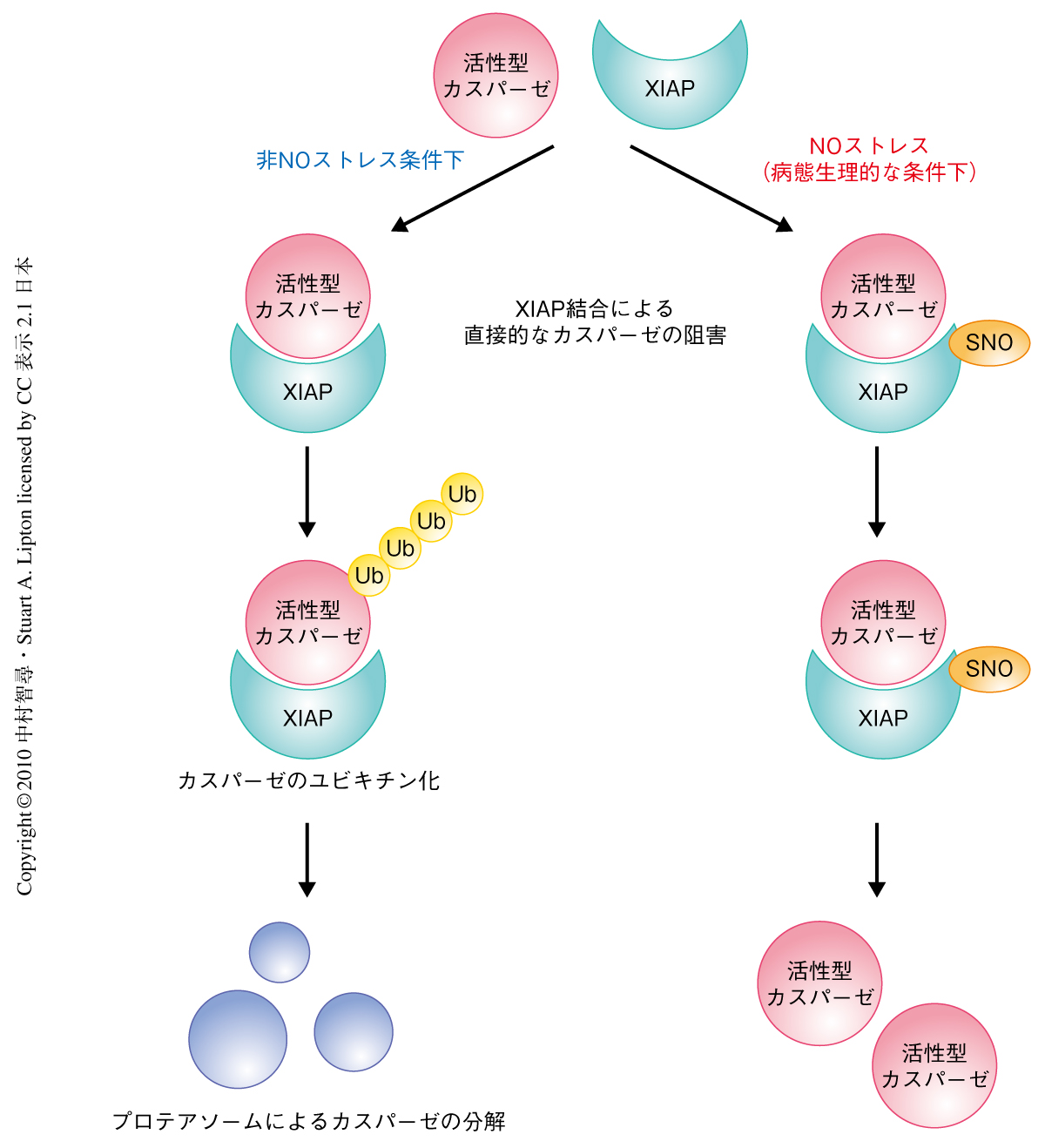
RINGドメインの450番目のシステイン残基がS-ニトロシル化されることから,NOがXIAPのユビキチンリガーゼ活性を調節していると考え,ユビキチン化反応を行ってみた.カスパーゼは細胞内で前駆体として発現し,アポトーシス刺激に応じて切断され活性化されるが,XIAPは活性型カスパーゼのみに結合し阻害因子として作用することが知られている.そこでまず,in vitroで精製したXIAPと活性型カスパーゼ-3または活性型カスパーゼ-9を用い,カスパーゼのユビキチン化を検出した.すると,S-ニトロシル化XIAPではカスパーゼをユビキチン化する活性が減少していることがわかった.さらに,培養細胞にてカスパーゼのユビキチン化を検討したところ,NO処理のあとでは活性型カスパーゼ-3および活性型カスパーゼ-9のユビキチン化は減少していた.すなわち,XIAPがS-ニトロシル化されるとユビキチンリガーゼ活性が減少することが示唆された(図1).
それでは,S-ニトロシル化はXIAPの抗アポトーシス活性にどのような影響をあたえているのだろうか? XIAPのS-ニトロシル化がカスパーゼのユビキチン化を減少させるということは,プロテアソームによるカスパーゼの分解も減少しているのではないかと考えた.実際に,XIAPを高発現している細胞にNOを発生させてみると,活性型カスパーゼのタンパク質量が増加してくることがわかった.そこでつづいて,S-ニトロシル化XIAPが神経細胞死に及ぼす影響を検討した.
まず,ヒト神経芽細胞腫SH-SY5Y細胞にBaxを発現させてアポトーシスが起こることを示した.このとき,XIAPを強発現させるとアポトーシスが抑制されたが,NO供与体で処理するとXIAPのアポトーシス抑制効果が減少した.また,このNO供与体の効果はRINGドメインを欠損したXIAP変異体に対しては認められなかった.以上の結果より,XIAPのRINGドメインがS-ニトロシル化されてユビキチンリガーゼ活性が低下すると,活性型カスパーゼの量が増加してアポトーシスの促進されることが示された.
さらに,ラット大脳皮質神経細胞の初代培養を用い,S-ニトロシル化XIAPの神経細胞死の抑制活性を解析した.ラット大脳皮質神経細胞を過剰のNMDAで処理すると,12時間から24時間ほどで神経細胞死が認められる.このNMDAによる細胞死の惹起にはNOストレスとカスパーゼ活性化とがかかわっている.実際に,XIAPをラット大脳皮質神経細胞に高発現させるとNMDAによる神経細胞死の抑制が認められた.また,XIAPの450番目のシステイン残基をヒスチジン残基に置換した変異体をラット神経細胞に導入すると,野生型XIAPより高い抗アポトーシス効果を発揮した.これは,この変異XIAPはNOによる抑制をうけないので,より効率的にカスパーゼの分解を促進したためであると考えられた(図1).
ここまで,NOがXIAPをS-ニトロシル化しアポトーシスを促進することを述べてきた.しかしながら,さきにも述べたように,NOはカスパーゼをS-ニトロシル化しその活性を抑制することも知られている.それでは,S-ニトロシル化XIAPとS-ニトロシル化カスパーゼとはどのような関係にあるのだろうか? 以前,Stamlerらのグループは,アポトーシスを起こしている細胞では活性型カスパーゼ-3が選択的に脱ニトロシル化されていることを見いだしていた7).さらに最近,このグループは,カスパーゼの脱ニトロシル化にはチオレドキシン系がかかわっていることを報告した10).一方で,Marlettaらは,NOがチオレドキシンからにカスパーゼ-3に転移(トランスニトロシル化)する可能性を示した11).いずれにせよ,なぜ活性型カスパーゼのみが脱ニトロシル化をうけやすいのか,その分子機構は十分には解明されていなかった.興味深いことに,XIAPは活性型カスパーゼのみに結合する.そこで,XIAPが活性型カスパーゼの選択的な脱ニトロシル化にかかわっているものと仮定した.
まず,S-ニトロシル化活性型カスパーゼがXIAPの選択的なNO供与体となり,XIAPをS-ニトロシル化するものと考えた.in vitroでS-ニトロシル化活性型カスパーゼ-3を調製したのち,XIAPと混合したところ,XIAPがS-ニトロシル化された.逆に,S-ニトロシル化XIAPを調製してから活性型カスパーゼ-3と混合したところ,活性型カスパーゼ-3はS-ニトロシル化されなかった.これは,S-ニトロシル化活性型カスパーゼ-3はXIAPのNO供与体となりうるが,その逆の反応は起らないことを示唆していた.さらに,S-ニトロシル化前駆体カスパーゼ-3をXIAPと混合しても,XIAPのS-ニトロシル化は認められなかったことから,カスパーゼ-3とXIAPとの直接的な相互作用がトランスS-ニトロシル化には必要であることがわかった.
では,このNOの転移は細胞内でも起こりうるのだろうか? これを検討するため,活性型カスパーゼ-3とXIAPとの細胞内における標準酸化還元電位差を求めることにした.ビオチンスイッチ法により酸化型(S-ニトロシル化型)活性型カスパーゼ-3,還元型活性型カスパーゼ-3,酸化型XIAP,そして,還元型XIAPをそれぞれ定量し,それらを改変型Nernst式へと代入した.その結果,活性型カスパーゼ-3からXIAPへのNOの転移は細胞内でも容易に起こりうる反応であることが示唆された.以上の結果は,活性型カスパーゼ-3からXIAPにNOが移行し,その結果,活性型カスパーゼの選択的な脱ニトロシル化(NOによる活性抑制がなくなりアポトーシスが増大する)と,XIAPのS-ニトロシル化(ユビキチンリガーゼ活性が低下しアポトーシスが促進される)とが,同時に起こることを示していた(図2).
今回,XIAPのS-ニトロシル化が神経細胞死を促進する重要なシグナル伝達経路に関与していることを明らかにした.近年,神経変性疾患の初期段階では,まず,神経シナプスが消失し,そのことが認知機能障害などの原因となっていることが報告されている.このシナプスの脱落にもカスパーゼなどの細胞死実行タンパク質が関与していることが示唆されていることから,S-ニトロシル化XIAPがこの過程にもかかわっているかどうか興味深いところである.
S-ニトロシル化タンパク質の研究は,近年,めざましい発展を遂げている.その一方で,多くの研究者が生理的な条件下では存在しないような高い濃度のNOを用いて実験しているなど,S-ニトロシル化の本当の生理作用を解明する研究がいまひとつなされていないのが現状でもある12).今後,S-ニトロシル化の生理的な活性の全貌が解明され,神経変性疾患およびほかの疾病の治療や予防に役立つことを期待する.
(米国Sanford-Burnham Medical Research Institute,Neuroscience, Aging and Stem Cell Research Center)
email:中村智尋
DOI: 10.7875/first.author.2010.012
Transnitrosylation of XIAP regulates caspase-dependent neuronal cell death.
Tomohiro Nakamura, Lei Wang, Catherine C.L. Wong, Fiona L. Scott, Brendan P. Eckelman, Xuemei Han, Christos Tzitzilonis, Fanjun Meng, Zezong Gu, Emily A. Holland, Arjay T. Clemente, Shu-ichi Okamoto, Guy S. Salvesen, Roland Riek, John R. Yates, Stuart A. Lipton
Molecular Cell, 39, 184-195 (2010)
要 約
XIAPは,カスパーゼに直接に結合してそのプロテアーゼ活性を阻害すると同時に,ユビキチンリガーゼ活性によってカスパーゼの分解を促進することで,その高いアポトーシス抑制活性を発揮するタンパク質である.しかしながら,XIAPのアポトーシス抑制活性がどのように制御されているのか,その分子機構は不明であった.筆者らは,最近,一酸化窒素がXIAPのRINGドメインをS-ニトロシル化することでユビキチンリガーゼ活性を抑制することを示した.さらに,アルツハイマー病,パーキンソン病,ハンチントン病の死後脳において,S-ニトロシル化されたXIAPが顕著に増加していた.また,予期せぬことに,S-ニトロシル化されたカスパーゼからXIAPへとNOが転移することも明らかになった.以上の結果は,S-ニトロシル化されたXIAPが神経変性疾患の発症に関与していることを示唆している.
はじめに
パーキンソン病やアルツハイマー病に代表される神経変性疾患は,中枢神経系に存在する神経細胞の傷害や変性が原因となりひき起こされる神経難病である.神経変性疾患発症の分子機構にはいまだ不明な点が多いが,少なくともそのプロセスの一部には,アポトーシス性細胞死の関与が疑われている1).一般に,アポトーシスはシステインプロテアーゼであるカスパーゼファミリーに依存して起こり,実際に,アルツハイマー病では,カスパーゼによるアミロイド前駆体やタウタンパク質の切断が発症に寄与していることが示唆されている.一方,活性型のカスパーゼ-3,カスパーゼ-7,カスパーゼ-9を選択的に阻害するXIAPは,神経細胞をアポトーシスから効率的に保護することから,神経変性疾患発症の重要な制御タンパク質のひとつとみられている.XIAPには3つのBIRドメインとC末端にひとつのRINGドメインがある.BIRドメインの周辺領域はカスパーゼとの直接の相互作用に重要であり,RINGドメインはユビキチンリガーゼ活性をもちカスパーゼのユビキチン化および分解にかかわっている2).
一方,一酸化窒素(NO)が神経細胞の生死を制御していることが知られている.NO(もしくは,類似の窒素酸化物)は,cGMPの生成,または,タンパク質のシステイン残基のS-ニトロシル化などを介して,その生理活性を発揮している3).NOの生理活性には両面性があり,たとえば,NMDA受容体やカスパーゼのS-ニトロシル化はタンパク質の活性を阻害し神経細胞死を抑制するが,Parkin,PDI,Drp1,GAPDHなどがS-ニトロシル化されると異常タンパク質の凝集・蓄積やミトコンドリア異常などを起こしアポトーシスが促進される4-9).
今回,筆者らは,XIAPのRINGドメインがS-ニトロシル化されるとカスパーゼ依存性の神経細胞死が促進されるという知見を得た.さらに,S-ニトロシル化されたカスパーゼがXIAPをS-ニトロシル化するという興味深い現象を発見したので,紹介したい.
1.XIAPのS-ニトロシル化はRINGドメイン内で起こる
近年,筆者らを含めた複数のグループが,ParkinのRINGドメインがS-ニトロシル化されることを報告した5,9).そこで,同様にRINGドメインをもつXIAPの活性もS-ニトロシル化により制御されているものと仮定し,解析を行うことにした.まず,精製したXIAP組換え体タンパク質を用い,in vitro系でS-ニトロシル化XIAPの検出を試みたところ,RINGドメインを含む組換え体にのみS-ニトロシル化のシグナルが検出された.つづいて,細胞内や組織内でS-ニトロシル化タンパク質を検出することのできるビオチンスイッチ法を用いたところ,RINGドメインを欠損したXIAP変異体はS-ニトロシル化をうけないことがわかった.以上の結果は,XIAPのRINGドメインに存在するシステイン残基がS-ニトロシル化のおもな標的であることを示していた.さらに,順次,NMR,質量分析,ビオチンスイッチ法を取り入れて解析を行った結果,RINGドメインにある450番目のシステイン残基がS-ニトロシル化修飾をうけていることを突き止めた.
さらに,アルツハイマー病,パーキンソン病,ハンチントン病の死後脳の組織をビオチンスイッチ法にて解析したところ,いずれの疾患においてもS-ニトロシル化XIAPが顕著に増加していた.これは,S-ニトロシル化XIAPがこれら疾患の発症にかかわっていることを強く示唆している.
2.S-ニトロシル化はXIAPのユビキチンリガーゼ活性を抑制する
RINGドメインの450番目のシステイン残基がS-ニトロシル化されることから,NOがXIAPのユビキチンリガーゼ活性を調節していると考え,ユビキチン化反応を行ってみた.カスパーゼは細胞内で前駆体として発現し,アポトーシス刺激に応じて切断され活性化されるが,XIAPは活性型カスパーゼのみに結合し阻害因子として作用することが知られている.そこでまず,in vitroで精製したXIAPと活性型カスパーゼ-3または活性型カスパーゼ-9を用い,カスパーゼのユビキチン化を検出した.すると,S-ニトロシル化XIAPではカスパーゼをユビキチン化する活性が減少していることがわかった.さらに,培養細胞にてカスパーゼのユビキチン化を検討したところ,NO処理のあとでは活性型カスパーゼ-3および活性型カスパーゼ-9のユビキチン化は減少していた.すなわち,XIAPがS-ニトロシル化されるとユビキチンリガーゼ活性が減少することが示唆された(図1).
3.S-ニトロシル化はXIAPの抗アポトーシス活性を抑制する
それでは,S-ニトロシル化はXIAPの抗アポトーシス活性にどのような影響をあたえているのだろうか? XIAPのS-ニトロシル化がカスパーゼのユビキチン化を減少させるということは,プロテアソームによるカスパーゼの分解も減少しているのではないかと考えた.実際に,XIAPを高発現している細胞にNOを発生させてみると,活性型カスパーゼのタンパク質量が増加してくることがわかった.そこでつづいて,S-ニトロシル化XIAPが神経細胞死に及ぼす影響を検討した.
まず,ヒト神経芽細胞腫SH-SY5Y細胞にBaxを発現させてアポトーシスが起こることを示した.このとき,XIAPを強発現させるとアポトーシスが抑制されたが,NO供与体で処理するとXIAPのアポトーシス抑制効果が減少した.また,このNO供与体の効果はRINGドメインを欠損したXIAP変異体に対しては認められなかった.以上の結果より,XIAPのRINGドメインがS-ニトロシル化されてユビキチンリガーゼ活性が低下すると,活性型カスパーゼの量が増加してアポトーシスの促進されることが示された.
さらに,ラット大脳皮質神経細胞の初代培養を用い,S-ニトロシル化XIAPの神経細胞死の抑制活性を解析した.ラット大脳皮質神経細胞を過剰のNMDAで処理すると,12時間から24時間ほどで神経細胞死が認められる.このNMDAによる細胞死の惹起にはNOストレスとカスパーゼ活性化とがかかわっている.実際に,XIAPをラット大脳皮質神経細胞に高発現させるとNMDAによる神経細胞死の抑制が認められた.また,XIAPの450番目のシステイン残基をヒスチジン残基に置換した変異体をラット神経細胞に導入すると,野生型XIAPより高い抗アポトーシス効果を発揮した.これは,この変異XIAPはNOによる抑制をうけないので,より効率的にカスパーゼの分解を促進したためであると考えられた(図1).
4.S-ニトロシル化カスパーゼがXIAPをトランスニトロシル化する
ここまで,NOがXIAPをS-ニトロシル化しアポトーシスを促進することを述べてきた.しかしながら,さきにも述べたように,NOはカスパーゼをS-ニトロシル化しその活性を抑制することも知られている.それでは,S-ニトロシル化XIAPとS-ニトロシル化カスパーゼとはどのような関係にあるのだろうか? 以前,Stamlerらのグループは,アポトーシスを起こしている細胞では活性型カスパーゼ-3が選択的に脱ニトロシル化されていることを見いだしていた7).さらに最近,このグループは,カスパーゼの脱ニトロシル化にはチオレドキシン系がかかわっていることを報告した10).一方で,Marlettaらは,NOがチオレドキシンからにカスパーゼ-3に転移(トランスニトロシル化)する可能性を示した11).いずれにせよ,なぜ活性型カスパーゼのみが脱ニトロシル化をうけやすいのか,その分子機構は十分には解明されていなかった.興味深いことに,XIAPは活性型カスパーゼのみに結合する.そこで,XIAPが活性型カスパーゼの選択的な脱ニトロシル化にかかわっているものと仮定した.
まず,S-ニトロシル化活性型カスパーゼがXIAPの選択的なNO供与体となり,XIAPをS-ニトロシル化するものと考えた.in vitroでS-ニトロシル化活性型カスパーゼ-3を調製したのち,XIAPと混合したところ,XIAPがS-ニトロシル化された.逆に,S-ニトロシル化XIAPを調製してから活性型カスパーゼ-3と混合したところ,活性型カスパーゼ-3はS-ニトロシル化されなかった.これは,S-ニトロシル化活性型カスパーゼ-3はXIAPのNO供与体となりうるが,その逆の反応は起らないことを示唆していた.さらに,S-ニトロシル化前駆体カスパーゼ-3をXIAPと混合しても,XIAPのS-ニトロシル化は認められなかったことから,カスパーゼ-3とXIAPとの直接的な相互作用がトランスS-ニトロシル化には必要であることがわかった.
では,このNOの転移は細胞内でも起こりうるのだろうか? これを検討するため,活性型カスパーゼ-3とXIAPとの細胞内における標準酸化還元電位差を求めることにした.ビオチンスイッチ法により酸化型(S-ニトロシル化型)活性型カスパーゼ-3,還元型活性型カスパーゼ-3,酸化型XIAP,そして,還元型XIAPをそれぞれ定量し,それらを改変型Nernst式へと代入した.その結果,活性型カスパーゼ-3からXIAPへのNOの転移は細胞内でも容易に起こりうる反応であることが示唆された.以上の結果は,活性型カスパーゼ-3からXIAPにNOが移行し,その結果,活性型カスパーゼの選択的な脱ニトロシル化(NOによる活性抑制がなくなりアポトーシスが増大する)と,XIAPのS-ニトロシル化(ユビキチンリガーゼ活性が低下しアポトーシスが促進される)とが,同時に起こることを示していた(図2).
おわりに
今回,XIAPのS-ニトロシル化が神経細胞死を促進する重要なシグナル伝達経路に関与していることを明らかにした.近年,神経変性疾患の初期段階では,まず,神経シナプスが消失し,そのことが認知機能障害などの原因となっていることが報告されている.このシナプスの脱落にもカスパーゼなどの細胞死実行タンパク質が関与していることが示唆されていることから,S-ニトロシル化XIAPがこの過程にもかかわっているかどうか興味深いところである.
S-ニトロシル化タンパク質の研究は,近年,めざましい発展を遂げている.その一方で,多くの研究者が生理的な条件下では存在しないような高い濃度のNOを用いて実験しているなど,S-ニトロシル化の本当の生理作用を解明する研究がいまひとつなされていないのが現状でもある12).今後,S-ニトロシル化の生理的な活性の全貌が解明され,神経変性疾患およびほかの疾病の治療や予防に役立つことを期待する.
文 献
- Mattson, M. P.: Apoptosis in neurodegenerative disorders. Nat. Rev. Mol. Cell Biol., 1, 120-129 (2000)[PubMed]
- Salvesen, G. S. & Duckett, C. S.: IAP proteins: blocking the road to death's door. Nat. Rev. Mo.l Cell Biol., 3, 401-410 (2002)[PubMed]
- Hess, D. T., Matsumoto, A., Kim, S. O. et al.: Protein S-nitrosylation: purview and parameters. Nat. Rev. Mol. Cell Biol., 6, 150-166 (2005)[PubMed]
- Cho, D. H., Nakamura, T., Fang, J. et al.: S-Nitrosylation of Drp1 mediates beta-amyloid-related mitochondrial fission and neuronal injury. Science, 324, 102-105 (2009)[PubMed]
- Chung, K. K., Thomas, B., Li, X. et al.: S-Nitrosylation of parkin regulates ubiquitination and compromises parkin's protective function. Science, 304, 1328-1331 (2004)[PubMed]
- Lipton, S. A., Choi, Y. B., Pan, Z. H. et al.: A redox-based mechanism for the neuroprotective and neurodestructive effects of nitric oxide and related nitroso-compounds. Nature, 364, 626-632 (1993)[PubMed]
- Mannick, J. B., Hausladen, A., Liu, L. et al.: Fas-induced caspase denitrosylation. Science, 284, 651-654 (1999)[PubMed]
- Uehara, T., Nakamura, T., Yao, D. et al.: S-Nitrosylated protein-disulphide isomerase links protein misfolding to neurodegeneration. Nature, 441, 513-517 (2006)[PubMed]
- Yao, D., Gu, Z., Nakamura, T. et al.: Nitrosative stress linked to sporadic Parkinson's disease: S-nitrosylation of parkin regulates its E3 ubiquitin ligase activity. Proc. Natl. Acad. Sci. USA, 101, 10810-10814 (2004)[PubMed]
- Benhar, M., Forrester, M. T., Hess, D. T. et al.: Regulated protein denitrosylation by cytosolic and mitochondrial thioredoxins. Science, 320, 1050-1054 (2008)[PubMed]
- Mitchell, D. A. & Marletta, M. A.: Thioredoxin catalyzes the S-nitrosation of the caspase-3 active site cysteine. Nat. Chem. Biol., 1, 154-158 (2005)[PubMed]
- Tsang, A. H., Lee, Y. I., Ko, H. S. et al.: S-Nitrosylation of XIAP compromises neuronal survival in Parkinson’s disease. Proc. Natl. Acad. Sci. USA, 106, 4900-4905 (2009)[PubMed]
著者プロフィール
略歴:2002年 筑波大学大学院生物科学研究科 修了,日本学術振興会 海外特別研究員を経て,2009年より米国Sanford-Burnham Medical Research InstituteにてResearch Assistant Professor.
研究テーマ:一酸化窒素ストレスが神経変性をひき起こす分子機序の解明.
抱負:ここで紹介したような基礎研究をトランスレーショナルリサーチへ応用していきたい.子どもといっしょにメジャーリーグの試合を見に行くことが楽しみ.
Stuart A. Lipton
米国Sanford-Burnham Medical Research Institute教授.
研究室URL:http://www.sanfordburnham.org/research_and_faculty/faculty_search/lipton_s_md_phd.aspx
© 2010 中村智尋・Stuart A. Lipton Licensed under CC 表示 2.1 日本