家族性乳がんの原因遺伝子の産物であるBRCA1の新規の結合タンパク質OLA1は中心体を制御する
松澤綾子・千葉奈津子
(東北大学加齢医学研究所 免疫遺伝子制御研究分野)
email:千葉奈津子
DOI: 10.7875/first.author.2013.161
The BRCA1/BARD1-interacting protein OLA1 functions in centrosome regulation.
Ayako Matsuzawa, Shin-ichiro Kanno, Masahiro Nakayama, Hironori Mochiduki, Leizhen Wei, Tatsuro Shimaoka, Yumiko Furukawa, Kei Kato, Shun Shibata, Akira Yasui, Chikashi Ishioka, Natsuko Chiba
Molecular Cell, 53, 101-114 (2014)
BRCA1遺伝子は遺伝性乳がん・卵巣がん症候群をひき起こすがん抑制遺伝子である.その産物であるBRCA1はBARD1とヘテロ二量体を形成し,DNA修復,中心体の制御,転写制御などに関与する.筆者らは,プロテオミクス解析によりBARD1に結合する新規のタンパク質としてOLA1を同定した.OLA1はBARD1にくわえ,BRCA1および中心体の主要な構成タンパク質であるγチューブリンと直接に結合した.OLA1は間期には細胞質および中心体,分裂期には紡錘体極に局在した.OLA1の発現を抑制すると,中心体の数の増加および中心体に依存性の微小管の重合の促進がみられた.乳がん細胞株に由来するOLA1の変異体ではBRCA1との結合が消失し,その発現により中心体の数に異常をきたした.また,家族性乳がんに由来し中心体の数に異常をきたすBRCA1の変異体ではOLA1との結合能がいちじるしく低下していた.よって,OLA1はBRCA1とともに中心体の制御において重要な機能をはたし,そのがん抑制能に関与すると考えられた.
BRCA1(Breast Cancer gene 1)遺伝子はその生殖細胞系列における変異により遺伝性乳がん・卵巣がん症候群をひき起こすがん抑制遺伝子である1).その生殖系列細胞における変異による乳がんの発症のリスクは約80%,卵巣がんの発症のリスクは約40~50%とされている.一方,散発性のがんにおいて変異はほとんど検出されないが,BRCA1遺伝子のDNAメチル化やBRCA1の発現量の減少がみられ,近年では,難治性の乳がんであるトリプルネガティブ乳がんとのかかわりも明らかになっている.
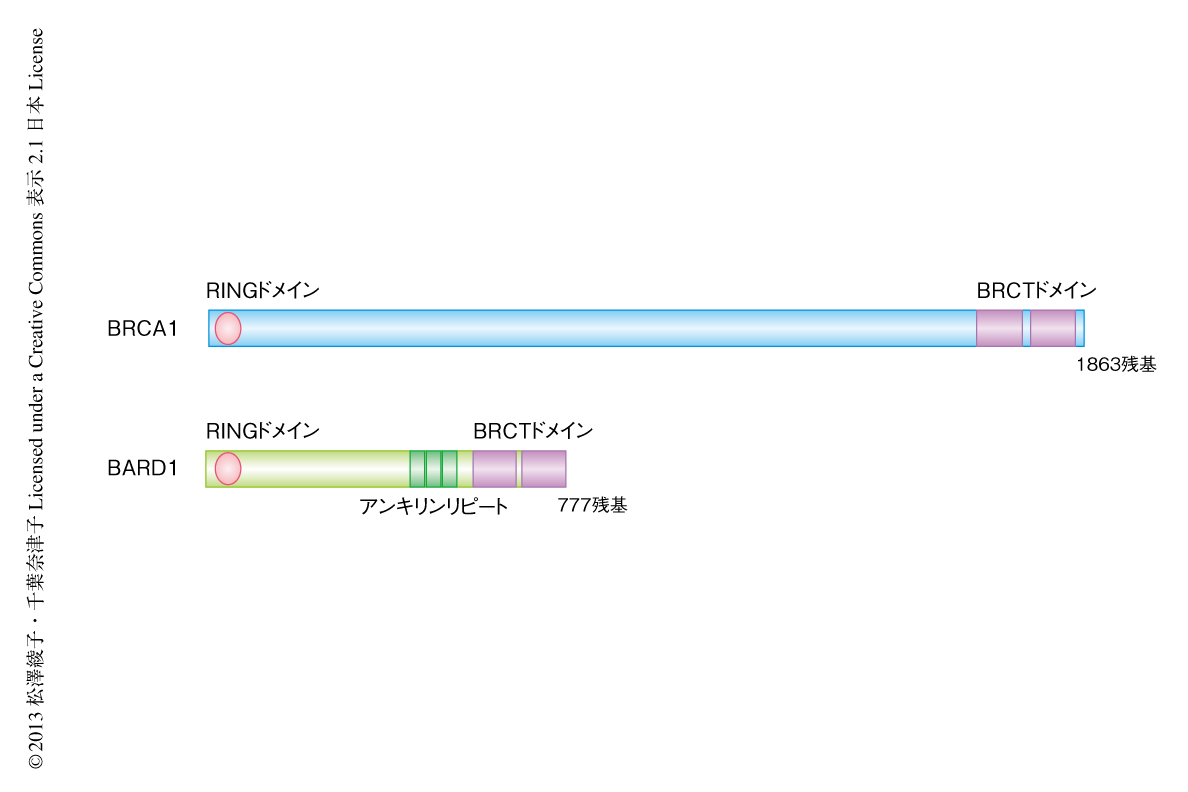
BRCA1はそのN末端側の領域に結合するタンパク質として同定されたBARD1(BRCA1-associated RING domain protein 1)とヘテロ二量体を形成する2).BRCA1およびBARD1はともにN末端側の領域にRINGドメイン,C末端側の領域に2つのBRCTドメインをもち(図1),それぞれのRINGドメインを介して安定な二量体を形成しユビキチンリガーゼ活性を示す.BRCA1はBARD1とともに,DNA修復,中心体の制御,転写制御,クロマチンの再編成など,細胞内のさまざまな機構に関与する3).腫瘍に由来するBRCA1の点変異によりBARD1との結合能が消失することから,BARD1はBRCA1のがん抑制能において重要だと考えられる.また,BARD1のC末端側の領域のBRCTドメインとその周辺にも,乳がんおよび卵巣がんにおいていくつかのミスセンス変異が報告されている.
そこで,筆者らは,BRCA1のもつがん抑制能について明らかにする目的で,プロテオミクス解析によりBARD1のBRCTドメインを含むC末端側の領域に結合する新規のタンパク質を同定し,その機能を解析した.
FLAGタグを付加したBARD1のC末端側の断片の発現をテトラサイクリンにより誘導することのできる293細胞株を樹立した.この細胞株を大量に培養し,テトラサイクリンにより処理したのち細胞抽出液を調製し,抗FLAG抗体により免疫沈降した.共沈したタンパク質を質量分析により解析することにより,BARD1のC末端側の領域に結合する新規タンパク質としてOLA1(Obg-like ATPase 1)を同定した.OLA1は396アミノ酸残基からなるタンパク質で,ATPase活性をもつことが知られていた.OLA1のC末端側の断片およびBARD1のC末端側の断片の精製タンパク質を用い解析したところ,OLA1はBARD1のC末端側の領域と直接に結合することが明らかになった.
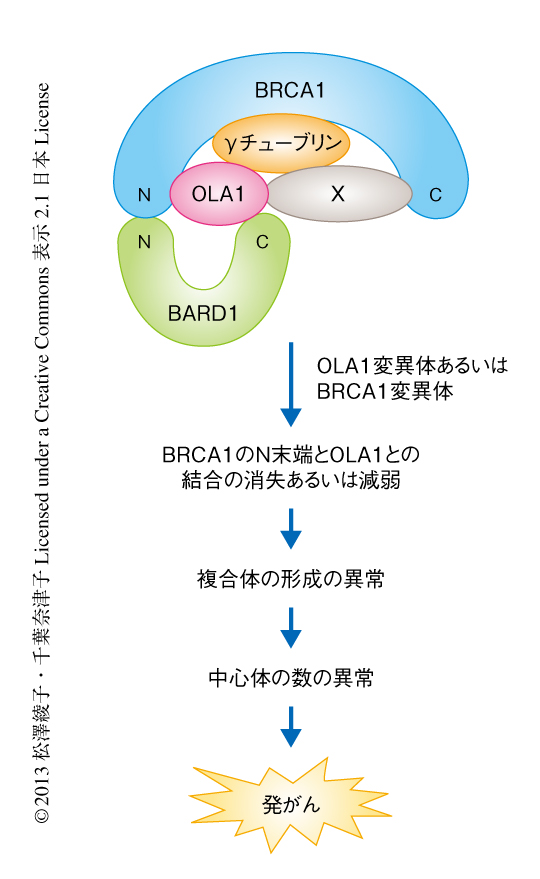
OLA1の細胞における局在についてHeLa細胞などを免疫染色して解析した結果,OLA1は間期においては細胞質および中心体,分裂期においては紡錘体極に局在することが明らかになった.また,スクロース密度勾配遠心法を用いてタンパク質を分画すると,OLA1はBRCA1およびBARD1とともに中心体の画分に存在した.BRCA1も中心体とともに紡錘体極に局在することが報告されている.そこで,OLA1とBRCA1との結合について解析したところ,OLA1はBRCA1のN末端側の領域と直接に結合し,中間の領域およびC末端側の領域とは相互作用した.BRCA1の中間部の領域は中心体の主要な構成タンパク質であるγチューブリンと直接に結合することが報告されている4).そこで,精製タンパク質を用いてγチューブリンとOLA1との結合について解析したところ,OLA1とγチューブリンは直接に結合することが明らかになった.BRCA1のN末端側の領域はγチューブリンとは直接には結合しないが,OLA1を介して結合することも明らかになった.これらの結果から,OLA1はBRCA1,BARD1,γチューブリンと直接に結合し,未知のタンパク質Xとともに複合体を形成することが示唆された(図2).
BRCA1の発現を抑制することにより中心体の数が増加し,中心体に依存性の微小管の重合が促進することが報告されている5,6).OLA1の発現を抑制したところ,BRCA1の発現抑制と同様に,中心体の数の増加と中心体に依存性の微小管の重合の促進がみられた.中心体はL字型に配置した母中心小体と娘中心小体,および,その周辺の中心小体周辺物質からなり,微小管形成中心として機能し,細胞周期においてS期に1回だけ複製される.中心体の数の増加の原因としては,細胞質分裂の制御機構の破綻によりS期がくり返されるため,中心体の複製のライセンシング機構の破綻による中心体の過剰な複製,中心体の断片化が考えられ,BRCA1の発現抑制により中心体の過剰な複製および中心体の断片化の起こることが報告されている5,7).中心小体のマーカーとなるセントリンおよび成熟した母中心小体のマーカーであるCep170との二重免疫蛍光染色により,OLA1の発現を抑制したときにも中心体の過剰な複製および中心体の断片化の起こることが明らかになった.
乳がん細胞株であるHCC1008細胞株にはOLA1のホモ接合性の点変異として168番目のGluのGlnへの変異が報告されている8).このOLA1変異体と,BRCA1のN末端側の領域,BARD1のC末端側の領域,γチューブリンとの結合を解析したところ,BARD1のC末端側の領域とγチューブリンとの直接の結合は保たれていたが,BRCA1のN末端側の領域との直接の結合は消失していた.また,OLA1の発現を抑制した細胞に野生型のOLA1あるいは168番目のGluがGlnに変異したOLA1を発現させたところ,野生型OLA1の導入はOLA1の発現抑制による中心体の数の増加をレスキューしたが,この変異体のOLA1の導入ではレスキューできなかった.一方,この変異体はOLA1の発現抑制により生じる中心体に依存性の微小管の重合の促進はレスキューした.
家族性乳がんの家系に由来する,N末端側の領域である42番目のIleがVlaに変異したBRCA1は,BARD1との結合能,ユビキチンリガーゼ活性,DNA修復能に異常はないが,中心体の数の制御に異常をきたす9,10).この変異をもつBRCA1のN末端側の領域の精製タンパク質は,野生型のBRCA1と比較して,OLA1との直接的な結合能がいちじるしく低下していた.
BARD1のC末端側の領域に結合するタンパク質としてOLA1を同定した.OLA1は中心体および紡錘体極に局在し,BARD1にくわえ,BRCA1,γチューブリンと直接に結合することが明らかになった.これまで報告されていたBRCA1の発現抑制と同様に,OLA1の発現抑制によっても中心体の数の増加と中心体に依存性の微小管の重合の促進がみられ,OLA1はBRCA1と同じ経路により中心体の制御に関与することが示唆された.また,乳がん細胞株に由来する168番目のGluがGlnに変異したOLA1ではBRCA1のN末端側の領域との直接の結合能が消失し,中心体の数の制御に異常をきたすことが明らかになった.また,家族性乳がん家系における変異として報告され中心体の数の制御能に異常を来すN末端側の領域である42番目のIleがVlaに変異したBRCA1では,OLA1との結合能がいちじるしく低下することが明らかになった.
中心体の数の増加は細胞分裂において重要な染色体分配に異常をもたらし発がんの原因となる.よって,BRCA1あるいはOLA1のいずれの変異によっても,BRCA1のN末端側の領域とOLA1との直接の結合の消失あるいは減弱によりこれらのタンパク質複合体に異常が生じ,中心体の数の制御に異常をきたし発がんの原因になると考えられた(図2).
これまで,BRCA1のがん抑制能に関してはDNA修復経路における機能が重要と考えられ注目をあつめてきた.しかしながら,近年,同様に遺伝性乳がん・卵巣がん症候群の原因となるBRCA2もまた,中心体の複製において重要なはたらきをすることが明らかになっている.よって,OLA1もまた,遺伝性乳がん・卵巣がん症候群の発がん機構に関与する可能性があると考えられた.この研究では,OLA1の発現抑制の影響について検討したが,OLA1は多くの腫瘍においてもその発現が上昇していることや,乳がん細胞の移動と浸潤を抑制し乳がんの進行にも関与することが示唆されている.今後,OLA1の機能をさらに解析することにより,OLA1の機能の異常と発がんとの関連が明らかになり,さらには,トリプルネガティブ乳がんなど難治性のがんの新しい診断法あるいは治療法の開発にも貢献することが期待される.
略歴:2013年 東北大学大学院生命科学研究科にて博士号取得.
千葉 奈津子(Natsuko Chiba)
東北大学加齢医学研究所 准教授.
© 2013 松澤綾子・千葉奈津子 Licensed under CC 表示 2.1 日本
(東北大学加齢医学研究所 免疫遺伝子制御研究分野)
email:千葉奈津子
DOI: 10.7875/first.author.2013.161
The BRCA1/BARD1-interacting protein OLA1 functions in centrosome regulation.
Ayako Matsuzawa, Shin-ichiro Kanno, Masahiro Nakayama, Hironori Mochiduki, Leizhen Wei, Tatsuro Shimaoka, Yumiko Furukawa, Kei Kato, Shun Shibata, Akira Yasui, Chikashi Ishioka, Natsuko Chiba
Molecular Cell, 53, 101-114 (2014)
要 約
BRCA1遺伝子は遺伝性乳がん・卵巣がん症候群をひき起こすがん抑制遺伝子である.その産物であるBRCA1はBARD1とヘテロ二量体を形成し,DNA修復,中心体の制御,転写制御などに関与する.筆者らは,プロテオミクス解析によりBARD1に結合する新規のタンパク質としてOLA1を同定した.OLA1はBARD1にくわえ,BRCA1および中心体の主要な構成タンパク質であるγチューブリンと直接に結合した.OLA1は間期には細胞質および中心体,分裂期には紡錘体極に局在した.OLA1の発現を抑制すると,中心体の数の増加および中心体に依存性の微小管の重合の促進がみられた.乳がん細胞株に由来するOLA1の変異体ではBRCA1との結合が消失し,その発現により中心体の数に異常をきたした.また,家族性乳がんに由来し中心体の数に異常をきたすBRCA1の変異体ではOLA1との結合能がいちじるしく低下していた.よって,OLA1はBRCA1とともに中心体の制御において重要な機能をはたし,そのがん抑制能に関与すると考えられた.
はじめに
BRCA1(Breast Cancer gene 1)遺伝子はその生殖細胞系列における変異により遺伝性乳がん・卵巣がん症候群をひき起こすがん抑制遺伝子である1).その生殖系列細胞における変異による乳がんの発症のリスクは約80%,卵巣がんの発症のリスクは約40~50%とされている.一方,散発性のがんにおいて変異はほとんど検出されないが,BRCA1遺伝子のDNAメチル化やBRCA1の発現量の減少がみられ,近年では,難治性の乳がんであるトリプルネガティブ乳がんとのかかわりも明らかになっている.
BRCA1はそのN末端側の領域に結合するタンパク質として同定されたBARD1(BRCA1-associated RING domain protein 1)とヘテロ二量体を形成する2).BRCA1およびBARD1はともにN末端側の領域にRINGドメイン,C末端側の領域に2つのBRCTドメインをもち(図1),それぞれのRINGドメインを介して安定な二量体を形成しユビキチンリガーゼ活性を示す.BRCA1はBARD1とともに,DNA修復,中心体の制御,転写制御,クロマチンの再編成など,細胞内のさまざまな機構に関与する3).腫瘍に由来するBRCA1の点変異によりBARD1との結合能が消失することから,BARD1はBRCA1のがん抑制能において重要だと考えられる.また,BARD1のC末端側の領域のBRCTドメインとその周辺にも,乳がんおよび卵巣がんにおいていくつかのミスセンス変異が報告されている.
そこで,筆者らは,BRCA1のもつがん抑制能について明らかにする目的で,プロテオミクス解析によりBARD1のBRCTドメインを含むC末端側の領域に結合する新規のタンパク質を同定し,その機能を解析した.
1.BARD1に結合する新規のタンパク質としてOLA1を同定した
FLAGタグを付加したBARD1のC末端側の断片の発現をテトラサイクリンにより誘導することのできる293細胞株を樹立した.この細胞株を大量に培養し,テトラサイクリンにより処理したのち細胞抽出液を調製し,抗FLAG抗体により免疫沈降した.共沈したタンパク質を質量分析により解析することにより,BARD1のC末端側の領域に結合する新規タンパク質としてOLA1(Obg-like ATPase 1)を同定した.OLA1は396アミノ酸残基からなるタンパク質で,ATPase活性をもつことが知られていた.OLA1のC末端側の断片およびBARD1のC末端側の断片の精製タンパク質を用い解析したところ,OLA1はBARD1のC末端側の領域と直接に結合することが明らかになった.
2.OLA1は中心体および紡錘体極に局在しBRCA1,BARD1,γチューブリンと直接に結合する
OLA1の細胞における局在についてHeLa細胞などを免疫染色して解析した結果,OLA1は間期においては細胞質および中心体,分裂期においては紡錘体極に局在することが明らかになった.また,スクロース密度勾配遠心法を用いてタンパク質を分画すると,OLA1はBRCA1およびBARD1とともに中心体の画分に存在した.BRCA1も中心体とともに紡錘体極に局在することが報告されている.そこで,OLA1とBRCA1との結合について解析したところ,OLA1はBRCA1のN末端側の領域と直接に結合し,中間の領域およびC末端側の領域とは相互作用した.BRCA1の中間部の領域は中心体の主要な構成タンパク質であるγチューブリンと直接に結合することが報告されている4).そこで,精製タンパク質を用いてγチューブリンとOLA1との結合について解析したところ,OLA1とγチューブリンは直接に結合することが明らかになった.BRCA1のN末端側の領域はγチューブリンとは直接には結合しないが,OLA1を介して結合することも明らかになった.これらの結果から,OLA1はBRCA1,BARD1,γチューブリンと直接に結合し,未知のタンパク質Xとともに複合体を形成することが示唆された(図2).
3.OLA1は中心体の複製および中心体に依存性の微小管の重合を制御する
BRCA1の発現を抑制することにより中心体の数が増加し,中心体に依存性の微小管の重合が促進することが報告されている5,6).OLA1の発現を抑制したところ,BRCA1の発現抑制と同様に,中心体の数の増加と中心体に依存性の微小管の重合の促進がみられた.中心体はL字型に配置した母中心小体と娘中心小体,および,その周辺の中心小体周辺物質からなり,微小管形成中心として機能し,細胞周期においてS期に1回だけ複製される.中心体の数の増加の原因としては,細胞質分裂の制御機構の破綻によりS期がくり返されるため,中心体の複製のライセンシング機構の破綻による中心体の過剰な複製,中心体の断片化が考えられ,BRCA1の発現抑制により中心体の過剰な複製および中心体の断片化の起こることが報告されている5,7).中心小体のマーカーとなるセントリンおよび成熟した母中心小体のマーカーであるCep170との二重免疫蛍光染色により,OLA1の発現を抑制したときにも中心体の過剰な複製および中心体の断片化の起こることが明らかになった.
4.乳がん細胞株に由来するOLA1変異体はBRCA1との結合能を消失し中心体の制御に異常をきたす
乳がん細胞株であるHCC1008細胞株にはOLA1のホモ接合性の点変異として168番目のGluのGlnへの変異が報告されている8).このOLA1変異体と,BRCA1のN末端側の領域,BARD1のC末端側の領域,γチューブリンとの結合を解析したところ,BARD1のC末端側の領域とγチューブリンとの直接の結合は保たれていたが,BRCA1のN末端側の領域との直接の結合は消失していた.また,OLA1の発現を抑制した細胞に野生型のOLA1あるいは168番目のGluがGlnに変異したOLA1を発現させたところ,野生型OLA1の導入はOLA1の発現抑制による中心体の数の増加をレスキューしたが,この変異体のOLA1の導入ではレスキューできなかった.一方,この変異体はOLA1の発現抑制により生じる中心体に依存性の微小管の重合の促進はレスキューした.
5.家族性乳がんに由来し中心体の制御に異常をきたすBRCA1変異体はOLA1との結合能が著明に低下する
家族性乳がんの家系に由来する,N末端側の領域である42番目のIleがVlaに変異したBRCA1は,BARD1との結合能,ユビキチンリガーゼ活性,DNA修復能に異常はないが,中心体の数の制御に異常をきたす9,10).この変異をもつBRCA1のN末端側の領域の精製タンパク質は,野生型のBRCA1と比較して,OLA1との直接的な結合能がいちじるしく低下していた.
おわりに
BARD1のC末端側の領域に結合するタンパク質としてOLA1を同定した.OLA1は中心体および紡錘体極に局在し,BARD1にくわえ,BRCA1,γチューブリンと直接に結合することが明らかになった.これまで報告されていたBRCA1の発現抑制と同様に,OLA1の発現抑制によっても中心体の数の増加と中心体に依存性の微小管の重合の促進がみられ,OLA1はBRCA1と同じ経路により中心体の制御に関与することが示唆された.また,乳がん細胞株に由来する168番目のGluがGlnに変異したOLA1ではBRCA1のN末端側の領域との直接の結合能が消失し,中心体の数の制御に異常をきたすことが明らかになった.また,家族性乳がん家系における変異として報告され中心体の数の制御能に異常を来すN末端側の領域である42番目のIleがVlaに変異したBRCA1では,OLA1との結合能がいちじるしく低下することが明らかになった.
中心体の数の増加は細胞分裂において重要な染色体分配に異常をもたらし発がんの原因となる.よって,BRCA1あるいはOLA1のいずれの変異によっても,BRCA1のN末端側の領域とOLA1との直接の結合の消失あるいは減弱によりこれらのタンパク質複合体に異常が生じ,中心体の数の制御に異常をきたし発がんの原因になると考えられた(図2).
これまで,BRCA1のがん抑制能に関してはDNA修復経路における機能が重要と考えられ注目をあつめてきた.しかしながら,近年,同様に遺伝性乳がん・卵巣がん症候群の原因となるBRCA2もまた,中心体の複製において重要なはたらきをすることが明らかになっている.よって,OLA1もまた,遺伝性乳がん・卵巣がん症候群の発がん機構に関与する可能性があると考えられた.この研究では,OLA1の発現抑制の影響について検討したが,OLA1は多くの腫瘍においてもその発現が上昇していることや,乳がん細胞の移動と浸潤を抑制し乳がんの進行にも関与することが示唆されている.今後,OLA1の機能をさらに解析することにより,OLA1の機能の異常と発がんとの関連が明らかになり,さらには,トリプルネガティブ乳がんなど難治性のがんの新しい診断法あるいは治療法の開発にも貢献することが期待される.
文 献
- Miki, Y., Swensen, J., Shattuck-Eidens, D. et al.: A strong candidate for the breast and ovarian cancer susceptibility gene BRCA1. Science, 266, 66-71 (1994)[PubMed]
- Wu, L. C., Wang, Z. W., Tsan, J. T. et al.: Identification of a RING protein that can interact in vivo with the BRCA1 gene product. Nat. Genet., 14, 430-440 (1996)[PubMed]
- Parvin, J. D.: Overview of history and progress in BRCA1 research: the first BRCA1 decade. Cancer Biol. Ther., 3, 505-508 (2004)[PubMed]
- Hsu, L. C., Doan, T. P. & White, R. L.: Identification of a γ-tubulin-binding domain in BRCA1. Cancer Res., 61, 7713-7718 (2001)[PubMed]
- Starita, L. M., Machida, Y., Sankaran, S. et al.: BRCA1-dependent ubiquitination of γ-tubulin regulates centrosome number. Mol. Cell. Biol., 24, 8457-8466 (2004)[PubMed]
- Sankaran, S., Starita, L. M., Groen, A. C. et al.: Centrosomal microtubule nucleation activity is inhibited by BRCA1-dependent ubiquitination. Mol. Cell. Biol., 25, 8656-8668 (2005)[PubMed]
- Ko, M. J., Murata, K., Hwang, D. S. et al.: Inhibition of BRCA1 in breast cell lines causes the centrosome duplication cycle to be disconnected from the cell cycle. Oncogene, 25, 298-303 (2006)[PubMed]
- Sjoblom, T., Jones, S., Wood, L. D. et al.: The consensus coding sequences of human breast and colorectal cancers. Science, 314, 268-274 (2006)[PubMed]
- Kais, Z., Chiba, N., Ishioka, C. et al.: Functional differences among BRCA1 missense mutations in the control of centrosome duplication. Oncogene, 31, 799-804 (2012)[PubMed]
- Ransburgh, D. J., Chiba, N., Ishioka, C. et al.: Identification of breast tumor mutations in BRCA1 that abolish its function in homologous DNA recombination. Cancer Res., 70, 988-995 (2010)[PubMed]
著者プロフィール
略歴:2013年 東北大学大学院生命科学研究科にて博士号取得.
千葉 奈津子(Natsuko Chiba)
東北大学加齢医学研究所 准教授.
© 2013 松澤綾子・千葉奈津子 Licensed under CC 表示 2.1 日本