腸内細菌の産生する酪酸による制御性T細胞の分化の誘導
古澤之裕1・福田真嗣2・長谷耕二1・大野博司3
(1東京大学医科学研究所 国際粘膜ワクチン開発研究センター粘膜バリア学分野,2慶応義塾大学先端生命科学研究所,3理化学研究所統合生命医科学研究センター 粘膜システム研究グループ)
email:古澤之裕
DOI: 10.7875/first.author.2013.167
Commensal microbe-derived butyrate induces the differentiation of colonic regulatory T cells.
Yukihiro Furusawa, Yuuki Obata, Shinji Fukuda, Takaho A. Endo, Gaku Nakato, Daisuke Takahashi, Yumiko Nakanishi, Chikako Uetake, Keiko Kato, Tamotsu Kato, Masumi Takahashi, Noriko N. Fukuda, Shinnosuke Murakami, Eiji Miyauchi, Shingo Hino, Koji Atarashi, Satoshi Onawa, Yumiko Fujimura, Trevor Lockett, Julie M. Clarke, David L. Topping, Masaru Tomita, Shohei Hori, Osamu Ohara, Tatsuya Morita, Haruhiko Koseki, Jun Kikuchi, Kenya Honda, Koji Hase, Hiroshi Ohno
Nature, 504, 446-450 (2013)
腸管には多種多様な細菌が共生し,宿主の消化液では分解できない食物繊維などを腸内発酵により代謝することで,宿主に有用な代謝産物を供給している.ある種の腸内細菌には炎症やアレルギーを抑制する効果のあることが報告されていたが,その分子機構については不明であった.筆者らは,腸内細菌の産生する代謝産物のうち,短鎖脂肪酸のひとつである酪酸が,末梢組織において免疫寛容を担う制御性T細胞の分化を誘導していることを見い出した.酪酸はヒストン脱アセチル化酵素の阻害活性を介し,制御性T細胞のマスター転写因子であるFoxp3の遺伝子プロモーター領域およびエンハンサー領域のヒストンのアセチル化を亢進させることにより,Foxp3の発現を促進した.この作用により,ナイーブT細胞から制御性T細胞への分化が促進されることが判明した.さらに,酪酸で修飾したデンプンを摂取させることにより,マウスの大腸の粘膜固有層における制御性T細胞の割合は増加し,実験的な大腸炎モデルマウスにおいて大腸炎の発症は抑制された.これより,腸内細菌は腸内発酵により酪酸を産生することで,T細胞のエピゲノム状態を変化させて制御性T細胞の分化を誘導し,腸管免疫系の恒常性の維持に貢献することが明らかになった.
ヒトの体表や粘膜には体細胞の総数をはるかにこえる数の共生微生物が定着しており,恒常性の維持において重要な役割をはたしている.われわれヒトを含む動物の腸内には腸内フローラと総称される多種多様な細菌が棲息している.ヒトの腸内フローラは細菌種として1000種以上,その総数は100兆個以上と算出されており,腸管は潜在的な炎症の誘導の場となっている.しかしながら,健常な腸管においては,常在細菌に対する免疫応答と免疫寛容とのバランスにより炎症応答は適切に制御されている.このバランスの破綻は炎症性腸疾患に代表される慢性あるいは再発性の炎症疾患の原因となる.近年,腸内細菌をもたない無菌マウスや,抗生物質の投与により腸内フローラをかく乱したマウスを用いた研究から,腸内常在細菌は免疫系の成熟や機能の維持において必要不可欠とされている1).さらに最近の研究より,クロストリジウム目に属する細菌が腸内細菌に対する免疫寛容をつかさどる制御性T細胞(regulatory T cell:Treg)の分化を誘導することが判明している2).このように,腸管免疫系の恒常性は共生細菌と宿主との相互作用を介して維持されているが,共生細菌による制御性T細胞の分化の誘導の機構は不明であった.この研究では,腸内細菌が産生する代謝産物に着目し,制御性T細胞の分化の誘導能をもつ代謝産物の探索とその分子機構の解明を試みた.
なお,腸内細菌と腸管免疫については,本田 賢也, 領域融合レビュー, 2, e011, 2013 も参照されたい.
腸内フローラは食物繊維などの未消化物を栄養源として発酵分解し,低分子の代謝産物を産生している.これら腸内細菌の代謝産物は,腸上皮細胞のエネルギーとなることや,腸のバリア機能を高めることが知られている3)(新着論文レビュー でも掲載).無菌マウスでは腸内発酵が起こらないため,未消化物の蓄積により盲腸が肥大している.無菌マウスにクロロホルム耐性細菌(大部分が,クロストリジウム目の細菌からなる)を定着させることにより,盲腸の大きさが正常のマウスと同じにまで縮小する事実に着目し,クロストリジウム目細菌が産生する代謝産物が制御性T細胞の誘導になんらかの役割を担うと推測した.
そこで,クロロホルム耐性細菌の定着したマウスに,発酵の基質となる食物繊維を多く含む餌(高繊維食)とほとんど含まない餌(低繊維食)をあたえて一定の期間にわたり飼育したところ,高繊維食をあたえたマウスでは低繊維食をあたえたマウスに比べ,大腸において有意にFoxp3陽性細胞が増加していた.Foxp3陽性の制御性T細胞は,胸腺において分化した制御性T細胞と,末梢組織において分化した制御性T細胞とに大別され,これらは厳密とはいえないものの,細胞の表面マーカーであるNeuropilin1の有無により大まかに分類することができる4).高繊維食をあたえたマウスでは低繊維食をあたえたマウスに比べ,末梢組織において分化した制御性T細胞の割合が増加していた.一方,主として胸腺において分化した制御性T細胞から構成される脾臓の制御性T細胞については,両者の割合に差は認められなかった.以上の結果より,腸内発酵により産生される代謝産物は大腸の局所において,末梢組織において分化した制御性T細胞の誘導に関与していることが示唆された.そこで,メタボロミクスにより高繊維食をあたえたマウスにおいて増加している代謝産物について網羅的に解析した結果,短鎖脂肪酸(酢酸,プロピオン酸,酪酸),および,アミノ酸(ロイシン,イソロイシン,γアミノ酪酸)の増加が検出された.
メタボローム解析により同定された代謝産物が実際に制御性T細胞の分化を誘導するのかどうか調べるため,制御性T細胞の分化が誘導される条件においてナイーブT細胞を培養する際に,培養液にそれぞれの代謝産物を添加した.その結果,酢酸およびアミノ酸は制御性T細胞の分化にまったく影響を及ぼさなかったが,プロピオン酸はわずかに,酪酸は顕著に,制御性T細胞の割合を増加させた.さらに,生体における制御性T細胞の分化の誘導について調べるため,短鎖脂肪酸(酢酸,プロピオン,酪酸)のいずれかひとつをエステル結合させた難消化性のデンプンをマウスに摂取させた.これらの化学修飾デンプンはエステル結合が緩徐に分解されて短鎖脂肪酸を遊離するため,大腸の局所における短鎖脂肪酸の濃度を人為的に高めることができる5)(一方,短鎖脂肪酸を飲水から投与する実験6,7) では,短鎖脂肪酸が大腸に到達するまえに小腸において吸収されてしまうため,腸内細菌による生理的な短鎖脂肪酸の産生の場である大腸の局所における役割は検討できず,さらに,非生理的な高濃度の短鎖脂肪酸が血中に流入してしまう可能性のあることに留意すべきである).酢酸により修飾したデンプンをあたえたマウスでは対照となるマウスに比べ,末梢組織において分化した制御性T細胞の割合に変化はみられなかった.一方で,プロピオン酸により修飾したデンプンをあたえたマウスでは末梢組織において分化した制御性T細胞がわずかに増加し,酪酸により修飾したデンプンをあたえたマウスでは末梢組織において分化した制御性T細胞が有意に増加した.この結果は,in vitroにおける観察の結果と完全に一致するものであり,酪酸がもっとも重要な制御性T細胞の分化誘導因子であることが明らかになった.一方で,酪酸はエフェクターT細胞の分化には影響しなかった.さらに興味深いことに,in vitroにおいて,ナイーブT細胞をTh1細胞あるいはTh17細胞の分化が誘導される条件において培養した場合でも,酪酸はT細胞においてFoxp3の発現を亢進し制御性T細胞の割合を高めることが判明した.すなわち,酪酸はナイーブT細胞から制御性T細胞への分化を選択的に促進することが明らかになった.
短鎖脂肪酸のなかで酪酸はヒストン脱アセチル化酵素に対しもっとも強い阻害活性をもち,プロピオン酸は緩和な阻害活性をもつが,酢酸はほとんど阻害活性を示さない.このように,ヒストン脱アセチル化酵素の阻害活性と制御性T細胞の分化誘導活性には正の相関があったことから,酪酸はT細胞においてヒストンのアセチル化の状態を変化させることにより制御性T細胞の分化の誘導を促進すると示唆された.
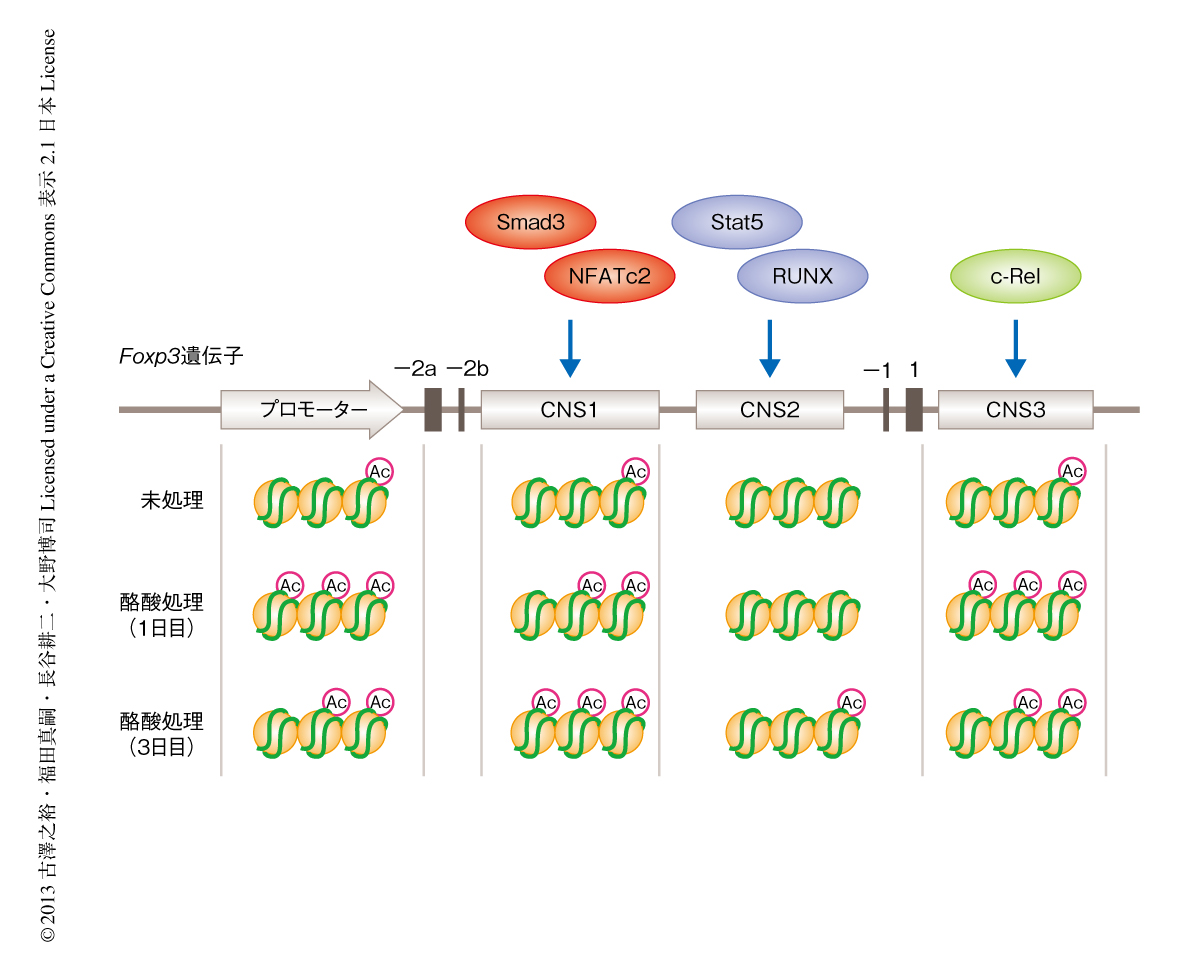
酪酸の標的であるヒストン脱アセチル化酵素は,ヒストンのテイルにおけるリジン残基の脱アセチル化を促進することにより転写を負に制御するコリプレッサーである.そこで,酪酸がヒストン脱アセチル化酵素の阻害作用を介してヒストンのアセチル化にあたえる影響をクロマチン免疫沈降-シークエンシング法により解析した.制御性T細胞の分化を誘導する条件にてナイーブT細胞を培養し,そのとき培養液に酪酸を添加しておくと,24時間以内にFoxp3遺伝子の上流のプロモーター領域におけるヒストンH3のアセチル化が亢進した.このようなエピジェネティックな変化はFoxp3遺伝子の発現の誘導にさきだって観察された.Foxp3遺伝子にはプロモーター領域のほかにも種をこえて高度に保存されているエンハンサー領域としてCNS1,CNS2,CNS3が存在する8).CNS1およびCNS3はde novoにおけるFoxp3の発現の誘導に重要であり,前者には転写因子であるSmad3やNFATc2が,後者にはRelファミリークラスIIタンパク質のひとつであるc-Relが結合する8,9).これらの領域におけるヒストンアセチル化の状態は転写因子の結合に影響する8)(図1).一方,CNS2はCpGアイランドを含み,転写因子であるRUNXおよびSTAT5の結合領域であり,DNAの脱メチル化状態がFoxp3の発現の維持に貢献する10).T細胞を酪酸により処理すると,CNS3においてもFoxp3遺伝子プロモーター領域と同様に24時間以内に顕著なヒストンアセチル化の亢進がみられた.さらに,CNS1に関しても経時的にヒストンアセチル化が増加した(図1).一方,Foxp3の発現を制御する上流の転写因子をコードするStat5遺伝子,Smad3遺伝子,Nfatc2遺伝子,Rel遺伝子(c-Relをコード)や,エフェクターT細胞のマスター転写因子をコードするTbx21遺伝子(T-betをコード),Gata3遺伝子,Rorc遺伝子(RORγtをコード)の遺伝子プロモーター領域のヒストンアセチル化状態については,酪酸の処理による影響は認められなかった.以上の結果より,酪酸はFoxp3遺伝子のプロモーター領域およびエンハンサー領域のヒストンアセチル化を介してFoxp3の発現を誘導し,制御性T細胞の分化を促進すると考えられた.
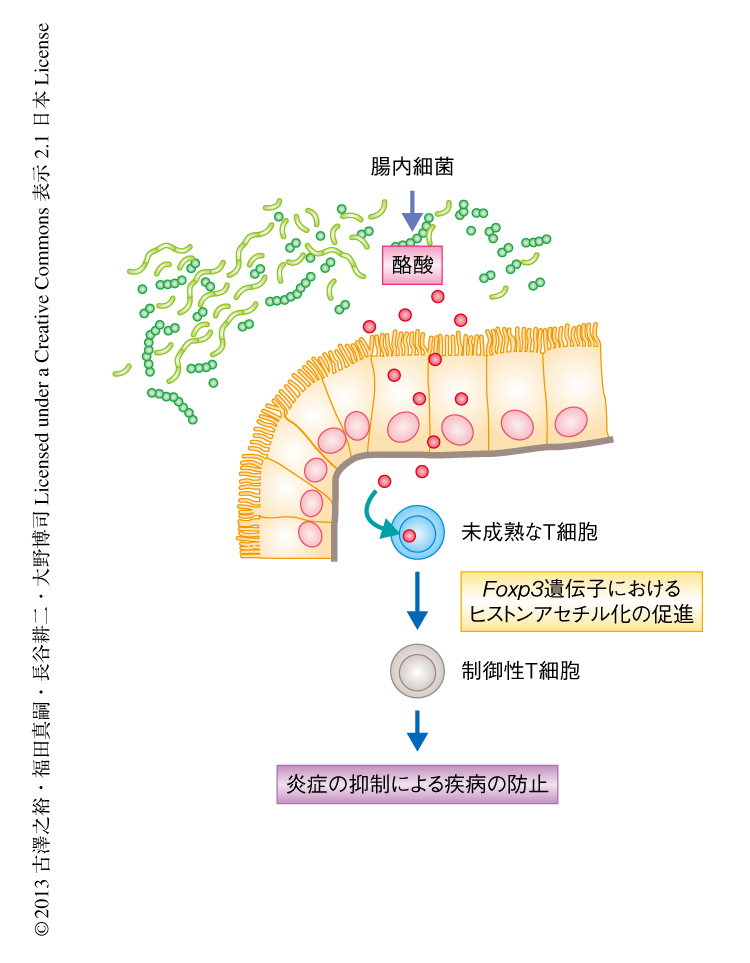
Foxp3は2003年に同定された制御性T細胞のマスター転写因子であるが,厳密には,Foxp3の発現は必ずしもT細胞を制御性T細胞として定義するための必要十分条件ではない11).そこで,酪酸により分化の誘導されたFoxp3陽性細胞は,実際に生体において機能的であるかどうかの検証を試みた.最初に,正常なマウスに酪酸を修飾したデンプンをあたえたときに増加する制御性T細胞は,抑制性サイトカインであるインターロイキン10を産生することがわかった.つぎに,炎症性腸疾患の実験的なモデルマウスとして,CD4陽性CD45RB高発現ナイーブT細胞をRag1ノックアウトマウスに移入することによりヘルパーT細胞を介在する慢性大腸炎モデルマウスを作製し,酪酸により修飾したデンプンを含むあるいは含まない飼料をあたえた.その結果,酪酸により修飾したデンプンをあたえたマウスでは大腸の粘膜固有層における制御性T細胞の割合が増加し,腸炎を発症したときに観察される体重の減少,大腸の粘膜への炎症性の細胞の浸潤,および,腸管壁の肥厚の軽減が認められた.つぎに,Foxp3およびヒトのCD2を発現するレポーターマウス11) に由来するナイーブT細胞を用い同様の大腸炎モデルマウスを作出したのち,抗ヒトCD2抗体を静脈内に投与することにより制御性T細胞を除去したところ,酪酸により修飾したデンプンの摂取による抗炎症作用が完全に消失したことから,酪酸による炎症の抑制効果は制御性T細胞の分化の誘導を介することが確認された.以上の知見より,クロストリジウム目細菌などによる腸内発酵を介し産生される酪酸は,Foxp3遺伝子におけるヒストンのアセチル化を促進することにより機能的な制御性T細胞の分化を誘導し,腸管の免疫恒常性を維持していることが明らかになった(図2).
腸内細菌は代謝産物のひとつとして酪酸を産生することにより,大腸において制御性T細胞の分化を促進することが明らかになった.近年,わが国においても食生活の欧米化にともない腸内環境のバランスのくずれることが炎症性腸疾患の増加の一因と考えられている.実際に,炎症性腸疾患の患者においては酪酸産生細菌が顕著に減少することや12),炎症性腸疾患の症状の緩和のため酪酸の腸への注入あるいは酪酸産生細菌の経口投与が経験的に行われている点から,ヒトにおいても酪酸が腸管免疫系の恒常性の維持に寄与していることが示唆される.酪酸による制御性T細胞の選択的な分化の誘導機構に関しては今後の課題であるものの,この研究の成果は,原因不明の疾患である炎症性腸疾患の病態機構の解明にもつながるものである.
略歴:2012年 富山大学大学院医学薬学教育部博士後期課程 修了,同年より東京大学医科学研究所 特任助教.
福田 真嗣(Shinji Fukuda)
慶応義塾大学先端生命科学研究所 特任准教授.
長谷 耕二(Koji Hase)
東京大学医科学研究所 特任教授.
研究室URL:http://www.ims.u-tokyo.ac.jp/dmb/index.html
大野 博司(Hiroshi Ohno)
理化学研究所統合生命医科学研究所 グループディレクター,横浜市立大学大学院生命医科学研究科 客員教授.
研究室URL:http://leib.rcai.riken.jp/riken/index.html
© 2013 古澤之裕・福田真嗣・長谷耕二・大野博司 Licensed under CC 表示 2.1 日本
(1東京大学医科学研究所 国際粘膜ワクチン開発研究センター粘膜バリア学分野,2慶応義塾大学先端生命科学研究所,3理化学研究所統合生命医科学研究センター 粘膜システム研究グループ)
email:古澤之裕
DOI: 10.7875/first.author.2013.167
Commensal microbe-derived butyrate induces the differentiation of colonic regulatory T cells.
Yukihiro Furusawa, Yuuki Obata, Shinji Fukuda, Takaho A. Endo, Gaku Nakato, Daisuke Takahashi, Yumiko Nakanishi, Chikako Uetake, Keiko Kato, Tamotsu Kato, Masumi Takahashi, Noriko N. Fukuda, Shinnosuke Murakami, Eiji Miyauchi, Shingo Hino, Koji Atarashi, Satoshi Onawa, Yumiko Fujimura, Trevor Lockett, Julie M. Clarke, David L. Topping, Masaru Tomita, Shohei Hori, Osamu Ohara, Tatsuya Morita, Haruhiko Koseki, Jun Kikuchi, Kenya Honda, Koji Hase, Hiroshi Ohno
Nature, 504, 446-450 (2013)
この論文に出現する遺伝子・タンパク質のUniprot ID
ヒストン脱アセチル化酵素, Foxp3(Q99JB6), Neuropilin1(P97333), ヒストンH3, Smad3(Q8BUN5), NFATc2(Q60591), c-Rel(P15307), RUNX(Q01196), STAT5, Stat5, Nfatc2(Q60591), Rel(P15307), Tbx21(Q9JKD8), T-bet(Q9JKD8), Gata3(P23772), Rorc(P51450), RORγt(P51450), サイトカイン, インターロイキン10(P18893), CD4(P06332), CD45RB(P06800), Rag1(P15919), CD2(P06729)
要 約
腸管には多種多様な細菌が共生し,宿主の消化液では分解できない食物繊維などを腸内発酵により代謝することで,宿主に有用な代謝産物を供給している.ある種の腸内細菌には炎症やアレルギーを抑制する効果のあることが報告されていたが,その分子機構については不明であった.筆者らは,腸内細菌の産生する代謝産物のうち,短鎖脂肪酸のひとつである酪酸が,末梢組織において免疫寛容を担う制御性T細胞の分化を誘導していることを見い出した.酪酸はヒストン脱アセチル化酵素の阻害活性を介し,制御性T細胞のマスター転写因子であるFoxp3の遺伝子プロモーター領域およびエンハンサー領域のヒストンのアセチル化を亢進させることにより,Foxp3の発現を促進した.この作用により,ナイーブT細胞から制御性T細胞への分化が促進されることが判明した.さらに,酪酸で修飾したデンプンを摂取させることにより,マウスの大腸の粘膜固有層における制御性T細胞の割合は増加し,実験的な大腸炎モデルマウスにおいて大腸炎の発症は抑制された.これより,腸内細菌は腸内発酵により酪酸を産生することで,T細胞のエピゲノム状態を変化させて制御性T細胞の分化を誘導し,腸管免疫系の恒常性の維持に貢献することが明らかになった.
はじめに
ヒトの体表や粘膜には体細胞の総数をはるかにこえる数の共生微生物が定着しており,恒常性の維持において重要な役割をはたしている.われわれヒトを含む動物の腸内には腸内フローラと総称される多種多様な細菌が棲息している.ヒトの腸内フローラは細菌種として1000種以上,その総数は100兆個以上と算出されており,腸管は潜在的な炎症の誘導の場となっている.しかしながら,健常な腸管においては,常在細菌に対する免疫応答と免疫寛容とのバランスにより炎症応答は適切に制御されている.このバランスの破綻は炎症性腸疾患に代表される慢性あるいは再発性の炎症疾患の原因となる.近年,腸内細菌をもたない無菌マウスや,抗生物質の投与により腸内フローラをかく乱したマウスを用いた研究から,腸内常在細菌は免疫系の成熟や機能の維持において必要不可欠とされている1).さらに最近の研究より,クロストリジウム目に属する細菌が腸内細菌に対する免疫寛容をつかさどる制御性T細胞(regulatory T cell:Treg)の分化を誘導することが判明している2).このように,腸管免疫系の恒常性は共生細菌と宿主との相互作用を介して維持されているが,共生細菌による制御性T細胞の分化の誘導の機構は不明であった.この研究では,腸内細菌が産生する代謝産物に着目し,制御性T細胞の分化の誘導能をもつ代謝産物の探索とその分子機構の解明を試みた.
なお,腸内細菌と腸管免疫については,本田 賢也, 領域融合レビュー, 2, e011, 2013 も参照されたい.
1.腸内発酵により産生される代謝産物の同定
腸内フローラは食物繊維などの未消化物を栄養源として発酵分解し,低分子の代謝産物を産生している.これら腸内細菌の代謝産物は,腸上皮細胞のエネルギーとなることや,腸のバリア機能を高めることが知られている3)(新着論文レビュー でも掲載).無菌マウスでは腸内発酵が起こらないため,未消化物の蓄積により盲腸が肥大している.無菌マウスにクロロホルム耐性細菌(大部分が,クロストリジウム目の細菌からなる)を定着させることにより,盲腸の大きさが正常のマウスと同じにまで縮小する事実に着目し,クロストリジウム目細菌が産生する代謝産物が制御性T細胞の誘導になんらかの役割を担うと推測した.
そこで,クロロホルム耐性細菌の定着したマウスに,発酵の基質となる食物繊維を多く含む餌(高繊維食)とほとんど含まない餌(低繊維食)をあたえて一定の期間にわたり飼育したところ,高繊維食をあたえたマウスでは低繊維食をあたえたマウスに比べ,大腸において有意にFoxp3陽性細胞が増加していた.Foxp3陽性の制御性T細胞は,胸腺において分化した制御性T細胞と,末梢組織において分化した制御性T細胞とに大別され,これらは厳密とはいえないものの,細胞の表面マーカーであるNeuropilin1の有無により大まかに分類することができる4).高繊維食をあたえたマウスでは低繊維食をあたえたマウスに比べ,末梢組織において分化した制御性T細胞の割合が増加していた.一方,主として胸腺において分化した制御性T細胞から構成される脾臓の制御性T細胞については,両者の割合に差は認められなかった.以上の結果より,腸内発酵により産生される代謝産物は大腸の局所において,末梢組織において分化した制御性T細胞の誘導に関与していることが示唆された.そこで,メタボロミクスにより高繊維食をあたえたマウスにおいて増加している代謝産物について網羅的に解析した結果,短鎖脂肪酸(酢酸,プロピオン酸,酪酸),および,アミノ酸(ロイシン,イソロイシン,γアミノ酪酸)の増加が検出された.
2.酪酸による制御性T細胞の分化の誘導
メタボローム解析により同定された代謝産物が実際に制御性T細胞の分化を誘導するのかどうか調べるため,制御性T細胞の分化が誘導される条件においてナイーブT細胞を培養する際に,培養液にそれぞれの代謝産物を添加した.その結果,酢酸およびアミノ酸は制御性T細胞の分化にまったく影響を及ぼさなかったが,プロピオン酸はわずかに,酪酸は顕著に,制御性T細胞の割合を増加させた.さらに,生体における制御性T細胞の分化の誘導について調べるため,短鎖脂肪酸(酢酸,プロピオン,酪酸)のいずれかひとつをエステル結合させた難消化性のデンプンをマウスに摂取させた.これらの化学修飾デンプンはエステル結合が緩徐に分解されて短鎖脂肪酸を遊離するため,大腸の局所における短鎖脂肪酸の濃度を人為的に高めることができる5)(一方,短鎖脂肪酸を飲水から投与する実験6,7) では,短鎖脂肪酸が大腸に到達するまえに小腸において吸収されてしまうため,腸内細菌による生理的な短鎖脂肪酸の産生の場である大腸の局所における役割は検討できず,さらに,非生理的な高濃度の短鎖脂肪酸が血中に流入してしまう可能性のあることに留意すべきである).酢酸により修飾したデンプンをあたえたマウスでは対照となるマウスに比べ,末梢組織において分化した制御性T細胞の割合に変化はみられなかった.一方で,プロピオン酸により修飾したデンプンをあたえたマウスでは末梢組織において分化した制御性T細胞がわずかに増加し,酪酸により修飾したデンプンをあたえたマウスでは末梢組織において分化した制御性T細胞が有意に増加した.この結果は,in vitroにおける観察の結果と完全に一致するものであり,酪酸がもっとも重要な制御性T細胞の分化誘導因子であることが明らかになった.一方で,酪酸はエフェクターT細胞の分化には影響しなかった.さらに興味深いことに,in vitroにおいて,ナイーブT細胞をTh1細胞あるいはTh17細胞の分化が誘導される条件において培養した場合でも,酪酸はT細胞においてFoxp3の発現を亢進し制御性T細胞の割合を高めることが判明した.すなわち,酪酸はナイーブT細胞から制御性T細胞への分化を選択的に促進することが明らかになった.
短鎖脂肪酸のなかで酪酸はヒストン脱アセチル化酵素に対しもっとも強い阻害活性をもち,プロピオン酸は緩和な阻害活性をもつが,酢酸はほとんど阻害活性を示さない.このように,ヒストン脱アセチル化酵素の阻害活性と制御性T細胞の分化誘導活性には正の相関があったことから,酪酸はT細胞においてヒストンのアセチル化の状態を変化させることにより制御性T細胞の分化の誘導を促進すると示唆された.
3.酪酸によるFoxp3遺伝子におけるヒストンの修飾
酪酸の標的であるヒストン脱アセチル化酵素は,ヒストンのテイルにおけるリジン残基の脱アセチル化を促進することにより転写を負に制御するコリプレッサーである.そこで,酪酸がヒストン脱アセチル化酵素の阻害作用を介してヒストンのアセチル化にあたえる影響をクロマチン免疫沈降-シークエンシング法により解析した.制御性T細胞の分化を誘導する条件にてナイーブT細胞を培養し,そのとき培養液に酪酸を添加しておくと,24時間以内にFoxp3遺伝子の上流のプロモーター領域におけるヒストンH3のアセチル化が亢進した.このようなエピジェネティックな変化はFoxp3遺伝子の発現の誘導にさきだって観察された.Foxp3遺伝子にはプロモーター領域のほかにも種をこえて高度に保存されているエンハンサー領域としてCNS1,CNS2,CNS3が存在する8).CNS1およびCNS3はde novoにおけるFoxp3の発現の誘導に重要であり,前者には転写因子であるSmad3やNFATc2が,後者にはRelファミリークラスIIタンパク質のひとつであるc-Relが結合する8,9).これらの領域におけるヒストンアセチル化の状態は転写因子の結合に影響する8)(図1).一方,CNS2はCpGアイランドを含み,転写因子であるRUNXおよびSTAT5の結合領域であり,DNAの脱メチル化状態がFoxp3の発現の維持に貢献する10).T細胞を酪酸により処理すると,CNS3においてもFoxp3遺伝子プロモーター領域と同様に24時間以内に顕著なヒストンアセチル化の亢進がみられた.さらに,CNS1に関しても経時的にヒストンアセチル化が増加した(図1).一方,Foxp3の発現を制御する上流の転写因子をコードするStat5遺伝子,Smad3遺伝子,Nfatc2遺伝子,Rel遺伝子(c-Relをコード)や,エフェクターT細胞のマスター転写因子をコードするTbx21遺伝子(T-betをコード),Gata3遺伝子,Rorc遺伝子(RORγtをコード)の遺伝子プロモーター領域のヒストンアセチル化状態については,酪酸の処理による影響は認められなかった.以上の結果より,酪酸はFoxp3遺伝子のプロモーター領域およびエンハンサー領域のヒストンアセチル化を介してFoxp3の発現を誘導し,制御性T細胞の分化を促進すると考えられた.
4.酪酸による制御性T細胞の誘導を介した大腸炎の抑制
Foxp3は2003年に同定された制御性T細胞のマスター転写因子であるが,厳密には,Foxp3の発現は必ずしもT細胞を制御性T細胞として定義するための必要十分条件ではない11).そこで,酪酸により分化の誘導されたFoxp3陽性細胞は,実際に生体において機能的であるかどうかの検証を試みた.最初に,正常なマウスに酪酸を修飾したデンプンをあたえたときに増加する制御性T細胞は,抑制性サイトカインであるインターロイキン10を産生することがわかった.つぎに,炎症性腸疾患の実験的なモデルマウスとして,CD4陽性CD45RB高発現ナイーブT細胞をRag1ノックアウトマウスに移入することによりヘルパーT細胞を介在する慢性大腸炎モデルマウスを作製し,酪酸により修飾したデンプンを含むあるいは含まない飼料をあたえた.その結果,酪酸により修飾したデンプンをあたえたマウスでは大腸の粘膜固有層における制御性T細胞の割合が増加し,腸炎を発症したときに観察される体重の減少,大腸の粘膜への炎症性の細胞の浸潤,および,腸管壁の肥厚の軽減が認められた.つぎに,Foxp3およびヒトのCD2を発現するレポーターマウス11) に由来するナイーブT細胞を用い同様の大腸炎モデルマウスを作出したのち,抗ヒトCD2抗体を静脈内に投与することにより制御性T細胞を除去したところ,酪酸により修飾したデンプンの摂取による抗炎症作用が完全に消失したことから,酪酸による炎症の抑制効果は制御性T細胞の分化の誘導を介することが確認された.以上の知見より,クロストリジウム目細菌などによる腸内発酵を介し産生される酪酸は,Foxp3遺伝子におけるヒストンのアセチル化を促進することにより機能的な制御性T細胞の分化を誘導し,腸管の免疫恒常性を維持していることが明らかになった(図2).
おわりに
腸内細菌は代謝産物のひとつとして酪酸を産生することにより,大腸において制御性T細胞の分化を促進することが明らかになった.近年,わが国においても食生活の欧米化にともない腸内環境のバランスのくずれることが炎症性腸疾患の増加の一因と考えられている.実際に,炎症性腸疾患の患者においては酪酸産生細菌が顕著に減少することや12),炎症性腸疾患の症状の緩和のため酪酸の腸への注入あるいは酪酸産生細菌の経口投与が経験的に行われている点から,ヒトにおいても酪酸が腸管免疫系の恒常性の維持に寄与していることが示唆される.酪酸による制御性T細胞の選択的な分化の誘導機構に関しては今後の課題であるものの,この研究の成果は,原因不明の疾患である炎症性腸疾患の病態機構の解明にもつながるものである.
文 献
- Chung, H., Pamp, S. J., Hill, J. A. et al.: Gut immune maturation depends on colonization with a host-specific microbiota. Cell, 149, 1578-1593 (2012)[PubMed]
- Atarashi, K., Tanoue, T., Shima, T. et al.: Induction of colonic regulatory T cells by indigenous Clostridium species. Science, 331, 337-341 (2011)[PubMed]
- Fukuda, S., Toh, H., Hase, K. et al.: Bifidobacteria can protect from enteropathogenic infection through production of acetate. Nature, 469, 543-547 (2011)[PubMed] [新着論文レビュー]
- Yadav, M., Louvet, C., Davini, D. et al.: Neuropilin-1 distinguishes natural and inducible regulatory T cells among regulatory T cell subsets in vivo. J. Exp. Med., 209, 1713-1722 (2012)[PubMed]
- Annison, G., Illman, R. J. & Topping, D. L.: Acetylated, propionylated or butyrylated starches raise large bowel short-chain fatty acids preferentially when fed to rats. J. Nutr., 133, 3523-3528 (2003)[PubMed]
- Smith, P. M., Howitt, M. R., Panikov, N. et al.: The microbial metabolites, short-chain fatty acids, regulate colonic Treg cell homeostasis. Science, 341, 569-573 (2013)[PubMed]
- Arpaia, N., Campbell, C., Fan, X. et al.: Metabolites produced by commensal bacteria promote peripheral regulatory T-cell generation. Nature, 504, 451-455 (2013)[PubMed]
- Zheng, Y., Josefowicz, S., Chaudhry, A. et al.: Role of conserved non-coding DNA elements in the Foxp3 gene in regulatory T-cell fate. Nature, 463, 808-812 (2010)[PubMed]
- Tone, Y., Furuuchi, K., Kojima, Y. et al.: Smad3 and NFAT cooperate to induce Foxp3 expression through its enhancer. Nat. Immunol., 9, 194-202 (2007)[PubMed]
- Josefowicz, S. Z., Lu, L. -F. & Rudensky, A. Y.: Regulatory T cells: mechanisms of differentiation and function. Annu. Rev. Immunol., 30, 531-564 (2012)[PubMed]
- Miyao, T., Floess, S., Setoguchi, R. et al.: Plasticity of Foxp3+ T cells reflects promiscuous Foxp3 expression in conventional T cells but not reprogramming of regulatory T cells. Immunity, 36, 262-275 (2012)[PubMed] [新着論文レビュー]
- Frank, D. N., St. Amand, A. L., Feldman, R. A. et al.: Molecular-phylogenetic characterization of microbial community imbalances in human inflammatory bowel diseases. Proc. Natl. Acad. Sci. USA, 104, 13780-13785 (2007)[PubMed]
著者プロフィール
略歴:2012年 富山大学大学院医学薬学教育部博士後期課程 修了,同年より東京大学医科学研究所 特任助教.
福田 真嗣(Shinji Fukuda)
慶応義塾大学先端生命科学研究所 特任准教授.
長谷 耕二(Koji Hase)
東京大学医科学研究所 特任教授.
研究室URL:http://www.ims.u-tokyo.ac.jp/dmb/index.html
大野 博司(Hiroshi Ohno)
理化学研究所統合生命医科学研究所 グループディレクター,横浜市立大学大学院生命医科学研究科 客員教授.
研究室URL:http://leib.rcai.riken.jp/riken/index.html
© 2013 古澤之裕・福田真嗣・長谷耕二・大野博司 Licensed under CC 表示 2.1 日本