ヒストンメチル化酵素であるEHMT1はPRDM16転写複合体を介して褐色脂肪細胞の分化と熱産生能を制御する
大野晴也・篠田幸作・大山夏奈・梶村真吾
(米国California大学San Francisco校UCSF Diabetes Center)
email:梶村真吾
DOI: 10.7875/first.author.2013.159
褐色脂肪組織はエネルギーを熱として消費することにより体温の恒常性に寄与しており,肥満を改善する効果も期待されている.褐色脂肪細胞はPRDM16転写複合体のはたらきを介してMyf5遺伝子を発現する皮筋板に由来する前駆細胞から分化することが報告されていた.しかし,その分化の誘導を決定づける分子スイッチは不明であった.今回,筆者らは,EHMT1がPRDM16転写複合体を構成する必須のヒストンメチル化酵素として,褐色脂肪細胞の分化を制御していることを見い出した.褐色脂肪細胞においてEHMT1が欠損すると,骨格筋細胞への分化を促進する遺伝子のプロモーター領域にあるヒストンH3の9番目のリジン残基が脱メチル化することにより,骨格筋細胞様の細胞への分化が誘導された.一方で,EHMT1はPRDM16転写複合体を安定化させることにより褐色脂肪組織に特異的な熱産生能を亢進した.さらに,マウスの脂肪組織においてEHMT1を欠損させると,全身の熱産生能および基礎代謝量の低下,肥満,インスリン抵抗性の増大が認められた.以上の結果より,EHMT1は褐色脂肪細胞における必須の分化促進タンパク質であり,全身のエネルギー代謝に関与していることが示された.
肥満はエネルギーの総摂取量がエネルギーの総消費量をうわまった結果として起こる.現在までに承認されている抗肥満薬は,食欲を抑制するものや消化管からのエネルギー吸収を抑制するものなど,すべてエネルギーの摂取量を抑えることにより効果を発揮する.しかし,抑うつや消化器症状などの副作用もあり,別の方面からアプローチする薬剤の開発が望まれている.褐色脂肪組織はこの組織に特異的なUCP1(uncoupling protein 1)というタンパク質をつうじエネルギーを熱として放出する機能をもつ.以前は,胎児やげっ歯類などの小動物にのみ存在するとされていたが,最近の研究により,成人にも活性のある褐色脂肪組織が存在することが判明し,糖尿病や肥満症を克服する可能性のある組織として注目をあつめている1,2).
肩甲骨のあいだに存在する褐色脂肪組織にある褐色脂肪細胞は,骨格筋細胞と同じMyf5遺伝子を発現する皮筋板に由来する前駆細胞から分化することが報告された3).この褐色脂肪細胞と骨格筋細胞の2つの系統への分化を決定づけている転写因子として,PRDM16(PR domain-containing protein 16)およびCEB/βが大きな役割をはたすが4),その詳細な分子機構は不明であった5).
PRDM16のもつPRドメインはヒストンメチル化活性をもつSETドメインと高い相同性をもつが6,7),PRDM16それ自体はヒストンメチル化活性をもたない.しかし,細胞から精製されたPRDM16転写複合体はヒストンメチル化活性をもち,この活性はPRDM16転写複合体のもつ褐色脂肪細胞への分化能と強い相関を示していた.一方,ジンクフィンガードメインを欠失したPRDM16から構成された転写複合体ではヒストンメチル化活性ならびに褐色脂肪細胞への分化能が失われていたことから,野生型のPRDM16とは結合するが,ジンクフィンガードメインを欠失したPRDM16とは結合しないPRDM16転写複合体の構成タンパク質を液体クロマトグラフィー-質量分析法により網羅的に探索したところ,唯一のヒストンメチル化酵素としてEHMT1(euchromatic histone-lysine N-methyltransferase 1)が同定された.EHMT1はヒストンH3の9番目のリジン残基をモノメチル化もしくはジメチル化する活性をもち,さらに興味深いことに,ヒトにおいてEHMT1遺伝子の変異による精神発育遅滞などの表現型が報告されており,そのうち40~50%は肥満症を合併していた8,9).PRDM16転写複合体は褐色脂肪組織の分化に大きな役割をはたしているため,EHMT1が褐色脂肪組織の熱産生能,さらには,基礎エネルギー代謝を制御する重要な酵素である可能性が考えられた.
まず,褐色脂肪細胞におけるPRDM16とEHMT1との結合を免疫沈降法により確認した.さらに,PRDM16のジンクフィンガードメインを含む224~454アミノ酸残基および881~1038アミノ酸残基が,in vitro翻訳系により作製したEHMT1と直接に結合していることが確認された.褐色脂肪細胞においてshRNAを用いてEHMT1をノックダウンするとPRDM16転写複合体のヒストンメチル化活性のほとんどが失われたため,EHMT1がPRDM16転写複合体のもつヒストンメチル化活性の大部分を担っていることが考えられた.さらに興味深いことに,EHMT1はマウスにおいてとくに褐色脂肪細胞に多く発現しており,PRDM16の発現パターンとは非常によく一致していた.
EHMT1が褐色脂肪組織の分化にあたえる影響をin vivoにおいて検討した.EHMT1の全身におけるノックアウトマウスは褐色脂肪組織が形成されるまえの胎生9日において致死となる.そこで,Ehmt1flox/floxマウス10) とMyf5遺伝子のプロモーターのもとCreを発現するマウスとを交配することにより,褐色脂肪組織において特異的にEHMT1を欠損するコンディショナルノックアウトマウスを作製し,その表現型について検討した.出生の直後の褐色脂肪組織に特異的なEHMT1ノックアウトマウスにおいて,肩甲骨のあいだの褐色脂肪組織は著明に縮小していた.褐色脂肪組織をヘマトキシリン-エオジン染色して顕微鏡により観察すると,このコンディショナルノックアウトマウスの褐色脂肪細胞では脂肪滴の含有量が減少していた.また,褐色脂肪組織の重量そのものも有意に減少していた.
RNAシークエンス法により,野生型マウスおよび褐色脂肪組織に特異的なEHMT1ノックアウトマウスの褐色脂肪組織における遺伝子発現パターンを網羅的に解析した.遺伝子オントロジー解析により,褐色脂肪組織に特異的なEHMT1ノックアウトマウスの褐色脂肪組織ではMyogenin遺伝子をはじめとする骨格筋細胞に特異的な遺伝子の発現の上昇を認め,逆に,Ucp1遺伝子,Pgc1a遺伝子,Cebpb遺伝子などの褐色脂肪組織に特異的な遺伝子の発現は低下しており,より骨格筋細胞に近い表現型を示していた.さらに重要なことに,遺伝子発現の変化を示した150の遺伝子のうち,78.7%にあたる118の遺伝子は骨格筋細胞の分化,褐色脂肪組織の分化,グルコース代謝や脂肪酸代謝など褐色脂肪組織の機能にかかわる遺伝子であった.以上の結果より,マウスの発生においてEHMT1は褐色脂肪組織と骨格筋細胞との分化スイッチとして重要な役割を担うことが示唆された.
EHMT1が分化スイッチとしてはたらく機序を検討するため,マウスの骨格筋細胞系列であるC2C12細胞にPRDM16を過剰発現させ,さらに,EHMT1のshRNAをコードしたレトロウイルスを発現させることによりEHMT1をノックダウンした.PRDM16の過剰発現により,ミオシン重鎖の免疫染色により評価した骨格筋細胞への分化は強力に抑制されたが,EHMT1をノックダウンすることによりPRDM16に依存した骨格筋細胞への分化の抑制は認められなくなった.遺伝子の発現を検討したところ,Myogenin遺伝子など骨格筋細胞に特異的な遺伝子の発現はPRDM16の過剰発現により抑制されたが,EHMT1のノックダウンによりその抑制は解除された.
EHMT1はヒストンH3の9番目のリジン残基のメチル化酵素であることから,分化スイッチに対しエピジェネティクスな変化が大きく関連している可能性が考えられた.そこで,クロマチン免疫沈降アッセイによりヒストンの修飾を調べたところ,Myogenin遺伝子のプロモーター領域にあるヒストンH3の9番目のリジン残基のジメチル化およびトリメチル化はEHMT1のノックダウンにより減少しており,さらに,EHMT1は直接にこの領域に結合していた.遺伝子の活性化のマーカーであるヒストンH3の9番目のリジン残基および14番目のリジン残基のアセチル化は,EHMT1のノックダウンにより増加していた.
PRDM16を過剰発現したC2C12細胞を脂肪細胞への分化を誘導するような条件にて培養すると褐色脂肪細胞へと分化するが,このPRDM16に依存的な褐色脂肪細胞への分化の誘導はEHMT1のノックダウンにより認められなくなった.褐色脂肪細胞に特異的なUcp1遺伝子,Cidea遺伝子,Elovl3遺伝子などの発現の誘導,および,脂肪細胞に特異的なFabp4遺伝子やAdipoq遺伝子などの発現の誘導は,EHMT1のノックダウンにより抑制された.以上の結果より,EHMT1はPRDM16転写複合体を介してヒストンを修飾し,骨格筋細胞と褐色脂肪細胞との分化を制御するスイッチとしてはたらいていることが示唆された(図1).
褐色脂肪細胞においてEHMT1が熱産生能にあたえる影響について検討するため,マウスの肩甲骨のあいだから採取し不死化した褐色脂肪前駆細胞を作製した11).この細胞を通常の脂肪細胞分化用の培地により分化を誘導すると,Ucp1遺伝子やCidea遺伝子など褐色脂肪細胞に特異的な遺伝子を発現する.この細胞系列にレトロウイルスを用いてEHMT1のshRNAを導入しEHMT1をノックダウンするとUcp1遺伝子などの発現は抑制された.これらの細胞系列の酸素消費量について検討したところ,EHMT1のノックダウンにより総酸素消費量,および,酸化的リン酸化の阻害剤であるオリゴマイシンに不応性の酸素消費量はともに減少し,これは遺伝子発現パターンの変化と一致した.EHMT1を褐色脂肪前駆細胞に過剰に発現させて分化の誘導ののち遺伝子の発現を検討したところ,Ucp1遺伝子,Pgca1遺伝子,Dio2遺伝子,Cidea遺伝子など熱産生能にかかわる褐色脂肪細胞に特異的な遺伝子の発現が上昇した.
EHMT1が褐色脂肪細胞に特異的な遺伝子の発現を上昇させる際にPRDM16が必要であるかどうかを検討した.PRDM16とC/CBP-βを共発現させることにより,マウス胎仔線維芽細胞などの繊維芽細胞を機能的な褐色脂肪細胞へと分化させることができる4).EHMT1のみをマウス胎仔線維芽細胞に過剰に発現させても脂肪細胞への分化は認められなかった.しかし,PRDM16とC/EBP-βにくわえEHMT1を過剰発現することによりUcp1遺伝子,Cidea遺伝子,Cox7a遺伝子,Cox8b遺伝子などの褐色脂肪細胞に特異的な遺伝子の発現が上昇した.以上の結果より,EHMT1はPRDM16を介して褐色脂肪細胞に特異的な遺伝子の発現を正に制御していることが考えられた.
筆者らは以前に,PRDM16の安定性が褐色脂肪細胞の分化に大きくかかわっていることを報告していたため12),今回も,PRDM16の安定性に着目してさらなる検討をくわえた.シクロヘキシミドを添加することによりPRDM16の安定性について検討したところ,EHMT1を共発現させた場合にPRDM16の分解は抑制されていた.この分解の抑制はSET活性部位を変異させてヒストンメチル化活性を失活させたEHMT1変異体においても認められたため,この安定性の増加がEHMT1とPRDM16との結合そのものによりもたらされている可能性が考えられた.
in vivoにおいてEHMT1が反応性の熱産生能にあたえる役割について検討した.さきに述べた褐色脂肪組織に特異的なEHMT1ノックアウトマウスは,Myf5遺伝子のプロモーターは熱産生に非常に重要な役割をはたす骨格筋細胞においても機能しているため,全身の代謝の状態を評価するには不適切なモデルであったことから,新たに,Ehmt1flox/floxマウスをアディポネクチン遺伝子のプロモーターのもとCreを発現するマウスと交配することにより,脂肪細胞において特異的にEHMT1を欠損するコンディショナルノックアウトマウスを作製し,その表現型を検討した.アディポネクチンは褐色脂肪細胞にも白色脂肪細胞にも同様に発現しているが,EHMT1の発現は褐色脂肪組織に多いため,とくに褐色脂肪細胞におけるEHMT1ノックアウトの効果を検討することができる.このコンディショナルノックアウトマウスに対し4℃の環境における寒冷刺激試験を行うと,5時間後には直腸温が30℃近くまですみやかに低下したのに対し,野生型マウスは36℃以上の直腸温を保つことができた.以上の結果より,in vivoにおいてもEHMT1は褐色脂肪組織の熱産生能の保持に必要であると考えられた.
褐色脂肪組織における熱産生能は全身の基礎代謝に大きく寄与している13).脂肪細胞に特異的なEHMT1ノックアウトマウスにおいて,寒冷刺激反応において必要とされるβ3アドレナリン受容体シグナル経路を活性化することにより基礎代謝量を検討した.β3アドレナリン受容体のアゴニストであるCL316,243を投与すると野生型マウスでは酸素消費量がすみやかに上昇するが,脂肪細胞に特異的なEHMT1ノックアウトノックアウトマウスではこの反応は認められなかった.また,脂肪細胞に特異的なEHMT1ノックアウトマウスの血清において遊離の脂肪酸の濃度が上昇しており,これらの所見は,褐色脂肪組織は熱産生の過程で遊離の脂肪酸を大量に消費し,褐色脂肪組織におけるβ酸化能の障害が血清に遊離の脂肪酸の濃度を上昇させるという既報とよく一致していた14).実際に,脂肪細胞に特異的なEHMT1ノックアウトマウスの褐色脂肪組織における脂肪酸の酸化能は,基礎状態においてもCL316,243による刺激ののちに低下していた.また,褐色脂肪組織への脂肪酸の取り込み自体もこのコンディショナルノックアウトマウスでは低下していた.以上より,脂肪細胞に特異的なEHMT1ノックアウトマウスにおける血清に遊離の脂肪酸の濃度の上昇は,褐色脂肪細胞における遊離の脂肪酸の代謝不全によるものと考えられた.
褐色脂肪組織におけるEHMT1の欠損が,食事により誘導される肥満にあたえる影響について検討した.UCP1ノックアウトマウスは室温ではなく温熱的中性域(29~30℃)で飼育された場合のみ肥満の表現型を示すことが報告されていたため15,16),温熱的中性域環境において高脂肪食の負荷を行ったところ,脂肪細胞に特異的なEHMT1ノックアウトマウスは野生型マウスに比べ大きな体重の増加を示した.食事の摂取量には変化を認めなかった.また,このコンディショナルノックアウトマウスは野生型マウスに比べ褐色脂肪組織重量も白色脂肪組織重量も大きくなり,ヘマトキシリン-エオジン染色により評価した脂肪滴も大きくなっていた.
褐色脂肪組織におけるEHMT1の欠損が全身の糖代謝にあたえる影響を検討するため,グルコース負荷試験およびインスリン負荷試験を行った.グルコース負荷試験では脂肪細胞に特異的なEHMT1ノックアウトマウスにおいてより血糖値が上昇しており,インスリン負荷試験では脂肪細胞に特異的なEHMT1ノックアウトマウスにおいてインスリンへの反応の低下が認められた.以上の結果と一致して,血中のインスリン値はこのコンディショナルノックアウトマウスにおいて上昇しており,インスリン抵抗性の上昇が示唆された.高脂肪食を負荷したのちの肝臓をヘマトキシリン-エオジン染色により観察したところ,脂肪細胞に特異的なEHMT1ノックアウトマウスにおいてより多くの脂肪滴の沈着および腫大が認められた.また,中性脂肪の含有量は脂肪細胞に特異的なEHMT1ノックアウトマウスの肝臓においてより多かった.肝臓におけるインスリンシグナルの程度を検討すると,インスリンを注射したのちのシグナルの活性化を表わすAktのリン酸化は,脂肪細胞に特異的なEHMT1ノックアウトマウスにおいて低下していた.以上の結果より,脂肪細胞におけるEHMT1の欠損が,肥満,インスリン抵抗性,脂肪肝をひき起こすことが示された.興味深いことに,最近,褐色脂肪細胞の移植により糖尿病マウスのインスリン感受性が改善することも報告されており17),褐色脂肪細胞が全身の糖代謝にも大きく影響をあたえている可能性が考えられた.
褐色脂肪細胞の分化の誘導における分化スイッチとして,ヒストンメチル化酵素であるEHMT1を新規に同定した(図2).EHMT1の欠損により褐色脂肪組織の機能不全が生じた.また,この褐色脂肪細胞に特異的なEHMT1ノックアウトマウスにおいて耐糖能の異常が出現しており,褐色脂肪組織と全身の糖制御機構との深い関係性も示された.褐色脂肪細胞の機能の回復および活性化により,肥満症だけでなく,耐糖能異常の改善により糖尿病の治療にも新たな選択肢がくわわる可能性がある.
略歴:2011年 広島大学大学院医歯薬学総合研究科 修了,同年 米国California大学San Francisco校Postdoc Fellowを経て,2013年より広島大学病院 医科診療医.
研究テーマ:褐色脂肪細胞と糖代謝とのかかわり.
篠田 幸作(Kosaku Shinoda)
米国California大学San Francisco校Postdoc Fellow.
大山 夏奈(Kana Ohyama)
米国California大学San Francisco校Specialist.
梶村 真吾(Shingo Kajimura)
米国California大学San Francisco校Assistant Professor.
研究室URL:http://kajimuralab.ucsf.edu/
© 2013 大野晴也・篠田幸作・大山加奈・梶村真吾 Licensed under CC 表示 2.1 日本
(米国California大学San Francisco校UCSF Diabetes Center)
email:梶村真吾
DOI: 10.7875/first.author.2013.159
EHMT1 controls brown adipose cell fate and thermogenesis through the PRDM16 complex.
Haruya Ohno, Kosaku Shinoda, Kana Ohyama, Louis Z. Sharp, Shingo Kajimura
Nature, 504, 163-167 (2013)
Haruya Ohno, Kosaku Shinoda, Kana Ohyama, Louis Z. Sharp, Shingo Kajimura
Nature, 504, 163-167 (2013)
要 約
褐色脂肪組織はエネルギーを熱として消費することにより体温の恒常性に寄与しており,肥満を改善する効果も期待されている.褐色脂肪細胞はPRDM16転写複合体のはたらきを介してMyf5遺伝子を発現する皮筋板に由来する前駆細胞から分化することが報告されていた.しかし,その分化の誘導を決定づける分子スイッチは不明であった.今回,筆者らは,EHMT1がPRDM16転写複合体を構成する必須のヒストンメチル化酵素として,褐色脂肪細胞の分化を制御していることを見い出した.褐色脂肪細胞においてEHMT1が欠損すると,骨格筋細胞への分化を促進する遺伝子のプロモーター領域にあるヒストンH3の9番目のリジン残基が脱メチル化することにより,骨格筋細胞様の細胞への分化が誘導された.一方で,EHMT1はPRDM16転写複合体を安定化させることにより褐色脂肪組織に特異的な熱産生能を亢進した.さらに,マウスの脂肪組織においてEHMT1を欠損させると,全身の熱産生能および基礎代謝量の低下,肥満,インスリン抵抗性の増大が認められた.以上の結果より,EHMT1は褐色脂肪細胞における必須の分化促進タンパク質であり,全身のエネルギー代謝に関与していることが示された.
はじめに
肥満はエネルギーの総摂取量がエネルギーの総消費量をうわまった結果として起こる.現在までに承認されている抗肥満薬は,食欲を抑制するものや消化管からのエネルギー吸収を抑制するものなど,すべてエネルギーの摂取量を抑えることにより効果を発揮する.しかし,抑うつや消化器症状などの副作用もあり,別の方面からアプローチする薬剤の開発が望まれている.褐色脂肪組織はこの組織に特異的なUCP1(uncoupling protein 1)というタンパク質をつうじエネルギーを熱として放出する機能をもつ.以前は,胎児やげっ歯類などの小動物にのみ存在するとされていたが,最近の研究により,成人にも活性のある褐色脂肪組織が存在することが判明し,糖尿病や肥満症を克服する可能性のある組織として注目をあつめている1,2).
肩甲骨のあいだに存在する褐色脂肪組織にある褐色脂肪細胞は,骨格筋細胞と同じMyf5遺伝子を発現する皮筋板に由来する前駆細胞から分化することが報告された3).この褐色脂肪細胞と骨格筋細胞の2つの系統への分化を決定づけている転写因子として,PRDM16(PR domain-containing protein 16)およびCEB/βが大きな役割をはたすが4),その詳細な分子機構は不明であった5).
1.PRDM16と転写因子複合体を形成するヒストンメチル化酵素EHMT1の同定
PRDM16のもつPRドメインはヒストンメチル化活性をもつSETドメインと高い相同性をもつが6,7),PRDM16それ自体はヒストンメチル化活性をもたない.しかし,細胞から精製されたPRDM16転写複合体はヒストンメチル化活性をもち,この活性はPRDM16転写複合体のもつ褐色脂肪細胞への分化能と強い相関を示していた.一方,ジンクフィンガードメインを欠失したPRDM16から構成された転写複合体ではヒストンメチル化活性ならびに褐色脂肪細胞への分化能が失われていたことから,野生型のPRDM16とは結合するが,ジンクフィンガードメインを欠失したPRDM16とは結合しないPRDM16転写複合体の構成タンパク質を液体クロマトグラフィー-質量分析法により網羅的に探索したところ,唯一のヒストンメチル化酵素としてEHMT1(euchromatic histone-lysine N-methyltransferase 1)が同定された.EHMT1はヒストンH3の9番目のリジン残基をモノメチル化もしくはジメチル化する活性をもち,さらに興味深いことに,ヒトにおいてEHMT1遺伝子の変異による精神発育遅滞などの表現型が報告されており,そのうち40~50%は肥満症を合併していた8,9).PRDM16転写複合体は褐色脂肪組織の分化に大きな役割をはたしているため,EHMT1が褐色脂肪組織の熱産生能,さらには,基礎エネルギー代謝を制御する重要な酵素である可能性が考えられた.
まず,褐色脂肪細胞におけるPRDM16とEHMT1との結合を免疫沈降法により確認した.さらに,PRDM16のジンクフィンガードメインを含む224~454アミノ酸残基および881~1038アミノ酸残基が,in vitro翻訳系により作製したEHMT1と直接に結合していることが確認された.褐色脂肪細胞においてshRNAを用いてEHMT1をノックダウンするとPRDM16転写複合体のヒストンメチル化活性のほとんどが失われたため,EHMT1がPRDM16転写複合体のもつヒストンメチル化活性の大部分を担っていることが考えられた.さらに興味深いことに,EHMT1はマウスにおいてとくに褐色脂肪細胞に多く発現しており,PRDM16の発現パターンとは非常によく一致していた.
2.EHMT1は骨格筋細胞と褐色脂肪細胞との分化スイッチとしてはたらく
EHMT1が褐色脂肪組織の分化にあたえる影響をin vivoにおいて検討した.EHMT1の全身におけるノックアウトマウスは褐色脂肪組織が形成されるまえの胎生9日において致死となる.そこで,Ehmt1flox/floxマウス10) とMyf5遺伝子のプロモーターのもとCreを発現するマウスとを交配することにより,褐色脂肪組織において特異的にEHMT1を欠損するコンディショナルノックアウトマウスを作製し,その表現型について検討した.出生の直後の褐色脂肪組織に特異的なEHMT1ノックアウトマウスにおいて,肩甲骨のあいだの褐色脂肪組織は著明に縮小していた.褐色脂肪組織をヘマトキシリン-エオジン染色して顕微鏡により観察すると,このコンディショナルノックアウトマウスの褐色脂肪細胞では脂肪滴の含有量が減少していた.また,褐色脂肪組織の重量そのものも有意に減少していた.
RNAシークエンス法により,野生型マウスおよび褐色脂肪組織に特異的なEHMT1ノックアウトマウスの褐色脂肪組織における遺伝子発現パターンを網羅的に解析した.遺伝子オントロジー解析により,褐色脂肪組織に特異的なEHMT1ノックアウトマウスの褐色脂肪組織ではMyogenin遺伝子をはじめとする骨格筋細胞に特異的な遺伝子の発現の上昇を認め,逆に,Ucp1遺伝子,Pgc1a遺伝子,Cebpb遺伝子などの褐色脂肪組織に特異的な遺伝子の発現は低下しており,より骨格筋細胞に近い表現型を示していた.さらに重要なことに,遺伝子発現の変化を示した150の遺伝子のうち,78.7%にあたる118の遺伝子は骨格筋細胞の分化,褐色脂肪組織の分化,グルコース代謝や脂肪酸代謝など褐色脂肪組織の機能にかかわる遺伝子であった.以上の結果より,マウスの発生においてEHMT1は褐色脂肪組織と骨格筋細胞との分化スイッチとして重要な役割を担うことが示唆された.
EHMT1が分化スイッチとしてはたらく機序を検討するため,マウスの骨格筋細胞系列であるC2C12細胞にPRDM16を過剰発現させ,さらに,EHMT1のshRNAをコードしたレトロウイルスを発現させることによりEHMT1をノックダウンした.PRDM16の過剰発現により,ミオシン重鎖の免疫染色により評価した骨格筋細胞への分化は強力に抑制されたが,EHMT1をノックダウンすることによりPRDM16に依存した骨格筋細胞への分化の抑制は認められなくなった.遺伝子の発現を検討したところ,Myogenin遺伝子など骨格筋細胞に特異的な遺伝子の発現はPRDM16の過剰発現により抑制されたが,EHMT1のノックダウンによりその抑制は解除された.
EHMT1はヒストンH3の9番目のリジン残基のメチル化酵素であることから,分化スイッチに対しエピジェネティクスな変化が大きく関連している可能性が考えられた.そこで,クロマチン免疫沈降アッセイによりヒストンの修飾を調べたところ,Myogenin遺伝子のプロモーター領域にあるヒストンH3の9番目のリジン残基のジメチル化およびトリメチル化はEHMT1のノックダウンにより減少しており,さらに,EHMT1は直接にこの領域に結合していた.遺伝子の活性化のマーカーであるヒストンH3の9番目のリジン残基および14番目のリジン残基のアセチル化は,EHMT1のノックダウンにより増加していた.
PRDM16を過剰発現したC2C12細胞を脂肪細胞への分化を誘導するような条件にて培養すると褐色脂肪細胞へと分化するが,このPRDM16に依存的な褐色脂肪細胞への分化の誘導はEHMT1のノックダウンにより認められなくなった.褐色脂肪細胞に特異的なUcp1遺伝子,Cidea遺伝子,Elovl3遺伝子などの発現の誘導,および,脂肪細胞に特異的なFabp4遺伝子やAdipoq遺伝子などの発現の誘導は,EHMT1のノックダウンにより抑制された.以上の結果より,EHMT1はPRDM16転写複合体を介してヒストンを修飾し,骨格筋細胞と褐色脂肪細胞との分化を制御するスイッチとしてはたらいていることが示唆された(図1).
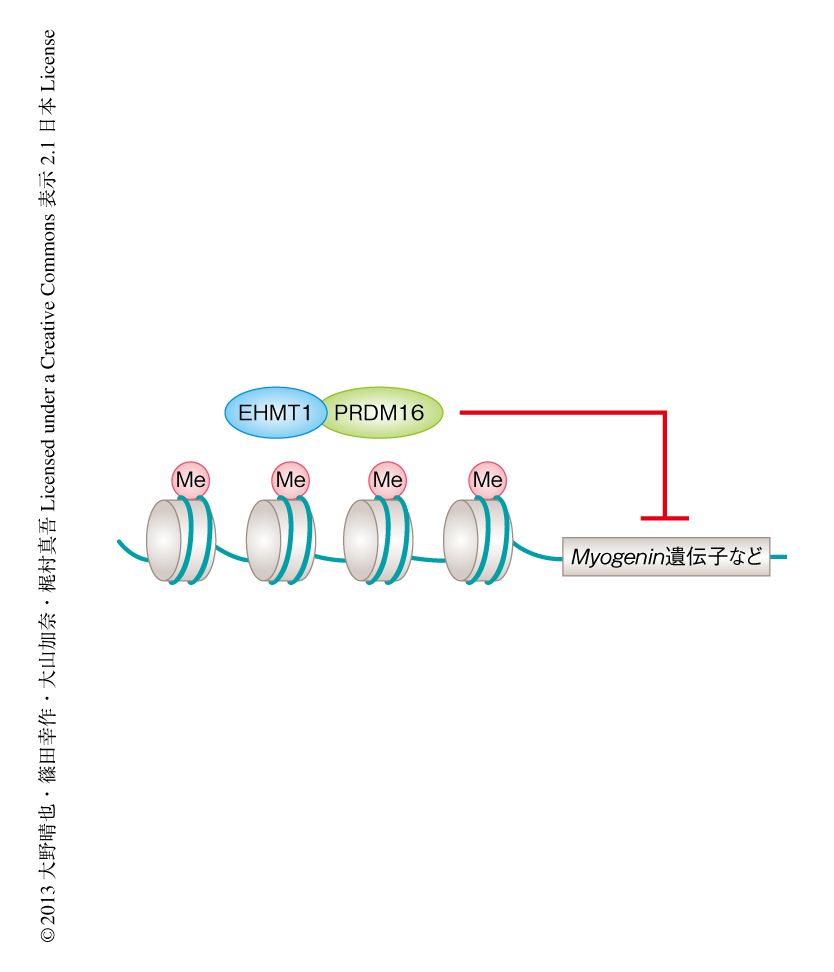
図1 EHMT1はPRDM16転写複合体を介して骨格筋細胞と褐色脂肪細胞との分化スイッチとしてはたらく
PRDM16転写複合体の構成タンパク質のひとつであるEHMT1は,ヒストンH3の9番目のリジン残基のメチル化(Me)により,Myogenin遺伝子などの骨格筋細胞への分化にはたらく遺伝子の発現を抑制する.
[Download]
PRDM16転写複合体の構成タンパク質のひとつであるEHMT1は,ヒストンH3の9番目のリジン残基のメチル化(Me)により,Myogenin遺伝子などの骨格筋細胞への分化にはたらく遺伝子の発現を抑制する.
[Download]
3.EHMT1はPRDM16を介して褐色脂肪細胞における熱産生能を制御する
褐色脂肪細胞においてEHMT1が熱産生能にあたえる影響について検討するため,マウスの肩甲骨のあいだから採取し不死化した褐色脂肪前駆細胞を作製した11).この細胞を通常の脂肪細胞分化用の培地により分化を誘導すると,Ucp1遺伝子やCidea遺伝子など褐色脂肪細胞に特異的な遺伝子を発現する.この細胞系列にレトロウイルスを用いてEHMT1のshRNAを導入しEHMT1をノックダウンするとUcp1遺伝子などの発現は抑制された.これらの細胞系列の酸素消費量について検討したところ,EHMT1のノックダウンにより総酸素消費量,および,酸化的リン酸化の阻害剤であるオリゴマイシンに不応性の酸素消費量はともに減少し,これは遺伝子発現パターンの変化と一致した.EHMT1を褐色脂肪前駆細胞に過剰に発現させて分化の誘導ののち遺伝子の発現を検討したところ,Ucp1遺伝子,Pgca1遺伝子,Dio2遺伝子,Cidea遺伝子など熱産生能にかかわる褐色脂肪細胞に特異的な遺伝子の発現が上昇した.
EHMT1が褐色脂肪細胞に特異的な遺伝子の発現を上昇させる際にPRDM16が必要であるかどうかを検討した.PRDM16とC/CBP-βを共発現させることにより,マウス胎仔線維芽細胞などの繊維芽細胞を機能的な褐色脂肪細胞へと分化させることができる4).EHMT1のみをマウス胎仔線維芽細胞に過剰に発現させても脂肪細胞への分化は認められなかった.しかし,PRDM16とC/EBP-βにくわえEHMT1を過剰発現することによりUcp1遺伝子,Cidea遺伝子,Cox7a遺伝子,Cox8b遺伝子などの褐色脂肪細胞に特異的な遺伝子の発現が上昇した.以上の結果より,EHMT1はPRDM16を介して褐色脂肪細胞に特異的な遺伝子の発現を正に制御していることが考えられた.
筆者らは以前に,PRDM16の安定性が褐色脂肪細胞の分化に大きくかかわっていることを報告していたため12),今回も,PRDM16の安定性に着目してさらなる検討をくわえた.シクロヘキシミドを添加することによりPRDM16の安定性について検討したところ,EHMT1を共発現させた場合にPRDM16の分解は抑制されていた.この分解の抑制はSET活性部位を変異させてヒストンメチル化活性を失活させたEHMT1変異体においても認められたため,この安定性の増加がEHMT1とPRDM16との結合そのものによりもたらされている可能性が考えられた.
in vivoにおいてEHMT1が反応性の熱産生能にあたえる役割について検討した.さきに述べた褐色脂肪組織に特異的なEHMT1ノックアウトマウスは,Myf5遺伝子のプロモーターは熱産生に非常に重要な役割をはたす骨格筋細胞においても機能しているため,全身の代謝の状態を評価するには不適切なモデルであったことから,新たに,Ehmt1flox/floxマウスをアディポネクチン遺伝子のプロモーターのもとCreを発現するマウスと交配することにより,脂肪細胞において特異的にEHMT1を欠損するコンディショナルノックアウトマウスを作製し,その表現型を検討した.アディポネクチンは褐色脂肪細胞にも白色脂肪細胞にも同様に発現しているが,EHMT1の発現は褐色脂肪組織に多いため,とくに褐色脂肪細胞におけるEHMT1ノックアウトの効果を検討することができる.このコンディショナルノックアウトマウスに対し4℃の環境における寒冷刺激試験を行うと,5時間後には直腸温が30℃近くまですみやかに低下したのに対し,野生型マウスは36℃以上の直腸温を保つことができた.以上の結果より,in vivoにおいてもEHMT1は褐色脂肪組織の熱産生能の保持に必要であると考えられた.
4.褐色脂肪組織におけるEHMT1の欠損は肥満,インスリン抵抗性,脂肪肝をひき起こす
褐色脂肪組織における熱産生能は全身の基礎代謝に大きく寄与している13).脂肪細胞に特異的なEHMT1ノックアウトマウスにおいて,寒冷刺激反応において必要とされるβ3アドレナリン受容体シグナル経路を活性化することにより基礎代謝量を検討した.β3アドレナリン受容体のアゴニストであるCL316,243を投与すると野生型マウスでは酸素消費量がすみやかに上昇するが,脂肪細胞に特異的なEHMT1ノックアウトノックアウトマウスではこの反応は認められなかった.また,脂肪細胞に特異的なEHMT1ノックアウトマウスの血清において遊離の脂肪酸の濃度が上昇しており,これらの所見は,褐色脂肪組織は熱産生の過程で遊離の脂肪酸を大量に消費し,褐色脂肪組織におけるβ酸化能の障害が血清に遊離の脂肪酸の濃度を上昇させるという既報とよく一致していた14).実際に,脂肪細胞に特異的なEHMT1ノックアウトマウスの褐色脂肪組織における脂肪酸の酸化能は,基礎状態においてもCL316,243による刺激ののちに低下していた.また,褐色脂肪組織への脂肪酸の取り込み自体もこのコンディショナルノックアウトマウスでは低下していた.以上より,脂肪細胞に特異的なEHMT1ノックアウトマウスにおける血清に遊離の脂肪酸の濃度の上昇は,褐色脂肪細胞における遊離の脂肪酸の代謝不全によるものと考えられた.
褐色脂肪組織におけるEHMT1の欠損が,食事により誘導される肥満にあたえる影響について検討した.UCP1ノックアウトマウスは室温ではなく温熱的中性域(29~30℃)で飼育された場合のみ肥満の表現型を示すことが報告されていたため15,16),温熱的中性域環境において高脂肪食の負荷を行ったところ,脂肪細胞に特異的なEHMT1ノックアウトマウスは野生型マウスに比べ大きな体重の増加を示した.食事の摂取量には変化を認めなかった.また,このコンディショナルノックアウトマウスは野生型マウスに比べ褐色脂肪組織重量も白色脂肪組織重量も大きくなり,ヘマトキシリン-エオジン染色により評価した脂肪滴も大きくなっていた.
褐色脂肪組織におけるEHMT1の欠損が全身の糖代謝にあたえる影響を検討するため,グルコース負荷試験およびインスリン負荷試験を行った.グルコース負荷試験では脂肪細胞に特異的なEHMT1ノックアウトマウスにおいてより血糖値が上昇しており,インスリン負荷試験では脂肪細胞に特異的なEHMT1ノックアウトマウスにおいてインスリンへの反応の低下が認められた.以上の結果と一致して,血中のインスリン値はこのコンディショナルノックアウトマウスにおいて上昇しており,インスリン抵抗性の上昇が示唆された.高脂肪食を負荷したのちの肝臓をヘマトキシリン-エオジン染色により観察したところ,脂肪細胞に特異的なEHMT1ノックアウトマウスにおいてより多くの脂肪滴の沈着および腫大が認められた.また,中性脂肪の含有量は脂肪細胞に特異的なEHMT1ノックアウトマウスの肝臓においてより多かった.肝臓におけるインスリンシグナルの程度を検討すると,インスリンを注射したのちのシグナルの活性化を表わすAktのリン酸化は,脂肪細胞に特異的なEHMT1ノックアウトマウスにおいて低下していた.以上の結果より,脂肪細胞におけるEHMT1の欠損が,肥満,インスリン抵抗性,脂肪肝をひき起こすことが示された.興味深いことに,最近,褐色脂肪細胞の移植により糖尿病マウスのインスリン感受性が改善することも報告されており17),褐色脂肪細胞が全身の糖代謝にも大きく影響をあたえている可能性が考えられた.
おわりに
褐色脂肪細胞の分化の誘導における分化スイッチとして,ヒストンメチル化酵素であるEHMT1を新規に同定した(図2).EHMT1の欠損により褐色脂肪組織の機能不全が生じた.また,この褐色脂肪細胞に特異的なEHMT1ノックアウトマウスにおいて耐糖能の異常が出現しており,褐色脂肪組織と全身の糖制御機構との深い関係性も示された.褐色脂肪細胞の機能の回復および活性化により,肥満症だけでなく,耐糖能異常の改善により糖尿病の治療にも新たな選択肢がくわわる可能性がある.
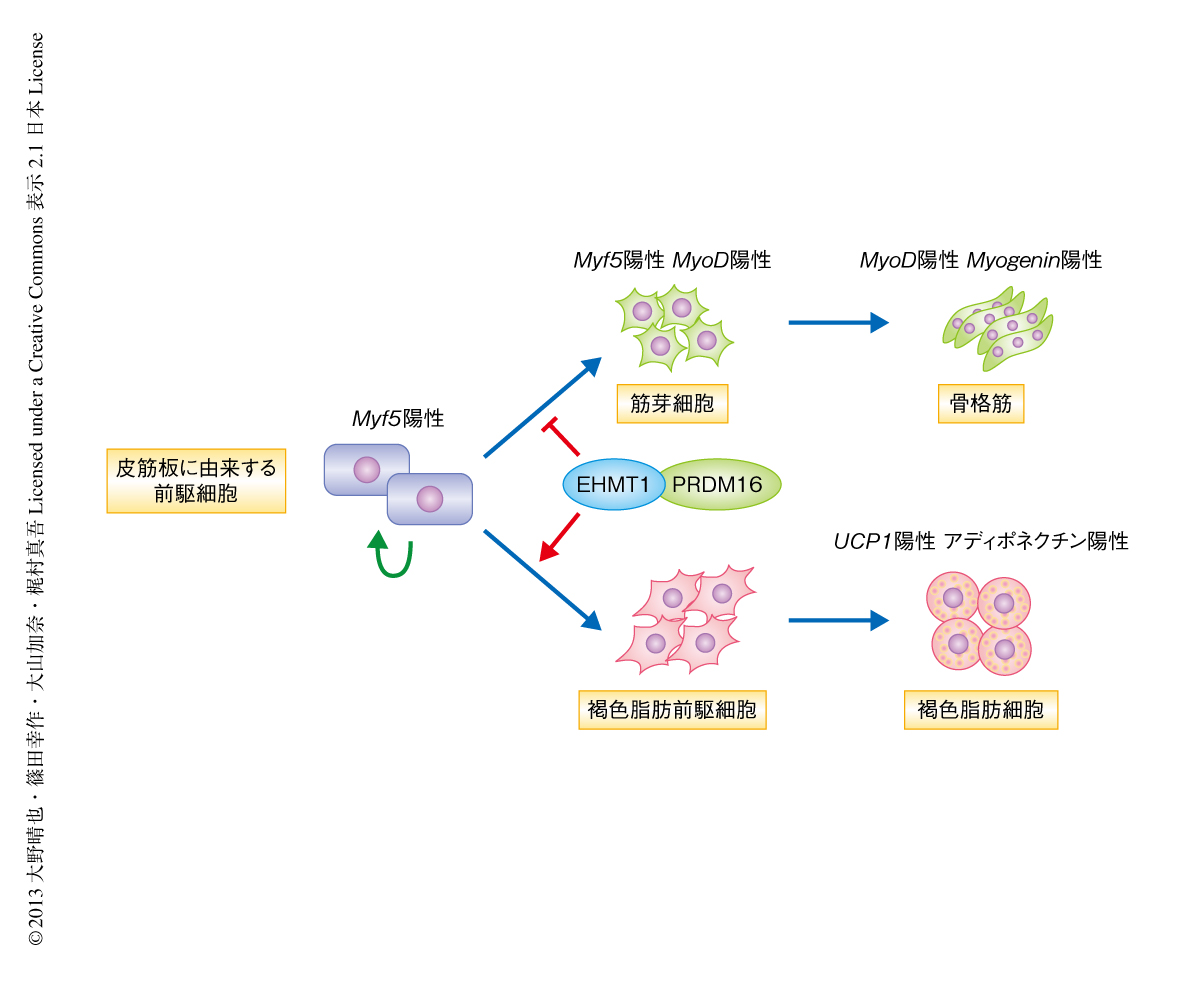
図2 PRDM16転写複合体に含まれるヒストンメチル化酵素EHMT1は褐色脂肪細胞への分化の誘導を決定づける
褐色脂肪細胞は骨格筋細胞と同じMyf5遺伝子を発現する前駆細胞より分化し,EHMT1が褐色脂肪細胞への分化の誘導を決定づけている.
[Download]
褐色脂肪細胞は骨格筋細胞と同じMyf5遺伝子を発現する前駆細胞より分化し,EHMT1が褐色脂肪細胞への分化の誘導を決定づけている.
[Download]
文 献
- Nedergaard, J., Bengtsson, T. & Cannon, B.: Unexpected evidence for active brown adipose tissue in adult humans. Am. J. Physiol., 293, E444-E452 (2007)[PubMed]
- van Marken Lichtenbelt, W. D., Vanhommerig, J. W., Smulders, N. M. et al.: Cold-activated brown adipose tissue in healthy men. New Engl. J. Med., 360, 1500-1508 (2009)[PubMed]
- Seale, P., Bjork, B., Yang, W. et al.: PRDM16 controls a brown fat/skeletal muscle switch. Nature, 454, 961-967 (2008)[PubMed]
- Kajimura, S., Seale, P., Kubota, K. et al.: Initiation of myoblast to brown fat switch by a PRDM16-C/EBP-β transcriptional complex. Nature, 460, 1154-1158 (2009)[PubMed]
- Kajimura, S., Seale, P. & Spiegelman, B. M.: Transcriptional control of brown fat development. Cell Metab., 11, 257-262 (2010)[PubMed]
- Shing, D. C., Trubia, M., Marchesi, F. et al.: Overexpression of sPRDM16 coupled with loss of p53 induces myeloid leukemias in mice. J. Clin. Invest., 117, 3696-3707 (2007)[PubMed]
- Pinheiro, I., Margueron, R., Shukeir, N. et al.: Prdm3 and Prdm16 are H3K9me1 methyltransferases required for mammalian heterochromatin integrity. Cell, 150, 948-960 (2012)[PubMed]
- Cormier-Daire, V., Molinari, F., Rio, M. et al.: Cryptic terminal deletion of chromosome 9q34: a novel cause of syndromic obesity in childhood? J. Med. Genet., 40, 300-303 (2003)[PubMed]
- Willemsen, M. H., Vulto-van Silfhout, A. T., Nillesen, W. M. et al.: Update on Kleefstra Syndrome. Mol. Syndromol., 2, 202-212 (2012)[PubMed]
- Schaefer, A., Sampath, S. C., Intrator, A. et al.: Control of cognition and adaptive behavior by the GLP/G9a epigenetic suppressor complex. Neuron, 64, 678-691 (2009)[PubMed]
- Uldry, M., Yang, W., St-Pierre, J. et al.: Complementary action of the PGC-1 coactivators in mitochondrial biogenesis and brown fat differentiation. Cell Metab., 3, 333-341 (2006)[PubMed]
- Ohno, H., Shinoda, K., Spiegelman, B. M. et al.: PPARγ agonists induce a white-to-brown fat conversion through stabilization of PRDM16 protein. Cell Metab., 15, 395-404 (2012)[PubMed] [新着論文レビュー]
- Cannon, B. & Nedergaard, J.: Nonshivering thermogenesis and its adequate measurement in metabolic studies. J. Exp. Biol., 214, 242-253 (2011)[PubMed]
- Wu, Q., Kazantzis, M., Doege, H. et al.: Fatty acid transport protein 1 is required for nonshivering thermogenesis in brown adipose tissue. Diabetes, 55, 3229-3237 (2006)[PubMed]
- Enerback, S., Jacobsson, A., Simpson, E. M. et al.: Mice lacking mitochondrial uncoupling protein are cold-sensitive but not obese. Nature, 387, 90-94 (1997)[PubMed]
- Feldmann, H. M., Golozoubova, V., Cannon, B. et al.: UCP1 ablation induces obesity and abolishes diet-induced thermogenesis in mice exempt from thermal stress by living at thermoneutrality. Cell Metab., 9, 203-209 (2009)[PubMed]
- Stanford, K. I., Middelbeek, R. J., Townsend, K. L.: et al.: Brown adipose tissue regulates glucose homeostasis and insulin sensitivity. J. Clin. Invest., 123, 215-223 (2013)[PubMed]
著者プロフィール
略歴:2011年 広島大学大学院医歯薬学総合研究科 修了,同年 米国California大学San Francisco校Postdoc Fellowを経て,2013年より広島大学病院 医科診療医.
研究テーマ:褐色脂肪細胞と糖代謝とのかかわり.
篠田 幸作(Kosaku Shinoda)
米国California大学San Francisco校Postdoc Fellow.
大山 夏奈(Kana Ohyama)
米国California大学San Francisco校Specialist.
梶村 真吾(Shingo Kajimura)
米国California大学San Francisco校Assistant Professor.
研究室URL:http://kajimuralab.ucsf.edu/
© 2013 大野晴也・篠田幸作・大山加奈・梶村真吾 Licensed under CC 表示 2.1 日本