核外輸送の過程におけるリボソームの品質管理の機構
松尾 芳隆
(ドイツHeidelberg大学Biochemi-Zentrum)
email:松尾芳隆
DOI: 10.7875/first.author.2013.158
Coupled GTPase and remodelling ATPase activities form a checkpoint for ribosome export.
Yoshitaka Matsuo, Sander Granneman, Matthias Thoms, Rizos-Georgios Manikas, David Tollervey, Ed Hurt
Nature, 505, 112-116 (2014)
リボソームはタンパク質の合成装置として重要なはたらきを担っており,正常なリボソームの供給は細胞の増殖や条件に応じた遺伝子発現にとって非常に重要である.真核生物のリボソームは4種類のrRNAと79種類のタンパク質からなる巨大な複合体であり,その生合成には,rRNAの合成および修飾,プロセシング,リボソームタンパク質の集合,正確な立体構造の形成,核から細胞質への輸送など,多くの過程がある.この複雑な過程の大部分はタンパク質合成の場である細胞質とは隔離された核において行われている.核において生じた異常なリボソームはすみやかに分解され,正常に合成されたリボソームだけが細胞質へと輸送される.このことは,異常なリボソームが翻訳にかかわることをふせいでおり,核外へと輸送されるリボソームの品質が厳しく管理されていることを示唆している.しかしながら,正常に合成されたリボソームを識別する分子機構は長いあいだ未解明のままであった.リボソームの60Sサブユニット前駆体は核外移行シグナルをもつ輸送アダプタータンパク質Nmd3と結合することにより核外への移行能を獲得する.筆者らは,GTPaseであるNug2が60Sサブユニット前駆体のNmd3との結合領域に結合しその結合をふせぐことにより未成熟な60Sサブユニット前駆体の核外輸送を阻止すること,さらに,60Sサブユニット前駆体からのNug2の解離はRea1による60Sサブユニット前駆体の再編成,および,それにともなうNug2のGTP加水分解反応に依存していることを明らかにした.
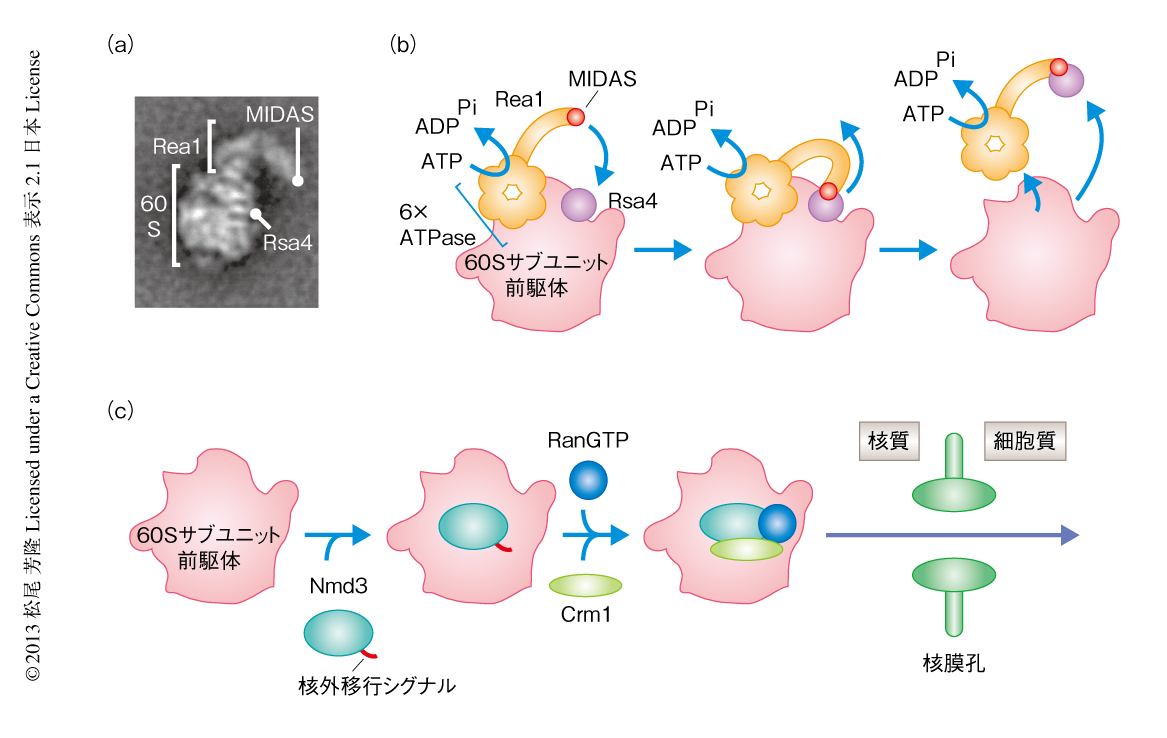
真核生物のリボソームの生合成は200種類以上の分子の関与する非常に複雑な反応であり,核小体から核質をへて細胞質へ移動するまで,多種多様なリボソーム前駆体が観察される1).これらリボソーム前駆体はさまざまなタンパク質を含む複合体として存在しており,これらのタンパク質をベイトに用いたアフィニティ精製法により精製することができる.核質に存在するRix1をベイトに用いたアフィニティ精製では,AAA-ATPaseであるRea1や,その相互作用タンパク質であるRsa4,GTPaseであるNug2などを多く含む,Rix1前駆体とよばれる60Sサブユニットの前駆体が精製される2).Rea1は6つのATP結合部位からなるリング領域とMIDASドメインを含むテイル領域から構成されている3).電子顕微鏡を用いたRix1前駆体の解析では,Rea1のリング領域が60Sサブユニット前駆体の5S rRNA領域と結合するのに対し,テイル領域は免疫電子顕微鏡により同定された60SサブユニットのRsa4との結合領域の近傍と相互作用する可能性が示されている2)(図1a).実際に,Rea1のMIDASドメインはRsa4のN末端領域のMIDOドメインと相互作用する2).さらに,精製したRix1前駆体とATPとを反応させると,Rix1前駆体からRea1およびRsa4の解離が誘導されることが報告されている2).以上のことから,Rea1によりRsa4の解離をともなう60Sサブユニット前駆体の大きな構造変換がひき起こされるという,Rea1による60Sサブユニット前駆体の再編成モデルが考えられている2,3)(図1b).
60Sサブユニットの生合成の大部分は核において行われ,正確に合成されたものだけが核膜孔を通過し細胞質へと輸送される.通常,イオンや低分子を除き,核から細胞質への積み荷の輸送には核外移行シグナルが必須である.積み荷のもつ核外移行シグナルはExportinにより認識され,GTPaseであるRanとともに核外へと輸送される.60Sサブユニット前駆体は核質において核外移行シグナルをもつ輸送アダプタータンパク質Nmd3と結合し,Crm1およびRanGTPに依存して細胞質へと輸送される4,5)(図1c).しかし,核において生じた異常な60Sサブユニット前駆体はTRAMP複合体によりポリアデニル化され,核外へ輸送されることなくエクソソームにより分解されることが報告されている6).このことは,核外へ輸送されるまえに,60Sサブユニット前駆体の品質を管理する機構が存在していることを示唆する.
Nug2は酵母からヒトまで非常によく保存されている核に存在するGTPaseであり,酵母においては細胞の増殖に必須である.これまで,Nug2は核質に局在し60Sサブユニット前駆体に結合していることが報告されている7).しかしながら,細胞における詳細な機能はわかっていない.細菌におけるNug2のホモログであるYlqF(RbgA)は23S rRNAと直接に結合することが報告されていることから8),Nug2も核質の60Sサブユニット前駆体に含まれるrRNAと直接に結合していることが予想された.そこで,CRAC(cross-linking and analysis of cDNA)法を用いて9),rRNAにおけるNug2の結合領域の決定を試みたところ,25S rRNAのH38,H69-71,H80-86,H89,H91-92と結合することが明らかになった.これらの領域を60Sサブユニットの立体構造においてマッピングすると,結合領域は60Sサブユニットと40Sサブユニットとの会合面にあることがわかった.近年,低温電子顕微鏡により60SサブユニットとNmd3との結合が可視化されており10),その結果は60Sサブユニット前駆体とNug2との結合領域と類似していた.そこで,rRNAにおけるNmd3の詳細な結合領域を同定したところ,H38,H69,H89に結合することが明らかになった.以上の結果は,60Sサブユニット前駆体におけるNug2およびNmd3の結合領域が重複していることを示しており,60Sサブユニット前駆体とNug2との結合と,60Sサブユニット前駆体とNmd3との結合が競合関係にある可能性を示唆した.
GTPaseはGTP結合ドメインにG1,G2,G3,G4といったモチーフをもち,この領域はGTPの加水分解能や結合能に深くかかわる.そこで,GTPaseであるNug2について,G1モチーフとG3モチーフにそれぞれ変異を導入した2種類の優性阻害変異体を作製し,ポリソーム解析およびリボソームタンパク質L25との共局在性の解析を行った.すると,これら2つの変異体は60Sサブユニット前駆体との結合は保持するが,60Sサブユニット前駆体の生合成および核外輸送を阻害することが確認された.近年,GTPの加水分解にK+を必要とするGTPaseファミリーが報告されており11),アミノ酸配列の解析からNug2もこのファミリーに属する可能性が高いことが示された.そこで,Nug2のGTP加水分解能にK+が必須であるかどうかを調べた.なお,in vitroにおける解析には,熱安定性を示す高熱性の真菌Chaetomium thermophilum 12) のNug2を用いた.アミノ酸配列の解析から予想されたとおり,Nug2はGTPの加水分解にK+を必要とすることが確認された.一方で,さきの2つのNug2変異体ではK+の存在下においてもGTPの加水分解はみられなかった.GTPとGDPとの結合能を調べたところ,野生型のNug2および一方のNug2変異体では結合が観察されたものの,もう一方のNug2変異体では結合は観察されなかった.つまり,前者のNug2変異体はGTPの結合能を失った変異体であるのに対し,後者のNug2変異体はGTPとの結合能は保っているがGTP加水分解能を失った変異体であることが確認された.
Nug2はRix1前駆体に非常に多く含まれており,さらに遺伝学的な解析により,GTPの結合能を失ったNug2の変異体とRsa4の温度感受性変異体,もしくは,GTPの結合能を失ったNug2の変異体とRea1のMIDASドメインの変異体との二重変異が合成致死を示すことが明らかにされた.そこで,Rea1による60Sサブユニット前駆体の再編成(図1b)により,Nug2もRsa4と同様に60Sサブユニット前駆体から解離するかどうかを調べた.以前の解析では,Rea1による60Sサブユニット前駆体の再編成によりRsa4は60Sサブユニット前駆体から解離するが,Nug2は解離しないと報告されている2).しかしながら,この解析に使用された緩衝液にはK+が存在していなかった.Nug2のGTP加水分解反応にはK+が必須であるため,K+の存在下および非存在下において解析を行った.その結果,Nug2はK+の存在およびRea1による60Sサブユニット前駆体の再編成に依存して,60Sサブユニット前駆体から解離することが明らかになった.また,さきのGTPの結合能が欠損したNug2変異体およびGTPの加水分解能が欠損したNug2変異体においても同様に解析したところ,GTPの結合能が欠損したNug2変異体では60Sサブユニット前駆体からRsa4,Rea1,Nug2すべての解離が阻害され,GTPの加水分解能が欠損したNug2変異体では60Sサブユニット前駆体からNug2の解離だけが阻害されることが明らかになった.これらの結果は,Rea1による60Sサブユニット前駆体の再編成を誘導するためにはNug2のGTP結合能が,そして,60Sサブユニット前駆体からのNug2の解離にはNug2のK+依存性のGTP加水分解能,および,Rea1の60Sサブユニット前駆体の再編成の活性が必要であることを示していた.
さきの結果は,60Sサブユニット前駆体におけるNug2およびNmd3の結合領域が重複していることを示していた.そこで,Nug2とNmd3が同時に60Sサブユニット前駆体に結合することが可能かどうか調べるため,核小体から細胞質まで,さまざまな60Sサブユニット前駆体に含まれる構成タンパク質を比較した.その結果,輸送タンパク質であるArx1をベイトに用いて精製したArx1前駆体とよばれる60Sサブユニット前駆体においてのみ,Nug2およびNmd3が含まれていることが明らかになった.また,Nug2をベイトに用いて精製した60Sサブユニット前駆体にはNmd3は含まれておらず,同様に,Nmd3をベイトに用いて精製した60Sサブユニット前駆体にもNug2は含まれていなかった.これらの結果は,Nug2とNmd3は同時に60Sサブユニット前駆体に結合できないこと,そして,Arx1前駆体にはNug2が結合している60Sサブユニット前駆体とNmd3が結合している60Sサブユニット前駆体の2種類が存在することを示していた.60Sサブユニット前駆体から解離することのできない,GTPの結合能が欠損したNug2変異をもつ株,および,GTPの加水分解能が欠損したNug2変異をもつ株において,Arx1前駆体の構成タンパク質を調べたところ,Nmd3の取り込みが特異的に阻害されていることが明らかになった.このことは,60Sサブユニット前駆体からのNug2の解離が阻害されることにより,60Sサブユニット前駆体へのNmd3の取り込みも阻害されることを示していた.さらに,Nug2の枯渇した条件においてRix1前駆体につき調べたところ,通常は60Sサブユニット前駆体には含まれないはずのNmd3が取り込まれていた.これらの結果は,60Sサブユニット前駆体とNug2との結合が,60Sサブユニット前駆体へのNmd3の未成熟な結合をふせぎ,60Sサブユニット前駆体からNug2が解離することにより60Sサブユニット前駆体とNmd3との結合が可能になることを示していた.
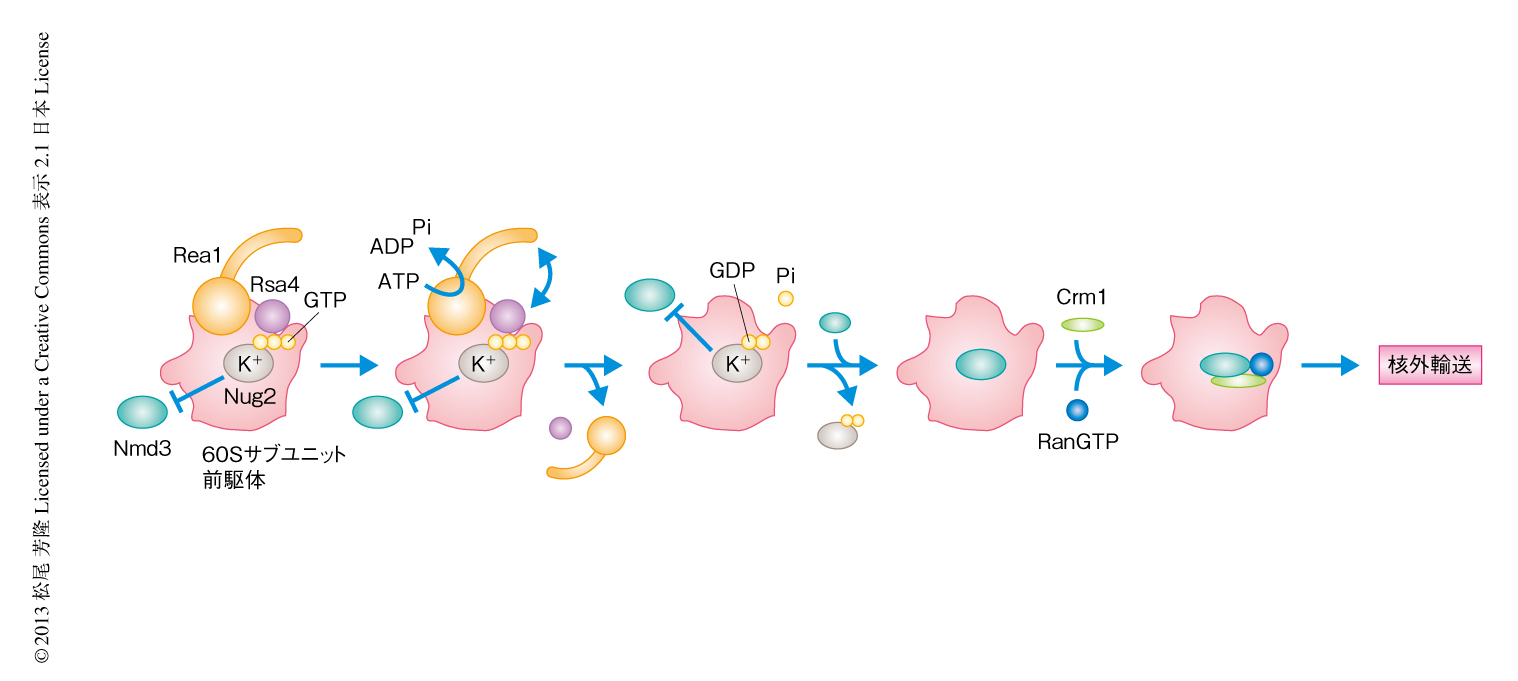
この論文では,GTPaseであるNug2が輸送アダプタータンパク質であるNmd3のプレースホルダーとしてはたらき,未成熟な60Sサブユニット前駆体にNmd3が取り込まれることを阻止すること,さらに,60Sサブユニット前駆体からのNug2の解離がAAA-ATPaseであるRea1による60Sサブユニット前駆体の再編成,および,それにともなうNug2によるGTP加水分解反応に依存していることを明らかにした.これらの結果から,核外輸送の過程におけるリボソームの品質管理機構のモデルは以下のように示唆された(図2).1)Rea1による60Sサブユニット前駆体の再編成にともない60Sサブユニット前駆体に構造変換がひき起こされる.2)Nug2が60Sサブユニット前駆体の構造変換を感知し,Nug2のもつK+依存性のGTPase活性が上昇する.3)GDP型に変換されたNug2が60Sサブユニット前駆体から解離することにより,60Sサブユニット前駆体のNmd3との結合領域が露出する.4)Nmd3が60Sサブユニット前駆体と結合し,つづいて,Crm1およびRanGTPが取り込まれることにより核外へと輸送される.
ヒトのNug2オルソログであるGNL2(NPG-1,あるいは,Nucleostemin2ともよばれる)は,がん細胞など増殖性の細胞において高く発現しており,細胞周期の進行制御に関与していることが報告されている13).また,GNL2だけでなく,リボソームタンパク質やリボソームの生合成に関与するほかの分子における遺伝子変異が,さまざまな遺伝病やがんに対する感受性を上昇させる原因になることもわかってきている14).そのため,創薬のターゲットとしてリボソーム生合成の研究が注目されている15).したがって,これまでに明らかにされてきた出芽酵母における知見が,今後,大いに役だつことが期待される.
略歴:2006年 奈良先端科学技術大学院大学情報科学研究科 修了,同年 同 ポスドク研究員,2008年 ドイツHeidelberg大学 ポスドク研究員を経て,2013年 東北大学大学院薬学研究科 助教.
研究テーマ:リボソームの生合成および核外輸送における分子機構,mRNAの品質管理機構.
© 2013 松尾 芳隆 Licensed under CC 表示 2.1 日本
(ドイツHeidelberg大学Biochemi-Zentrum)
email:松尾芳隆
DOI: 10.7875/first.author.2013.158
Coupled GTPase and remodelling ATPase activities form a checkpoint for ribosome export.
Yoshitaka Matsuo, Sander Granneman, Matthias Thoms, Rizos-Georgios Manikas, David Tollervey, Ed Hurt
Nature, 505, 112-116 (2014)
要 約
リボソームはタンパク質の合成装置として重要なはたらきを担っており,正常なリボソームの供給は細胞の増殖や条件に応じた遺伝子発現にとって非常に重要である.真核生物のリボソームは4種類のrRNAと79種類のタンパク質からなる巨大な複合体であり,その生合成には,rRNAの合成および修飾,プロセシング,リボソームタンパク質の集合,正確な立体構造の形成,核から細胞質への輸送など,多くの過程がある.この複雑な過程の大部分はタンパク質合成の場である細胞質とは隔離された核において行われている.核において生じた異常なリボソームはすみやかに分解され,正常に合成されたリボソームだけが細胞質へと輸送される.このことは,異常なリボソームが翻訳にかかわることをふせいでおり,核外へと輸送されるリボソームの品質が厳しく管理されていることを示唆している.しかしながら,正常に合成されたリボソームを識別する分子機構は長いあいだ未解明のままであった.リボソームの60Sサブユニット前駆体は核外移行シグナルをもつ輸送アダプタータンパク質Nmd3と結合することにより核外への移行能を獲得する.筆者らは,GTPaseであるNug2が60Sサブユニット前駆体のNmd3との結合領域に結合しその結合をふせぐことにより未成熟な60Sサブユニット前駆体の核外輸送を阻止すること,さらに,60Sサブユニット前駆体からのNug2の解離はRea1による60Sサブユニット前駆体の再編成,および,それにともなうNug2のGTP加水分解反応に依存していることを明らかにした.
はじめに
真核生物のリボソームの生合成は200種類以上の分子の関与する非常に複雑な反応であり,核小体から核質をへて細胞質へ移動するまで,多種多様なリボソーム前駆体が観察される1).これらリボソーム前駆体はさまざまなタンパク質を含む複合体として存在しており,これらのタンパク質をベイトに用いたアフィニティ精製法により精製することができる.核質に存在するRix1をベイトに用いたアフィニティ精製では,AAA-ATPaseであるRea1や,その相互作用タンパク質であるRsa4,GTPaseであるNug2などを多く含む,Rix1前駆体とよばれる60Sサブユニットの前駆体が精製される2).Rea1は6つのATP結合部位からなるリング領域とMIDASドメインを含むテイル領域から構成されている3).電子顕微鏡を用いたRix1前駆体の解析では,Rea1のリング領域が60Sサブユニット前駆体の5S rRNA領域と結合するのに対し,テイル領域は免疫電子顕微鏡により同定された60SサブユニットのRsa4との結合領域の近傍と相互作用する可能性が示されている2)(図1a).実際に,Rea1のMIDASドメインはRsa4のN末端領域のMIDOドメインと相互作用する2).さらに,精製したRix1前駆体とATPとを反応させると,Rix1前駆体からRea1およびRsa4の解離が誘導されることが報告されている2).以上のことから,Rea1によりRsa4の解離をともなう60Sサブユニット前駆体の大きな構造変換がひき起こされるという,Rea1による60Sサブユニット前駆体の再編成モデルが考えられている2,3)(図1b).
60Sサブユニットの生合成の大部分は核において行われ,正確に合成されたものだけが核膜孔を通過し細胞質へと輸送される.通常,イオンや低分子を除き,核から細胞質への積み荷の輸送には核外移行シグナルが必須である.積み荷のもつ核外移行シグナルはExportinにより認識され,GTPaseであるRanとともに核外へと輸送される.60Sサブユニット前駆体は核質において核外移行シグナルをもつ輸送アダプタータンパク質Nmd3と結合し,Crm1およびRanGTPに依存して細胞質へと輸送される4,5)(図1c).しかし,核において生じた異常な60Sサブユニット前駆体はTRAMP複合体によりポリアデニル化され,核外へ輸送されることなくエクソソームにより分解されることが報告されている6).このことは,核外へ輸送されるまえに,60Sサブユニット前駆体の品質を管理する機構が存在していることを示唆する.
1.60Sサブユニット前駆体とNug2との結合領域はNmd3との結合領域と重複する
Nug2は酵母からヒトまで非常によく保存されている核に存在するGTPaseであり,酵母においては細胞の増殖に必須である.これまで,Nug2は核質に局在し60Sサブユニット前駆体に結合していることが報告されている7).しかしながら,細胞における詳細な機能はわかっていない.細菌におけるNug2のホモログであるYlqF(RbgA)は23S rRNAと直接に結合することが報告されていることから8),Nug2も核質の60Sサブユニット前駆体に含まれるrRNAと直接に結合していることが予想された.そこで,CRAC(cross-linking and analysis of cDNA)法を用いて9),rRNAにおけるNug2の結合領域の決定を試みたところ,25S rRNAのH38,H69-71,H80-86,H89,H91-92と結合することが明らかになった.これらの領域を60Sサブユニットの立体構造においてマッピングすると,結合領域は60Sサブユニットと40Sサブユニットとの会合面にあることがわかった.近年,低温電子顕微鏡により60SサブユニットとNmd3との結合が可視化されており10),その結果は60Sサブユニット前駆体とNug2との結合領域と類似していた.そこで,rRNAにおけるNmd3の詳細な結合領域を同定したところ,H38,H69,H89に結合することが明らかになった.以上の結果は,60Sサブユニット前駆体におけるNug2およびNmd3の結合領域が重複していることを示しており,60Sサブユニット前駆体とNug2との結合と,60Sサブユニット前駆体とNmd3との結合が競合関係にある可能性を示唆した.
2.Nug2はK+に依存性のGTP加水分解能をもつ
GTPaseはGTP結合ドメインにG1,G2,G3,G4といったモチーフをもち,この領域はGTPの加水分解能や結合能に深くかかわる.そこで,GTPaseであるNug2について,G1モチーフとG3モチーフにそれぞれ変異を導入した2種類の優性阻害変異体を作製し,ポリソーム解析およびリボソームタンパク質L25との共局在性の解析を行った.すると,これら2つの変異体は60Sサブユニット前駆体との結合は保持するが,60Sサブユニット前駆体の生合成および核外輸送を阻害することが確認された.近年,GTPの加水分解にK+を必要とするGTPaseファミリーが報告されており11),アミノ酸配列の解析からNug2もこのファミリーに属する可能性が高いことが示された.そこで,Nug2のGTP加水分解能にK+が必須であるかどうかを調べた.なお,in vitroにおける解析には,熱安定性を示す高熱性の真菌Chaetomium thermophilum 12) のNug2を用いた.アミノ酸配列の解析から予想されたとおり,Nug2はGTPの加水分解にK+を必要とすることが確認された.一方で,さきの2つのNug2変異体ではK+の存在下においてもGTPの加水分解はみられなかった.GTPとGDPとの結合能を調べたところ,野生型のNug2および一方のNug2変異体では結合が観察されたものの,もう一方のNug2変異体では結合は観察されなかった.つまり,前者のNug2変異体はGTPの結合能を失った変異体であるのに対し,後者のNug2変異体はGTPとの結合能は保っているがGTP加水分解能を失った変異体であることが確認された.
3.Nug2はRea1による60Sサブユニット前駆体の再編成およびNug2のGTP加水分解反応に依存して解離する
Nug2はRix1前駆体に非常に多く含まれており,さらに遺伝学的な解析により,GTPの結合能を失ったNug2の変異体とRsa4の温度感受性変異体,もしくは,GTPの結合能を失ったNug2の変異体とRea1のMIDASドメインの変異体との二重変異が合成致死を示すことが明らかにされた.そこで,Rea1による60Sサブユニット前駆体の再編成(図1b)により,Nug2もRsa4と同様に60Sサブユニット前駆体から解離するかどうかを調べた.以前の解析では,Rea1による60Sサブユニット前駆体の再編成によりRsa4は60Sサブユニット前駆体から解離するが,Nug2は解離しないと報告されている2).しかしながら,この解析に使用された緩衝液にはK+が存在していなかった.Nug2のGTP加水分解反応にはK+が必須であるため,K+の存在下および非存在下において解析を行った.その結果,Nug2はK+の存在およびRea1による60Sサブユニット前駆体の再編成に依存して,60Sサブユニット前駆体から解離することが明らかになった.また,さきのGTPの結合能が欠損したNug2変異体およびGTPの加水分解能が欠損したNug2変異体においても同様に解析したところ,GTPの結合能が欠損したNug2変異体では60Sサブユニット前駆体からRsa4,Rea1,Nug2すべての解離が阻害され,GTPの加水分解能が欠損したNug2変異体では60Sサブユニット前駆体からNug2の解離だけが阻害されることが明らかになった.これらの結果は,Rea1による60Sサブユニット前駆体の再編成を誘導するためにはNug2のGTP結合能が,そして,60Sサブユニット前駆体からのNug2の解離にはNug2のK+依存性のGTP加水分解能,および,Rea1の60Sサブユニット前駆体の再編成の活性が必要であることを示していた.
4.60Sサブユニット前駆体からのNug2の解離は60Sサブユニット前駆体とNmd3との結合を可能にする
さきの結果は,60Sサブユニット前駆体におけるNug2およびNmd3の結合領域が重複していることを示していた.そこで,Nug2とNmd3が同時に60Sサブユニット前駆体に結合することが可能かどうか調べるため,核小体から細胞質まで,さまざまな60Sサブユニット前駆体に含まれる構成タンパク質を比較した.その結果,輸送タンパク質であるArx1をベイトに用いて精製したArx1前駆体とよばれる60Sサブユニット前駆体においてのみ,Nug2およびNmd3が含まれていることが明らかになった.また,Nug2をベイトに用いて精製した60Sサブユニット前駆体にはNmd3は含まれておらず,同様に,Nmd3をベイトに用いて精製した60Sサブユニット前駆体にもNug2は含まれていなかった.これらの結果は,Nug2とNmd3は同時に60Sサブユニット前駆体に結合できないこと,そして,Arx1前駆体にはNug2が結合している60Sサブユニット前駆体とNmd3が結合している60Sサブユニット前駆体の2種類が存在することを示していた.60Sサブユニット前駆体から解離することのできない,GTPの結合能が欠損したNug2変異をもつ株,および,GTPの加水分解能が欠損したNug2変異をもつ株において,Arx1前駆体の構成タンパク質を調べたところ,Nmd3の取り込みが特異的に阻害されていることが明らかになった.このことは,60Sサブユニット前駆体からのNug2の解離が阻害されることにより,60Sサブユニット前駆体へのNmd3の取り込みも阻害されることを示していた.さらに,Nug2の枯渇した条件においてRix1前駆体につき調べたところ,通常は60Sサブユニット前駆体には含まれないはずのNmd3が取り込まれていた.これらの結果は,60Sサブユニット前駆体とNug2との結合が,60Sサブユニット前駆体へのNmd3の未成熟な結合をふせぎ,60Sサブユニット前駆体からNug2が解離することにより60Sサブユニット前駆体とNmd3との結合が可能になることを示していた.
おわりに
この論文では,GTPaseであるNug2が輸送アダプタータンパク質であるNmd3のプレースホルダーとしてはたらき,未成熟な60Sサブユニット前駆体にNmd3が取り込まれることを阻止すること,さらに,60Sサブユニット前駆体からのNug2の解離がAAA-ATPaseであるRea1による60Sサブユニット前駆体の再編成,および,それにともなうNug2によるGTP加水分解反応に依存していることを明らかにした.これらの結果から,核外輸送の過程におけるリボソームの品質管理機構のモデルは以下のように示唆された(図2).1)Rea1による60Sサブユニット前駆体の再編成にともない60Sサブユニット前駆体に構造変換がひき起こされる.2)Nug2が60Sサブユニット前駆体の構造変換を感知し,Nug2のもつK+依存性のGTPase活性が上昇する.3)GDP型に変換されたNug2が60Sサブユニット前駆体から解離することにより,60Sサブユニット前駆体のNmd3との結合領域が露出する.4)Nmd3が60Sサブユニット前駆体と結合し,つづいて,Crm1およびRanGTPが取り込まれることにより核外へと輸送される.
ヒトのNug2オルソログであるGNL2(NPG-1,あるいは,Nucleostemin2ともよばれる)は,がん細胞など増殖性の細胞において高く発現しており,細胞周期の進行制御に関与していることが報告されている13).また,GNL2だけでなく,リボソームタンパク質やリボソームの生合成に関与するほかの分子における遺伝子変異が,さまざまな遺伝病やがんに対する感受性を上昇させる原因になることもわかってきている14).そのため,創薬のターゲットとしてリボソーム生合成の研究が注目されている15).したがって,これまでに明らかにされてきた出芽酵母における知見が,今後,大いに役だつことが期待される.
文 献
- Kressler, D., Hurt, E. & Bassler, J.: Driving ribosome assembly. Biochim. Biophys. Acta, 1803, 673-683 (2010)[PubMed]
- Ulbrich, C., Diepholz, M., Bassler, J. et al.: Mechanochemical removal of ribosome biogenesis factors from nascent 60S ribosomal subunits. Cell, 138, 911-922 (2009)[PubMed]
- Kressler, D., Hurt, E., Bergler, H. et al.: The power of AAA-ATPases on the road of pre-60S ribosome maturation: molecular machines that strip pre-ribosomal particles. Biochim. Biophys. Acta, 1823, 92-100 (2012)[PubMed]
- Gadal, O., Strauss, D., Kessl, J. et al.: Nuclear export of 60s ribosomal subunits depends on Xpo1p and requires a nuclear export sequence-containing factor, Nmd3p, that associates with the large subunit protein Rpl10p. Mol. Cell. Biol., 21, 3405-3415 (2001)[PubMed]
- Ho, J. H., Kallstrom, G. & Johnson, A. W.: Nmd3p is a Crm1p-dependent adapter protein for nuclear export of the large ribosomal subunit. J. Cell Biol., 151, 1057-1066 (2000)[PubMed]
- Dez, C., Houseley, J. & Tollervey, D.: Surveillance of nuclear-restricted pre-ribosomes within a subnucleolar region of Saccharomyces cerevisiae. EMBO J., 25, 1534-1546 (2006)[PubMed]
- Bassler, J., Grandi, P., Gadal, O. et al.: Identification of a 60S preribosomal particle that is closely linked to nuclear export. Mol. Cell, 8, 517-529 (2001)[PubMed]
- Matsuo, Y., Morimoto, T., Kuwano, M. et al.: The GTP-binding protein YlqF participates in the late step of 50 S ribosomal subunit assembly in Bacillus subtilis. J. Biol. Chem., 281, 8110-8117 (2006)[PubMed]
- Granneman, S., Kudla, G., Petfalski, E. et al.: Identification of protein binding sites on U3 snoRNA and pre-rRNA by UV cross-linking and high-throughput analysis of cDNAs. Proc. Natl. Acad. Sci. USA, 106, 9613-9618 (2009)[PubMed]
- Sengupta, J., Bussiere, C., Pallesen, J. et al.: Characterization of the nuclear export adaptor protein Nmd3 in association with the 60S ribosomal subunit. J. Cell Biol., 189, 1079-1086 (2010)[PubMed]
- Ash, M. R., Maher, M. J., Mitchell Guss, J. et al.: The cation-dependent G-proteins: in a class of their own. FEBS Lett., 586, 2218-2224 (2012)[PubMed]
- Amlacher, S., Sarges, P., Flemming, D. et al.: Insight into structure and assembly of the nuclear pore complex by utilizing the genome of a eukaryotic thermophile. Cell, 146, 277-289 (2011)[PubMed]
- Chennupati, V., Datta, D., Rao, M. R. et al.: Signals and pathways regulating nucleolar retention of novel putative nucleolar GTPase NGP-1(GNL-2). Biochemistry, 50, 4521-4536 (2011)[PubMed]
- Teng, T., Thomas, G. & Mercer, C. A.: Growth control and ribosomopathies. Curr. Opin. Genet. Dev., 23, 63-71 (2013)[PubMed]
- Vlatkovic, N., Boyd, M. T. & Rubbi, C. P.: Nucleolar control of p53: a cellular Achilles' heel and a target for cancer therapy. Cell. Mol. Life Sci., 71, 771-791 (2014)[PubMed]
著者プロフィール
略歴:2006年 奈良先端科学技術大学院大学情報科学研究科 修了,同年 同 ポスドク研究員,2008年 ドイツHeidelberg大学 ポスドク研究員を経て,2013年 東北大学大学院薬学研究科 助教.
研究テーマ:リボソームの生合成および核外輸送における分子機構,mRNAの品質管理機構.
© 2013 松尾 芳隆 Licensed under CC 表示 2.1 日本