mTOR複合体1-4E-BPシグナル伝達系による翻訳の制御を介したミトコンドリアの活性化
森田斉弘・Nahum Sonenberg
(カナダMcGill大学Department of Biochemistry)
email:森田斉弘
DOI: 10.7875/first.author.2013.156
mTORC1 controls mitochondrial activity and biogenesis through 4E-BP-dependent translational regulation.
Masahiro Morita, Simon-Pierre Gravel, Valérie Chénard, Kristina Sikström, Liang Zheng, Tommy Alain, Valentina Gandin, Daina Avizonis, Meztli Arguello, Chadi Zakaria, Shannon McLaughlan, Yann Nouet, Arnim Pause, Michael Pollak, Eyal Gottlieb, Ola Larsson, Julie St-Pierre, Ivan Topisirovic, Nahum Sonenberg
Cell Metabolism, 18, 698-711 (2013)
タンパク質の生合成は細胞においてもっともエネルギーを消費する過程であり,細胞におけるATPの20~30%を消費する.タンパク質合成とATPの産生とのエネルギーバランスの維持は細胞の増殖にとり重要であり,その破綻はがんや糖尿病などの疾患や老化と密接にかかわる.mTOR複合体1は翻訳や脂質代謝および糖代謝を制御していることが知られている.筆者らは,mTOR複合体1が翻訳開始因子であるeIF4Eの結合タンパク質4E-BPを介しミトコンドリアタンパク質の翻訳を選択的に促進することにより,ミトコンドリアの機能を活性化していることを明らかにした.mTOR複合体1-4E-BPシグナル伝達系によるミトコンドリアの活性化は,タンパク質合成のため必要とされるATPの産生能を増大させ,エネルギー恒常性の維持に重要であると考えられる.この研究では,mTORの異常な活性化がみられるがんや糖尿病といった代謝に関連する疾患におけるmTOR複合体1シグナル伝達系の一端を明らかにした.
タンパク質の生合成は細胞においてもっともエネルギーを消費する過程のひとつであり,細胞におけるATP総消費量の20~30%をしめると考えられている1).ミトコンドリアは哺乳動物の細胞においてATPをおもに産生するオルガネラであり,細胞におけるエネルギーバランスの維持において重要な役割をはたす2).また,がん細胞のような増殖する細胞において,ミトコンドリアは新たな細胞に必要とされるリン脂質や核酸などの生合成においても重要な役割をはたす2).
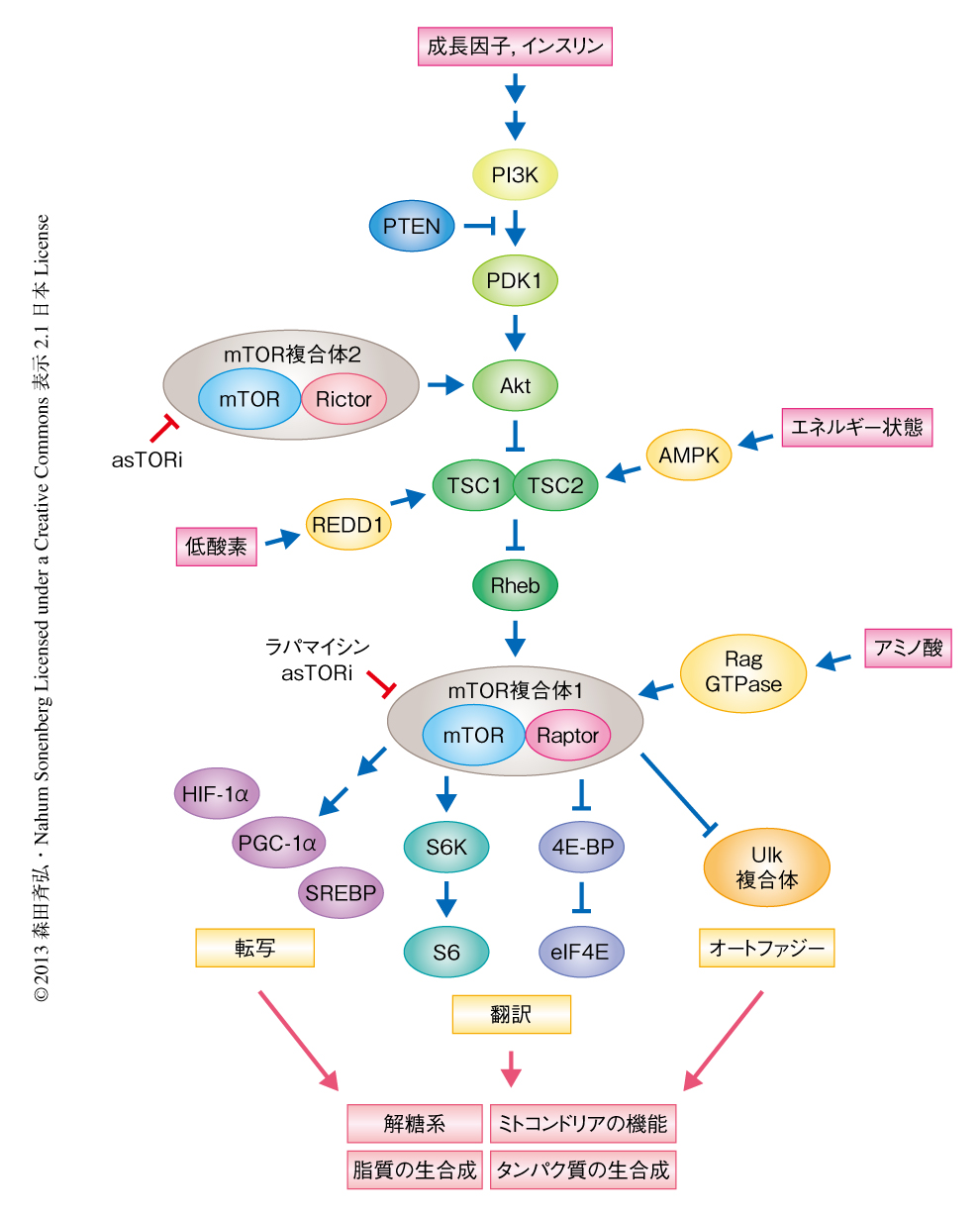
mTOR(mechanistic/mammalian target of rapamycin)は酵母からヒトまで保存されたセリン/スレオニンキナーゼであり,成長因子やアミノ酸,ストレスなど細胞の内外からのさまざまなシグナルを感知し,細胞の成長,代謝,生存を制御している3).mTORはmTOR複合体1およびmTOR複合体2という機能の異なる2種類のタンパク質複合体を形成している(図1).mTOR複合体1は翻訳にかかわるタンパク質や転写因子を介しタンパク質合成および脂質合成などの同化代謝や細胞周期の進行を制御している.mTORC2はAktやSGKなどのキナーゼを介して細胞骨格や細胞の生存,糖代謝および脂質代謝を制御している.がんや糖尿病などの疾患や病態においてmTORシグナルの異常な亢進が観察されており,免疫抑制作用や抗がん作用の知られているラパマイシンやその誘導体はmTOR複合体1を特異的に抑制することが知られている.近年は,mTORのキナーゼ活性を標的にした阻害剤asTORi(active-site mTOR inhibitor)が開発されており,新たな抗がん剤として期待されている4).
mTOR複合体1は,翻訳開始因子eIF4Eの結合タンパク質である4E-BPおよびS6K(ribosomal protein S6 kinase)を含む下流の標的タンパク質をリン酸化することによりタンパク質合成を活性化する5)(図1).eIF4EはmRNAの5’キャップ構造に結合し,リボソームをmRNAへと導入することにより翻訳の開始を制御している.4E-BPはeIF4Eと結合することによりリボソームの導入を抑制し翻訳を阻害する.4E-BPの活性はmTOR複合体1によるリン酸化により制御されており,高リン酸化型の4E-BPはeIF4Eから遊離し翻訳は活性化される.また,mTOR複合体1はHIF-1α,PGC-1α,SREBPなどの転写因子を介しても糖代謝および脂質代謝やミトコンドリアの制御を行うことが知られている3).
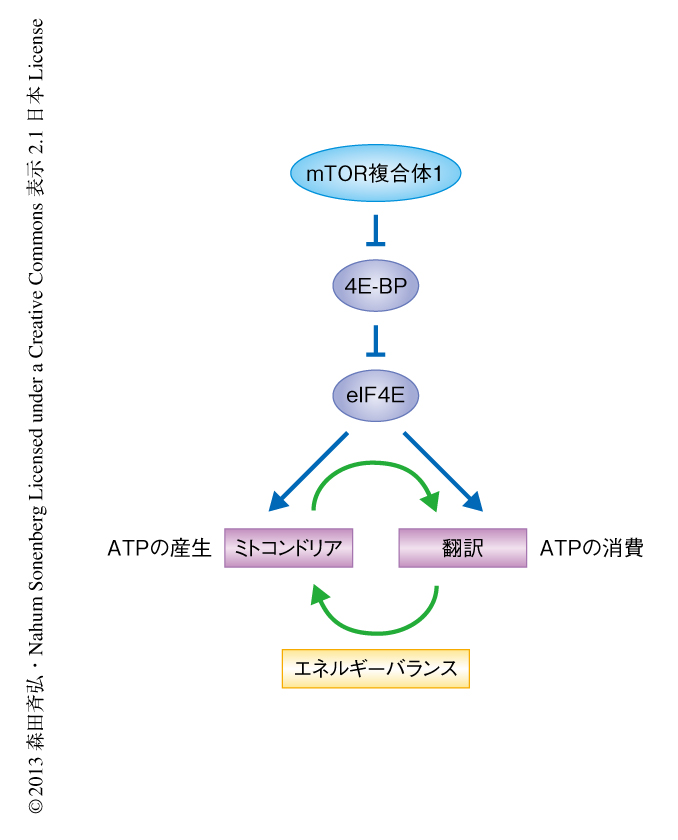
この研究は,mTOR複合体1が4E-BPを介した翻訳の制御によりミトコンドリアタンパク質の発現を選択的に制御し,ミトコンドリアの機能を活性化していることを明らかにした.その結果,mTOR複合体1-4E-BPシグナル伝達系は,タンパク質合成と,それに必要とされるATPの産生を担うミトコンドリアの機能とを同時に制御することにより,細胞におけるエネルギーバランスの維持に重要な役割をはたしているという新たなモデルを提唱した(図2).
以前の研究において,筆者らは,mTORの下流において翻訳の制御をうけるmRNAの網羅的な探索として,mTORのキナーゼ活性の阻害剤であるasTORiとポリソーム分離法とを組み合わせたトランスレイトーム解析を行った6).mTORの標的として約500のmRNAが同定され,どのような機能をもつmRNAが含まれるか調べたところ,予想されたように,細胞周期にかかわるタンパク質をコードするmRNAが多く同定された.興味深いことに,ミトコンドリアタンパク質をコードするmRNAがもっとも多く同定され,とくに,ミトコンドリアにおけるATP合成酵素複合体あるいは呼吸鎖複合体Iの構成タンパク質をコードするmRNAが多く含まれていた.また,ミトコンドリアの合成やリボソームにかかわるタンパク質をコードするmRNAも多く同定された.
個々のミトコンドリアタンパク質の翻訳活性や発現量がasTORiにより抑制されるかどうか調べた.これまでに報告されていたように,asTORiは4E-BPおよびリボソームタンパク質S6のリン酸化を抑制し,細胞におけるタンパク質合成を約35%減少させていた.このことは,asTORiが特定のmRNAの翻訳を抑制していることを示唆し,実際に,同定されたミトコンドリアタンパク質の翻訳は抑制していたが,βアクチンをコードするmRNAの翻訳は抑制していなかった.asTORiにより処理された細胞において,これらのミトコンドリアタンパク質の発現量の低下もみられた.以上のことより,mTORシグナルの抑制は翻訳の阻害を介し選択的にミトコンドリアタンパク質の発現量の低下をひき起こすことを見い出した.
ミトコンドリアは好気的な呼吸の行われる場であり,酸素を消費することによりATPを合成する.すなわち,解糖系により産生されたピルビン酸を利用することにより,TCA回路,電子伝達系,酸化的リン酸化を介してATPが合成される.mTORのキナーゼ活性の阻害剤であるasTORiはミトコンドリアタンパク質の翻訳を抑制することから,細胞においてミトコンドリアに依存的な呼吸量を調べたところ,asTORiは酸素消費を抑制した.また,質量分析計によりTCA回路および解糖系における代謝産物の量を調べたところ,asTORiによりTCA回路の中間代謝産物の量は減少し,また,解糖系により産生される乳酸およびピルビン酸の減少もみられた.一方,asTORiにより処理された細胞にはグルコースの蓄積がみられ,この結果は,mTORが解糖系を刺激するという報告と一致した7,8).放射性同位体により標識したグルコースを用いて解糖系およびTCA回路へのグルコースの流量を調べたところ,mTORの阻害は解糖系だけでなくTCA回路の抑制をひき起こすことが明らかになった.さらに,asTORiが細胞におけるミトコンドリアの量を減少させることも確認された.asTORiにより処理された細胞において観察されたミトコンドリアの機能および解糖系の抑制と合致するように,細胞におけるATP量の減少が観察された.これらの結果から,mTORの阻害はTCA回路やATPの合成などミトコンドリアの機能を抑制することによりATPの生産能を低下させることが明らかになった.
asTORiはラパマイシンと異なりmTOR複合体1だけでなくmTOR複合体2も抑制する(図1).RaptorはmTOR複合体1の,RictorはmTOR複合体2の特異的な構成タンパク質として知られており,この特異的な構成タンパク質をノックダウンすることによりmTOR複合体1とmTOR複合体2の機能を別々に解析することができる.RaptorのノックダウンはS6Kや4E-BPのリン酸化を減少させ,RictorのノックダウンはAktのリン酸化を減少させた.これらの細胞において,酸素消費やTCA回路などミトコンドリアの活性を調べたところ,Raptorのノックダウンだけが酸素消費量を低下させ,また,クエン酸やαケトグルタル酸などTCA回路の中間代謝産物の量の減少をひき起こした.興味深いことに,乳酸やピルビン酸の量の低下は,Raptorをノックダウンした細胞だけでなくRictorをノックダウンした細胞においても確認された.このことは,mTOR複合体2が解糖系を制御しているという報告と一致した8).また,細胞におけるミトコンドリアやATPの量の低下もRaptorをノックダウンした細胞においてのみ観察された.以上のことから,mTOR複合体1のかかわるシグナル伝達系がおもにミトコンドリアの制御を担うことが示唆された.
mTOR複合体1は低分子量GTPaseであるRhebにより活性化され,RhebはTSC1-TSC2複合体により抑制されることが知られている(図1).TSC2をノックアウトした細胞においてはmTOR複合体1の恒常的な活性化のみられることから,TSC2ノックアウト細胞を用いてミトコンドリアにおけるmTOR複合体1の役割を確認した.予想されたように,野生型の細胞と比較してTSC2ノックアウト細胞においては4E-BPおよびS6Kのリン酸化の上昇が確認され,また,ミトコンドリアタンパク質の翻訳の活性および発現量の上昇も確認された.これらの結果と一致するように,mTOR複合体1が活性化した細胞においては酸素消費量,ミトコンドリアの量,ATP量の増加が確認された.以上の結果より,mTOR複合体1はミトコンドリアタンパク質の翻訳を刺激することによりミトコンドリアの活性化および合成を促進することが明らかになった.
mTOR複合体1はおもに4E-BPを介して翻訳を制御していることから,mTOR複合体1に依存的なミトコンドリアの制御における4E-BPの役割について調べた.4E-BP(4E-BP1および4E-BP2)をノックダウンした細胞をmTORのキナーゼ活性の阻害剤であるasTORiで処理したところ,対照となる細胞においてみられたasTORiによるタンパク質合成の阻害は4E-BPノックダウン細胞ではみられなかった.個々のmRNAについても,asTORiによるミトコンドリアタンパク質の翻訳および発現量の抑制は4E-BPノックダウン細胞ではみられなかった.このことは,4E-BPがmTOR複合体1によるミトコンドリアタンパク質の翻訳の活性化に重要であることを示唆した.asTORiによるミトコンドリアの機能の抑制における4E-BPの役割について検討したところ,4E-BPノックダウン細胞ではasTORiによる酸素消費の抑制への抵抗性がみられた.さらに,放射性同位体により標識したグルコースを用いて解糖系あるいはTCA回路の制御におけるmTOR複合体1に依存的な4E-BPの役割について調べたところ,対照となる細胞においてはasTORiにより解糖系およびTCA回路の活性は抑制されたが,4E-BPのノックダウンによりこの抑制は減弱した.また,asTORiによりひき起こされるミトコンドリアの量の減少は,4E-BPのノックダウンにより回復することを見い出した.その結果,4E-BPノックダウン細胞では対照となる細胞においてみられるようなasTORiによるATP量の減少はみられなくなった.これらの結果は,mTOR複合体1によるミトコンドリアタンパク質の翻訳の促進およびミトコンドリアの機能の活性化は4E-BPを介することを示唆した.
mTOR複合体1からの翻訳制御のシグナルは,4E-BPだけでなくS6Kを介しても伝達することが知られている(図1).そこで,S6K(S6K1およびS6K2)をノックアウトした細胞を用いてmTOR複合体1によるミトコンドリアの機能の制御におけるS6Kの役割について調べた.asTORiはS6Kノックアウト細胞においても対照となる細胞と同じように酸素消費を抑制しTCA回路の活性も抑制した.また,転写因子であるPGC-1αおよびHIF-1αはmTOR複合体1の下流において解糖系やミトコンドリアの機能を制御することが報告されている7,9).そこで,これらの転写因子の役割についても考察したところ,PGC-1αあるいはHIF-1αの欠損はmTOR複合体1による解糖系あるいはミトコンドリアの機能の制御に対し影響しなかった.そのほかの解析からも,mTOR複合体1の下流においては転写の制御よりも翻訳の制御が先行して起こっていることが示唆された.以上のことから,mTOR複合体1によるミトコンドリアの機能の制御は,おもに4E-BPを介することが明らかになった.
mTOR複合体1の活性の阻害はオートファジーを活性化し,ミトコンドリアを含むオルガネラの分解をひき起こす(図1).オートファジーを制御するタンパク質であるATG5をノックダウンした細胞を用いて,mTOR複合体1に依存的なミトコンドリアの機能の制御におけるオートファジーの役割について調べた.その結果,mTOR複合体1の下流において4E-BPによる翻訳の制御とオートファジーとは協調してミトコンドリアの合成を制御していることが示唆された.
この研究では,mTOR複合体1が翻訳を制御するタンパク質である4E-BPを介しミトコンドリアタンパク質の発現量を増加させ,ミトコンドリアにおけるATPの生産能を増大させることを明らかにした.このことは,mTOR複合体1が翻訳を制御するタンパク質を介し,タンパク質の生合成だけでなくそれに必要とされるATPを供給するという正のフィードバック機構を形成していることを示唆した(図2).これまでに,mTOR複合体1-4E-BPシグナル伝達系はサイクリンなどの翻訳を活性化することにより細胞周期の進行を促進していることが明らかになっていたが,この研究から,ミトコンドリアや解糖系などの代謝系も制御していることが明らかになり,mTOR複合体1-4E-BPシグナル伝達系はこれらの制御を介して細胞の増殖を活性化していることが示唆された.代謝系のリプログラミングはがん細胞における大きな特徴のひとつであり,好気的な条件にもかかわらず解糖系が活性化されるワールブルグ効果はそのひとつである.また,分裂している細胞は同時にリン脂質や核酸など細胞を構成する成分を必要としており,ミトコンドリアもこれらの産生に貢献していることが知られている2).mTOR複合体1-4E-BPシグナル伝達系によるミトコンドリアおよび解糖系の制御機構の解明は,mTORのキナーゼ活性の阻害剤であり抗がん剤として期待されるasTORiの作用機序を知るうえで重要な発見であると考えられる.
また,糖尿病などの代謝系の疾患においてもmTORの恒常的な活性化が確認されている.さらに,mTOR複合体1の機能の抑制が延命効果をもたらすことも報告されており,mTOR複合体1による代謝系の制御は注目をあびている.今回,同定したmTOR複合体1-4E-BPシグナル伝達系によるミトコンドリアの機能の制御は,mTORによる新たな代謝制御機構として興味深い研究課題であると考えられる.
略歴:2008年 東京大学大学院理学系研究科 修了,同年 東京大学医科学研究所 博士研究員を経て,2010年よりカナダMcGill大学 博士研究員.
研究テーマ:肥満やがんなどの疾患におけるmRNAの分解や翻訳の制御機構.
関心事:RNAによる生体機能の制御.
Nahum Sonenberg
カナダMcGill大学 教授.
© 2013 森田斉弘・Nahum Sonenberg Licensed under CC 表示 2.1 日本
(カナダMcGill大学Department of Biochemistry)
email:森田斉弘
DOI: 10.7875/first.author.2013.156
mTORC1 controls mitochondrial activity and biogenesis through 4E-BP-dependent translational regulation.
Masahiro Morita, Simon-Pierre Gravel, Valérie Chénard, Kristina Sikström, Liang Zheng, Tommy Alain, Valentina Gandin, Daina Avizonis, Meztli Arguello, Chadi Zakaria, Shannon McLaughlan, Yann Nouet, Arnim Pause, Michael Pollak, Eyal Gottlieb, Ola Larsson, Julie St-Pierre, Ivan Topisirovic, Nahum Sonenberg
Cell Metabolism, 18, 698-711 (2013)
この論文に出現する遺伝子・タンパク質のUniprot ID
mTOR複合体1, 4E-BP, mTORC1, eIF4E(P06730), mTOR, mechanistic/mammalian target of rapamycin, セリン/スレオニンキナーゼ, mTOR複合体2, mTORC2, Akt, SGK, S6K, ribosomal protein S6 kinase, HIF-1α(Q16665), PGC-1α(Q9UBK2), SREBP, ATP合成酵素, 呼吸鎖複合体I, リボソームタンパク質S6(P62753), βアクチン, Raptor(Q8N122), Rictor(Q6R327), Rheb(Q15382), TSC1(Q92574), TSC2(P49815), 4E-BP1(Q13541), 4E-BP2(Q13542), S6K1(P23443), S6K2(Q9UBS0), ATG5(Q9H1Y0), サイクリン, PI3キナーゼ, PI3K, Ulk複合体
要 約
タンパク質の生合成は細胞においてもっともエネルギーを消費する過程であり,細胞におけるATPの20~30%を消費する.タンパク質合成とATPの産生とのエネルギーバランスの維持は細胞の増殖にとり重要であり,その破綻はがんや糖尿病などの疾患や老化と密接にかかわる.mTOR複合体1は翻訳や脂質代謝および糖代謝を制御していることが知られている.筆者らは,mTOR複合体1が翻訳開始因子であるeIF4Eの結合タンパク質4E-BPを介しミトコンドリアタンパク質の翻訳を選択的に促進することにより,ミトコンドリアの機能を活性化していることを明らかにした.mTOR複合体1-4E-BPシグナル伝達系によるミトコンドリアの活性化は,タンパク質合成のため必要とされるATPの産生能を増大させ,エネルギー恒常性の維持に重要であると考えられる.この研究では,mTORの異常な活性化がみられるがんや糖尿病といった代謝に関連する疾患におけるmTOR複合体1シグナル伝達系の一端を明らかにした.
はじめに
タンパク質の生合成は細胞においてもっともエネルギーを消費する過程のひとつであり,細胞におけるATP総消費量の20~30%をしめると考えられている1).ミトコンドリアは哺乳動物の細胞においてATPをおもに産生するオルガネラであり,細胞におけるエネルギーバランスの維持において重要な役割をはたす2).また,がん細胞のような増殖する細胞において,ミトコンドリアは新たな細胞に必要とされるリン脂質や核酸などの生合成においても重要な役割をはたす2).
mTOR(mechanistic/mammalian target of rapamycin)は酵母からヒトまで保存されたセリン/スレオニンキナーゼであり,成長因子やアミノ酸,ストレスなど細胞の内外からのさまざまなシグナルを感知し,細胞の成長,代謝,生存を制御している3).mTORはmTOR複合体1およびmTOR複合体2という機能の異なる2種類のタンパク質複合体を形成している(図1).mTOR複合体1は翻訳にかかわるタンパク質や転写因子を介しタンパク質合成および脂質合成などの同化代謝や細胞周期の進行を制御している.mTORC2はAktやSGKなどのキナーゼを介して細胞骨格や細胞の生存,糖代謝および脂質代謝を制御している.がんや糖尿病などの疾患や病態においてmTORシグナルの異常な亢進が観察されており,免疫抑制作用や抗がん作用の知られているラパマイシンやその誘導体はmTOR複合体1を特異的に抑制することが知られている.近年は,mTORのキナーゼ活性を標的にした阻害剤asTORi(active-site mTOR inhibitor)が開発されており,新たな抗がん剤として期待されている4).
mTOR複合体1は,翻訳開始因子eIF4Eの結合タンパク質である4E-BPおよびS6K(ribosomal protein S6 kinase)を含む下流の標的タンパク質をリン酸化することによりタンパク質合成を活性化する5)(図1).eIF4EはmRNAの5’キャップ構造に結合し,リボソームをmRNAへと導入することにより翻訳の開始を制御している.4E-BPはeIF4Eと結合することによりリボソームの導入を抑制し翻訳を阻害する.4E-BPの活性はmTOR複合体1によるリン酸化により制御されており,高リン酸化型の4E-BPはeIF4Eから遊離し翻訳は活性化される.また,mTOR複合体1はHIF-1α,PGC-1α,SREBPなどの転写因子を介しても糖代謝および脂質代謝やミトコンドリアの制御を行うことが知られている3).
この研究は,mTOR複合体1が4E-BPを介した翻訳の制御によりミトコンドリアタンパク質の発現を選択的に制御し,ミトコンドリアの機能を活性化していることを明らかにした.その結果,mTOR複合体1-4E-BPシグナル伝達系は,タンパク質合成と,それに必要とされるATPの産生を担うミトコンドリアの機能とを同時に制御することにより,細胞におけるエネルギーバランスの維持に重要な役割をはたしているという新たなモデルを提唱した(図2).
1.asTORiによるミトコンドリアタンパク質の翻訳の阻害
以前の研究において,筆者らは,mTORの下流において翻訳の制御をうけるmRNAの網羅的な探索として,mTORのキナーゼ活性の阻害剤であるasTORiとポリソーム分離法とを組み合わせたトランスレイトーム解析を行った6).mTORの標的として約500のmRNAが同定され,どのような機能をもつmRNAが含まれるか調べたところ,予想されたように,細胞周期にかかわるタンパク質をコードするmRNAが多く同定された.興味深いことに,ミトコンドリアタンパク質をコードするmRNAがもっとも多く同定され,とくに,ミトコンドリアにおけるATP合成酵素複合体あるいは呼吸鎖複合体Iの構成タンパク質をコードするmRNAが多く含まれていた.また,ミトコンドリアの合成やリボソームにかかわるタンパク質をコードするmRNAも多く同定された.
個々のミトコンドリアタンパク質の翻訳活性や発現量がasTORiにより抑制されるかどうか調べた.これまでに報告されていたように,asTORiは4E-BPおよびリボソームタンパク質S6のリン酸化を抑制し,細胞におけるタンパク質合成を約35%減少させていた.このことは,asTORiが特定のmRNAの翻訳を抑制していることを示唆し,実際に,同定されたミトコンドリアタンパク質の翻訳は抑制していたが,βアクチンをコードするmRNAの翻訳は抑制していなかった.asTORiにより処理された細胞において,これらのミトコンドリアタンパク質の発現量の低下もみられた.以上のことより,mTORシグナルの抑制は翻訳の阻害を介し選択的にミトコンドリアタンパク質の発現量の低下をひき起こすことを見い出した.
2.asTORiによるミトコンドリアの機能および合成の抑制
ミトコンドリアは好気的な呼吸の行われる場であり,酸素を消費することによりATPを合成する.すなわち,解糖系により産生されたピルビン酸を利用することにより,TCA回路,電子伝達系,酸化的リン酸化を介してATPが合成される.mTORのキナーゼ活性の阻害剤であるasTORiはミトコンドリアタンパク質の翻訳を抑制することから,細胞においてミトコンドリアに依存的な呼吸量を調べたところ,asTORiは酸素消費を抑制した.また,質量分析計によりTCA回路および解糖系における代謝産物の量を調べたところ,asTORiによりTCA回路の中間代謝産物の量は減少し,また,解糖系により産生される乳酸およびピルビン酸の減少もみられた.一方,asTORiにより処理された細胞にはグルコースの蓄積がみられ,この結果は,mTORが解糖系を刺激するという報告と一致した7,8).放射性同位体により標識したグルコースを用いて解糖系およびTCA回路へのグルコースの流量を調べたところ,mTORの阻害は解糖系だけでなくTCA回路の抑制をひき起こすことが明らかになった.さらに,asTORiが細胞におけるミトコンドリアの量を減少させることも確認された.asTORiにより処理された細胞において観察されたミトコンドリアの機能および解糖系の抑制と合致するように,細胞におけるATP量の減少が観察された.これらの結果から,mTORの阻害はTCA回路やATPの合成などミトコンドリアの機能を抑制することによりATPの生産能を低下させることが明らかになった.
3.mTOR複合体1による翻訳の制御を介したミトコンドリアの機能の制御
asTORiはラパマイシンと異なりmTOR複合体1だけでなくmTOR複合体2も抑制する(図1).RaptorはmTOR複合体1の,RictorはmTOR複合体2の特異的な構成タンパク質として知られており,この特異的な構成タンパク質をノックダウンすることによりmTOR複合体1とmTOR複合体2の機能を別々に解析することができる.RaptorのノックダウンはS6Kや4E-BPのリン酸化を減少させ,RictorのノックダウンはAktのリン酸化を減少させた.これらの細胞において,酸素消費やTCA回路などミトコンドリアの活性を調べたところ,Raptorのノックダウンだけが酸素消費量を低下させ,また,クエン酸やαケトグルタル酸などTCA回路の中間代謝産物の量の減少をひき起こした.興味深いことに,乳酸やピルビン酸の量の低下は,Raptorをノックダウンした細胞だけでなくRictorをノックダウンした細胞においても確認された.このことは,mTOR複合体2が解糖系を制御しているという報告と一致した8).また,細胞におけるミトコンドリアやATPの量の低下もRaptorをノックダウンした細胞においてのみ観察された.以上のことから,mTOR複合体1のかかわるシグナル伝達系がおもにミトコンドリアの制御を担うことが示唆された.
mTOR複合体1は低分子量GTPaseであるRhebにより活性化され,RhebはTSC1-TSC2複合体により抑制されることが知られている(図1).TSC2をノックアウトした細胞においてはmTOR複合体1の恒常的な活性化のみられることから,TSC2ノックアウト細胞を用いてミトコンドリアにおけるmTOR複合体1の役割を確認した.予想されたように,野生型の細胞と比較してTSC2ノックアウト細胞においては4E-BPおよびS6Kのリン酸化の上昇が確認され,また,ミトコンドリアタンパク質の翻訳の活性および発現量の上昇も確認された.これらの結果と一致するように,mTOR複合体1が活性化した細胞においては酸素消費量,ミトコンドリアの量,ATP量の増加が確認された.以上の結果より,mTOR複合体1はミトコンドリアタンパク質の翻訳を刺激することによりミトコンドリアの活性化および合成を促進することが明らかになった.
4.mTOR複合体1に依存的なミトコンドリアの制御は4E-BPを介する
mTOR複合体1はおもに4E-BPを介して翻訳を制御していることから,mTOR複合体1に依存的なミトコンドリアの制御における4E-BPの役割について調べた.4E-BP(4E-BP1および4E-BP2)をノックダウンした細胞をmTORのキナーゼ活性の阻害剤であるasTORiで処理したところ,対照となる細胞においてみられたasTORiによるタンパク質合成の阻害は4E-BPノックダウン細胞ではみられなかった.個々のmRNAについても,asTORiによるミトコンドリアタンパク質の翻訳および発現量の抑制は4E-BPノックダウン細胞ではみられなかった.このことは,4E-BPがmTOR複合体1によるミトコンドリアタンパク質の翻訳の活性化に重要であることを示唆した.asTORiによるミトコンドリアの機能の抑制における4E-BPの役割について検討したところ,4E-BPノックダウン細胞ではasTORiによる酸素消費の抑制への抵抗性がみられた.さらに,放射性同位体により標識したグルコースを用いて解糖系あるいはTCA回路の制御におけるmTOR複合体1に依存的な4E-BPの役割について調べたところ,対照となる細胞においてはasTORiにより解糖系およびTCA回路の活性は抑制されたが,4E-BPのノックダウンによりこの抑制は減弱した.また,asTORiによりひき起こされるミトコンドリアの量の減少は,4E-BPのノックダウンにより回復することを見い出した.その結果,4E-BPノックダウン細胞では対照となる細胞においてみられるようなasTORiによるATP量の減少はみられなくなった.これらの結果は,mTOR複合体1によるミトコンドリアタンパク質の翻訳の促進およびミトコンドリアの機能の活性化は4E-BPを介することを示唆した.
mTOR複合体1からの翻訳制御のシグナルは,4E-BPだけでなくS6Kを介しても伝達することが知られている(図1).そこで,S6K(S6K1およびS6K2)をノックアウトした細胞を用いてmTOR複合体1によるミトコンドリアの機能の制御におけるS6Kの役割について調べた.asTORiはS6Kノックアウト細胞においても対照となる細胞と同じように酸素消費を抑制しTCA回路の活性も抑制した.また,転写因子であるPGC-1αおよびHIF-1αはmTOR複合体1の下流において解糖系やミトコンドリアの機能を制御することが報告されている7,9).そこで,これらの転写因子の役割についても考察したところ,PGC-1αあるいはHIF-1αの欠損はmTOR複合体1による解糖系あるいはミトコンドリアの機能の制御に対し影響しなかった.そのほかの解析からも,mTOR複合体1の下流においては転写の制御よりも翻訳の制御が先行して起こっていることが示唆された.以上のことから,mTOR複合体1によるミトコンドリアの機能の制御は,おもに4E-BPを介することが明らかになった.
5.オートファジーおよび翻訳の制御によるミトコンドリアの合成の制御
mTOR複合体1の活性の阻害はオートファジーを活性化し,ミトコンドリアを含むオルガネラの分解をひき起こす(図1).オートファジーを制御するタンパク質であるATG5をノックダウンした細胞を用いて,mTOR複合体1に依存的なミトコンドリアの機能の制御におけるオートファジーの役割について調べた.その結果,mTOR複合体1の下流において4E-BPによる翻訳の制御とオートファジーとは協調してミトコンドリアの合成を制御していることが示唆された.
おわりに
この研究では,mTOR複合体1が翻訳を制御するタンパク質である4E-BPを介しミトコンドリアタンパク質の発現量を増加させ,ミトコンドリアにおけるATPの生産能を増大させることを明らかにした.このことは,mTOR複合体1が翻訳を制御するタンパク質を介し,タンパク質の生合成だけでなくそれに必要とされるATPを供給するという正のフィードバック機構を形成していることを示唆した(図2).これまでに,mTOR複合体1-4E-BPシグナル伝達系はサイクリンなどの翻訳を活性化することにより細胞周期の進行を促進していることが明らかになっていたが,この研究から,ミトコンドリアや解糖系などの代謝系も制御していることが明らかになり,mTOR複合体1-4E-BPシグナル伝達系はこれらの制御を介して細胞の増殖を活性化していることが示唆された.代謝系のリプログラミングはがん細胞における大きな特徴のひとつであり,好気的な条件にもかかわらず解糖系が活性化されるワールブルグ効果はそのひとつである.また,分裂している細胞は同時にリン脂質や核酸など細胞を構成する成分を必要としており,ミトコンドリアもこれらの産生に貢献していることが知られている2).mTOR複合体1-4E-BPシグナル伝達系によるミトコンドリアおよび解糖系の制御機構の解明は,mTORのキナーゼ活性の阻害剤であり抗がん剤として期待されるasTORiの作用機序を知るうえで重要な発見であると考えられる.
また,糖尿病などの代謝系の疾患においてもmTORの恒常的な活性化が確認されている.さらに,mTOR複合体1の機能の抑制が延命効果をもたらすことも報告されており,mTOR複合体1による代謝系の制御は注目をあびている.今回,同定したmTOR複合体1-4E-BPシグナル伝達系によるミトコンドリアの機能の制御は,mTORによる新たな代謝制御機構として興味深い研究課題であると考えられる.
文 献
- Buttgereit, F. & Brand, M. D.: A hierarchy of ATP-consuming processes in mammalian cells. Biochem. J., 312, 163-167 (1995)[PubMed]
- Ward, P. S. & Thompson, C. B.: Metabolic reprogramming: a cancer hallmark even warburg did not anticipate. Cancer Cell, 21, 297-308 (2012)[PubMed]
- Laplante, M. & Sabatini, D. M.: mTOR signaling in growth control and disease. Cell, 149, 274-293 (2012)[PubMed]
- Benjamin, D., Colombi, M., Moroni, C. et al.: Rapamycin passes the torch: a new generation of mTOR inhibitors. Nat. Rev. Drug Discov., 10, 868-880 (2011)[PubMed]
- Roux, P. P. & Topisirovic, I.: Regulation of mRNA translation by signaling pathways. Cold Spring Harb. Perspect. Biol., 4, a012252 (2012)[PubMed]
- Larsson, O., Morita, M., Topisirovic, I. et al.: Distinct perturbation of the translatome by the antidiabetic drug metformin. Proc. Natl. Acad. Sci. USA, 109, 8977-8982 (2012)[PubMed]
- Duvel, K., Yecies, J. L., Menon, S. et al.: Activation of a metabolic gene regulatory network downstream of mTOR complex 1. Mol. Cell, 39, 171-183 (2010)[PubMed]
- Hagiwara, A., Cornu, M., Cybulski, N. et al.: Hepatic mTORC2 activates glycolysis and lipogenesis through Akt, glucokinase, and SREBP1c. Cell Metab., 15, 725-738 (2012)[PubMed]
- Cunningham, J. T., Rodgers, J. T., Arlow, D. H. et al.: mTOR controls mitochondrial oxidative function through a YY1-PGC-1α transcriptional complex. Nature, 450, 736-740 (2007)[PubMed]
著者プロフィール
略歴:2008年 東京大学大学院理学系研究科 修了,同年 東京大学医科学研究所 博士研究員を経て,2010年よりカナダMcGill大学 博士研究員.
研究テーマ:肥満やがんなどの疾患におけるmRNAの分解や翻訳の制御機構.
関心事:RNAによる生体機能の制御.
Nahum Sonenberg
カナダMcGill大学 教授.
© 2013 森田斉弘・Nahum Sonenberg Licensed under CC 表示 2.1 日本