哺乳類の大脳皮質における神経活性に依存的なBtbd3を介した樹状突起の方向性の制御
松居亜寿香・下郡智美
(理化学研究所脳科学総合研究センター 視床発生研究チーム)
email:松居亜寿香,下郡智美
DOI: 10.7875/first.author.2013.155
BTBD3 controls dendrite orientation toward active axons in mammalian neocortex.
Asuka Matsui, May Tran, Aya C. Yoshida, Satomi S. Kikuchi, Mami U, Masaharu Ogawa, Tomomi Shimogori
Science, 342, 1114-1118 (2013)
多数のニューロンからなる脳が正常に機能するためには,ニューロンどうしが正しく接続され情報のやりとりが行われる必要がある.この接続は多くの場合,ニューロンから情報を出力する軸索と入力をうける樹状突起からなる神経回路の形成により行われる.発生の過程の脳において,ニューロンはどの方向から軸索が伸長してきても接続することができるよう,さまざまな方向にむけ必要な数より多くの樹状突起を延ばしている.しかし,正しい軸索との接続ののち,不要となった樹状突起を残しておくことはまちがった接続をつくりだす可能性がある.そのため,過剰な樹状突起のうち不要なものを除去する機構は非常に重要である.今回の研究において,Btbd3がニューロンにおける余剰な樹状突起の除去に重要な役割を担うこと,そして,この分子機構が哺乳類の大脳皮質のさまざまな領域で保存された普遍的なものであることが明らかにされた.この分子機構は発生の過程の脳においてニューロンのあいだの接続ミスや混線をふせぎ,効率的な神経回路を形成することにより脳の機能の向上を担う可能性が示唆された.
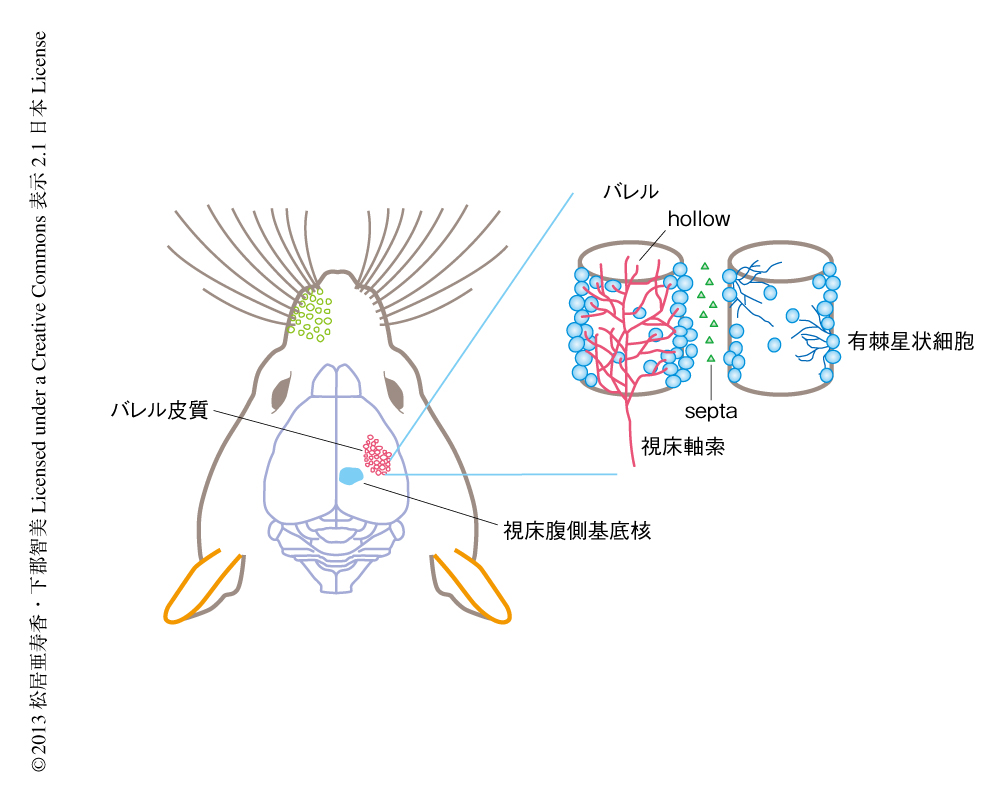
マウスの大脳皮質の体性感覚野にはバレル皮質とよばれるヒゲからの情報を処理する特徴的な構造がある.バレル皮質では1本のヒゲからの情報を中継する視床軸索が束をつくり,その視床軸索の束をとりかこむようにして大脳皮質第4層のニューロンがならんでいる.バレルの中心部をhollowとよび,バレルのあいだの隙間をseptaとよぶ(図1).大脳皮質第4層のニューロンの樹状突起は生後まもなくはすべての方向に延びた状態であるが,そののち,その形態を劇的に変化させ,最終的にhollowの側にむかってのみ樹状突起を延ばした状態になる.これによりhollowに入力する視床軸索と効率的にシナプスを形成することができる1)(図1).この生後1週目に起こる,不要な樹状突起の除去,および,必要な樹状突起の維持をつうじて形成される樹状突起の方向性にはヒゲからの入力が必要なことが知られているが,詳細な分子機構については不明な点が多い2).
そこで,樹状突起の形態が変化する生後のバレル皮質に発現する遺伝子を探索し,樹状突起の方向性に関する機能を明らかにしようと試みた.
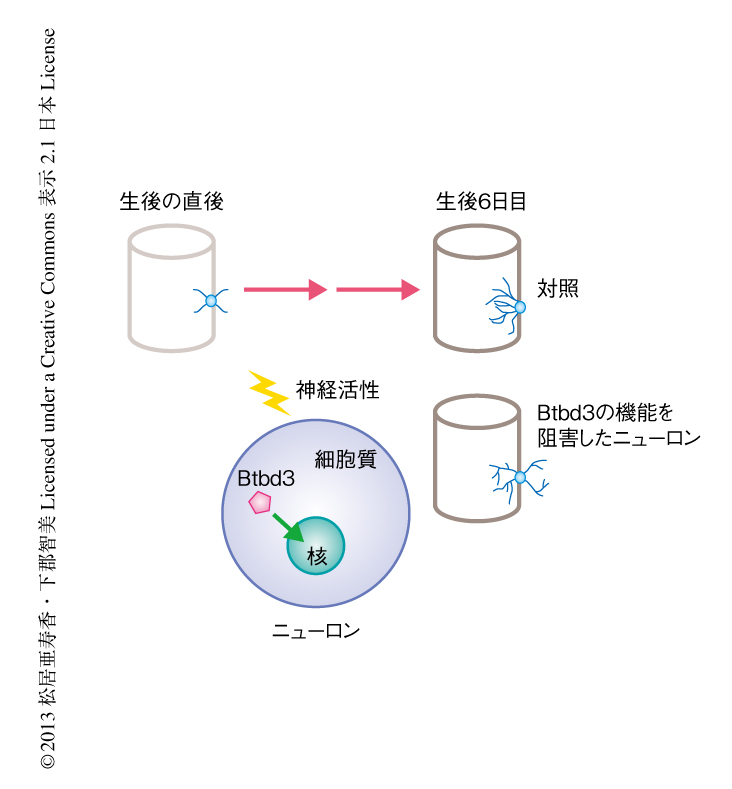
まず,Allen Brain Atlasというマウスの遺伝子発現データベースを使い,hollowに特異的に発現するBtbd3(BTB/POZ domain containing 3)遺伝子を見い出した.Btbd3のもつBTBドメインはタンパク質-タンパク質間の相互作用にかかわり,酵母からヒトにいたる多くの生物種に見い出されている.同じくBTBドメインをもつショウジョウバエのAbruptは感覚ニューロンの樹状突起の形態制御にかかわることが知られている3,4).このことから,Btbd3がバレル皮質において樹状突起の形態制御にかかわるのではないかと考えた.Btbd3は生後0日目では大脳皮質に発現していないが,生後2日目から発現しはじめ,生後6日目でバレルと同様の発現パターンを示し,樹状突起がその形態を変化させる時期をとおし発現することがわかった.Btbd3の機能阻害を行うため,子宮内エレクトロポレーション法を用いて大脳皮質第4層の細胞が生まれる時期である胎生13.5日目においてshRNAを遺伝子導入しBtbd3をノックダウンした.そののち,バレル皮質の形成される生後6日に達するのを待ち,体性感覚野におけるバレル皮質のニューロンの形態を共焦点顕微鏡により解析した.その結果,Btbd3をノックダウンしたニューロンはその樹状突起を本来は除去されるはずのseptaの側にも維持した状態となり,hollowにだけ樹状突起をむけた正しい形態を失うことが明らかになった(図2).
これまでの報告において,ヒゲからの入力を失うとhollowへのみ樹状突起を延ばすという樹状突起の方向性を失うことなどから神経活性の重要性が示されている5,6).このことから,Btbd3の発現を抑制した場合と同様に,樹状突起の方向性の失われた大脳皮質に特異的なNMDA受容体ノックアウトマウスを用いてBtbd3の発現を調べたところ,Btbd3の発現は維持され,かつ,総タンパク質量も変化していないことがわかった.しかしながら,Btbd3はNMDA受容体ノックアウトマウスでは細胞質画分に,野生型マウスでは核に多く存在したことから,Btbd3が神経活性により細胞質から核へと移行することが明らかになり,この核への移行が樹状突起の方向性の決定に重要であることが示唆された(図2).
バレル皮質における機能欠損実験の結果から,Btbd3は視床軸索からの入力の多いhollowの側の樹状突起を維持し,入力の少ない樹状突起を除去することにより効率的な神経回路の形成を行っていることが明らかにされた.そこで,機能獲得実験によりBtbd3を強制的に発現させ,神経活性の入力に応じて樹状突起を除去し方向性を変化させることができるようになるかどうか調べた.実験では,Btbd3を発現していないマウスの第1次視覚野に胎生13.5日目においてエレクトロポレーション法を用いてBtbd3を発現させた.さらに,神経活性の入力の強弱をつくりだすため片眼の遮蔽を行った.これにより,閉じた眼に由来する入力しかうけない単眼領域の神経活性は低く,開いた眼と閉じた眼の両方に由来する入力をうける両眼領域の神経活性は高い状態がつくることができた.そして,4日後に単眼領域と両眼領域との境界に存在するニューロンの樹状突起の形態を観察した.その結果,Btbd3が存在しない状態で片眼を閉じた場合にはニューロンはその樹状突起の形態を変化させなかったが,Btbd3を強制発現させた視覚野では樹状突起がその形態を変化させ,より強い入力,つまり,開いた目からの入力もうける両眼領域に樹状突起をむけていた.このことから,Btbd3を獲得することにより,ニューロンは入力に応じて不要な樹状突起を除去し,強い入力をうける領域に樹状突起をむけることができるようになることが示された.
筆者らの研究室の以前の報告において,Btbd3はマーモセットの第1次視覚野の4層細胞に特異的に発現することが報告されている7).マーモセットは眼優位性カラム構造をもち,視覚系の発達のすぐれた動物である.このことから,Btbd3が樹状突起の方向性を入力に依存して変化させることにより,眼優位性カラムにおいて効率的な神経回路の形成に機能している可能性が示唆された.そこで,マーモセットと同様に眼優位性カラムをもち8),第1次視覚野においてBtbd3が強く発現しているフェレットを用いてその検証を行った.まず,子宮内エレクトロポレーション法を用いてフェレットの胎仔の第1次視覚野に蛍光タンパク質GFPをコードするプラスミドを遺伝子導入した9).胎仔が生後12日目に達するのを待ち片眼の摘出を行うと,視覚野のニューロンは開いた目からの入力をうける領域に樹状突起をむけるようになった.しかし,エレクトロポレーション法によりshRNAを遺伝子導入し第1次視覚野においてBtbd3をノックダウンしたニューロンでは,入力に強弱があるにもかかわらず弱い入力をうける樹状突起の除去は起こらず形態は変化しなかった.このことから,種をこえて,かつ,大脳皮質の異なる領域においても,Btbd3は弱い入力をうける樹状突起を除去できることが明らかにされた.
今回,筆者らは,大脳皮質のニューロンにおける,神経活性の入力に依存的な樹状突起の除去にBtbd3が重要な役割をはたすことを明らかにした.また,このBtbd3を介した樹状突起の形態制御はほかの動物種においても保存されていることを示した.今回の研究から,生後の発生の過程において形成された過剰な樹状突起の除去機構の一端が明らかになった.今後は,核に移行したBtbd3がどのようにして不要な樹状突起を除去するのか,そのくわしい分子機構の解析,また,不要な樹状突起が除去されず残存することによりどのような機能的な障害が起こるのかを明らかにしていきたい.そしてさらには,この成果がヒトにおいて神経回路の混線が生じた場合に起こる,脳機能の障害や精神疾患の分子機構の解明につながると期待している.
略歴:2010年 大阪大学大学院生命機能研究科 修了,同年より理化学研究所脳科学総合研究センター 研究員.
研究テーマ:神経活性に応じた神経回路の形成.
下郡 智美(Tomomi Shimogori)
理化学研究所脳科学総合研究センター チームリーダー.
© 2013 松居亜寿香・下郡智美 Licensed under CC 表示 2.1 日本
(理化学研究所脳科学総合研究センター 視床発生研究チーム)
email:松居亜寿香,下郡智美
DOI: 10.7875/first.author.2013.155
BTBD3 controls dendrite orientation toward active axons in mammalian neocortex.
Asuka Matsui, May Tran, Aya C. Yoshida, Satomi S. Kikuchi, Mami U, Masaharu Ogawa, Tomomi Shimogori
Science, 342, 1114-1118 (2013)
要 約
多数のニューロンからなる脳が正常に機能するためには,ニューロンどうしが正しく接続され情報のやりとりが行われる必要がある.この接続は多くの場合,ニューロンから情報を出力する軸索と入力をうける樹状突起からなる神経回路の形成により行われる.発生の過程の脳において,ニューロンはどの方向から軸索が伸長してきても接続することができるよう,さまざまな方向にむけ必要な数より多くの樹状突起を延ばしている.しかし,正しい軸索との接続ののち,不要となった樹状突起を残しておくことはまちがった接続をつくりだす可能性がある.そのため,過剰な樹状突起のうち不要なものを除去する機構は非常に重要である.今回の研究において,Btbd3がニューロンにおける余剰な樹状突起の除去に重要な役割を担うこと,そして,この分子機構が哺乳類の大脳皮質のさまざまな領域で保存された普遍的なものであることが明らかにされた.この分子機構は発生の過程の脳においてニューロンのあいだの接続ミスや混線をふせぎ,効率的な神経回路を形成することにより脳の機能の向上を担う可能性が示唆された.
はじめに
マウスの大脳皮質の体性感覚野にはバレル皮質とよばれるヒゲからの情報を処理する特徴的な構造がある.バレル皮質では1本のヒゲからの情報を中継する視床軸索が束をつくり,その視床軸索の束をとりかこむようにして大脳皮質第4層のニューロンがならんでいる.バレルの中心部をhollowとよび,バレルのあいだの隙間をseptaとよぶ(図1).大脳皮質第4層のニューロンの樹状突起は生後まもなくはすべての方向に延びた状態であるが,そののち,その形態を劇的に変化させ,最終的にhollowの側にむかってのみ樹状突起を延ばした状態になる.これによりhollowに入力する視床軸索と効率的にシナプスを形成することができる1)(図1).この生後1週目に起こる,不要な樹状突起の除去,および,必要な樹状突起の維持をつうじて形成される樹状突起の方向性にはヒゲからの入力が必要なことが知られているが,詳細な分子機構については不明な点が多い2).
そこで,樹状突起の形態が変化する生後のバレル皮質に発現する遺伝子を探索し,樹状突起の方向性に関する機能を明らかにしようと試みた.
1.マウス体性感覚野においてBtbd3は樹状突起の方向性を制御する
まず,Allen Brain Atlasというマウスの遺伝子発現データベースを使い,hollowに特異的に発現するBtbd3(BTB/POZ domain containing 3)遺伝子を見い出した.Btbd3のもつBTBドメインはタンパク質-タンパク質間の相互作用にかかわり,酵母からヒトにいたる多くの生物種に見い出されている.同じくBTBドメインをもつショウジョウバエのAbruptは感覚ニューロンの樹状突起の形態制御にかかわることが知られている3,4).このことから,Btbd3がバレル皮質において樹状突起の形態制御にかかわるのではないかと考えた.Btbd3は生後0日目では大脳皮質に発現していないが,生後2日目から発現しはじめ,生後6日目でバレルと同様の発現パターンを示し,樹状突起がその形態を変化させる時期をとおし発現することがわかった.Btbd3の機能阻害を行うため,子宮内エレクトロポレーション法を用いて大脳皮質第4層の細胞が生まれる時期である胎生13.5日目においてshRNAを遺伝子導入しBtbd3をノックダウンした.そののち,バレル皮質の形成される生後6日に達するのを待ち,体性感覚野におけるバレル皮質のニューロンの形態を共焦点顕微鏡により解析した.その結果,Btbd3をノックダウンしたニューロンはその樹状突起を本来は除去されるはずのseptaの側にも維持した状態となり,hollowにだけ樹状突起をむけた正しい形態を失うことが明らかになった(図2).
2.Btbd3は神経活性に応答して細胞質から核へと移行する
これまでの報告において,ヒゲからの入力を失うとhollowへのみ樹状突起を延ばすという樹状突起の方向性を失うことなどから神経活性の重要性が示されている5,6).このことから,Btbd3の発現を抑制した場合と同様に,樹状突起の方向性の失われた大脳皮質に特異的なNMDA受容体ノックアウトマウスを用いてBtbd3の発現を調べたところ,Btbd3の発現は維持され,かつ,総タンパク質量も変化していないことがわかった.しかしながら,Btbd3はNMDA受容体ノックアウトマウスでは細胞質画分に,野生型マウスでは核に多く存在したことから,Btbd3が神経活性により細胞質から核へと移行することが明らかになり,この核への移行が樹状突起の方向性の決定に重要であることが示唆された(図2).
3.Btbd3の獲得によりマウスの視覚野のニューロンは樹状突起の形態を変化させる
バレル皮質における機能欠損実験の結果から,Btbd3は視床軸索からの入力の多いhollowの側の樹状突起を維持し,入力の少ない樹状突起を除去することにより効率的な神経回路の形成を行っていることが明らかにされた.そこで,機能獲得実験によりBtbd3を強制的に発現させ,神経活性の入力に応じて樹状突起を除去し方向性を変化させることができるようになるかどうか調べた.実験では,Btbd3を発現していないマウスの第1次視覚野に胎生13.5日目においてエレクトロポレーション法を用いてBtbd3を発現させた.さらに,神経活性の入力の強弱をつくりだすため片眼の遮蔽を行った.これにより,閉じた眼に由来する入力しかうけない単眼領域の神経活性は低く,開いた眼と閉じた眼の両方に由来する入力をうける両眼領域の神経活性は高い状態がつくることができた.そして,4日後に単眼領域と両眼領域との境界に存在するニューロンの樹状突起の形態を観察した.その結果,Btbd3が存在しない状態で片眼を閉じた場合にはニューロンはその樹状突起の形態を変化させなかったが,Btbd3を強制発現させた視覚野では樹状突起がその形態を変化させ,より強い入力,つまり,開いた目からの入力もうける両眼領域に樹状突起をむけていた.このことから,Btbd3を獲得することにより,ニューロンは入力に応じて不要な樹状突起を除去し,強い入力をうける領域に樹状突起をむけることができるようになることが示された.
4.Btbd3を介した樹状突起の方向性の制御はほかの哺乳類の異なる領野においても保存されている
筆者らの研究室の以前の報告において,Btbd3はマーモセットの第1次視覚野の4層細胞に特異的に発現することが報告されている7).マーモセットは眼優位性カラム構造をもち,視覚系の発達のすぐれた動物である.このことから,Btbd3が樹状突起の方向性を入力に依存して変化させることにより,眼優位性カラムにおいて効率的な神経回路の形成に機能している可能性が示唆された.そこで,マーモセットと同様に眼優位性カラムをもち8),第1次視覚野においてBtbd3が強く発現しているフェレットを用いてその検証を行った.まず,子宮内エレクトロポレーション法を用いてフェレットの胎仔の第1次視覚野に蛍光タンパク質GFPをコードするプラスミドを遺伝子導入した9).胎仔が生後12日目に達するのを待ち片眼の摘出を行うと,視覚野のニューロンは開いた目からの入力をうける領域に樹状突起をむけるようになった.しかし,エレクトロポレーション法によりshRNAを遺伝子導入し第1次視覚野においてBtbd3をノックダウンしたニューロンでは,入力に強弱があるにもかかわらず弱い入力をうける樹状突起の除去は起こらず形態は変化しなかった.このことから,種をこえて,かつ,大脳皮質の異なる領域においても,Btbd3は弱い入力をうける樹状突起を除去できることが明らかにされた.
おわりに
今回,筆者らは,大脳皮質のニューロンにおける,神経活性の入力に依存的な樹状突起の除去にBtbd3が重要な役割をはたすことを明らかにした.また,このBtbd3を介した樹状突起の形態制御はほかの動物種においても保存されていることを示した.今回の研究から,生後の発生の過程において形成された過剰な樹状突起の除去機構の一端が明らかになった.今後は,核に移行したBtbd3がどのようにして不要な樹状突起を除去するのか,そのくわしい分子機構の解析,また,不要な樹状突起が除去されず残存することによりどのような機能的な障害が起こるのかを明らかにしていきたい.そしてさらには,この成果がヒトにおいて神経回路の混線が生じた場合に起こる,脳機能の障害や精神疾患の分子機構の解明につながると期待している.
文 献
- Woolsey, T. A. & Van der Loos, H.: Structural organization of layer-IV in somatosensory region (SI) of mouse cerebral cortex. Description of a cortical field composed of discrete cytoarchitectonic units. Brain Res., 17, 205-242 (1970)[PubMed]
- Iwasato, T., Datwani, A., Wolf, A. M. et al.: Cortex-restricted disruption of NMDAR1 impairs neuronal patterns in the barrel cortex. Nature, 406, 726-731 (2000)[PubMed]
- Sugimura, K., Satoh, D., Estes, P. et al.: Development of morphological diversity of dendrites in Drosophila by the BTB-zinc finger protein abrupt. Neuron, 43, 809-822 (2004)[PubMed]
- Li, W., Wang, F., Menut, L. et al.: BTB/POZ-zinc finger protein abrupt suppresses dendritic branching in a neuronal subtype-specific and dosage-dependent manner. Neuron, 43, 823-834 (2004)[PubMed]
- Datwani, A., Iwasato, T., Itohara, S. et al.: NMDA receptor-dependent pattern transfer from afferents to postsynaptic cells and dendritic differentiation in the barrel cortex. Mol. Cell. Neurosci., 21, 477-492 (2002)[PubMed]
- Espinosa, J. S., Wheeler, D. G., Tsien, R. W. et al.: Uncoupling dendrite growth and patterning: single-cell knockout analysis of NMDA receptor 2B. Neuron, 62, 205-217 (2009)[PubMed]
- Mashiko, H., Yoshida, A. C., Kikuchi, S. S. et al.: Comparative anatomy of marmoset and mouse cortex from genomic expression. J. Neurosci., 32, 5039-5053 (2012)[PubMed]
- Crowley, J. C. & Katz, L. C.: Early development of ocular dominance columns. Science, 290, 1321-1324 (2000)[PubMed]
- Kawasaki, H., Iwai, L. & Tanno, K.: Rapid and efficient genetic manipulation of gyrencephalic carnivores using in utero electroporation. Mol. Brain, 5, 24 (2012)[PubMed]
著者プロフィール
略歴:2010年 大阪大学大学院生命機能研究科 修了,同年より理化学研究所脳科学総合研究センター 研究員.
研究テーマ:神経活性に応じた神経回路の形成.
下郡 智美(Tomomi Shimogori)
理化学研究所脳科学総合研究センター チームリーダー.
© 2013 松居亜寿香・下郡智美 Licensed under CC 表示 2.1 日本