嗅球のパルブアルブミン陽性ニューロンは僧帽細胞の匂い特異性を維持しつつ出力のレベルを調節する
加藤紘之・Jeffry S. Isaacson・小宮山尚樹
(米国California大学San Diego校Department of Neurosciences)
email:加藤紘之
DOI: 10.7875/first.author.2013.151
Parvalbumin-expressing interneurons linearly control olfactory bulb output.
Hiroyuki K. Kato, Shea N. Gillet, Andrew J. Peters, Jeffry S. Isaacson, Takaki Komiyama
Neuron, 80, 1218-1231 (2013)
脳における感覚情報処理は神経回路を構成する興奮性ニューロンと抑制性ニューロンとの協調的な活動により実現される.抑制性ニューロンは多くの脳領域において不均一な集団であるため,情報処理機構の理解にはそれぞれのサブタイプを区別したうえでその寄与を明らかにする必要がある.匂い情報の脳における最初の中継点である嗅球においてその抑制はおもに顆粒細胞により担われると予想されてきたが,明確にサブタイプを区別した検討は行われていなかった.この研究においては,遺伝学的に同定された抑制性ニューロンであるパルブアルブミン陽性ニューロンに着目した.脳切片における電気生理学的な実験および覚醒したマウスにおける機能的イメージングの結果,パルブアルブミン陽性ニューロンは,興奮性ニューロンとの高確率での相互シナプス接続,および,幅広い匂い選択性など,顆粒細胞とは対照的な性質をもつことが明らかになった.さらに,生体における選択的な不活性化の実験により,パルブアルブミン陽性ニューロンは興奮性ニューロンの匂い特異性を維持しつつ出力のレベルを抑制する,ゲイン調節機構としてはたらくことが示唆された.
感覚入力から必要な情報を抽出し,それに応じて適切な行動を出力することは動物の生存に必須である.脳における感覚情報処理はさまざまな種類のニューロンによる空間的および時間的に組織化された活動により実現される.とくに,神経回路における抑制性ニューロンの活動は,神経回路の過興奮を抑制するだけでなく,高次の脳領域へと伝達される情報の抽出機構としての積極的な役割をもつと考えられる1).近年,このような演算を実現する基盤として注目されているのが,抑制性ニューロンの多様性である.抑制性ニューロンは多くの脳領域において均一な集団ではなく,樹状突起の形態,遺伝子の発現,電気生理学的な性質,シナプス接続の選択性により複数のサブタイプに分類される2).この多様性が示唆するのは,それぞれの抑制性ニューロンのサブタイプは固有の役割をもち,神経回路における情報処理の異なる側面に寄与しているという可能性である.近年,光遺伝学(optogenetics)の発展により遺伝学的に特定された抑制性ニューロンのサブタイプに対し神経活動の記録および操作が可能となり,特定のサブタイプが感覚情報処理においてもつ役割の検討がはじめられている3,4).
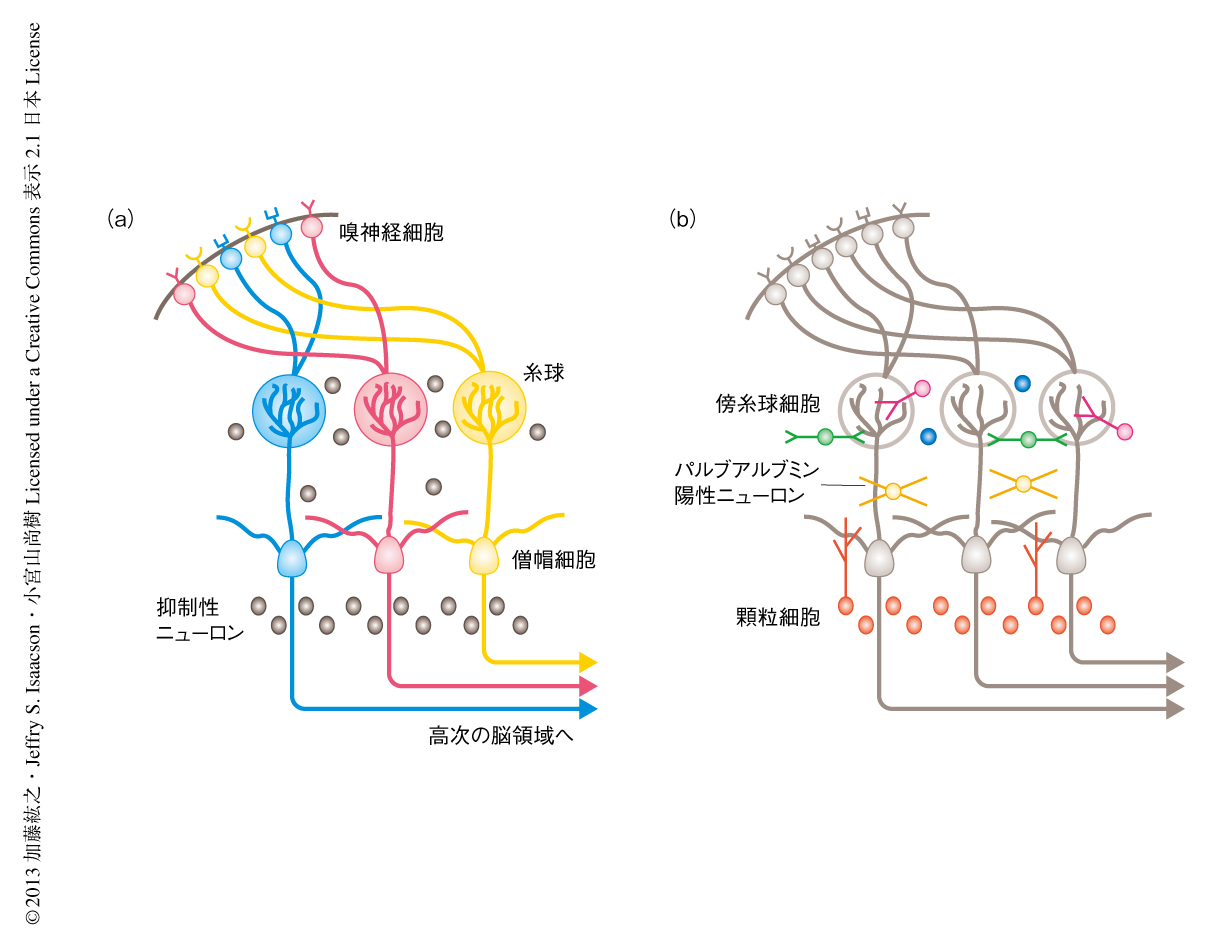
嗅球は嗅覚経路の脳における最初の情報処理領域であり,嗅神経細胞により検出された匂い情報はここで興奮性の僧帽細胞を介し高次の脳領域へと伝達される5)(図1a).マウスには約1000種類の嗅覚受容体の遺伝子が存在し,同一の嗅覚受容体を発現する嗅神経細胞は嗅球において特定の糸球に軸索を収束させる.したがって,感知された匂い情報は嗅球の表面においてどの糸球が活動したかという2次元的なマップとして表現される.僧帽細胞は樹状突起を単一の糸球に伸展し,特定の嗅覚受容体からの興奮性入力のみをうけとることから,嗅球は糸球とそれに接続した数十個の僧帽細胞を単位としたカラム構造と考えることができる.これらのカラムは互いに独立した構造ではなく,抑制性ニューロンを介したカラム内およびカラム間の相互作用により,高次の脳領域への出力が調節されると考えられている6,7).嗅球におけるニューロンの95%以上は抑制性ニューロンであると推定されており,そのなかでももっとも数の多いサブタイプが顆粒細胞である(図1b).その数の多さから,匂い情報処理における抑制性入力の大部分は顆粒細胞に起因すると推測されてきた.しかし,嗅球には機能の知られていない多様な抑制性ニューロンの存在が報告されており8),これまで,それぞれのサブタイプを明確に区別して役割を検討した研究はなされていない.この研究では,パルブアルブミン陽性ニューロンに着目し,そのシナプス接続のパターン,生体における匂い応答性,さらには,僧帽細胞の神経活動へおよぼす影響を体系的に理解することをめざした.
嗅球において混在する抑制性ニューロンのなかでパルブアルブミン陽性ニューロンを可視化するため,パルブアルブミン陽性ニューロンに特異的にDNA組換え酵素Creを発現するノックインマウスを,Cre依存的レポーターマウスと掛けあわせた.このマウスから作製した嗅球の切片において細胞のペアからの同時ホールセル記録を行い,パルブアルブミン陽性ニューロンと僧帽細胞,および,顆粒細胞と僧帽細胞とのシナプス接続を評価した.その結果,近傍(200μm以内)に存在する僧帽細胞→顆粒細胞のペアが4%というきわめて低い確率でしかシナプス接続していないのに対し,僧帽細胞→パルブアルブミン陽性ニューロンのペアのシナプス接続の確率は約60%と,10倍以上であることが明らかになった.糸球の直径が数十μm程度であることを考慮すると,嗅球の表面における半径200μmの円内には少なくとも10~20個の糸球が存在する.したがって,それぞれのパルブアルブミン陽性ニューロンは近傍に存在する多数の糸球カラムからの情報を統合していると考えられた(図2).これらの接続は双方向性であり,パルブアルブミン陽性ニューロンは周辺の多数の僧帽細胞に対し抑制性のフィードバックを行っていた.さらに,パルブアルブミン陽性ニューロンによる抑制は細胞種に選択的であり,顆粒細胞やパルブアルブミン陽性ニューロン自体など,ほかの抑制性ニューロンに対しては抑制を及ぼさなかった.これらの結果は,パルブアルブミン陽性ニューロンは顆粒細胞に比べ非常に少数でありながら,その密で細胞種に選択的な接続を介して僧帽細胞の活動を強く抑制している可能性を示唆した.
パルブアルブミン陽性ニューロンの生体における機能について検討するため,二光子励起Ca2+イメージング法を用いて覚醒したマウスの脳におけるそれぞれの細胞種の匂い応答を比較した.パルブアルブミン陽性ニューロンにおける神経活動を測定するため,パルブアルブミン陽性ニューロンに特異的にCreを発現するノックインマウスの嗅球にCre依存的ウイルスベクターを感染させることにより,パルブアルブミン陽性ニューロンにおいて選択的にCa2+インジケーターであるGCaMP5Gを発現させた.GCaMP5Gを発現した細胞において,神経活動はその蛍光強度の増加として観察される.さらに,嗅球の上の頭骨に観察用のガラス窓を埋め込み二光子励起顕微鏡の下に頭部を固定することにより,覚醒したマウスにおいて同一の細胞の集団を安定して観察することが可能になった9).これらのマウスに構造の異なる7種類の匂い分子を提示したところ,個々のパルブアルブミン陽性ニューロンは匂い選択性をもたず,7種類ほとんどすべての匂いに対し応答を示した.対照的に,僧帽細胞あるいは顆粒細胞にGCaMP5Gを発現したマウスにおいては,ほとんどの細胞は選択的に2~3種の匂いにしか応答しなかった.このパルブアルブミン陽性ニューロンの幅広い匂い応答は,個々のパルブアルブミン陽性ニューロンが周辺の多数の糸球カラムからの情報を統合しているという脳切片における観察と一致した(図2).したがって,パルブアルブミン陽性ニューロンはマウスの遭遇する特定の匂い分子の有無ではなく,嗅球の神経回路の総体としての活動のレベル(匂いの強度)に応じて僧帽細胞を抑制すると推測された.これに対し,個々の顆粒細胞は特定の匂いに遭遇したときにのみ僧帽細胞を抑制する.これらの結果は,パルブアルブミン陽性ニューロンおよび顆粒細胞という2種類の抑制性ニューロンが匂い入力から異なる情報を抽出し嗅球からの出力にフィードバックしていることを示唆した.
このような匂い選択性をもたないパルブアルブミン陽性ニューロンによる抑制性のフィードバックは,僧帽細胞の高次の脳領域への出力にどのような影響をおよぼすのだろうか? この課題を直接的に検討するため,生体における僧帽細胞の神経活動をCa2+イメージング法により測定し,同時に,パルブアルブミン陽性ニューロンを不活性化してその影響を評価した.イメージングとの干渉をさけるため,パルブアルブミン陽性ニューロンの不活性化には光遺伝学的な手法ではなく,薬理遺伝学的なツールであるPSAML141F-GlyRを用いた10).PSAML141F-GlyRは人工的に作製された陰イオンチャネルであり,人工的なリガンドの存在下においてニューロンの発火を抑制する.パルブアルブミン陽性ニューロンに選択的にPSAML141F-GlyRを発現させたマウスにおいては,腹腔内へのリガンドの投与によりパルブアルブミン陽性ニューロンの神経活動を生体において可逆的に不活性化することができた.このとき,僧帽細胞の匂い応答には有意な増強が観察され,パルブアルブミン陽性ニューロンが嗅球からの出力を抑制していることが確認された.興味深いことに,この増強にともない僧帽細胞の匂い選択性にほとんど影響はみられなかった(図3).この結果から,パルブアルブミン陽性ニューロンによる抑制性入力は嗅球からの出力の匂い選択性をかたちづくるわけではなく,その活動の強度だけを抑制するゲイン調節機構であることが示唆された.このような抑制性入力のパターンは神経回路の活動レベルの飽和をふせぐことにより,脳がコードできる刺激の強度のダイナミックレンジを広げる役割をもつと推測された1).
この論文と同時に掲載されたLiqun Luo・Adi Mizrahiグループによる論文も,嗅球のパルブアルブミン陽性ニューロンという同じ主題に着目し,筆者らとは異なる手法を用いて非常によく似た結論にいたっている11)(新着論文レビュー でも掲載).Luo・Mizrahiグループによる論文では,具体的には,狂犬病ウイルスを用いたトランスシナプス標識法を用いて,パルブアルブミン陽性ニューロンと僧帽細胞とが,顆粒細胞と僧帽細胞より高い頻度で接続していること,さらに,麻酔したマウスの生体における電気生理学的な記録法を用いて,パルブアルブミン陽性ニューロンの匂い選択性が僧帽細胞および顆粒細胞よりも顕著に広いことが示された.このように,独立した2つのグループからそれぞれに相補的な手法により同様の結論が得られたことはデータの信頼性を裏づけている.さらに,Luo・Mizrahiグループによる論文においては,僧帽細胞と相互接続するパルブアルブミン陽性ニューロンは顆粒細胞よりも嗅球の表面の広い範囲に分布することを明らかにしており,パルブアルブミン陽性ニューロンが空間的に多くの糸球カラムからの情報を統合して広い匂い選択性を獲得していることをより直接的に示している.
この2つの研究においてパルブアルブミン陽性ニューロンに見い出された“比較的少数の抑制性ニューロンが多数の興奮性ニューロンと密に相互接続することにより神経回路の活動のレベルを調節する”というモチーフは,マウスの視覚野3),ショウジョウバエの触覚葉12) などでも報告されている.感覚モダリティや生物種をこえてこのようなモチーフが観察されることは,生物の感覚情報処理における活動レベルの制御の普遍的な重要性を示唆する.一方,この2つの研究をとおしてもうひとつ明らかになったのは,パルブアルブミン陽性ニューロンとは対照的な顆粒細胞の性質である.顆粒細胞は僧帽細胞の100倍もの数があることから,嗅球における抑制性入力の主役と想定されてきた.しかし,顆粒細胞と僧帽細胞との接続はじつはきわめて低い確率であること,さらに,個々の顆粒細胞は選択的な匂いにしか応答せず神経活動においてもまばらであることが明らかになった.このような“きわめて多数の抑制性ニューロンが興奮性ニューロンをまばらに抑制する”神経回路が情報処理にどのように寄与しているのかは今後の課題である.将来的には,遺伝学的マーカーのライブラリーの拡充により生体において顆粒細胞の神経活動を選択的に操作することが可能になり,神経回路の活動および動物の匂い識別への影響が観察できるようになることを期待したい.
嗅球にはパルブアルブミン陽性ニューロンおよび顆粒細胞のほかにも,形態および遺伝子の発現により分類された多くの抑制性ニューロンのサブタイプが存在する.遺伝学的なツールを用いてこれら神経回路を構成する要素を切り分けその作用機構を明らかにすることは,嗅覚情報処理の機構のみならず,神経回路の普遍的な原理の抽出にも貢献するだろう.
略歴:2008年 東京大学大学院医学系研究科博士課程 修了,同年 同 博士研究員を経て,2010年より米国California大学San Diego校 博士研究員.
研究テーマ:生体における二光子励起イメージング法を用いた感覚情報処理の機構の解析.
Jeffry S. Isaacson
米国California大学San Diego校Professor.
小宮山 尚樹(Takaki Komiyama)
米国California大学San Diego校Assistant Professor.
© 2013 加藤紘之・Jeffry S. Isaacson・小宮山尚樹 Licensed under CC 表示 2.1 日本
(米国California大学San Diego校Department of Neurosciences)
email:加藤紘之
DOI: 10.7875/first.author.2013.151
Parvalbumin-expressing interneurons linearly control olfactory bulb output.
Hiroyuki K. Kato, Shea N. Gillet, Andrew J. Peters, Jeffry S. Isaacson, Takaki Komiyama
Neuron, 80, 1218-1231 (2013)
要 約
脳における感覚情報処理は神経回路を構成する興奮性ニューロンと抑制性ニューロンとの協調的な活動により実現される.抑制性ニューロンは多くの脳領域において不均一な集団であるため,情報処理機構の理解にはそれぞれのサブタイプを区別したうえでその寄与を明らかにする必要がある.匂い情報の脳における最初の中継点である嗅球においてその抑制はおもに顆粒細胞により担われると予想されてきたが,明確にサブタイプを区別した検討は行われていなかった.この研究においては,遺伝学的に同定された抑制性ニューロンであるパルブアルブミン陽性ニューロンに着目した.脳切片における電気生理学的な実験および覚醒したマウスにおける機能的イメージングの結果,パルブアルブミン陽性ニューロンは,興奮性ニューロンとの高確率での相互シナプス接続,および,幅広い匂い選択性など,顆粒細胞とは対照的な性質をもつことが明らかになった.さらに,生体における選択的な不活性化の実験により,パルブアルブミン陽性ニューロンは興奮性ニューロンの匂い特異性を維持しつつ出力のレベルを抑制する,ゲイン調節機構としてはたらくことが示唆された.
はじめに
感覚入力から必要な情報を抽出し,それに応じて適切な行動を出力することは動物の生存に必須である.脳における感覚情報処理はさまざまな種類のニューロンによる空間的および時間的に組織化された活動により実現される.とくに,神経回路における抑制性ニューロンの活動は,神経回路の過興奮を抑制するだけでなく,高次の脳領域へと伝達される情報の抽出機構としての積極的な役割をもつと考えられる1).近年,このような演算を実現する基盤として注目されているのが,抑制性ニューロンの多様性である.抑制性ニューロンは多くの脳領域において均一な集団ではなく,樹状突起の形態,遺伝子の発現,電気生理学的な性質,シナプス接続の選択性により複数のサブタイプに分類される2).この多様性が示唆するのは,それぞれの抑制性ニューロンのサブタイプは固有の役割をもち,神経回路における情報処理の異なる側面に寄与しているという可能性である.近年,光遺伝学(optogenetics)の発展により遺伝学的に特定された抑制性ニューロンのサブタイプに対し神経活動の記録および操作が可能となり,特定のサブタイプが感覚情報処理においてもつ役割の検討がはじめられている3,4).
嗅球は嗅覚経路の脳における最初の情報処理領域であり,嗅神経細胞により検出された匂い情報はここで興奮性の僧帽細胞を介し高次の脳領域へと伝達される5)(図1a).マウスには約1000種類の嗅覚受容体の遺伝子が存在し,同一の嗅覚受容体を発現する嗅神経細胞は嗅球において特定の糸球に軸索を収束させる.したがって,感知された匂い情報は嗅球の表面においてどの糸球が活動したかという2次元的なマップとして表現される.僧帽細胞は樹状突起を単一の糸球に伸展し,特定の嗅覚受容体からの興奮性入力のみをうけとることから,嗅球は糸球とそれに接続した数十個の僧帽細胞を単位としたカラム構造と考えることができる.これらのカラムは互いに独立した構造ではなく,抑制性ニューロンを介したカラム内およびカラム間の相互作用により,高次の脳領域への出力が調節されると考えられている6,7).嗅球におけるニューロンの95%以上は抑制性ニューロンであると推定されており,そのなかでももっとも数の多いサブタイプが顆粒細胞である(図1b).その数の多さから,匂い情報処理における抑制性入力の大部分は顆粒細胞に起因すると推測されてきた.しかし,嗅球には機能の知られていない多様な抑制性ニューロンの存在が報告されており8),これまで,それぞれのサブタイプを明確に区別して役割を検討した研究はなされていない.この研究では,パルブアルブミン陽性ニューロンに着目し,そのシナプス接続のパターン,生体における匂い応答性,さらには,僧帽細胞の神経活動へおよぼす影響を体系的に理解することをめざした.
1.パルブアルブミン陽性ニューロンと僧帽細胞は顆粒細胞と僧帽細胞よりはるかに高い確率でシナプス接続する
嗅球において混在する抑制性ニューロンのなかでパルブアルブミン陽性ニューロンを可視化するため,パルブアルブミン陽性ニューロンに特異的にDNA組換え酵素Creを発現するノックインマウスを,Cre依存的レポーターマウスと掛けあわせた.このマウスから作製した嗅球の切片において細胞のペアからの同時ホールセル記録を行い,パルブアルブミン陽性ニューロンと僧帽細胞,および,顆粒細胞と僧帽細胞とのシナプス接続を評価した.その結果,近傍(200μm以内)に存在する僧帽細胞→顆粒細胞のペアが4%というきわめて低い確率でしかシナプス接続していないのに対し,僧帽細胞→パルブアルブミン陽性ニューロンのペアのシナプス接続の確率は約60%と,10倍以上であることが明らかになった.糸球の直径が数十μm程度であることを考慮すると,嗅球の表面における半径200μmの円内には少なくとも10~20個の糸球が存在する.したがって,それぞれのパルブアルブミン陽性ニューロンは近傍に存在する多数の糸球カラムからの情報を統合していると考えられた(図2).これらの接続は双方向性であり,パルブアルブミン陽性ニューロンは周辺の多数の僧帽細胞に対し抑制性のフィードバックを行っていた.さらに,パルブアルブミン陽性ニューロンによる抑制は細胞種に選択的であり,顆粒細胞やパルブアルブミン陽性ニューロン自体など,ほかの抑制性ニューロンに対しては抑制を及ぼさなかった.これらの結果は,パルブアルブミン陽性ニューロンは顆粒細胞に比べ非常に少数でありながら,その密で細胞種に選択的な接続を介して僧帽細胞の活動を強く抑制している可能性を示唆した.
2.パルブアルブミン陽性ニューロンは匂い選択性をもたず広範な匂い分子に応答する
パルブアルブミン陽性ニューロンの生体における機能について検討するため,二光子励起Ca2+イメージング法を用いて覚醒したマウスの脳におけるそれぞれの細胞種の匂い応答を比較した.パルブアルブミン陽性ニューロンにおける神経活動を測定するため,パルブアルブミン陽性ニューロンに特異的にCreを発現するノックインマウスの嗅球にCre依存的ウイルスベクターを感染させることにより,パルブアルブミン陽性ニューロンにおいて選択的にCa2+インジケーターであるGCaMP5Gを発現させた.GCaMP5Gを発現した細胞において,神経活動はその蛍光強度の増加として観察される.さらに,嗅球の上の頭骨に観察用のガラス窓を埋め込み二光子励起顕微鏡の下に頭部を固定することにより,覚醒したマウスにおいて同一の細胞の集団を安定して観察することが可能になった9).これらのマウスに構造の異なる7種類の匂い分子を提示したところ,個々のパルブアルブミン陽性ニューロンは匂い選択性をもたず,7種類ほとんどすべての匂いに対し応答を示した.対照的に,僧帽細胞あるいは顆粒細胞にGCaMP5Gを発現したマウスにおいては,ほとんどの細胞は選択的に2~3種の匂いにしか応答しなかった.このパルブアルブミン陽性ニューロンの幅広い匂い応答は,個々のパルブアルブミン陽性ニューロンが周辺の多数の糸球カラムからの情報を統合しているという脳切片における観察と一致した(図2).したがって,パルブアルブミン陽性ニューロンはマウスの遭遇する特定の匂い分子の有無ではなく,嗅球の神経回路の総体としての活動のレベル(匂いの強度)に応じて僧帽細胞を抑制すると推測された.これに対し,個々の顆粒細胞は特定の匂いに遭遇したときにのみ僧帽細胞を抑制する.これらの結果は,パルブアルブミン陽性ニューロンおよび顆粒細胞という2種類の抑制性ニューロンが匂い入力から異なる情報を抽出し嗅球からの出力にフィードバックしていることを示唆した.
3.パルブアルブミン陽性ニューロンは僧帽細胞の匂い選択性に影響をあたえず活動のレベルを調節する
このような匂い選択性をもたないパルブアルブミン陽性ニューロンによる抑制性のフィードバックは,僧帽細胞の高次の脳領域への出力にどのような影響をおよぼすのだろうか? この課題を直接的に検討するため,生体における僧帽細胞の神経活動をCa2+イメージング法により測定し,同時に,パルブアルブミン陽性ニューロンを不活性化してその影響を評価した.イメージングとの干渉をさけるため,パルブアルブミン陽性ニューロンの不活性化には光遺伝学的な手法ではなく,薬理遺伝学的なツールであるPSAML141F-GlyRを用いた10).PSAML141F-GlyRは人工的に作製された陰イオンチャネルであり,人工的なリガンドの存在下においてニューロンの発火を抑制する.パルブアルブミン陽性ニューロンに選択的にPSAML141F-GlyRを発現させたマウスにおいては,腹腔内へのリガンドの投与によりパルブアルブミン陽性ニューロンの神経活動を生体において可逆的に不活性化することができた.このとき,僧帽細胞の匂い応答には有意な増強が観察され,パルブアルブミン陽性ニューロンが嗅球からの出力を抑制していることが確認された.興味深いことに,この増強にともない僧帽細胞の匂い選択性にほとんど影響はみられなかった(図3).この結果から,パルブアルブミン陽性ニューロンによる抑制性入力は嗅球からの出力の匂い選択性をかたちづくるわけではなく,その活動の強度だけを抑制するゲイン調節機構であることが示唆された.このような抑制性入力のパターンは神経回路の活動レベルの飽和をふせぐことにより,脳がコードできる刺激の強度のダイナミックレンジを広げる役割をもつと推測された1).
おわりに
この論文と同時に掲載されたLiqun Luo・Adi Mizrahiグループによる論文も,嗅球のパルブアルブミン陽性ニューロンという同じ主題に着目し,筆者らとは異なる手法を用いて非常によく似た結論にいたっている11)(新着論文レビュー でも掲載).Luo・Mizrahiグループによる論文では,具体的には,狂犬病ウイルスを用いたトランスシナプス標識法を用いて,パルブアルブミン陽性ニューロンと僧帽細胞とが,顆粒細胞と僧帽細胞より高い頻度で接続していること,さらに,麻酔したマウスの生体における電気生理学的な記録法を用いて,パルブアルブミン陽性ニューロンの匂い選択性が僧帽細胞および顆粒細胞よりも顕著に広いことが示された.このように,独立した2つのグループからそれぞれに相補的な手法により同様の結論が得られたことはデータの信頼性を裏づけている.さらに,Luo・Mizrahiグループによる論文においては,僧帽細胞と相互接続するパルブアルブミン陽性ニューロンは顆粒細胞よりも嗅球の表面の広い範囲に分布することを明らかにしており,パルブアルブミン陽性ニューロンが空間的に多くの糸球カラムからの情報を統合して広い匂い選択性を獲得していることをより直接的に示している.
この2つの研究においてパルブアルブミン陽性ニューロンに見い出された“比較的少数の抑制性ニューロンが多数の興奮性ニューロンと密に相互接続することにより神経回路の活動のレベルを調節する”というモチーフは,マウスの視覚野3),ショウジョウバエの触覚葉12) などでも報告されている.感覚モダリティや生物種をこえてこのようなモチーフが観察されることは,生物の感覚情報処理における活動レベルの制御の普遍的な重要性を示唆する.一方,この2つの研究をとおしてもうひとつ明らかになったのは,パルブアルブミン陽性ニューロンとは対照的な顆粒細胞の性質である.顆粒細胞は僧帽細胞の100倍もの数があることから,嗅球における抑制性入力の主役と想定されてきた.しかし,顆粒細胞と僧帽細胞との接続はじつはきわめて低い確率であること,さらに,個々の顆粒細胞は選択的な匂いにしか応答せず神経活動においてもまばらであることが明らかになった.このような“きわめて多数の抑制性ニューロンが興奮性ニューロンをまばらに抑制する”神経回路が情報処理にどのように寄与しているのかは今後の課題である.将来的には,遺伝学的マーカーのライブラリーの拡充により生体において顆粒細胞の神経活動を選択的に操作することが可能になり,神経回路の活動および動物の匂い識別への影響が観察できるようになることを期待したい.
嗅球にはパルブアルブミン陽性ニューロンおよび顆粒細胞のほかにも,形態および遺伝子の発現により分類された多くの抑制性ニューロンのサブタイプが存在する.遺伝学的なツールを用いてこれら神経回路を構成する要素を切り分けその作用機構を明らかにすることは,嗅覚情報処理の機構のみならず,神経回路の普遍的な原理の抽出にも貢献するだろう.
文 献
- Isaacson, J. S. & Scanziani, M.: How inhibition shapes cortical activity. Neuron, 72, 231-243 (2011)[PubMed]
- Markrum, H., Toledo-Rodriguez, M., Wang, Y. et al.: Interneurons of the neocortical inhibitory system. Nat. Rev. Neurosci., 5, 793-807 (2004)[PubMed]
- Atallah, B. V., Bruns, W., Carandini, M. et al.: Parvalbumin-expressing interneurons linearly transform cortical responses to visual stimuli. Neuron, 73, 159-170 (2012)[PubMed]
- Adesnik, H., Bruns, W., Taniguchi, H. et al.: A neural circuit for spatial summation in visual cortex. Nature, 490, 226-231 (2012)[PubMed]
- Wilson, R.I. & Mainen, Z. F.: Early events in olfactory processing. Annu. Rev. Neurosci., 29, 163-201 (2006)[PubMed]
- Yokoi, M., Mori, K. & Nakanishi, S.: Refinement of odor molecule tuning by dendrodendritic synaptic inhibition in the olfactory bulb. Proc. Natl. Acad. Sci. USA, 92, 3371-3375 (1995)[PubMed]
- Isaacson, J. S. & Strawbridge, B. W.: Olfactory reciprocal synapses: dendritic signaling in the CNS. Neuron, 20, 749-761 (1998)[PubMed]
- Batista-Brito, R., Close, J., Machold, R. et al.: The distinct temporal origins of olfactory bulb interneuron subtypes. J. Neurosci., 28, 3966-3975 (2008)[PubMed]
- Kato, H. K., Chu, M. W., Isaacson, J. S. et al.: Dynamic sensory representations in the olfactory bulb: modulation by wakefulness and experience. Neuron, 76, 962-975 (2012)[PubMed]
- Magnus, C. J., Lee, P. H., Atasoy, D. et al.: Chemical and genetic engineering of selective ion channel-ligand interactions. Science, 333, 1292-1296 (2011)[PubMed]
- Miyamichi, K., Shlomai-Fuchs, Y., Shu, M. et al.: Dissecting local circuits: parvalbumin interneurons underlie broad feedback control of olfactory bulb output. Neuron, 80, 1232-1245 (2013)[PubMed] [新着論文レビュー]
- Olsen, S. R. & Wilson, R. I.: Lateral presynaptic inhibition mediates gain control in an olfactory circuit. Nature, 452, 956-960 (2008)[PubMed]
著者プロフィール
略歴:2008年 東京大学大学院医学系研究科博士課程 修了,同年 同 博士研究員を経て,2010年より米国California大学San Diego校 博士研究員.
研究テーマ:生体における二光子励起イメージング法を用いた感覚情報処理の機構の解析.
Jeffry S. Isaacson
米国California大学San Diego校Professor.
小宮山 尚樹(Takaki Komiyama)
米国California大学San Diego校Assistant Professor.
© 2013 加藤紘之・Jeffry S. Isaacson・小宮山尚樹 Licensed under CC 表示 2.1 日本