マウスの胚における前後軸の形成は子宮から胚への力学的な作用により開始される
平松竜司・松尾 勲
(大阪府立母子保健総合医療センター研究所 病因病態部門)
email:平松竜司,松尾 勲
DOI: 10.7875/first.author.2013.143
External mechanical cues trigger the establishment of the anterior-posterior axis in early mouse embryos.
Ryuji Hiramatsu, Toshiki Matsuoka, Chiharu Kimura-Yoshida, Sung-Woong Han, Kyoko Mochida, Taiji Adachi, Shuichi Takayama, Isao Matsuo
Developmental Cell, 27, 131-144 (2013)
マウスの胚において最初に決定される体軸である前後軸は,遠位臓側内胚葉の形成により開始される.しかしながら,その形成の機構にはいまだ不明な点が多い.今回,筆者らは,子宮に似せた人工装置として微小腔をもつマイクロデバイスを作製し,それを用いて着床の直後のマウスの胚を体外において培養した.その結果,胚に対して周囲からの適切な圧力をくわえることが遠位臓側内胚葉の形成に必要であることを明らかにした.このことは,遠位臓側内胚葉の形成は胚において自律的に進むのではなく,母体の子宮からの作用も必要であることを示した.さらに,胚の外から力がくわわることにより遠位部において局所的に基底膜の分断が起こり,胚体外胚葉から臓側内胚葉への細胞の移動が誘導されることを見い出した.以上の結果から,哺乳類の発生における基本的な現象である前後軸の形成は,胚と母体の子宮との相互関係により生じる“力”により直接的に制御されているという新たなモデルを提唱した.
哺乳類における胚の発生は母体の卵管および子宮の内部で進行するという大きな特徴をもつ.卵管の膨大部において受精した卵は,発生を進行しながら子宮へと移動し,胚盤胞期において子宮の内膜に着床する.哺乳類において受精卵は非対称性についての情報をもっておらず,そののちの発生の過程において体軸や細胞分化などの極性を獲得するとされている.
マウスの胚において前後軸は最初に決定される体軸である.胎生4.5日ごろに着床した胚は,胎生5.5日ごろには胚の遠位部にある臓側内胚葉(visceral endoderm)において遠位臓側内胚葉(distal visceral endoderm)とよばれる特殊な細胞集団を形成する.そののち,遠位臓側内胚葉は将来の前方となる領域に移動し前方臓側内胚葉(anterior visceral endoderm)を形成する1-3).この前方臓側内胚葉が隣接する胚性外胚葉(エピブラスト)において後方化のシグナルを抑制することにより,頭部への分化が促進され前後軸が確立する1,4,5).
これまで,遺伝子改変マウスの解析などからNodal経路やWnt経路など前後軸の形成にかかわるシグナル伝達経路が同定されてきた6,7).また,哺乳類に特有の発生の様式から,子宮そのものが前後軸の形成にあたえる影響も考えられており,着床の部位とそののちに形成される胚の体軸との相関関係について組織学的な観察も報告されている8,9).しかしながら,遠位臓側内胚葉はなぜ遠位部に形成されるのか,つまり,前後軸が近遠軸の方向にそって最初に確立されることの合理的な機構は示されていなかった.そこで,筆者らは,子宮が前後軸の形成期において胚の発生にあたえる影響に着目し,詳細な組織学的な解析と実験的なアプローチを試みた.
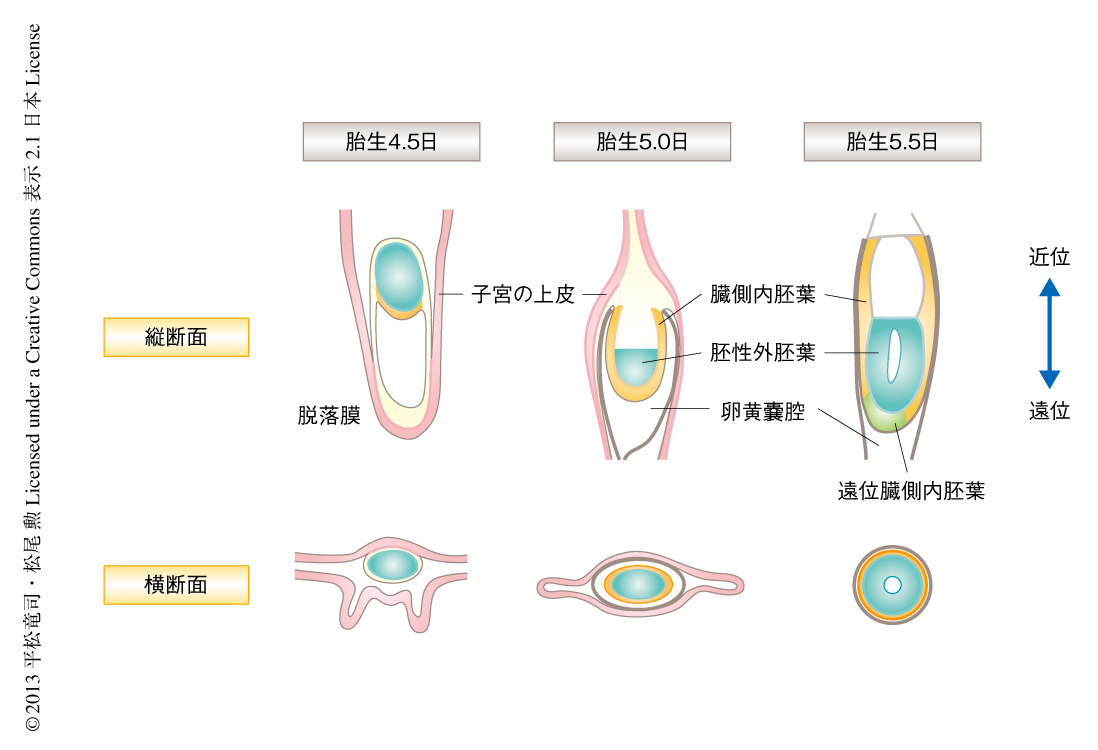
着床の直後の胎生4.5日から遠位臓側内胚葉の形成される胎生5.5日まで,マウスの胚と周囲の子宮内膜(脱落膜)の形態をヘマトキシリン-エオシン染色により観察した.胎生4.5日では胚は胚盤胞様の形状をとり,壁栄養膜細胞層が子宮の上皮に接着していた.また,子宮の上皮層は明瞭に観察された.この時期には遠位臓側内胚葉のマーカーであるCer1遺伝子の発現は認められなかった.胎生5.0日では脱落膜が胚をとりかこむようになり,胚は徐々に卵筒型を呈するようになった.胚の周囲と脱落膜とのあいだには卵黄嚢腔が存在し,横断面における両端に突出部が存在した.突出部のヒンジの領域では子宮の上皮層が部分的に融合していた.そのほかの子宮の上皮層は一部が認められるものの,その構造は徐々にくずれていた.この時期でもCer1遺伝子の発現はほとんど認められなかった.胎生5.5日では胚性外胚葉層および原始羊膜腔が明瞭になり,近遠軸の方向に伸長し卵筒型を呈していた.遠位部には遠位臓側内胚葉の特徴である臓側内胚葉の肥厚が認められた.また,Cer1遺伝子の発現が強く認められた.卵黄嚢腔は遠位部にのみ観察され,胚の側面部にはほとんど認められなかった.卵黄嚢腔の突出部も消失し完全な筒状となっていた.また,子宮の上皮層の構造は認められなかった.以上の組織学的な解析により,着床から前後軸の形成期にかけて脱落膜が胚を包み込むようにとりかこみ,遠位部にのみ空洞が残されるようすが観察された(図1).
胚の形状と卵黄嚢腔の形状を定量するため,それぞれの長さを計測した.その結果,胚の縦軸(近遠軸の方向)の長さは胎生5.0日では約120μm,胎生5.5日では約210μm,胚の横軸の長さは胎生5.0日では約85μm,胎生5.5日では約95μmであった.また,縦軸と横軸との比率は胎生5.0日では約1.4,胎生5.5日では約2.2~2.3であった.このことは,この時期の胚は近遠軸の方向には伸長するものの,横軸の方向にはほとんど成長しないため,縦長の卵筒型の形状を呈するようになることを示していた.また,同じ時期の卵黄嚢腔の径長を計測したところ,卵管-子宮頚部の方向の径長は胎生5.0日では約105μm,胎生5.5日では約95μm,左右の方向の径長は胎生5.0日では約60μm,胎生5.5日では約88μmであった.つまり,胎生5.0日から胎生5.5日にかけて,卵黄嚢腔の径長と胚の横軸の方向の長さは90μm前後に収束することが示された.これらの結果から,脱落膜により形成される卵黄嚢腔の形状そのものが,前後軸の形成期における胚の形状に影響をあたえている可能性が考えられた.
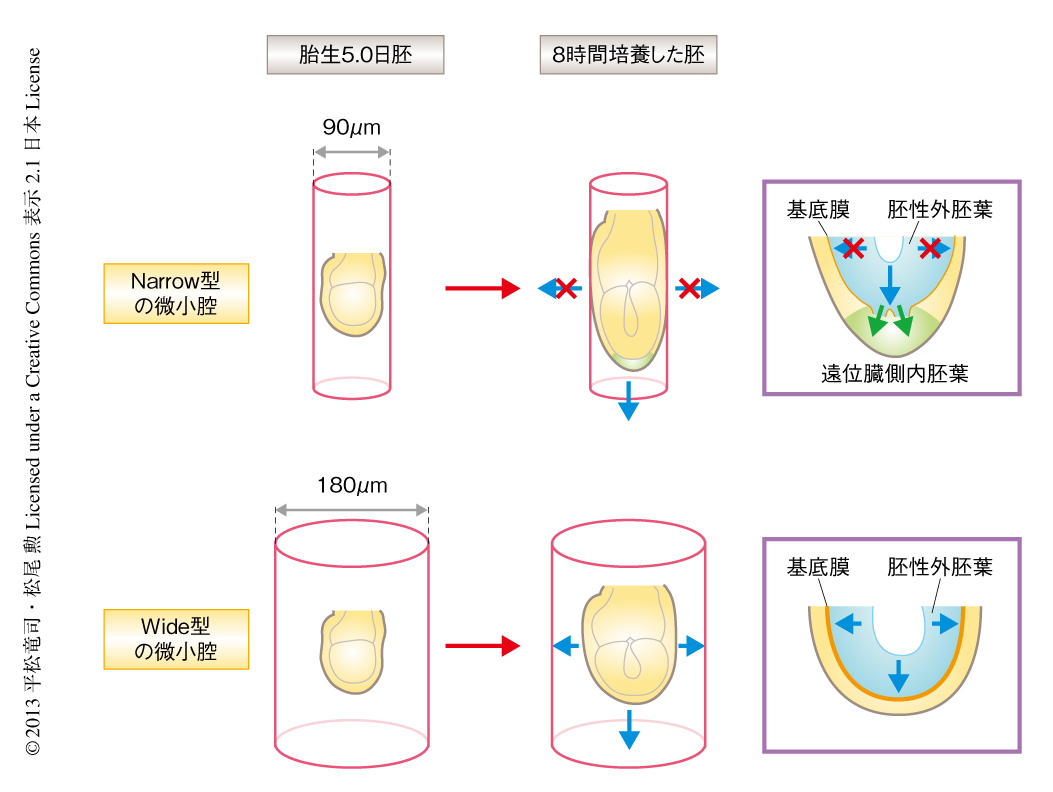
卵黄嚢腔の形状という空間的な制約そのものが前後軸の形成期における胚の発生に影響しているのかどうかを検討するため,高分子ポリマーであるポリジメチルシロキサンを用いて2つの直径をもつ微小腔を作製した.直径の細いNarrow型は直径90μmで,胎生5.5日の卵黄嚢腔の径とほぼ同じ長さをもち,直径の太いWide型は直径180μmで,胎生5.5日の卵黄嚢腔の径の2倍の長さをもつ.子宮から取り出した胎生5.0日の胚をそれぞれの微小腔のなかで8時間にわたり培養した.それぞれの培養胚について形状を測定したところ,Narrow型の微小腔において培養した胚の縦軸と横軸との比は2.15とほぼ胎生5.5日の胚と同様,つまり,卵筒型を呈したのに対し,Wide型の微小腔において培養した胚の縦軸と横軸との比は1.34と胎生5.0日の胚と変わらない形状であった.一方,培養胚の全細胞数については両者に差は認められなかった.また,遠位臓側内胚葉が形成されているかどうかを検討したところ,Narrow型の微小腔において培養した胚では遠位部にCer1遺伝子などの遠位臓側内胚葉のマーカーの発現が高い率で認められるのに対し,Wide型の微小腔において培養した胚ではこれらはほとんど認められなかった(図2).
この空間的な制約という外からの力学的な要因が前後軸の形成期における胚の発生に必要かどうかをさらに検討するため,さまざまな濃度のアガロースゲルの内部に直径90μmの微小腔を作製し,そのなかで胎生5.0日の胚を培養した.なお,アガロースゲルの硬さはアガロースの濃度の2乗に比例して上昇する.その結果,0.3%以下の濃度のアガロースゲル(約7~8 kPaの硬さ)において培養した胚では縦軸と横軸との比は1.3~1.5とほぼ胎生5.0日の胚と同じままで,Cer1遺伝子の発現もほぼ認められなかった.それに対し,0.5%以上の濃度のアガロースゲル(約23 kPaの硬さ)において培養した胚では縦軸と横軸との比が2.0~2.1と胎生5.5日の胚の示す卵筒型を呈し,また,Cer1遺伝子の発現も高い率で認められた.さらに,原子間力顕微鏡を用いて胎生5.5日ごろの胚の周囲の脱落膜における弾性力を計測したところ,約23 kPaであった.以上の結果より,前後軸の形成期における胚の発生は,胚において自律的に進行するのではなく,空間的な制約という外からの力学的な作用をうけることによりひき起こされることが示された.
Narrow型の微小腔で培養した胚とWide型の微小腔で培養した胚はいったい何が違うのか.マイクロアレイ解析によりそれぞれの遺伝子発現の差を調べたところ,有意に1.5倍以上の差の認められたのは遠位臓側内胚葉のマーカーであるCer1遺伝子のみであり(Narrow型の微小腔における培養で上昇),1.2倍以上の差としてもわずかに10個程度の遺伝子しかなく,その半数近くは遠位臓側内胚葉に発現する遺伝子であった.in situハイブリダイゼーション解析においても結果は同様であった.つまり,前後軸の形成期における空間的な制約の有無による胚の発生の差について,遠位臓側内胚葉に発現する遺伝子のほかに,胚の内部における遺伝子発現の変化はともなわないことが示された.
Narrow型の微小腔で培養した胚とWide型の微小腔で培養した胚についてその違いを形態的に解析したところ,Wide型の微小腔で培養した胚には胚性外胚葉と臓側内胚葉とのあいだに基底膜が胚の全体にわたり明瞭に認められたのに対し,Narrow型の微小腔で培養した胚では遠位部において基底膜が薄くなっていた.また,胚性外胚葉細胞を蛍光タンパク質Venusにより標識したトランスジェニックマウスを用いて,その挙動を生細胞イメージング法により観察したところ,Narrow型の微小腔で培養した胚ではCer1遺伝子を発現した部位において胚性外胚葉から臓側内胚葉への細胞の移動が認められた.実際に,胎生5.5日の胚の遠位部において基底膜の薄化や分断が認められ,その部位は遠位臓側内胚葉細胞の出現する領域と一致していた.また,胚性外胚葉細胞をβガラクトシターゼにより特異的に標識したトランスジェニックマウスを用いてその挙動を観察したところ,胎生5.0日の胚では胚性外胚葉に限局していたβガラクトシターゼ陽性細胞が,胎生5.5日の胚では数個が遠位部の臓側内胚葉において認められ,胎生6.0日以降の胚では数個が前方近位部の臓側内胚葉(前方臓側内胚葉の領域)においても認められた.なお,前方臓側内胚葉の領域に存在したβガラクトシターゼ陽性細胞は,とくに胚性外胚葉と胚体外外胚葉との境界に近い部分に認められ,そのほかの部分の前方臓側内胚葉細胞はβガラクトシダーゼ陰性であった.以上の結果から,外からの力学的な作用をうけることにより,遺伝子発現の変化をともなうことなく,胚の遠位部に限局して基底膜の分断や胚性外胚葉から臓側内胚葉への細胞の移動が誘導されること,さらに,それらの細胞が遠位臓側内胚葉および前方臓側内胚葉に寄与することが示された(図2).
外からの力学的な作用をうけることにより基底膜はどのように分断されるのか.一般的に,基底膜の分解にはマトリックスメタロプロテアーゼのかかわることが知られているが,Narrow型の微小腔で培養した胚とWide型の微小腔で培養した胚とでマトリックスメタロプロテアーゼの遺伝子の発現に差は認められなかった.また,蛍光試薬を用いたマトリックスメタロプロテアーゼ活性の解析においても,Narrow型の微小腔で培養した胚とWide型の微小腔で培養した胚,および,胎生5.5日の胚では,胚の内部において活性は認められなかったことから,マトリックスメタロプロテアーゼによる分解は関与していないことが強く示唆された.そこで,力学的な作用が基底膜の分断を直接的に誘導しているかどうかを検討するため,L字型などへと変形させた微小腔を作製してそのなかで胚を培養したところ,微小腔の形状にそって異所的に基底膜の分断が誘導された.また,細胞増殖の阻害剤の添加により胚の成長を抑制することで,Narrow型の微小腔で培養した胚においても基底膜の分断や胚性外胚葉から臓側内胚葉への細胞の移動は認められなくなった.しかし,さらに細い直径70μmの微小腔で培養すると,細胞増殖の阻害剤の添加のもとでも基底膜の分断や胚性外胚葉から臓側内胚葉への細胞の移動が認められるようになった.くわえて,基底膜が胚の全体にわたり厚いままのWide型の微小腔で培養した胚に対して,原子間力顕微鏡を用いて10分間という短時間のあいだ局所的に力をくわえたところ,いくつかの胚においては,力をくわえた領域の周囲において基底膜の分断や胚性外胚葉細胞の臓側内胚葉への突出が認められた.これらの結果から,前後軸の形成期における胚では,外から力をくわえることにより基底膜の分断を直接的に誘導できることが示された.
この研究により,不明な点の多かった前後軸の形成期における胚の発生の機構の一端が明らかになった.すなわち,子宮という胚の外側の環境が,胚に対し空間的な制約などの力学的な作用をくわえることにより,前後軸の形成という発生における基本的な現象を直接的に制御していることが示された.
胎生という哺乳類に特有の発生の様式から,これまでも子宮の環境が胚の発生にあたえる影響について考えられてきた.1950年代には,胚移植技術を用いることにより,2つの系統のマウスのあいだで異なる腰椎の数は,胚そのものの系統ではなく,移植先の母体の系統に大きく左右されることが実験的に示された10).つまりこのことは,母体の子宮の環境が胚の解剖学的な特質に影響をあたえることを示唆した.しかしながらこれ以降,子宮が哺乳類における胚の発生にあたえる影響についての研究は,技術的な障壁もありほとんど進むことはなかった.今後,胚の外の環境,そして,力学的な作用という視点から解析を進めることが,哺乳類の発生の過程のさらなる理解につながると考えている.
略歴:国立感染症研究所 研究員.
松尾 勲(Isao Matuo)
大阪府立母子保健総合医療センター研究所 部長
研究室URL:http://www.mch.pref.osaka.jp/research/embryology/index.html
© 2013 平松竜司・松尾 勲 Licensed under CC 表示 2.1 日本
(大阪府立母子保健総合医療センター研究所 病因病態部門)
email:平松竜司,松尾 勲
DOI: 10.7875/first.author.2013.143
External mechanical cues trigger the establishment of the anterior-posterior axis in early mouse embryos.
Ryuji Hiramatsu, Toshiki Matsuoka, Chiharu Kimura-Yoshida, Sung-Woong Han, Kyoko Mochida, Taiji Adachi, Shuichi Takayama, Isao Matsuo
Developmental Cell, 27, 131-144 (2013)
要 約
マウスの胚において最初に決定される体軸である前後軸は,遠位臓側内胚葉の形成により開始される.しかしながら,その形成の機構にはいまだ不明な点が多い.今回,筆者らは,子宮に似せた人工装置として微小腔をもつマイクロデバイスを作製し,それを用いて着床の直後のマウスの胚を体外において培養した.その結果,胚に対して周囲からの適切な圧力をくわえることが遠位臓側内胚葉の形成に必要であることを明らかにした.このことは,遠位臓側内胚葉の形成は胚において自律的に進むのではなく,母体の子宮からの作用も必要であることを示した.さらに,胚の外から力がくわわることにより遠位部において局所的に基底膜の分断が起こり,胚体外胚葉から臓側内胚葉への細胞の移動が誘導されることを見い出した.以上の結果から,哺乳類の発生における基本的な現象である前後軸の形成は,胚と母体の子宮との相互関係により生じる“力”により直接的に制御されているという新たなモデルを提唱した.
はじめに
哺乳類における胚の発生は母体の卵管および子宮の内部で進行するという大きな特徴をもつ.卵管の膨大部において受精した卵は,発生を進行しながら子宮へと移動し,胚盤胞期において子宮の内膜に着床する.哺乳類において受精卵は非対称性についての情報をもっておらず,そののちの発生の過程において体軸や細胞分化などの極性を獲得するとされている.
マウスの胚において前後軸は最初に決定される体軸である.胎生4.5日ごろに着床した胚は,胎生5.5日ごろには胚の遠位部にある臓側内胚葉(visceral endoderm)において遠位臓側内胚葉(distal visceral endoderm)とよばれる特殊な細胞集団を形成する.そののち,遠位臓側内胚葉は将来の前方となる領域に移動し前方臓側内胚葉(anterior visceral endoderm)を形成する1-3).この前方臓側内胚葉が隣接する胚性外胚葉(エピブラスト)において後方化のシグナルを抑制することにより,頭部への分化が促進され前後軸が確立する1,4,5).
これまで,遺伝子改変マウスの解析などからNodal経路やWnt経路など前後軸の形成にかかわるシグナル伝達経路が同定されてきた6,7).また,哺乳類に特有の発生の様式から,子宮そのものが前後軸の形成にあたえる影響も考えられており,着床の部位とそののちに形成される胚の体軸との相関関係について組織学的な観察も報告されている8,9).しかしながら,遠位臓側内胚葉はなぜ遠位部に形成されるのか,つまり,前後軸が近遠軸の方向にそって最初に確立されることの合理的な機構は示されていなかった.そこで,筆者らは,子宮が前後軸の形成期において胚の発生にあたえる影響に着目し,詳細な組織学的な解析と実験的なアプローチを試みた.
1.マウスの胚は前後軸の形成期において脱落膜にとりかこまれ近遠軸の方向に伸長する
着床の直後の胎生4.5日から遠位臓側内胚葉の形成される胎生5.5日まで,マウスの胚と周囲の子宮内膜(脱落膜)の形態をヘマトキシリン-エオシン染色により観察した.胎生4.5日では胚は胚盤胞様の形状をとり,壁栄養膜細胞層が子宮の上皮に接着していた.また,子宮の上皮層は明瞭に観察された.この時期には遠位臓側内胚葉のマーカーであるCer1遺伝子の発現は認められなかった.胎生5.0日では脱落膜が胚をとりかこむようになり,胚は徐々に卵筒型を呈するようになった.胚の周囲と脱落膜とのあいだには卵黄嚢腔が存在し,横断面における両端に突出部が存在した.突出部のヒンジの領域では子宮の上皮層が部分的に融合していた.そのほかの子宮の上皮層は一部が認められるものの,その構造は徐々にくずれていた.この時期でもCer1遺伝子の発現はほとんど認められなかった.胎生5.5日では胚性外胚葉層および原始羊膜腔が明瞭になり,近遠軸の方向に伸長し卵筒型を呈していた.遠位部には遠位臓側内胚葉の特徴である臓側内胚葉の肥厚が認められた.また,Cer1遺伝子の発現が強く認められた.卵黄嚢腔は遠位部にのみ観察され,胚の側面部にはほとんど認められなかった.卵黄嚢腔の突出部も消失し完全な筒状となっていた.また,子宮の上皮層の構造は認められなかった.以上の組織学的な解析により,着床から前後軸の形成期にかけて脱落膜が胚を包み込むようにとりかこみ,遠位部にのみ空洞が残されるようすが観察された(図1).
胚の形状と卵黄嚢腔の形状を定量するため,それぞれの長さを計測した.その結果,胚の縦軸(近遠軸の方向)の長さは胎生5.0日では約120μm,胎生5.5日では約210μm,胚の横軸の長さは胎生5.0日では約85μm,胎生5.5日では約95μmであった.また,縦軸と横軸との比率は胎生5.0日では約1.4,胎生5.5日では約2.2~2.3であった.このことは,この時期の胚は近遠軸の方向には伸長するものの,横軸の方向にはほとんど成長しないため,縦長の卵筒型の形状を呈するようになることを示していた.また,同じ時期の卵黄嚢腔の径長を計測したところ,卵管-子宮頚部の方向の径長は胎生5.0日では約105μm,胎生5.5日では約95μm,左右の方向の径長は胎生5.0日では約60μm,胎生5.5日では約88μmであった.つまり,胎生5.0日から胎生5.5日にかけて,卵黄嚢腔の径長と胚の横軸の方向の長さは90μm前後に収束することが示された.これらの結果から,脱落膜により形成される卵黄嚢腔の形状そのものが,前後軸の形成期における胚の形状に影響をあたえている可能性が考えられた.
2.胚の卵筒型の形状および遠位臓側内胚葉の形成には胚の周囲からの力が必要である
卵黄嚢腔の形状という空間的な制約そのものが前後軸の形成期における胚の発生に影響しているのかどうかを検討するため,高分子ポリマーであるポリジメチルシロキサンを用いて2つの直径をもつ微小腔を作製した.直径の細いNarrow型は直径90μmで,胎生5.5日の卵黄嚢腔の径とほぼ同じ長さをもち,直径の太いWide型は直径180μmで,胎生5.5日の卵黄嚢腔の径の2倍の長さをもつ.子宮から取り出した胎生5.0日の胚をそれぞれの微小腔のなかで8時間にわたり培養した.それぞれの培養胚について形状を測定したところ,Narrow型の微小腔において培養した胚の縦軸と横軸との比は2.15とほぼ胎生5.5日の胚と同様,つまり,卵筒型を呈したのに対し,Wide型の微小腔において培養した胚の縦軸と横軸との比は1.34と胎生5.0日の胚と変わらない形状であった.一方,培養胚の全細胞数については両者に差は認められなかった.また,遠位臓側内胚葉が形成されているかどうかを検討したところ,Narrow型の微小腔において培養した胚では遠位部にCer1遺伝子などの遠位臓側内胚葉のマーカーの発現が高い率で認められるのに対し,Wide型の微小腔において培養した胚ではこれらはほとんど認められなかった(図2).
この空間的な制約という外からの力学的な要因が前後軸の形成期における胚の発生に必要かどうかをさらに検討するため,さまざまな濃度のアガロースゲルの内部に直径90μmの微小腔を作製し,そのなかで胎生5.0日の胚を培養した.なお,アガロースゲルの硬さはアガロースの濃度の2乗に比例して上昇する.その結果,0.3%以下の濃度のアガロースゲル(約7~8 kPaの硬さ)において培養した胚では縦軸と横軸との比は1.3~1.5とほぼ胎生5.0日の胚と同じままで,Cer1遺伝子の発現もほぼ認められなかった.それに対し,0.5%以上の濃度のアガロースゲル(約23 kPaの硬さ)において培養した胚では縦軸と横軸との比が2.0~2.1と胎生5.5日の胚の示す卵筒型を呈し,また,Cer1遺伝子の発現も高い率で認められた.さらに,原子間力顕微鏡を用いて胎生5.5日ごろの胚の周囲の脱落膜における弾性力を計測したところ,約23 kPaであった.以上の結果より,前後軸の形成期における胚の発生は,胚において自律的に進行するのではなく,空間的な制約という外からの力学的な作用をうけることによりひき起こされることが示された.
3.外からの力がくわわることにより胚の遠位部に限局して基底膜の分断や胚性外胚葉から臓側内胚葉への細胞の移動が誘導される
Narrow型の微小腔で培養した胚とWide型の微小腔で培養した胚はいったい何が違うのか.マイクロアレイ解析によりそれぞれの遺伝子発現の差を調べたところ,有意に1.5倍以上の差の認められたのは遠位臓側内胚葉のマーカーであるCer1遺伝子のみであり(Narrow型の微小腔における培養で上昇),1.2倍以上の差としてもわずかに10個程度の遺伝子しかなく,その半数近くは遠位臓側内胚葉に発現する遺伝子であった.in situハイブリダイゼーション解析においても結果は同様であった.つまり,前後軸の形成期における空間的な制約の有無による胚の発生の差について,遠位臓側内胚葉に発現する遺伝子のほかに,胚の内部における遺伝子発現の変化はともなわないことが示された.
Narrow型の微小腔で培養した胚とWide型の微小腔で培養した胚についてその違いを形態的に解析したところ,Wide型の微小腔で培養した胚には胚性外胚葉と臓側内胚葉とのあいだに基底膜が胚の全体にわたり明瞭に認められたのに対し,Narrow型の微小腔で培養した胚では遠位部において基底膜が薄くなっていた.また,胚性外胚葉細胞を蛍光タンパク質Venusにより標識したトランスジェニックマウスを用いて,その挙動を生細胞イメージング法により観察したところ,Narrow型の微小腔で培養した胚ではCer1遺伝子を発現した部位において胚性外胚葉から臓側内胚葉への細胞の移動が認められた.実際に,胎生5.5日の胚の遠位部において基底膜の薄化や分断が認められ,その部位は遠位臓側内胚葉細胞の出現する領域と一致していた.また,胚性外胚葉細胞をβガラクトシターゼにより特異的に標識したトランスジェニックマウスを用いてその挙動を観察したところ,胎生5.0日の胚では胚性外胚葉に限局していたβガラクトシターゼ陽性細胞が,胎生5.5日の胚では数個が遠位部の臓側内胚葉において認められ,胎生6.0日以降の胚では数個が前方近位部の臓側内胚葉(前方臓側内胚葉の領域)においても認められた.なお,前方臓側内胚葉の領域に存在したβガラクトシターゼ陽性細胞は,とくに胚性外胚葉と胚体外外胚葉との境界に近い部分に認められ,そのほかの部分の前方臓側内胚葉細胞はβガラクトシダーゼ陰性であった.以上の結果から,外からの力学的な作用をうけることにより,遺伝子発現の変化をともなうことなく,胚の遠位部に限局して基底膜の分断や胚性外胚葉から臓側内胚葉への細胞の移動が誘導されること,さらに,それらの細胞が遠位臓側内胚葉および前方臓側内胚葉に寄与することが示された(図2).
4.外的な力をくわえることにより前後軸の形成期の胚において基底膜の分断を直接的に誘導できる
外からの力学的な作用をうけることにより基底膜はどのように分断されるのか.一般的に,基底膜の分解にはマトリックスメタロプロテアーゼのかかわることが知られているが,Narrow型の微小腔で培養した胚とWide型の微小腔で培養した胚とでマトリックスメタロプロテアーゼの遺伝子の発現に差は認められなかった.また,蛍光試薬を用いたマトリックスメタロプロテアーゼ活性の解析においても,Narrow型の微小腔で培養した胚とWide型の微小腔で培養した胚,および,胎生5.5日の胚では,胚の内部において活性は認められなかったことから,マトリックスメタロプロテアーゼによる分解は関与していないことが強く示唆された.そこで,力学的な作用が基底膜の分断を直接的に誘導しているかどうかを検討するため,L字型などへと変形させた微小腔を作製してそのなかで胚を培養したところ,微小腔の形状にそって異所的に基底膜の分断が誘導された.また,細胞増殖の阻害剤の添加により胚の成長を抑制することで,Narrow型の微小腔で培養した胚においても基底膜の分断や胚性外胚葉から臓側内胚葉への細胞の移動は認められなくなった.しかし,さらに細い直径70μmの微小腔で培養すると,細胞増殖の阻害剤の添加のもとでも基底膜の分断や胚性外胚葉から臓側内胚葉への細胞の移動が認められるようになった.くわえて,基底膜が胚の全体にわたり厚いままのWide型の微小腔で培養した胚に対して,原子間力顕微鏡を用いて10分間という短時間のあいだ局所的に力をくわえたところ,いくつかの胚においては,力をくわえた領域の周囲において基底膜の分断や胚性外胚葉細胞の臓側内胚葉への突出が認められた.これらの結果から,前後軸の形成期における胚では,外から力をくわえることにより基底膜の分断を直接的に誘導できることが示された.
おわりに
この研究により,不明な点の多かった前後軸の形成期における胚の発生の機構の一端が明らかになった.すなわち,子宮という胚の外側の環境が,胚に対し空間的な制約などの力学的な作用をくわえることにより,前後軸の形成という発生における基本的な現象を直接的に制御していることが示された.
胎生という哺乳類に特有の発生の様式から,これまでも子宮の環境が胚の発生にあたえる影響について考えられてきた.1950年代には,胚移植技術を用いることにより,2つの系統のマウスのあいだで異なる腰椎の数は,胚そのものの系統ではなく,移植先の母体の系統に大きく左右されることが実験的に示された10).つまりこのことは,母体の子宮の環境が胚の解剖学的な特質に影響をあたえることを示唆した.しかしながらこれ以降,子宮が哺乳類における胚の発生にあたえる影響についての研究は,技術的な障壁もありほとんど進むことはなかった.今後,胚の外の環境,そして,力学的な作用という視点から解析を進めることが,哺乳類の発生の過程のさらなる理解につながると考えている.
文 献
- Thomas, P. & Beddington, R.: Anterior primitive endoderm may be responsible for patterning the anterior neural plate in the mouse embryo. Curr. Biol., 6, 1487-1496 (1996)[PubMed]
- Thomas, P. Q., Brown, A. & Beddington, R. S.: Hex: a homeobox gene revealing peri-implantation asymmetry in the mouse embryo and an early transient marker of endothelial cell precursors. Development, 125, 85-94 (1998)[PubMed]
- Beddington, R. S. & Robertson, E. J.: Axis development and early asymmetry in mammals. Cell, 96, 195-209 (1999)[PubMed]
- Kimura, C., Yoshinaga, K., Tian, E. et al.: Visceral endoderm mediates forebrain development by suppressing posteriorizing signals. Dev. Biol., 225, 304-321 (2000)[PubMed]
- Perea-Gomez, A., Vella, F. D., Shawlot, W. et al.: Nodal antagonists in the anterior visceral endoderm prevent the formation of multiple primitive streaks. Dev. Cell, 3, 745-756 (2002)[PubMed]
- Arnold, S. J. & Robertson, E. J.: Making a commitment: cell lineage allocation and axis patterning in the early mouse embryo. Nat. Rev. Mol. Cell Biol., 10, 91-103 (2009)[PubMed]
- Rossant, J. & Tam, P. P.: Blastocyst lineage formation, early embryonic asymmetries and axis patterning in the mouse. Development, 136, 701-713 (2009)[PubMed]
- Smith, L. J.: Embryonic axis orientation in the mouse and its correlation with blastocyst relationships to the uterus. II. Relationships from 4 1/4 to 9 1/2 days. J. Embryol. Exp. Morphol., 89, 15-35 (1985)[PubMed]
- Mesnard, D., Filipe, M., Belo, J. A. et al.: The anterior-posterior axis emerges respecting the morphology of the mouse embryo that changes and aligns with the uterus before gastrulation. Curr. Biol., 14, 184-196 (2004)[PubMed]
- McLaren, A. & Michie, D.: Factors affecting vertebral variation in mice. 4. Experimental proof of the uterine basis of a maternal effect. J. Embryol. Exp. Morphol., 6, 645-659 (1958)[PubMed]
著者プロフィール
略歴:国立感染症研究所 研究員.
松尾 勲(Isao Matuo)
大阪府立母子保健総合医療センター研究所 部長
研究室URL:http://www.mch.pref.osaka.jp/research/embryology/index.html
© 2013 平松竜司・松尾 勲 Licensed under CC 表示 2.1 日本