bHLH型転写因子の発現の振動による神経幹細胞の自己複製能と多分化能の制御およびその光操作
今吉 格・影山龍一郎
(京都大学ウイルス研究所 増殖制御研究分野)
email:今吉 格,影山龍一郎
DOI: 10.7875/first.author.2013.145
Oscillatory control of factors determining multipotency and fate in mouse neural progenitors.
Itaru Imayoshi, Akihiro Isomura, Yukiko Harima, Kyogo Kawaguchi, Hiroshi Kori, Hitoshi Miyachi, Takahiro Fujiwara, Fumiyoshi Ishidate, Ryoichiro Kageyama
Science, 342, 1203-1208 (2013)
bHLH型の転写因子であるAscl1,Hes1,Olig2は,それぞれ,ニューロン,アストロサイト,オリゴデンドロサイトへの分化における運命決定を制御しており,神経幹細胞に共発現していることが知られている.筆者らは,単一の細胞のレベルにおけるリアルタイムでのイメージングにより,神経幹細胞においてこれらbHLH型転写因子の発現は振動していることを見い出した.また,神経幹細胞からの分化の際には,この3つのbHLH型転写因子のうち1つの発現が優性になることがわかった.さらに,光遺伝学的な手法により,Ascl1の発現パターンを光照射により操作することに成功した.Ascl1の持続的な発現はニューロンへの分化を誘導したのに対し,Ascl1の発現の振動は神経幹細胞の増殖を促進した.これらの結果から,神経幹細胞の多分化能とは複数の分化運命決定因子の発現が振動している状態であり,細胞分化とは単一の分化運命決定因子が持続的に発現している状態であることが明らかになった.
神経幹細胞は自己複製能をもち,かつ,脳を構成する主要な3種類の細胞であるニューロン,アストロサイト,オリゴデンドロサイトを生み出す多分化能をもつ.神経幹細胞の自己複製および分化の制御機構の解明は,脳神経系の発生の機構の解明につながるだけでなく,脳の損傷や神経変性疾患に対する再生医療の実現にむけた基盤的な知識ともなる.しかし,神経幹細胞が自己複製能と多分化能というまったく異なる能力をどのような分子機構により保持しているのかは不明であった.また,神経幹細胞が分化するとき,ニューロン,アストロサイト,オリゴデンドロサイトという3つの選択肢のなかから,どのように1つを選ぶかについてもよくわかっていなかった.
神経幹細胞の自己複製と分化はbHLH型転写因子により制御されている1,2).そこでは,神経幹細胞における未分化性の維持とアストロサイトへの分化を制御するHes1,ニューロンへの分化を制御するAscl1,オリゴデンドロサイトへの分化を制御するOlig2という3つのbHLH型転写因子が重要なはたらきを担うことが知られている.しかし,Hes1が幹細胞の未分化性の維持およびアストロサイトへの分化という相反する2つの機能をどのような分子機構により発揮するのかはよくわかっていない.また,Ascl1やOlig2はニューロンあるいはオリゴデンドロサイトへの分化のほか,神経幹細胞の増殖および維持にも重要であることが知られているが,この相反する機能をどのように制御しているのかも不明であった.この研究では,ホタルの発光タンパク質であるルシフェラーゼとHes1,Ascl1,Olig2の3つのbHLH型転写因子それぞれとの融合タンパク質を発現する遺伝子改変マウスを作製し,それらbHLH型転写因子の発現の動態を解析した.
顕微鏡のシステムや画像解析法の最適化により,単一の細胞のレベルにおけるbHLH型転写因子のリアルタイムでのイメージングに成功した.その結果,神経幹細胞において,Hes1およびAscl1は2~3時間の周期,Olig2は5~8時間の周期で,発現が振動していることが明らかになった.これまで,Hes1の遺伝子プロモーター活性のイメージングは行われていたが3-5),この研究では,bHLH型転写因子のタンパク質レベルでの発現の振動を単一の細胞のレベルにおいて観察することに成功した.さらに,Hes1,Ascl1,Olig2のいずれかを欠損した神経幹細胞では増殖が低下していたことから,bHLH型転写因子の発現が振動をくり返すことにより神経幹細胞の増殖は促進されることが示唆された.
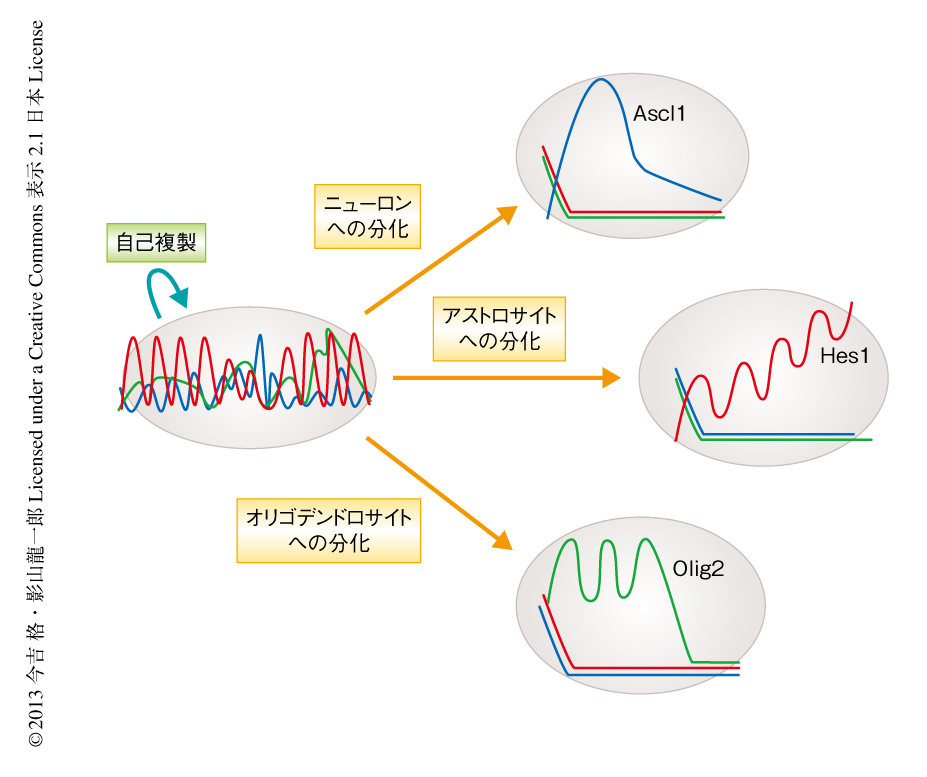
神経幹細胞に分化を誘導し,そのときのHes1,Ascl1,Olig2の発現の動態をリアルタイムでのイメージングにより解析した.その結果,ニューロンへの分化の際にはAscl1,アストロサイトへの分化の際にはHes1,オリゴデンドロサイトへの分化の際にはOlig2が,それぞれ蓄積することが明らかになった(図1).神経幹細胞からいずれかの細胞種に分化するときには,発現の振動をくり返していたHes1,Ascl1,Olig2のうちどれか1つの発現が上昇し,ほかの2つの発現が消失した.つまり,Hes1,Ascl1,Olig2は神経幹細胞においてすでに発現しており,発現の振動をくり返すことにより神経幹細胞の増殖を促進していると考えられた.一方,分化を誘導したときにはそのうちどれか1つの発現が上昇し,分化を促進することが明らかになった.すなわち,神経幹細胞は複数のbHLH型転写因子の発現を振動させることにより,多分化能をもちつつも未分化性を保持して自己複製すると考えられた.
ここまで述べた結果から,同一のbHLH型転写因子が発現の動態を変えることにより神経幹細胞の増殖を活性化したり,特定の細胞種への分化を誘導したりすることが示唆された.たとえば,Ascl1は発現が振動すると神経幹細胞の増殖を活性化し,持続的に発現するとニューロンへの分化を誘導すると考えられた.
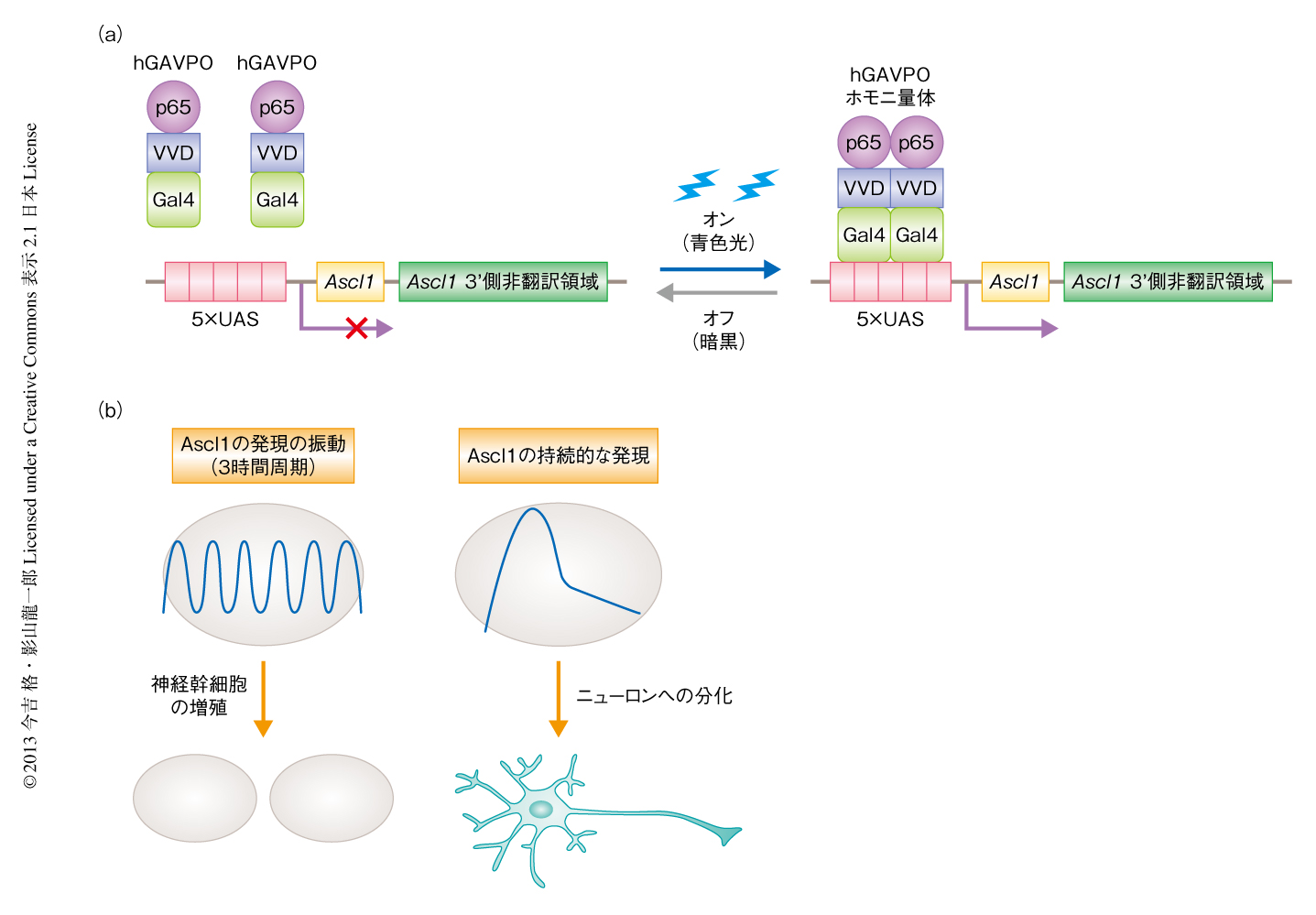
これらの仮説に対し実験的にアプローチするため,光により制御の可能な人工転写因子GAVPO 6) を用いた系により,Ascl1をノックアウトした神経幹細胞においてAscl1の発現パターンを制御することを試みた.GAVPOは,二量体化能を減弱した転写因子GAL4のDNA結合ドメイン,青色光の照射により構造の変化するLOVドメインをもつVVD,転写因子p65の転写活性化ドメインを,タンデムに連結したタンパク質である(図2a).GAVPOの結合するシス配列としてGAL4の結合配列であるUASを5個つないだもの(5×UAS)にTATAボックスを連結し,その下流に発現させたい遺伝子を配置したものを,GAVPOをコードする遺伝子とともに細胞に導入する.青色光を照射するとGAVPOはVVDを介して二量体化する.その結果,GAL4のDNA結合ドメインが二量体化することによりDNA結合活性が上昇し5×UASに結合する.すると,p65の転写活性化ドメインを介してTATAボックスに転写開始複合体が形成されその下流の遺伝子が転写される,というしくみである.重要な点は,外来性のタンパク質や化合物を投与することなく,遺伝子の発現を強力に制御することが可能である点である.
5×UASの下流にAscl1遺伝子を配置したレンチウイルスベクターを準備し,光の照射に依存してAscl1の発現の動態を人工的に制御できる実験系を構築した.その結果,3時間ごとに光照射することによりAscl1の発現の振動を,30分ごとに光照射することによりAscl1の持続的な発現を,神経幹細胞に起こすことに成功した.
Ascl1をノックアウトした神経幹細胞は,増殖速度の低下,および,ニューロンへの分化能の欠失のあることが報告されている7).GAVPOを用いた光遺伝学的な発現操作技術を用いて,Ascl1ノックアウト神経幹細胞においてAscl1の発現を3時間の周期で振動させたところ,増殖が促進された.一方,Ascl1を持続的に発現させたところ,ニューロンへの分化が誘導された(図2b).興味深いことに,Ascl1の発現を6時間の周期で振動させたときには増殖は促進されなかった.また,GAVPOを用いた光遺伝学的な発現操作技術では,照射する光の強さや単位照射時間を調整することにより遺伝子の発現量を制御することができる.照射する光の強さを弱めるあるいは単位照射時間を短くすることにより,Ascl1を低い発現量で持続的に発現させた場合にも,ニューロンへの分化が誘導された.これらの実験結果は,神経幹細胞の増殖あるいはニューロンへの分化の選択においてはAscl1の発現パターンが重要であり,Ascl1はその発現パターンを変えることにより,神経幹細胞の増殖の活性化とニューロンへの分化の誘導という異なる機能を発揮していることが明らかになった.
GAVPOを用いた光遺伝学的な発現操作技術を応用することにより,これまでのように外来性のタンパク質や化合物を投与することなく,光照射のパターンを変えるだけで神経幹細胞の増殖あるいはニューロンへの分化を制御することが可能になった.今後,この技術は再生医療の研究に貢献することが期待される.また,光の照射により神経幹細胞の増殖あるいは分化を制御する技術はマウスの脳に存在する神経幹細胞に対しても適応できる可能性があり,今後の実用化にむけ開発を推進したいと考えている.成体の脳に存在する神経幹細胞の多くは休眠状態で存在することが知られている8,9).脳においてbHLH型転写因子の発現動態を人工的に操作することにより,成体の脳に存在する神経幹細胞の増殖あるいはニューロンの産生を制御することができれば,損傷をうけた脳あるいは病態にある脳において失われた神経回路の再構築につながると期待される.
この研究は,自己複製能と多分化能の両立という神経幹細胞を幹細胞たらしめている根幹の分子機構を明らかにした.Hes1は神経幹細胞だけでなく,ES細胞やiPS細胞などの多能性幹細胞や,造血幹細胞や皮膚幹細胞などのほとんどの組織幹細胞において発現が確認されていることから,この研究において見い出された分化運命決定因子の発現の振動による制御機構は,神経幹細胞だけでなくほかの種類の幹細胞においても普遍的に使用されていると考えられ,幹細胞の研究の全体への幅広い波及効果が予想される.
略歴:2008年 京都大学大学院生命科学研究科博士課程 修了,同年 京都大学ウイルス研究所 研究員,2009年 科学技術振興機構さきがけ 研究員を経て,2011年より京都大学白眉センター 特定准教授.
研究テーマ:神経幹細胞の増殖および分化の制御,生後および成体の脳におけるニューロンの新生.
抱負:神経幹細胞とニューロンの新生の研究をつうじて,脳の設計図と可塑性についての理解を深めたい.
研究室URL:http://imayoshi.web.fc2.com/Itaru_Imayoshi_Ph.D./_Home.html
影山 龍一郎(Ryoichiro Kageyama)
京都大学ウイルス研究所 教授.
© 2013 今吉 格・影山龍一郎 Licensed under CC 表示 2.1 日本
(京都大学ウイルス研究所 増殖制御研究分野)
email:今吉 格,影山龍一郎
DOI: 10.7875/first.author.2013.145
Oscillatory control of factors determining multipotency and fate in mouse neural progenitors.
Itaru Imayoshi, Akihiro Isomura, Yukiko Harima, Kyogo Kawaguchi, Hiroshi Kori, Hitoshi Miyachi, Takahiro Fujiwara, Fumiyoshi Ishidate, Ryoichiro Kageyama
Science, 342, 1203-1208 (2013)
要 約
bHLH型の転写因子であるAscl1,Hes1,Olig2は,それぞれ,ニューロン,アストロサイト,オリゴデンドロサイトへの分化における運命決定を制御しており,神経幹細胞に共発現していることが知られている.筆者らは,単一の細胞のレベルにおけるリアルタイムでのイメージングにより,神経幹細胞においてこれらbHLH型転写因子の発現は振動していることを見い出した.また,神経幹細胞からの分化の際には,この3つのbHLH型転写因子のうち1つの発現が優性になることがわかった.さらに,光遺伝学的な手法により,Ascl1の発現パターンを光照射により操作することに成功した.Ascl1の持続的な発現はニューロンへの分化を誘導したのに対し,Ascl1の発現の振動は神経幹細胞の増殖を促進した.これらの結果から,神経幹細胞の多分化能とは複数の分化運命決定因子の発現が振動している状態であり,細胞分化とは単一の分化運命決定因子が持続的に発現している状態であることが明らかになった.
はじめに
神経幹細胞は自己複製能をもち,かつ,脳を構成する主要な3種類の細胞であるニューロン,アストロサイト,オリゴデンドロサイトを生み出す多分化能をもつ.神経幹細胞の自己複製および分化の制御機構の解明は,脳神経系の発生の機構の解明につながるだけでなく,脳の損傷や神経変性疾患に対する再生医療の実現にむけた基盤的な知識ともなる.しかし,神経幹細胞が自己複製能と多分化能というまったく異なる能力をどのような分子機構により保持しているのかは不明であった.また,神経幹細胞が分化するとき,ニューロン,アストロサイト,オリゴデンドロサイトという3つの選択肢のなかから,どのように1つを選ぶかについてもよくわかっていなかった.
1.自己複製する神経幹細胞においてHes1,Ascl1,Olig2の発現は振動している
神経幹細胞の自己複製と分化はbHLH型転写因子により制御されている1,2).そこでは,神経幹細胞における未分化性の維持とアストロサイトへの分化を制御するHes1,ニューロンへの分化を制御するAscl1,オリゴデンドロサイトへの分化を制御するOlig2という3つのbHLH型転写因子が重要なはたらきを担うことが知られている.しかし,Hes1が幹細胞の未分化性の維持およびアストロサイトへの分化という相反する2つの機能をどのような分子機構により発揮するのかはよくわかっていない.また,Ascl1やOlig2はニューロンあるいはオリゴデンドロサイトへの分化のほか,神経幹細胞の増殖および維持にも重要であることが知られているが,この相反する機能をどのように制御しているのかも不明であった.この研究では,ホタルの発光タンパク質であるルシフェラーゼとHes1,Ascl1,Olig2の3つのbHLH型転写因子それぞれとの融合タンパク質を発現する遺伝子改変マウスを作製し,それらbHLH型転写因子の発現の動態を解析した.
顕微鏡のシステムや画像解析法の最適化により,単一の細胞のレベルにおけるbHLH型転写因子のリアルタイムでのイメージングに成功した.その結果,神経幹細胞において,Hes1およびAscl1は2~3時間の周期,Olig2は5~8時間の周期で,発現が振動していることが明らかになった.これまで,Hes1の遺伝子プロモーター活性のイメージングは行われていたが3-5),この研究では,bHLH型転写因子のタンパク質レベルでの発現の振動を単一の細胞のレベルにおいて観察することに成功した.さらに,Hes1,Ascl1,Olig2のいずれかを欠損した神経幹細胞では増殖が低下していたことから,bHLH型転写因子の発現が振動をくり返すことにより神経幹細胞の増殖は促進されることが示唆された.
2.神経幹細胞からの分化においてはHes1,Ascl1,Olig2のうち1つの発現が上昇し2つの発現が消失する
神経幹細胞に分化を誘導し,そのときのHes1,Ascl1,Olig2の発現の動態をリアルタイムでのイメージングにより解析した.その結果,ニューロンへの分化の際にはAscl1,アストロサイトへの分化の際にはHes1,オリゴデンドロサイトへの分化の際にはOlig2が,それぞれ蓄積することが明らかになった(図1).神経幹細胞からいずれかの細胞種に分化するときには,発現の振動をくり返していたHes1,Ascl1,Olig2のうちどれか1つの発現が上昇し,ほかの2つの発現が消失した.つまり,Hes1,Ascl1,Olig2は神経幹細胞においてすでに発現しており,発現の振動をくり返すことにより神経幹細胞の増殖を促進していると考えられた.一方,分化を誘導したときにはそのうちどれか1つの発現が上昇し,分化を促進することが明らかになった.すなわち,神経幹細胞は複数のbHLH型転写因子の発現を振動させることにより,多分化能をもちつつも未分化性を保持して自己複製すると考えられた.
3.光応答性の人工転写因子を用いたAscl1の発現制御系
ここまで述べた結果から,同一のbHLH型転写因子が発現の動態を変えることにより神経幹細胞の増殖を活性化したり,特定の細胞種への分化を誘導したりすることが示唆された.たとえば,Ascl1は発現が振動すると神経幹細胞の増殖を活性化し,持続的に発現するとニューロンへの分化を誘導すると考えられた.
これらの仮説に対し実験的にアプローチするため,光により制御の可能な人工転写因子GAVPO 6) を用いた系により,Ascl1をノックアウトした神経幹細胞においてAscl1の発現パターンを制御することを試みた.GAVPOは,二量体化能を減弱した転写因子GAL4のDNA結合ドメイン,青色光の照射により構造の変化するLOVドメインをもつVVD,転写因子p65の転写活性化ドメインを,タンデムに連結したタンパク質である(図2a).GAVPOの結合するシス配列としてGAL4の結合配列であるUASを5個つないだもの(5×UAS)にTATAボックスを連結し,その下流に発現させたい遺伝子を配置したものを,GAVPOをコードする遺伝子とともに細胞に導入する.青色光を照射するとGAVPOはVVDを介して二量体化する.その結果,GAL4のDNA結合ドメインが二量体化することによりDNA結合活性が上昇し5×UASに結合する.すると,p65の転写活性化ドメインを介してTATAボックスに転写開始複合体が形成されその下流の遺伝子が転写される,というしくみである.重要な点は,外来性のタンパク質や化合物を投与することなく,遺伝子の発現を強力に制御することが可能である点である.
5×UASの下流にAscl1遺伝子を配置したレンチウイルスベクターを準備し,光の照射に依存してAscl1の発現の動態を人工的に制御できる実験系を構築した.その結果,3時間ごとに光照射することによりAscl1の発現の振動を,30分ごとに光照射することによりAscl1の持続的な発現を,神経幹細胞に起こすことに成功した.
4.神経幹細胞の増殖あるいはニューロンへの分化の選択においてはAscl1の発現パターンが重要である
Ascl1をノックアウトした神経幹細胞は,増殖速度の低下,および,ニューロンへの分化能の欠失のあることが報告されている7).GAVPOを用いた光遺伝学的な発現操作技術を用いて,Ascl1ノックアウト神経幹細胞においてAscl1の発現を3時間の周期で振動させたところ,増殖が促進された.一方,Ascl1を持続的に発現させたところ,ニューロンへの分化が誘導された(図2b).興味深いことに,Ascl1の発現を6時間の周期で振動させたときには増殖は促進されなかった.また,GAVPOを用いた光遺伝学的な発現操作技術では,照射する光の強さや単位照射時間を調整することにより遺伝子の発現量を制御することができる.照射する光の強さを弱めるあるいは単位照射時間を短くすることにより,Ascl1を低い発現量で持続的に発現させた場合にも,ニューロンへの分化が誘導された.これらの実験結果は,神経幹細胞の増殖あるいはニューロンへの分化の選択においてはAscl1の発現パターンが重要であり,Ascl1はその発現パターンを変えることにより,神経幹細胞の増殖の活性化とニューロンへの分化の誘導という異なる機能を発揮していることが明らかになった.
おわりに
GAVPOを用いた光遺伝学的な発現操作技術を応用することにより,これまでのように外来性のタンパク質や化合物を投与することなく,光照射のパターンを変えるだけで神経幹細胞の増殖あるいはニューロンへの分化を制御することが可能になった.今後,この技術は再生医療の研究に貢献することが期待される.また,光の照射により神経幹細胞の増殖あるいは分化を制御する技術はマウスの脳に存在する神経幹細胞に対しても適応できる可能性があり,今後の実用化にむけ開発を推進したいと考えている.成体の脳に存在する神経幹細胞の多くは休眠状態で存在することが知られている8,9).脳においてbHLH型転写因子の発現動態を人工的に操作することにより,成体の脳に存在する神経幹細胞の増殖あるいはニューロンの産生を制御することができれば,損傷をうけた脳あるいは病態にある脳において失われた神経回路の再構築につながると期待される.
この研究は,自己複製能と多分化能の両立という神経幹細胞を幹細胞たらしめている根幹の分子機構を明らかにした.Hes1は神経幹細胞だけでなく,ES細胞やiPS細胞などの多能性幹細胞や,造血幹細胞や皮膚幹細胞などのほとんどの組織幹細胞において発現が確認されていることから,この研究において見い出された分化運命決定因子の発現の振動による制御機構は,神経幹細胞だけでなくほかの種類の幹細胞においても普遍的に使用されていると考えられ,幹細胞の研究の全体への幅広い波及効果が予想される.
文 献
- Ross, S. E., Greenberg, M. E. & Stiles, C. D.: Basic helix-loop-helix factors in cortical development. Neuron, 39, 13-25 (2003)[PubMed]
- Bertrand, N., Castro, D. S. & Guillemot, F.: Proneural genes and the specification of neural cell types. Nat. Rev. Neurosci., 3, 517-530 (2002)[PubMed]
- Shimojo, H., Ohtsuka, T. & Kageyama, R.: Oscillations in Notch signaling regulate maintenance of neural progenitors. Neuron, 58, 52-64 (2008)[PubMed]
- Masamizu, Y., Ohtsuka, T., Takashima, Y. et al.: Real-time imaging of the somite segmentation clock: revelation of unstable oscillators in the individual presomitic mesoderm cell. Proc. Natl. Acad. Sci. USA, 103, 1313-1318 (2006)[PubMed]
- Imayoshi, I., Shimojo, H., Sakamoto, M. et al.: Genetic visualization of notch signaling in mammalian neurogenesis. Cell. Mol. Life Sci., 70, 2045-2057 (2012)[PubMed]
- Wang, X., Chen, X. & Yang, Y.: Spatiotemporal control of gene expression by a light-switchable transgene system. Nat. Methods, 9, 266-269 (2012)[PubMed]
- Castro, D. S., Martynoga, B., Parras, C. et al.: A novel function of the proneural factor Ascl1 in progenitor proliferation identified by genome-wide characterization of its targets. Genes Dev., 25, 930-945 (2011)[PubMed]
- Imayoshi, I., Sakamoto, M., Yamaguchi, M. et al.: Essential roles of Notch signaling in maintenance of neural stem cells in developing and adult brains. J. Neurosci., 30, 3489-3498 (2010)[PubMed]
- Imayoshi, I., Sakamoto, M., Ohtsuka, T. et al.: Roles of continuous neurogenesis in the structural and functional integrity of the adult forebrain. Nat. Neurosci., 11, 1153-1161 (2008)[PubMed]
著者プロフィール
略歴:2008年 京都大学大学院生命科学研究科博士課程 修了,同年 京都大学ウイルス研究所 研究員,2009年 科学技術振興機構さきがけ 研究員を経て,2011年より京都大学白眉センター 特定准教授.
研究テーマ:神経幹細胞の増殖および分化の制御,生後および成体の脳におけるニューロンの新生.
抱負:神経幹細胞とニューロンの新生の研究をつうじて,脳の設計図と可塑性についての理解を深めたい.
研究室URL:http://imayoshi.web.fc2.com/Itaru_Imayoshi_Ph.D./_Home.html
影山 龍一郎(Ryoichiro Kageyama)
京都大学ウイルス研究所 教授.
© 2013 今吉 格・影山龍一郎 Licensed under CC 表示 2.1 日本