フラビン酵素による酸化反応がFavorskii転位反応をひき起こす
宮永 顕正
(米国California大学San Diego校Scripps Institute of Oceanography)
email:宮永顕正
DOI: 10.7875/first.author.2013.141
Flavin-mediated dual oxidation controls an enzymatic Favorskii-type rearrangement.
Robin Teufel, Akimasa Miyanaga, Quentin Michaudel, Frederick Stull, Gordon Louie, Joseph P. Noel, Phil S. Baran, Bruce Palfey, Bradley S. Moore
Nature, 503, 552-556 (2013)
フラビン酵素は多様な酸化還元反応にかかわり,もっともよく研究されてきた酵素ファミリーのひとつである.これまで,フラビン酵素のかかわる酸素添加反応には,フラビンペルオキシドがかかわると考えられてきた.今回,筆者らは,ポリケタイド抗生物質であるエンテロシンの生合成にかかわるフラビン酵素EncMが,フラビンペルオキシドに非依存的に,水酸化反応と脱水素化反応の2回の酸化反応を触媒することを明らかにした.EncMとその合成基質アナログとの複合体のX線結晶構造解析と安定同位体による標識を用いた解析により,これまでの報告とは異なる,新しいフラビンの酸化還元反応が明らかにされた.EncMはフラビン-N5-オキシドと考えられる安定なフラビン酸素付加体をもち,これがエンテロシンの生合成において重要な,基質の酸化とFavorskii転位反応をひき起こしていると考えられた.
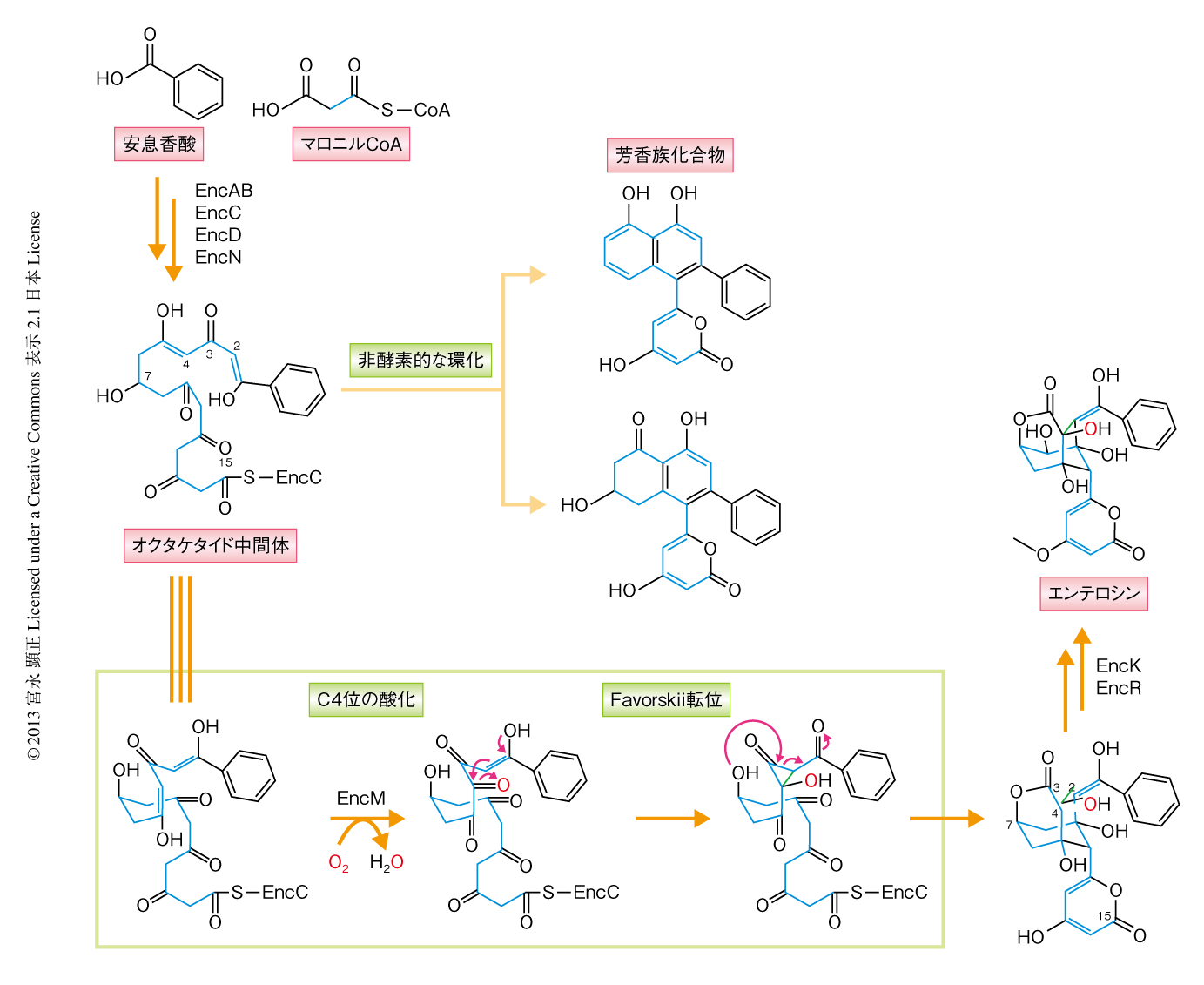
微生物の生産する天然化合物は多様な構造を示し,そのなかには有用な生理活性を示すものも多く存在する.抗生物質エンテロシンはStreptomyces maritimusなどの放線菌により生産され,ユニークなかご状の骨格をもつのが特徴である.その構造から生合成の機構に興味がもたれ,これまで研究が進められてきた.約40年前に行われた同位体標識した化合物の投与実験の結果からは,エンテロシンの生合成にはFavorskii転位反応のかかわることが予想された1).さらに近年,エンテロシン生合成遺伝子クラスターがクローニングされ,その生合成にII型ポリケタイド合成酵素のかかわることが明らかになった2).エンテロシンの生合成経路(図1)においては,まず,アシルキャリアータンパク質であるEncCのうえで開始基質である安息香酸に7分子のマロニルCoAが縮合しオクタケタイド中間体が生成する.一般的なII型ポリケタイド合成酵素の反応では,このような中間体は環化酵素により適切な環化反応をうけ芳香族ポリケタイドが生成する.しかし,エンテロシンの生合成経路に環化酵素は存在せず,別の酵素により環化反応が制御されていることが示唆された.生化学的な実験の結果などから,フラビン酵素EncMがその役割を担うことが明らかになった3,4).すなわち,EncMが生合成経路に存在しない場合には非酵素的に環化が起こり芳香族化合物が生成したのに対し,EncMが存在した場合には最終的にエンテロシンが生成した.おそらく,EncMがC4位の酸化およびFavorskii転位反応を起こしたあと,環化が起こっていると考えられた.このように,EncMというたった1つの酵素がかかわることにより,芳香族化合物を生成するという一般的なII型ポリケタイド合成酵素の反応においてみられる反応経路からはずれ,まったく異なる骨格構造をもつ化合物へと変換されていることになる.しかし,このような複雑な反応をEncMがどのように触媒しているかという分子機構については謎につつまれていた.
EncMの詳細な機能の解明のため,まず,EncMの組換えタンパク質を大腸菌において発現させ精製した.これを結晶化し,X線結晶構造を1.95Å分解能にて決定した(PDB ID:3W8W,図2).6-ヒドロキシ-D-ニコチン酸化酵素5) などほかのフラビン依存性の酸化酵素と同様に,EncMは基質結合ドメインとフラビン結合ドメインの2つのドメインからなり,内部に補酵素フラビンをもっていた.しかし,単量体として存在するほかのフラビン依存性の酸化酵素とは異なり,EncMはホモ二量体を形成しており,また,フラビンを含む活性中心につながるユニークな基質結合トンネルをもっていた.この基質結合トンネルはフラビンの近くにまで進んだのち,L字型に曲がってフラビン活性中心と疎水性ポケットを形成しており,全長は30Å程度であった.このような基質結合トンネルのかたちや長さから判断すると,基質結合トンネルにアシルキャリアータンパク質から延びるホスホパンテニル鎖,さらには,基質のオクタケタイド鎖およびフェニル基を直鎖状にうまくおさめることができると考えられた.また,ホモ二量体の界面の近くに基質結合トンネルの入り口が存在し,その周辺にはArg107やArg210で構成される正に荷電した領域をもつことから,負に荷電したアシルキャリアータンパク質との結合に適しているように思われた.
基質との結合様式を調べるため,EncMと基質との共結晶化を試みた.実際の基質と考えられるアシルキャリアータンパク質に結合したオクタケタイド化合物は不安定と考えられたため,代わりに,オクタケタイド化合物のC8位までを含んだC7,O4-ジヒドロテトラケタイドを基質アナログとして合成した.EncMとこの合成基質アナログとの複合体のX線結晶構造を1.8Å分解能にて決定した結果,フラビン活性中心および疎水性ポケットに基質アナログに対応する電子密度を確認することができた(PDB ID:3W8Z).トンネルの奥に位置する疎水性ポケットには合成基質アナログのフェニル基が位置していた.また,合成基質アナログのC1位のエノールはフラビンと水素結合していた一方で,C3位のケトンはフラビンとは反対側をむいており,Glu355およびTyr249と水素結合を形成していた.酸化をうけるC4位はフラビンのC4a位やN5位から近い位置にあり,反応に適した場所に配置されていると考えられた.そして,C7位の水酸基は基質結合トンネルがちょうどL字型に曲がる部分に位置していたことから,実際に結合する基質もC7位においてほぼ直角に曲がっていると考えられた.このようなEncMの基質結合トンネルの構造により,反応の起こる部分であるC1位からC6位までのトリケタイド鎖の部分を,そのほかのC8位からC15位までのテトラケタイド鎖の部分から分離し,それらのあいだで起こりうる不要な環化反応をふせぐことにより,EncMが触媒する酸化反応とFavorskii転位反応を起こりやすくしていると考えられた.
このようにEncMに関する構造情報が得られたところで,実際の反応機構を考えることにした.EncMは基質のC4位を水酸化し,そののち,生じた水酸基を脱水素化する反応を触媒することにより,基質の3,5-ジケトンの部分を3,4,5-トリケトンへと変換すると予想した.この反応機構モデルならば,C4位は求電子的な環化をうけFavorskii転位反応が起こりやすくなると考えられた.
EncMの反応機構についてさらに知見を得るため,EncMと合成基質アナログC7,O4-ジヒドロテトラケタイドとを反応させ,生成物をHPLCにより分析した.その結果,反応が進行し生成物の生じることが確認できた.一般的に,酸素添加反応を行うフラビン依存性の酵素は補酵素NAD(P)Hにより還元をうけたのち酸素分子をトラップし,フラビン-C4a-ペルオキドを形成して反応を行うが6),興味深いことに,EncMはNAD(P)Hの非存在下においても同様の生成物を生成した.NMRや質量分析により生成物の構造決定を行った結果,予想していたエンテロシン様のラクトン化合物ではなく,ラクトン環が開環した類縁化合物であった.おそらく,合成基質アナログが酸化的なFavorskii転位反応をうけてラクトン化合物が生じ,さらに非酵素的なレトロClaisen反応によるラクトン環の開裂が起こったと考えられた.一方,実際のエンテロシンの生合成においては,さらにC9位からC15位までのテトラケタイド鎖が存在し,それらとのあいだにアルドール縮合の起こることから,ラクトン環の開裂は起こらないと考えられた.
EncMの活性を評価するため,安定同位体により標識した酸素分子18O2の存在のもとで反応を行った.その結果,予想どおり,生成物のC4位に18Oが取り込まれた.一方,重酸素水H218Oのなかで反応を行ったところ,18OはC5位のカルボキシル基にしか取り込まれなかったことから,水分子はラクトン環の開裂にのみかかわっていることが明らかになった.このことから,Favorskii転位反応の際に生じる三員環は水分子の攻撃をうけて開環するのではなく,C7位の水酸基の攻撃により開環し,結果としてラクトン環が形成していると考えられた.
NAD(P)Hの非存在下におけるEncMの反応を詳細に調べたところ,EncMは触媒サイクルが1回転するごとに少しずつ不活性型になっていき,触媒サイクルが約10回転したのちには完全に活性を失った.不活性化したEncMは,活性型のEncMと比べやや異なった吸収スペクトルを示した.この結果から,活性型EncMが酸素を付加した酸化型フラビンを完全に失った結果,吸収スペクトルに変化が起こったのではないかと推測した.このEncM-酸素付加酸化型フラビンは触媒サイクルを1回転したのち大部分が回復したことから,EncMはNAD(P)Hのような外因性の還元剤を必要とせずに触媒活性を示すことの説明がついた.活性中心残基がフラビンに対し影響をあたえている可能性を考え,活性中心に存在するTyr249やGlu355に変異を導入してみたが,それらの変異体は依然としてEncM-酸素付加酸化型フラビンと同様の吸収スペクトルを示した.このことから,フラビンが酸素付加体のキャリアーとして機能しているとの仮説をたてた.その吸収スペクトルから,EncMと結合している酸素付加酸化型フラビンは既知のフラビン-C4a-ペルオキシドとは異なることがわかった.さらに,この酸素付加酸化型フラビンは4度における1週間のインキュベーションののちも安定に存在しており,安定性ではフラビン-C4a-ペルオキシド7) をはるかにうわまっていた.そのため,大腸菌を用いてEncMの組換えタンパク質を得た際に,大腸菌において生成したEncM-酸素付加酸化型フラビンが酵素の精製ののちもそのまま維持されたと考えられた.
EncM-酸素付加酸化型フラビンの触媒機能についてさらに調べるため,フラビンを嫌気的に還元したのちに再酸化を試みた.その結果,酸素分子の存在下においてEncM-酸素付加酸化型フラビンは蓄積されることがわかった.18O2を用いてEncM-酸素付加酸化型フラビンを調製したのち合成基質アナログと反応させたところ,1モル当量の合成基質アナログに18Oが取り込まれたことから,酸化型フラビンに付加している酸素により基質は直接に水酸化されることが示された.以上の構造機能解析の結果をふまえ,EncMの結合している酸素付加酸化型フラビンはフラビン-N5-オキシド8) の状態で存在していると考えた.EncM-酸素付加酸化型フラビンと化学的に合成したフラビン-N5-オキシドとを比較したところ,スペクトルがほぼ一致した.また,そのほかの化学的な性質も一致したことから,EncMがフラビン-N5-オキシドと結合している証拠が得られた.ただし,このフラビン-N5-オキシドの存在をX線結晶構造において確認することはできなかった.原因として,X線を照射したときフラビン-N5-オキシドがダメージをうけ変換してしまったことが考えられた.
これまでの結果を総合して,以下のようにEncMの反応機構を考えた.最初に,フラビン-N5-オキシドが基質のC5位のエノールによりプロトン化される.そののち,フラビン-N5-ヒドロキシアミンから異性化した求電子的なオキソアンモニウムにより基質のエノラートの部位に酸素が添加されて,酸化型フラビンと基質のC4位が水酸化された中間体が生成する.さらに,酸化型フラビンにより中間体のC4位の水酸基が脱水素化をうけ,還元型フラビンとC4位がケトンになった中間体が生成する.EncM-酸素付加酸化型フラビンと合成基質アナログとを嫌気条件において反応させたところ,まず酸化型フラビンが生じたのちに還元型フラビンが生成したことがスペクトルにより確認されたことから,この反応機構は支持された.そのあとは,基質においてはFavorskii転位反応が起こるとともに,還元型フラビンが酸素分子と反応してフラビン-N5-オキシドと結合したEncMが再生し,つぎの反応サイクルがはじまる.
今回,筆者らは,合成した基質アナログを用いてEncMのX線構造解析と生化学的な解析を行うことにより,酵素的な酸化がひき起こすFavorskii転位の反応機構に関する深い知見を得た.Favorskii転位反応が酵素的に起こる例はほとんど知られておらず,その反応機構が明らかになったことによる学術的な価値は高いと考えている.このように興味深い反応を行うEncMであるが,そこにはフラビン-N5-オキシドをもつという性質がかくされていた.研究をはじめた当初は,このようにフラビン-N5-オキシドが存在するとは予想もしておらず,EncMもほかのフラビン酵素と同様にNAD(P)Hに依存性であり,フラビンペルオキシドを用いて反応を行っていると考えていた.このときは,1μM程度の低濃度のEncMを酵素反応に用いており,NAD(P)Hの存在下では反応が進行しNAD(P)Hの非存在下では反応は進行しないと考えられる結果が得られていた.あとから考えると,NAD(P)Hの非存在下においてin vitroの条件では触媒サイクルが何回転かすると酵素がすべて不活性型になるため,少量の酵素を用いただけでは生成物の量が少なくて検出できなかったのだろう.一方,NAD(P)Hの存在下においては,反応により生じた不活性型のフラビンをおそらくNAD(P)Hがなんらかのかたちで活性型の酸化型フラビンへともどし,反応が停止しなかったため生成物を検出できたと考えられる.しかし,EncMの吸収スペクトルを注意深くみると既知のものとは少し異なっており,また,20μMと高濃度のEncMを用いた場合にはNAD(P)Hが存在しない場合にも反応の進行を検出できた.これらの知見をもとに,フラビン-N5-オキシドの存在にたどりつくことができたのである.このように,フラビンペルオキシドではなく安定なフラビン-N5-オキシドを酸素添加反応に使うフラビン酵素は,これまでみすごされているだけでEncMのほかにも存在するかもしれない.また,フラビン-N5-オキシドがどのように生成するのかは現時点では不明であり,今後,明らかにしていく必要があると考えている.
略歴:2006年 東京大学大学院農学生命科学研究科 修了,同年 同 博士研究員,2009年 米国California大学San Diego校 博士研究員,2011年 東京理科大学理工学部 助教を経て,2012年より東京工業大学大学院理工学研究科 助教.
テーマ:天然化合物の生合成にかかわる酵素の構造と機能.
抱負:酵素のもつ新しい機構を,立体構造から明らかにしていきたい.
© 2013 宮永 顕正 Licensed under CC 表示 2.1 日本
(米国California大学San Diego校Scripps Institute of Oceanography)
email:宮永顕正
DOI: 10.7875/first.author.2013.141
Flavin-mediated dual oxidation controls an enzymatic Favorskii-type rearrangement.
Robin Teufel, Akimasa Miyanaga, Quentin Michaudel, Frederick Stull, Gordon Louie, Joseph P. Noel, Phil S. Baran, Bruce Palfey, Bradley S. Moore
Nature, 503, 552-556 (2013)
要 約
フラビン酵素は多様な酸化還元反応にかかわり,もっともよく研究されてきた酵素ファミリーのひとつである.これまで,フラビン酵素のかかわる酸素添加反応には,フラビンペルオキシドがかかわると考えられてきた.今回,筆者らは,ポリケタイド抗生物質であるエンテロシンの生合成にかかわるフラビン酵素EncMが,フラビンペルオキシドに非依存的に,水酸化反応と脱水素化反応の2回の酸化反応を触媒することを明らかにした.EncMとその合成基質アナログとの複合体のX線結晶構造解析と安定同位体による標識を用いた解析により,これまでの報告とは異なる,新しいフラビンの酸化還元反応が明らかにされた.EncMはフラビン-N5-オキシドと考えられる安定なフラビン酸素付加体をもち,これがエンテロシンの生合成において重要な,基質の酸化とFavorskii転位反応をひき起こしていると考えられた.
はじめに
微生物の生産する天然化合物は多様な構造を示し,そのなかには有用な生理活性を示すものも多く存在する.抗生物質エンテロシンはStreptomyces maritimusなどの放線菌により生産され,ユニークなかご状の骨格をもつのが特徴である.その構造から生合成の機構に興味がもたれ,これまで研究が進められてきた.約40年前に行われた同位体標識した化合物の投与実験の結果からは,エンテロシンの生合成にはFavorskii転位反応のかかわることが予想された1).さらに近年,エンテロシン生合成遺伝子クラスターがクローニングされ,その生合成にII型ポリケタイド合成酵素のかかわることが明らかになった2).エンテロシンの生合成経路(図1)においては,まず,アシルキャリアータンパク質であるEncCのうえで開始基質である安息香酸に7分子のマロニルCoAが縮合しオクタケタイド中間体が生成する.一般的なII型ポリケタイド合成酵素の反応では,このような中間体は環化酵素により適切な環化反応をうけ芳香族ポリケタイドが生成する.しかし,エンテロシンの生合成経路に環化酵素は存在せず,別の酵素により環化反応が制御されていることが示唆された.生化学的な実験の結果などから,フラビン酵素EncMがその役割を担うことが明らかになった3,4).すなわち,EncMが生合成経路に存在しない場合には非酵素的に環化が起こり芳香族化合物が生成したのに対し,EncMが存在した場合には最終的にエンテロシンが生成した.おそらく,EncMがC4位の酸化およびFavorskii転位反応を起こしたあと,環化が起こっていると考えられた.このように,EncMというたった1つの酵素がかかわることにより,芳香族化合物を生成するという一般的なII型ポリケタイド合成酵素の反応においてみられる反応経路からはずれ,まったく異なる骨格構造をもつ化合物へと変換されていることになる.しかし,このような複雑な反応をEncMがどのように触媒しているかという分子機構については謎につつまれていた.
1.フラビン酵素EncMのX線結晶構造解析
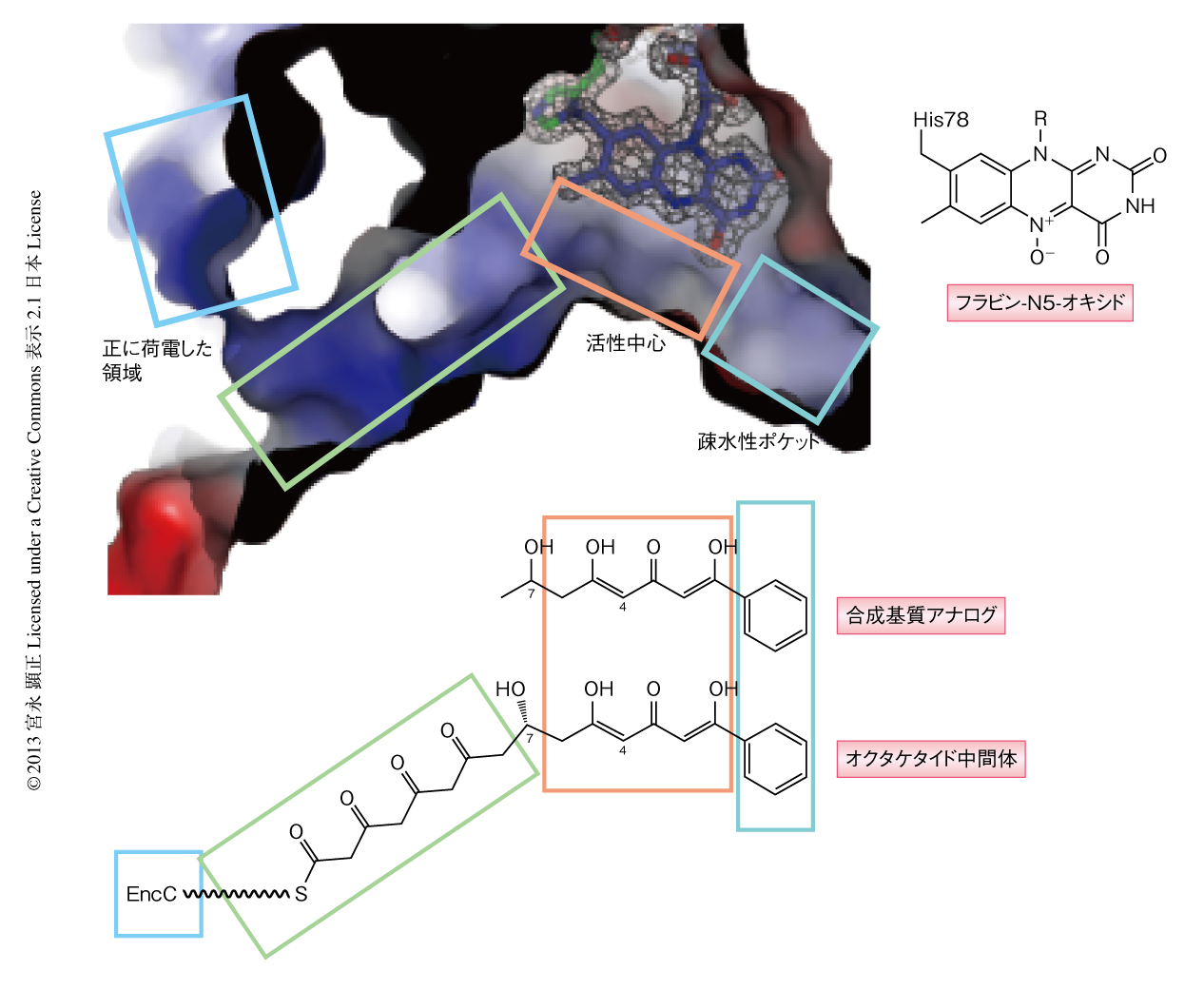
EncMの詳細な機能の解明のため,まず,EncMの組換えタンパク質を大腸菌において発現させ精製した.これを結晶化し,X線結晶構造を1.95Å分解能にて決定した(PDB ID:3W8W,図2).6-ヒドロキシ-D-ニコチン酸化酵素5) などほかのフラビン依存性の酸化酵素と同様に,EncMは基質結合ドメインとフラビン結合ドメインの2つのドメインからなり,内部に補酵素フラビンをもっていた.しかし,単量体として存在するほかのフラビン依存性の酸化酵素とは異なり,EncMはホモ二量体を形成しており,また,フラビンを含む活性中心につながるユニークな基質結合トンネルをもっていた.この基質結合トンネルはフラビンの近くにまで進んだのち,L字型に曲がってフラビン活性中心と疎水性ポケットを形成しており,全長は30Å程度であった.このような基質結合トンネルのかたちや長さから判断すると,基質結合トンネルにアシルキャリアータンパク質から延びるホスホパンテニル鎖,さらには,基質のオクタケタイド鎖およびフェニル基を直鎖状にうまくおさめることができると考えられた.また,ホモ二量体の界面の近くに基質結合トンネルの入り口が存在し,その周辺にはArg107やArg210で構成される正に荷電した領域をもつことから,負に荷電したアシルキャリアータンパク質との結合に適しているように思われた.
基質との結合様式を調べるため,EncMと基質との共結晶化を試みた.実際の基質と考えられるアシルキャリアータンパク質に結合したオクタケタイド化合物は不安定と考えられたため,代わりに,オクタケタイド化合物のC8位までを含んだC7,O4-ジヒドロテトラケタイドを基質アナログとして合成した.EncMとこの合成基質アナログとの複合体のX線結晶構造を1.8Å分解能にて決定した結果,フラビン活性中心および疎水性ポケットに基質アナログに対応する電子密度を確認することができた(PDB ID:3W8Z).トンネルの奥に位置する疎水性ポケットには合成基質アナログのフェニル基が位置していた.また,合成基質アナログのC1位のエノールはフラビンと水素結合していた一方で,C3位のケトンはフラビンとは反対側をむいており,Glu355およびTyr249と水素結合を形成していた.酸化をうけるC4位はフラビンのC4a位やN5位から近い位置にあり,反応に適した場所に配置されていると考えられた.そして,C7位の水酸基は基質結合トンネルがちょうどL字型に曲がる部分に位置していたことから,実際に結合する基質もC7位においてほぼ直角に曲がっていると考えられた.このようなEncMの基質結合トンネルの構造により,反応の起こる部分であるC1位からC6位までのトリケタイド鎖の部分を,そのほかのC8位からC15位までのテトラケタイド鎖の部分から分離し,それらのあいだで起こりうる不要な環化反応をふせぐことにより,EncMが触媒する酸化反応とFavorskii転位反応を起こりやすくしていると考えられた.
2.EncMの触媒するFavorskii転位反応の機構
このようにEncMに関する構造情報が得られたところで,実際の反応機構を考えることにした.EncMは基質のC4位を水酸化し,そののち,生じた水酸基を脱水素化する反応を触媒することにより,基質の3,5-ジケトンの部分を3,4,5-トリケトンへと変換すると予想した.この反応機構モデルならば,C4位は求電子的な環化をうけFavorskii転位反応が起こりやすくなると考えられた.
EncMの反応機構についてさらに知見を得るため,EncMと合成基質アナログC7,O4-ジヒドロテトラケタイドとを反応させ,生成物をHPLCにより分析した.その結果,反応が進行し生成物の生じることが確認できた.一般的に,酸素添加反応を行うフラビン依存性の酵素は補酵素NAD(P)Hにより還元をうけたのち酸素分子をトラップし,フラビン-C4a-ペルオキドを形成して反応を行うが6),興味深いことに,EncMはNAD(P)Hの非存在下においても同様の生成物を生成した.NMRや質量分析により生成物の構造決定を行った結果,予想していたエンテロシン様のラクトン化合物ではなく,ラクトン環が開環した類縁化合物であった.おそらく,合成基質アナログが酸化的なFavorskii転位反応をうけてラクトン化合物が生じ,さらに非酵素的なレトロClaisen反応によるラクトン環の開裂が起こったと考えられた.一方,実際のエンテロシンの生合成においては,さらにC9位からC15位までのテトラケタイド鎖が存在し,それらとのあいだにアルドール縮合の起こることから,ラクトン環の開裂は起こらないと考えられた.
EncMの活性を評価するため,安定同位体により標識した酸素分子18O2の存在のもとで反応を行った.その結果,予想どおり,生成物のC4位に18Oが取り込まれた.一方,重酸素水H218Oのなかで反応を行ったところ,18OはC5位のカルボキシル基にしか取り込まれなかったことから,水分子はラクトン環の開裂にのみかかわっていることが明らかになった.このことから,Favorskii転位反応の際に生じる三員環は水分子の攻撃をうけて開環するのではなく,C7位の水酸基の攻撃により開環し,結果としてラクトン環が形成していると考えられた.
3.EncMの触媒反応にかかわるフラビン-N5-オキシド
NAD(P)Hの非存在下におけるEncMの反応を詳細に調べたところ,EncMは触媒サイクルが1回転するごとに少しずつ不活性型になっていき,触媒サイクルが約10回転したのちには完全に活性を失った.不活性化したEncMは,活性型のEncMと比べやや異なった吸収スペクトルを示した.この結果から,活性型EncMが酸素を付加した酸化型フラビンを完全に失った結果,吸収スペクトルに変化が起こったのではないかと推測した.このEncM-酸素付加酸化型フラビンは触媒サイクルを1回転したのち大部分が回復したことから,EncMはNAD(P)Hのような外因性の還元剤を必要とせずに触媒活性を示すことの説明がついた.活性中心残基がフラビンに対し影響をあたえている可能性を考え,活性中心に存在するTyr249やGlu355に変異を導入してみたが,それらの変異体は依然としてEncM-酸素付加酸化型フラビンと同様の吸収スペクトルを示した.このことから,フラビンが酸素付加体のキャリアーとして機能しているとの仮説をたてた.その吸収スペクトルから,EncMと結合している酸素付加酸化型フラビンは既知のフラビン-C4a-ペルオキシドとは異なることがわかった.さらに,この酸素付加酸化型フラビンは4度における1週間のインキュベーションののちも安定に存在しており,安定性ではフラビン-C4a-ペルオキシド7) をはるかにうわまっていた.そのため,大腸菌を用いてEncMの組換えタンパク質を得た際に,大腸菌において生成したEncM-酸素付加酸化型フラビンが酵素の精製ののちもそのまま維持されたと考えられた.
EncM-酸素付加酸化型フラビンの触媒機能についてさらに調べるため,フラビンを嫌気的に還元したのちに再酸化を試みた.その結果,酸素分子の存在下においてEncM-酸素付加酸化型フラビンは蓄積されることがわかった.18O2を用いてEncM-酸素付加酸化型フラビンを調製したのち合成基質アナログと反応させたところ,1モル当量の合成基質アナログに18Oが取り込まれたことから,酸化型フラビンに付加している酸素により基質は直接に水酸化されることが示された.以上の構造機能解析の結果をふまえ,EncMの結合している酸素付加酸化型フラビンはフラビン-N5-オキシド8) の状態で存在していると考えた.EncM-酸素付加酸化型フラビンと化学的に合成したフラビン-N5-オキシドとを比較したところ,スペクトルがほぼ一致した.また,そのほかの化学的な性質も一致したことから,EncMがフラビン-N5-オキシドと結合している証拠が得られた.ただし,このフラビン-N5-オキシドの存在をX線結晶構造において確認することはできなかった.原因として,X線を照射したときフラビン-N5-オキシドがダメージをうけ変換してしまったことが考えられた.
4.EncMの反応モデル
これまでの結果を総合して,以下のようにEncMの反応機構を考えた.最初に,フラビン-N5-オキシドが基質のC5位のエノールによりプロトン化される.そののち,フラビン-N5-ヒドロキシアミンから異性化した求電子的なオキソアンモニウムにより基質のエノラートの部位に酸素が添加されて,酸化型フラビンと基質のC4位が水酸化された中間体が生成する.さらに,酸化型フラビンにより中間体のC4位の水酸基が脱水素化をうけ,還元型フラビンとC4位がケトンになった中間体が生成する.EncM-酸素付加酸化型フラビンと合成基質アナログとを嫌気条件において反応させたところ,まず酸化型フラビンが生じたのちに還元型フラビンが生成したことがスペクトルにより確認されたことから,この反応機構は支持された.そのあとは,基質においてはFavorskii転位反応が起こるとともに,還元型フラビンが酸素分子と反応してフラビン-N5-オキシドと結合したEncMが再生し,つぎの反応サイクルがはじまる.
おわりに
今回,筆者らは,合成した基質アナログを用いてEncMのX線構造解析と生化学的な解析を行うことにより,酵素的な酸化がひき起こすFavorskii転位の反応機構に関する深い知見を得た.Favorskii転位反応が酵素的に起こる例はほとんど知られておらず,その反応機構が明らかになったことによる学術的な価値は高いと考えている.このように興味深い反応を行うEncMであるが,そこにはフラビン-N5-オキシドをもつという性質がかくされていた.研究をはじめた当初は,このようにフラビン-N5-オキシドが存在するとは予想もしておらず,EncMもほかのフラビン酵素と同様にNAD(P)Hに依存性であり,フラビンペルオキシドを用いて反応を行っていると考えていた.このときは,1μM程度の低濃度のEncMを酵素反応に用いており,NAD(P)Hの存在下では反応が進行しNAD(P)Hの非存在下では反応は進行しないと考えられる結果が得られていた.あとから考えると,NAD(P)Hの非存在下においてin vitroの条件では触媒サイクルが何回転かすると酵素がすべて不活性型になるため,少量の酵素を用いただけでは生成物の量が少なくて検出できなかったのだろう.一方,NAD(P)Hの存在下においては,反応により生じた不活性型のフラビンをおそらくNAD(P)Hがなんらかのかたちで活性型の酸化型フラビンへともどし,反応が停止しなかったため生成物を検出できたと考えられる.しかし,EncMの吸収スペクトルを注意深くみると既知のものとは少し異なっており,また,20μMと高濃度のEncMを用いた場合にはNAD(P)Hが存在しない場合にも反応の進行を検出できた.これらの知見をもとに,フラビン-N5-オキシドの存在にたどりつくことができたのである.このように,フラビンペルオキシドではなく安定なフラビン-N5-オキシドを酸素添加反応に使うフラビン酵素は,これまでみすごされているだけでEncMのほかにも存在するかもしれない.また,フラビン-N5-オキシドがどのように生成するのかは現時点では不明であり,今後,明らかにしていく必要があると考えている.
文 献
- Seto, H., Sato, T., Urano, S. et al.: Utilization of 13C-13C coupling in structural and biosynthetic studies. VII. The structure and biosynthesis of vulgamycin. Tetrahedron Lett., 48, 4367-4370 (1976)
- Piel, J., Hertweck, C., Shipley, P. R. et al.: Cloning, sequencing and analysis of the enterocin biosynthesis gene cluster from the marine isolate ‘Streptomyces maritimus’: evidence for the derailment of an aromatic polyketide synthase. Chem. Biol., 7, 943-955 (2000)[PubMed]
- Xiang, L., Kalaitzis, J. A. & Moore, B. S.: EncM, a versatile enterocin biosynthetic enzyme involved in Favorskii oxidative rearrangement, aldol condensation, and heterocycle-forming reactions. Proc. Natl. Acad. Sci. USA, 101, 15609-15614 (2004)[PubMed]
- Cheng, Q., Xiang, L., Izumikawa, M. et al.: Enzymatic total synthesis of enterocin polyketides. Nat. Chem. Biol., 3, 557-558 (2007)[PubMed]
- Koetter, J. W. & Schulz, G. E.: Crystal structure of 6-hydroxy-D-nicotine oxidase from Arthrobacter nicotinovorans. J. Mol. Biol., 352, 418-428 (2005)[PubMed]
- Palfey, B. A. & McDonald, C. A.: Control of catalysis in flavin-dependent monooxygenases. Arch. Biochem. Biophys., 493, 26-36 (2010)[PubMed]
- Thotsaporn, K., Chenprakhon, P., Sucharitakul, J. et al.: Stabilization of C4a-hydroperoxyflavin in a two-component flavin-dependent monooxygenase is achieved through interactions at flavin N5 and C4a atoms. J. Biol. Chem., 286, 28170-28180 (2011)[PubMed]
- Rastetter, W. H., Gadek, T. R., Tane, J. P. et al.: Oxidations and oxygen transfers effected by a flavin N(5)-oxide. A model for flavin-dependent monooxygenases. J. Am. Chem. Soc., 101, 2228-2231 (1979)
著者プロフィール
略歴:2006年 東京大学大学院農学生命科学研究科 修了,同年 同 博士研究員,2009年 米国California大学San Diego校 博士研究員,2011年 東京理科大学理工学部 助教を経て,2012年より東京工業大学大学院理工学研究科 助教.
テーマ:天然化合物の生合成にかかわる酵素の構造と機能.
抱負:酵素のもつ新しい機構を,立体構造から明らかにしていきたい.
© 2013 宮永 顕正 Licensed under CC 表示 2.1 日本