移植の可能な胎生期の未熟な腸管上皮前駆細胞の体外における培養技術の確立
油井史郎・中村哲也・渡辺 守
(東京医科歯科大学大学院医歯学総合研究科 消化器病態学分野)
email:油井史郎
DOI: 10.7875/first.author.2013.142
Transplantation of expanded fetal intestinal progenitors contributes to colon regeneration after injury.
Robert P. Fordham, Shiro Yui, Nicholas R.F. Hannan, Christoffer Soendergaard, Alison Madgwick, Pawel J. Schweiger, Ole H. Nielsen, Ludovic Vallier, Roger A. Pedersen, Tetsuya Nakamura, Mamoru Watanabe, Kim B. Jensen
Cell Stem Cell, 13, 734-744 (2013)
筆者らは,ヒトおよびマウスの胎児の腸管上皮には成体の小腸上皮幹細胞とは異なる性質をもつ増殖性の前駆細胞が存在し,成体の小腸上皮幹細胞がin vivoにおいて形成するオルガノイドとは異なる球状体FEnSとして体外において長期にわたり培養できること,この増殖性の前駆細胞はin vitroにおいてヒトのiPS細胞からも誘導でき,これらの前駆細胞も体外においてFEnSと類似した球状体として培養の可能なことを明らかにした.さらに,この成熟の過程においてはWntシグナルがその駆動力として重要な役割をはたしていることをin vitroおよびin vivoにおいて明らかにした.筆者らの開発した独自の上皮移植系を用いることにより,成体の大腸の間質へ移植されたFEnSは,クリプト様の構造を呈して傷害をうけた大腸上皮の修復に寄与し,in vivoにおいて大腸上皮に類似した非腫瘍性の表現型を示すことを明らかにした.
近年,マウスおよびヒトの小腸上皮幹細胞や大腸上皮幹細胞を体外において培養する方法が確立され,その再生医療における可能性に注目があつまっている1).今回の研究は,胎児期の腸管上皮細胞はこれらの成体の腸管上皮細胞とは異なる性質をもつ球状体として,また,ヒトのiPS細胞からも同様の球状体として,体外において培養できることを報告するにとどまらず,胎児性の腸管上皮細胞から成体の小腸上皮幹細胞が分化し成熟する際の分子機構を明らかにするとともに,これらの細胞もまた,旺盛な再生能と環境に応じて柔軟に表現型を変化させうる可塑性とをもつ,興味深い生物学的な材料であることを報告することができた.
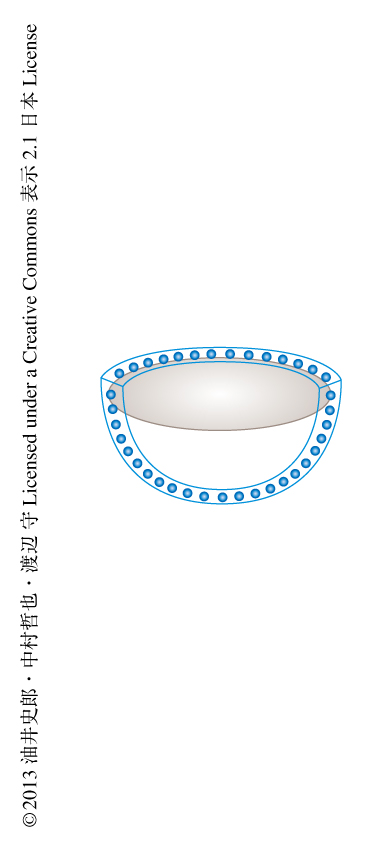
腸管は管状の閉鎖構造をしており,内腔は単層の上皮により被覆されている.上皮は管腔に突出する絨毛部分と,絨毛のあいだにあり間質に陥凹するクリプトという異なる2つのドメインより構成されている.クリプトの底部には成体の上皮幹細胞の存在することが知られ,近年,この上皮幹細胞がLgr5を特異的に発現することや2),マトリゲルとよばれる細胞外マトリックスに包埋し,EGF,Noggin(BMPシグナルのアンタゴニスト),R-spondin1(Wntシグナルのアゴニスト)の存在のもとで培養することにより,クリプト様の突起構造をもつヒトデ型のオルガノイド(図1)として長期にわたり体外において培養できることが示された3).腸管上皮の発生は定型的な変化を示すことが知られている4).ヒトにおいては,妊娠9週(マウスにおいては,胎生15日目)に絨毛の形成がはじまり,出生の直前(マウスにおいては,出生ののち2週間前後)にクリプトが完成し腸管上皮として成熟する.この変化と並行して,分泌系細胞(杯細胞,内分泌細胞,Paneth細胞)が腸管上皮に出現する.胎生期の未熟な腸管上皮に成体の腸管上皮が成熟し分化していく詳細な分子機構は不明であるが,その解明は,旺盛な増殖能をもつ胎生期の未熟な腸管上皮細胞や,iPS細胞など全能性の多能性幹細胞から成体の腸管上皮への分化を誘導する技術の開発,しいては,より安全で確実な再生医療あるいは細胞治療の確立へむけ重要な課題である.
妊娠10週のヒト胎児の腸管上皮には,絨毛のあいだの上皮に増殖性の上皮前駆細胞が確認できるものの,クリプトの構造は明瞭には形成されておらず,分泌系細胞の分化も十分ではない.このヒト胎児の腸管上皮細胞をマトリゲル包埋培養法により培養したところ,EGF,Noggin,R-spondin1にくわえプロスタグランジンE2を添加した条件において,2カ月以上にわたり球状体として増殖能を維持しつつ培養することができた.成体の腸管上皮細胞がin vivoにおいて形成するオルガノイドとは異なる性質をもつこの球状体を,FEnS(fetal enterospheres)と命名した.興味深いことに,ヒトに由来するFEnSは培養期間においてクリプト様の突起構造を形成しないのみならず,分泌系細胞の分化も生じず,胎児の腸管上皮に相当する性状を示した.
すでに,ヒトのiPS細胞はin vitroにおいて腸管上皮細胞への分化の誘導が可能であることが報告されている5).筆者らは,新規の化合物のみによる分化誘導法6) を用いてヒトiPS細胞を内胚葉にまで誘導し,そののち,マトリゲル包埋培養法により培養した.驚くべきことに,この細胞もFEnSに類似した球状体を形成し,遺伝子やタンパク質の発現パターンにおいても両者は高い相同性を示した.これらの結果から,iPS細胞が成体の上皮幹細胞へと分化する過程では,FEnSに類似する胎児の腸管上皮細胞の時期をへることが示唆された.これらヒト胎児の未熟な腸管上皮細胞の培養技術やiPS細胞の分化の誘導技術は,胎生期の未熟な腸管上皮が成体の腸管上皮へと成熟する過程の詳細を解析する際の有用なツールになると考えられた.
マウスにおける腸管上皮の発生の過程は,ヒトにおける過程と高い相同性があるうえ,入手は容易である.マウスの胎生期の未熟な腸管上皮に由来する,ヒトFEnSに相当する培養組織の樹立が可能であれば,それを用いて腸管上皮の成熟の機構の詳細な解析が可能になる.マウスの未熟な腸管上皮をマトリゲル包埋培養法により培養したところ,胎生16日目から生後2日目までの腸管上皮は体外においてFEnSとして培養が可能であった(図2).おもしろいことに,生後2日目の腸管上皮のマトリゲル培養ではおよそ半数がオルガノイドを形成し,生後15日目の腸管上皮の場合にはオルガノイドのみが形成され,マトリゲル包埋培養を行うのときの形態が小腸上皮の成熟とよく相関していることが明らかになった.マウスに由来するFEnSはその特徴的な球体構造においてはヒトのFEnSと同様であったが,プロスタグランジンE2なしで培養が可能であり,R-spondin1に対する要求性は樹立ののち早期に消失し,以後は,DKK1やPorcupineの阻害剤,Tankyraseの阻害剤(いずれも,Wntシグナル阻害剤)の存在のもとでも増殖能を維持したまま培養が可能であって,Wntシグナルに非依存性の増殖機構をもつことが示唆された.性状解析の結果,未熟な腸管上皮の性質を維持していること,すなわち,分泌系細胞のマーカーは遺伝子レベルおよびタンパク質レベルにおいて確認できず,Lgr5やLrig1 7) など成体の腸管上皮幹細胞のマーカーの発現も低レベルであることが明らかになった.すでに,Apcの欠損により恒常的にWntシグナルが活性化状態にある腫瘍性オルガノイドも球状体として維持されることが明らかになっているが8),両者の遺伝子発現のプロファイルはまったく異なっており,マウスFEnSでは長期にわたる培養ののちも正常な核型を示すこともあわせ,非腫瘍性の増殖性前駆細胞より形成されていることが確認された.
近位の小腸から遠位にむかい進行すると考えられていた腸管上皮の成熟は4),これとは逆向き(遠位から近位に)波及している可能性が見い出され,この進行はWntシグナルの腸管の局所における強さ,および,分泌系細胞のマーカーの発現量の両方に相関しているという興味深い事実が明らかになった.これらの関係を詳細に検討した結果,成体の上皮幹細胞の特異的なマーカーでありWntシグナルの標的遺伝子産物であるLgr5を発現する生後2日目の腸管上皮前駆細胞はin vitroにおいてオルガノイドを形成する能力をもつこと,胎生16日目の腸管上皮細胞に由来するFEnSはin vitroにおいてWntの刺激に反応しオルガノイドとして成熟すること,さらに,この形態学的な変化はPaneth細胞のマーカーであるリソソームを含む分泌系細胞のマーカーの発現の上昇をともなうことが見い出された.この未熟な腸管上皮から成体の腸管上皮への移行の過程におけるWntシグナルの重要性は,生後2日目の腸管上皮を材料としたマトリゲル包埋培養においても確認された.この時期の腸管上皮はEGF,Noggin,R-spondin1のみの添加による培養ではおよそ半分の割合でFEnSおよびオルガノイドの両方が形成された.実験はLgr5-GFPを発現するノックインマウスを用いて行い,EGF,Noggin,R-spondin1の添加およびWntリガンドやその阻害剤を組み合わせて行った.その結果,1)FEnSにおいても基礎的なレベルのLgr5の発現を認めるものの,オルガノイドにおいてはクリプト様の突起構造の部位に限局して強いLgr5の発現が確認できること,2)Wntリガンドの存在のもとではその局在はより広範囲となり,オルガノイドの形成率が高まること,3)Wntシグナルの阻害剤の存在のもとではオルガノイドの形成が阻害される一方で,FEnSの形成は影響をうけないこと,4)オルガノイドの形成はPaneth細胞のマーカーであるリソソームの発現量の増加と相関していること,が明らかになった.in vivoにおいては,成熟期にあたる生後2日目から生後15日目にかけてクリプトの底部においてPaneth細胞の成熟が進行し,これにともない成体幹細胞が腸管上皮において分化し,かつ,Wnt3a遺伝子もクリプトの底部に限局して発現することが確認された.
これら一連の結果は,未熟な腸管上皮前駆細胞におけるWntシグナルの活性化が腸管上皮の成熟において重要であることと同時に,腸管上皮においてはその成熟を駆動する内因性のWntシグナルが活性化しており,それに対し反応できることを示唆していた.より直接的にいえば,腸管上皮において自律的なWntの刺激とその応答の結果として,成体の腸管上皮におけるWntのみなもとであるPaneth細胞への分化9) と,成体の上皮幹細胞への分化が並行して起こり,この自律的なループのなかで胎生期の腸管上皮から成体の腸管上皮への成熟が進行していることが想定された.おもしろいことに,体外で長期にわたり培養の維持されたマウスFEnSはWntシグナルの存在のもとでも球状体に変化をきたさないうえ,分泌系細胞の分化も生じない.R-spondin1の受容体でもあるLgr5 10) の発現が培養の期間とともに低下していたことから,これは受容体の発現の低下によるWntシグナルへの反応性の低下によると予想された.
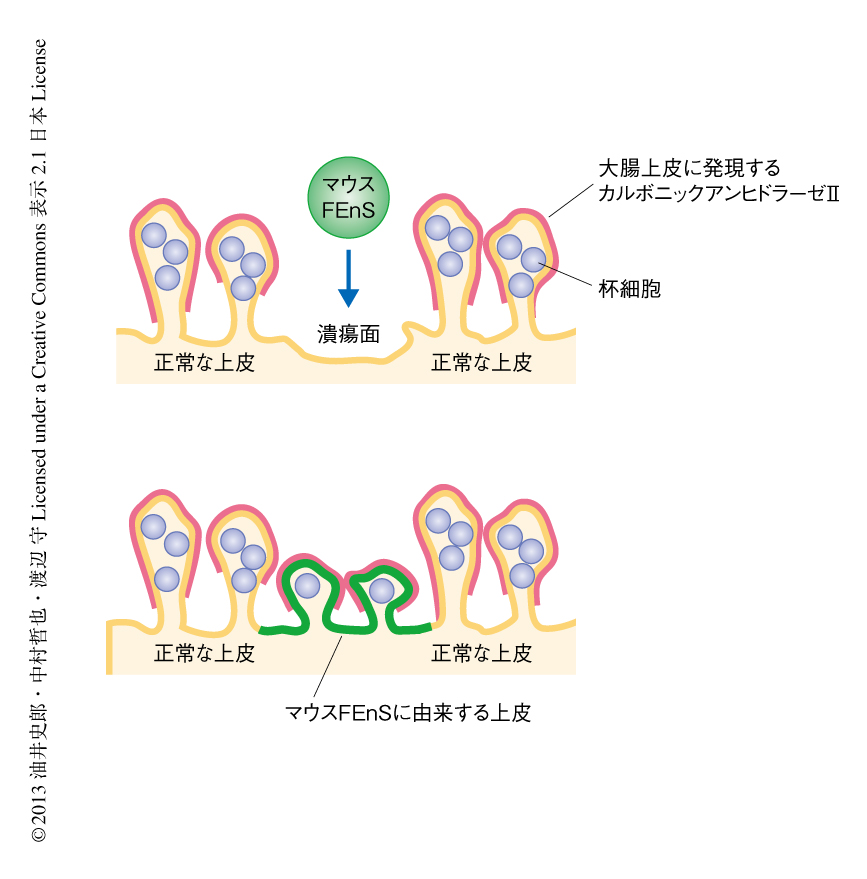
樹立ののち早期であれば的確な成体の腸管上皮への分化の誘導は可能であるが,長期にわたる体外での培養ののちにはそれが困難となるという性質は,再生医療あるいは細胞治療への利用においては不都合な側面と考えられる.そこで,FEnSを実際に生体に移植することによりこの点を評価することにした.実験は,筆者らの開発した独自の上皮移植系11) を用いて行った.驚くべきことに,体外において長期にわたり培養されたマウスFEnSは,in vitroにおける分化の誘導には抵抗性であったのにもかかわらず,移植の1週間のちには杯細胞への分化を示した.さらに驚くべきことに,その移植片においてPaneth細胞は確認されず,小腸上皮細胞に特異的なアルカリホスファターゼの発現も確認されず,一方で,マウスFEnSにおいて発現を認めないカルボニックアンヒドラーゼIIの発現を大腸上皮細胞と同様に認めた(図3).これらの結果は,体外において維持されたマウスFEnSは,部分的に未知の機構を介し,適切な分化の誘導が可能であり,しかも,小腸上皮の由来でありながら移植した部位にあわせた表現型を示しうること,すなわち,可塑性をもつ興味深い移植源であることを示唆した.
今回,筆者らは,ヒトおよびマウスの胎児の腸管上皮細胞を体外においてFEnSとして培養する新規の培養法を報告するとともに,胎児の未熟な腸管上皮が成体の腸管上皮として成熟する際には,腸管上皮におけるWntシグナルの活性化が重要であることを明らかにした.ヒトiPS細胞の腸管上皮細胞への分化の誘導においてはFEnSに類似した過程をへたことから,これらの知見は,ヒトiPS細胞の腸管上皮細胞への適切な分化の誘導技術の発展にとっても重要な知見であると考えられた.さらに,FEnSが移植の可能な生物学的な材料であることを示すとともに,これらの未熟な腸管上皮に由来する細胞が一定の可塑性をもつ可能性を見い出した.今後は,これらの興味深い細胞源を用いた腸管上皮の再生技術をさらに発展させ,炎症性腸疾患など慢性的な腸疾患に対する新規の治療として確立することがひとつの方向性であると考えられた.
略歴:2011年 東京医科歯科大学大学院医歯学総合研究科,2013年よりデンマークCopenhagen大学 研究員.
中村 哲也(Tetsuya Nakamura)
東京医科歯科大学大学院医歯学総合研究科 准教授.
渡辺 守(Mamoru Watanabe)
東京医科歯科大学大学院医歯学総合研究科 教授.
研究室URL:http://www.tmd.ac.jp/grad/gast/
© 2013 油井史郎・中村哲也・渡辺 守 Licensed under CC 表示 2.1 日本
(東京医科歯科大学大学院医歯学総合研究科 消化器病態学分野)
email:油井史郎
DOI: 10.7875/first.author.2013.142
Transplantation of expanded fetal intestinal progenitors contributes to colon regeneration after injury.
Robert P. Fordham, Shiro Yui, Nicholas R.F. Hannan, Christoffer Soendergaard, Alison Madgwick, Pawel J. Schweiger, Ole H. Nielsen, Ludovic Vallier, Roger A. Pedersen, Tetsuya Nakamura, Mamoru Watanabe, Kim B. Jensen
Cell Stem Cell, 13, 734-744 (2013)
要 約
筆者らは,ヒトおよびマウスの胎児の腸管上皮には成体の小腸上皮幹細胞とは異なる性質をもつ増殖性の前駆細胞が存在し,成体の小腸上皮幹細胞がin vivoにおいて形成するオルガノイドとは異なる球状体FEnSとして体外において長期にわたり培養できること,この増殖性の前駆細胞はin vitroにおいてヒトのiPS細胞からも誘導でき,これらの前駆細胞も体外においてFEnSと類似した球状体として培養の可能なことを明らかにした.さらに,この成熟の過程においてはWntシグナルがその駆動力として重要な役割をはたしていることをin vitroおよびin vivoにおいて明らかにした.筆者らの開発した独自の上皮移植系を用いることにより,成体の大腸の間質へ移植されたFEnSは,クリプト様の構造を呈して傷害をうけた大腸上皮の修復に寄与し,in vivoにおいて大腸上皮に類似した非腫瘍性の表現型を示すことを明らかにした.
はじめに
近年,マウスおよびヒトの小腸上皮幹細胞や大腸上皮幹細胞を体外において培養する方法が確立され,その再生医療における可能性に注目があつまっている1).今回の研究は,胎児期の腸管上皮細胞はこれらの成体の腸管上皮細胞とは異なる性質をもつ球状体として,また,ヒトのiPS細胞からも同様の球状体として,体外において培養できることを報告するにとどまらず,胎児性の腸管上皮細胞から成体の小腸上皮幹細胞が分化し成熟する際の分子機構を明らかにするとともに,これらの細胞もまた,旺盛な再生能と環境に応じて柔軟に表現型を変化させうる可塑性とをもつ,興味深い生物学的な材料であることを報告することができた.
腸管は管状の閉鎖構造をしており,内腔は単層の上皮により被覆されている.上皮は管腔に突出する絨毛部分と,絨毛のあいだにあり間質に陥凹するクリプトという異なる2つのドメインより構成されている.クリプトの底部には成体の上皮幹細胞の存在することが知られ,近年,この上皮幹細胞がLgr5を特異的に発現することや2),マトリゲルとよばれる細胞外マトリックスに包埋し,EGF,Noggin(BMPシグナルのアンタゴニスト),R-spondin1(Wntシグナルのアゴニスト)の存在のもとで培養することにより,クリプト様の突起構造をもつヒトデ型のオルガノイド(図1)として長期にわたり体外において培養できることが示された3).腸管上皮の発生は定型的な変化を示すことが知られている4).ヒトにおいては,妊娠9週(マウスにおいては,胎生15日目)に絨毛の形成がはじまり,出生の直前(マウスにおいては,出生ののち2週間前後)にクリプトが完成し腸管上皮として成熟する.この変化と並行して,分泌系細胞(杯細胞,内分泌細胞,Paneth細胞)が腸管上皮に出現する.胎生期の未熟な腸管上皮に成体の腸管上皮が成熟し分化していく詳細な分子機構は不明であるが,その解明は,旺盛な増殖能をもつ胎生期の未熟な腸管上皮細胞や,iPS細胞など全能性の多能性幹細胞から成体の腸管上皮への分化を誘導する技術の開発,しいては,より安全で確実な再生医療あるいは細胞治療の確立へむけ重要な課題である.
1.ヒト胎児の腸管上皮細胞の体外における培養技術の確立
妊娠10週のヒト胎児の腸管上皮には,絨毛のあいだの上皮に増殖性の上皮前駆細胞が確認できるものの,クリプトの構造は明瞭には形成されておらず,分泌系細胞の分化も十分ではない.このヒト胎児の腸管上皮細胞をマトリゲル包埋培養法により培養したところ,EGF,Noggin,R-spondin1にくわえプロスタグランジンE2を添加した条件において,2カ月以上にわたり球状体として増殖能を維持しつつ培養することができた.成体の腸管上皮細胞がin vivoにおいて形成するオルガノイドとは異なる性質をもつこの球状体を,FEnS(fetal enterospheres)と命名した.興味深いことに,ヒトに由来するFEnSは培養期間においてクリプト様の突起構造を形成しないのみならず,分泌系細胞の分化も生じず,胎児の腸管上皮に相当する性状を示した.
すでに,ヒトのiPS細胞はin vitroにおいて腸管上皮細胞への分化の誘導が可能であることが報告されている5).筆者らは,新規の化合物のみによる分化誘導法6) を用いてヒトiPS細胞を内胚葉にまで誘導し,そののち,マトリゲル包埋培養法により培養した.驚くべきことに,この細胞もFEnSに類似した球状体を形成し,遺伝子やタンパク質の発現パターンにおいても両者は高い相同性を示した.これらの結果から,iPS細胞が成体の上皮幹細胞へと分化する過程では,FEnSに類似する胎児の腸管上皮細胞の時期をへることが示唆された.これらヒト胎児の未熟な腸管上皮細胞の培養技術やiPS細胞の分化の誘導技術は,胎生期の未熟な腸管上皮が成体の腸管上皮へと成熟する過程の詳細を解析する際の有用なツールになると考えられた.
2.マウス胎仔の未熟な腸管上皮細胞に由来するFEnSの確立
マウスにおける腸管上皮の発生の過程は,ヒトにおける過程と高い相同性があるうえ,入手は容易である.マウスの胎生期の未熟な腸管上皮に由来する,ヒトFEnSに相当する培養組織の樹立が可能であれば,それを用いて腸管上皮の成熟の機構の詳細な解析が可能になる.マウスの未熟な腸管上皮をマトリゲル包埋培養法により培養したところ,胎生16日目から生後2日目までの腸管上皮は体外においてFEnSとして培養が可能であった(図2).おもしろいことに,生後2日目の腸管上皮のマトリゲル培養ではおよそ半数がオルガノイドを形成し,生後15日目の腸管上皮の場合にはオルガノイドのみが形成され,マトリゲル包埋培養を行うのときの形態が小腸上皮の成熟とよく相関していることが明らかになった.マウスに由来するFEnSはその特徴的な球体構造においてはヒトのFEnSと同様であったが,プロスタグランジンE2なしで培養が可能であり,R-spondin1に対する要求性は樹立ののち早期に消失し,以後は,DKK1やPorcupineの阻害剤,Tankyraseの阻害剤(いずれも,Wntシグナル阻害剤)の存在のもとでも増殖能を維持したまま培養が可能であって,Wntシグナルに非依存性の増殖機構をもつことが示唆された.性状解析の結果,未熟な腸管上皮の性質を維持していること,すなわち,分泌系細胞のマーカーは遺伝子レベルおよびタンパク質レベルにおいて確認できず,Lgr5やLrig1 7) など成体の腸管上皮幹細胞のマーカーの発現も低レベルであることが明らかになった.すでに,Apcの欠損により恒常的にWntシグナルが活性化状態にある腫瘍性オルガノイドも球状体として維持されることが明らかになっているが8),両者の遺伝子発現のプロファイルはまったく異なっており,マウスFEnSでは長期にわたる培養ののちも正常な核型を示すこともあわせ,非腫瘍性の増殖性前駆細胞より形成されていることが確認された.
3.胎生期の腸管上皮前駆細胞の成熟および分化の分子機構
近位の小腸から遠位にむかい進行すると考えられていた腸管上皮の成熟は4),これとは逆向き(遠位から近位に)波及している可能性が見い出され,この進行はWntシグナルの腸管の局所における強さ,および,分泌系細胞のマーカーの発現量の両方に相関しているという興味深い事実が明らかになった.これらの関係を詳細に検討した結果,成体の上皮幹細胞の特異的なマーカーでありWntシグナルの標的遺伝子産物であるLgr5を発現する生後2日目の腸管上皮前駆細胞はin vitroにおいてオルガノイドを形成する能力をもつこと,胎生16日目の腸管上皮細胞に由来するFEnSはin vitroにおいてWntの刺激に反応しオルガノイドとして成熟すること,さらに,この形態学的な変化はPaneth細胞のマーカーであるリソソームを含む分泌系細胞のマーカーの発現の上昇をともなうことが見い出された.この未熟な腸管上皮から成体の腸管上皮への移行の過程におけるWntシグナルの重要性は,生後2日目の腸管上皮を材料としたマトリゲル包埋培養においても確認された.この時期の腸管上皮はEGF,Noggin,R-spondin1のみの添加による培養ではおよそ半分の割合でFEnSおよびオルガノイドの両方が形成された.実験はLgr5-GFPを発現するノックインマウスを用いて行い,EGF,Noggin,R-spondin1の添加およびWntリガンドやその阻害剤を組み合わせて行った.その結果,1)FEnSにおいても基礎的なレベルのLgr5の発現を認めるものの,オルガノイドにおいてはクリプト様の突起構造の部位に限局して強いLgr5の発現が確認できること,2)Wntリガンドの存在のもとではその局在はより広範囲となり,オルガノイドの形成率が高まること,3)Wntシグナルの阻害剤の存在のもとではオルガノイドの形成が阻害される一方で,FEnSの形成は影響をうけないこと,4)オルガノイドの形成はPaneth細胞のマーカーであるリソソームの発現量の増加と相関していること,が明らかになった.in vivoにおいては,成熟期にあたる生後2日目から生後15日目にかけてクリプトの底部においてPaneth細胞の成熟が進行し,これにともない成体幹細胞が腸管上皮において分化し,かつ,Wnt3a遺伝子もクリプトの底部に限局して発現することが確認された.
これら一連の結果は,未熟な腸管上皮前駆細胞におけるWntシグナルの活性化が腸管上皮の成熟において重要であることと同時に,腸管上皮においてはその成熟を駆動する内因性のWntシグナルが活性化しており,それに対し反応できることを示唆していた.より直接的にいえば,腸管上皮において自律的なWntの刺激とその応答の結果として,成体の腸管上皮におけるWntのみなもとであるPaneth細胞への分化9) と,成体の上皮幹細胞への分化が並行して起こり,この自律的なループのなかで胎生期の腸管上皮から成体の腸管上皮への成熟が進行していることが想定された.おもしろいことに,体外で長期にわたり培養の維持されたマウスFEnSはWntシグナルの存在のもとでも球状体に変化をきたさないうえ,分泌系細胞の分化も生じない.R-spondin1の受容体でもあるLgr5 10) の発現が培養の期間とともに低下していたことから,これは受容体の発現の低下によるWntシグナルへの反応性の低下によると予想された.
4.胎生期の腸管上皮前駆細胞のin vivoにおける成熟
樹立ののち早期であれば的確な成体の腸管上皮への分化の誘導は可能であるが,長期にわたる体外での培養ののちにはそれが困難となるという性質は,再生医療あるいは細胞治療への利用においては不都合な側面と考えられる.そこで,FEnSを実際に生体に移植することによりこの点を評価することにした.実験は,筆者らの開発した独自の上皮移植系11) を用いて行った.驚くべきことに,体外において長期にわたり培養されたマウスFEnSは,in vitroにおける分化の誘導には抵抗性であったのにもかかわらず,移植の1週間のちには杯細胞への分化を示した.さらに驚くべきことに,その移植片においてPaneth細胞は確認されず,小腸上皮細胞に特異的なアルカリホスファターゼの発現も確認されず,一方で,マウスFEnSにおいて発現を認めないカルボニックアンヒドラーゼIIの発現を大腸上皮細胞と同様に認めた(図3).これらの結果は,体外において維持されたマウスFEnSは,部分的に未知の機構を介し,適切な分化の誘導が可能であり,しかも,小腸上皮の由来でありながら移植した部位にあわせた表現型を示しうること,すなわち,可塑性をもつ興味深い移植源であることを示唆した.
おわりに
今回,筆者らは,ヒトおよびマウスの胎児の腸管上皮細胞を体外においてFEnSとして培養する新規の培養法を報告するとともに,胎児の未熟な腸管上皮が成体の腸管上皮として成熟する際には,腸管上皮におけるWntシグナルの活性化が重要であることを明らかにした.ヒトiPS細胞の腸管上皮細胞への分化の誘導においてはFEnSに類似した過程をへたことから,これらの知見は,ヒトiPS細胞の腸管上皮細胞への適切な分化の誘導技術の発展にとっても重要な知見であると考えられた.さらに,FEnSが移植の可能な生物学的な材料であることを示すとともに,これらの未熟な腸管上皮に由来する細胞が一定の可塑性をもつ可能性を見い出した.今後は,これらの興味深い細胞源を用いた腸管上皮の再生技術をさらに発展させ,炎症性腸疾患など慢性的な腸疾患に対する新規の治療として確立することがひとつの方向性であると考えられた.
文 献
- Shaker, A. & Rubin, D. C.: Stem cells: one step closer to gut repair. Nature, 485, 181-182 (2012)[PubMed]
- Barker, N., van Es, J. H., Kuipers, J. et al.: Identification of stem cells in small intestine and colon by marker gene Lgr5. Nature, 449, 1003-1007 (2007)[PubMed]
- Sato, T., Vries, R. G., Snippert, H. J. et al.: Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature, 459, 262-265 (2009)[PubMed]
- Spence, J. R., Lauf, R. & Shroyer, N. F.: Vertebrate intestinal endoderm development. Dev. Dyn., 240, 501-520 (2011)[PubMed]
- Spence, J. R., Mayhew, C. N., Rankin, S. A. et al.: Directed differentiation of human pluripotent stem cells into intestinal tissue in vitro. Nature, 470, 105-109 (2011)[PubMed]
- Hannan, N. R. F., Fordham, R. P., Syed, Y. A. et al.: Generation of multipotent foregut stem cells from human pluripotent stem cells. Stem Cell Rep., 14, 293-306 (2013)[PubMed]
- Wong, V. W., Stange, D. E., Page, M. E. et al.: Lrig1 controls intestinal stem-cell homeostasis by negative regulation of ErbB signalling. Nat. Cell Biol., 14, 401-408 (2012)[PubMed]
- Sato, T., Stange, D. E., Ferrante, M. et al.: Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology, 141, 1762-1772 (2011)[PubMed]
- Sato, T., van Es, J. H., Snippert, H. J. et al.: Paneth cells constitute the niche for Lgr5 stem cells in intestinal crypts. Nature, 469, 415-418 (2011)[PubMed] [新着論文レビュー]
- de Lau, W., Barker, N., Low, T. Y. et al.: Lgr5 homologues associate with Wnt receptors and mediate R-spondin signalling. Nature, 476, 293-297 (2011)[PubMed]
- Yui, S., Nakamura, T., Sato, T. et al.: Functional engraftment of colon epithelium expanded in vitro from a single adult Lgr5+ stem cell. Nat. Med., 18, 618-623 (2012)[PubMed]
著者プロフィール
略歴:2011年 東京医科歯科大学大学院医歯学総合研究科,2013年よりデンマークCopenhagen大学 研究員.
中村 哲也(Tetsuya Nakamura)
東京医科歯科大学大学院医歯学総合研究科 准教授.
渡辺 守(Mamoru Watanabe)
東京医科歯科大学大学院医歯学総合研究科 教授.
研究室URL:http://www.tmd.ac.jp/grad/gast/
© 2013 油井史郎・中村哲也・渡辺 守 Licensed under CC 表示 2.1 日本