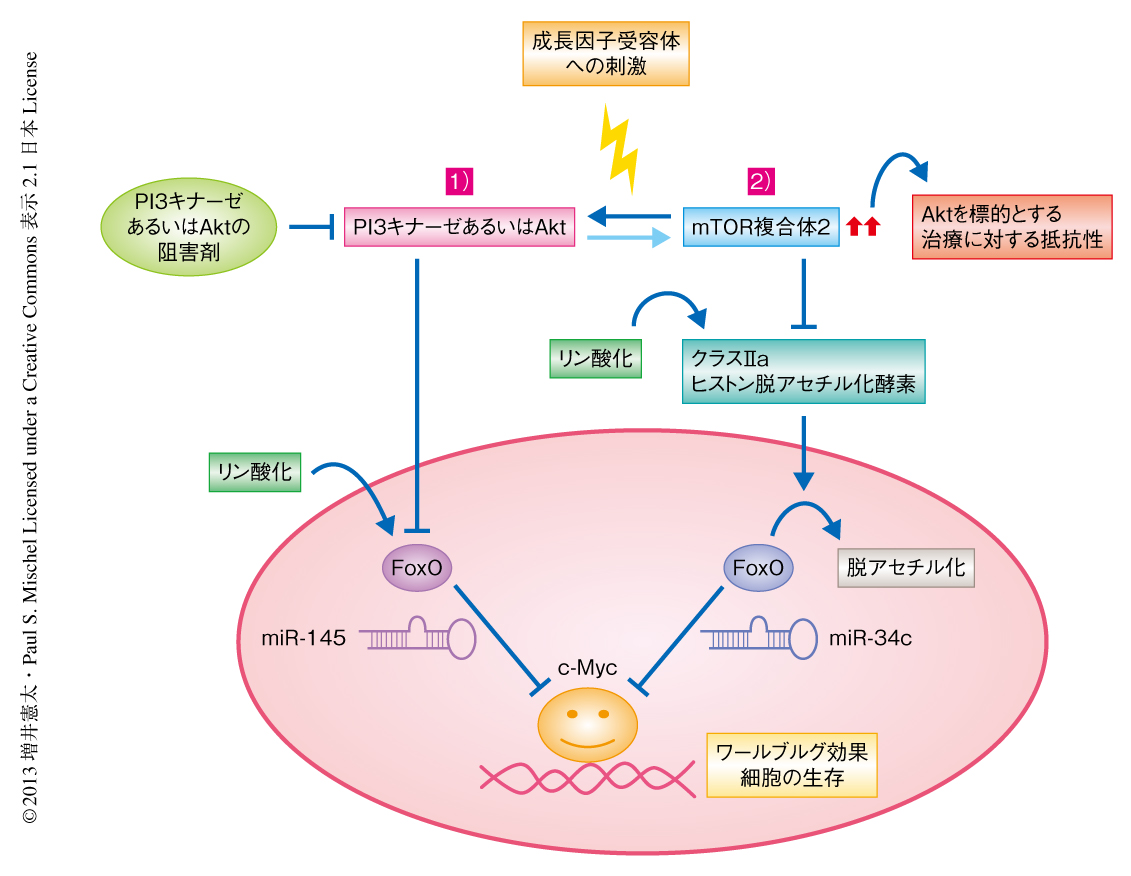
mTOR複合体2によるc-Mycの発現およびワールブルグ効果の促進は膠芽腫においてAktを標的とした治療法に対する抵抗性の機序のひとつである
増井憲太・Paul S. Mischel
(米国California大学San Diego校Ludwig Institute for Cancer Research)
email:増井憲太
DOI: 10.7875/first.author.2013.137
mTOR complex 2 controls glycolytic metabolism in glioblastoma through FoxO acetylation and upregulation of c-Myc.
Kenta Masui, Kazuhiro Tanaka, David Akhavan, Ivan Babic, Beatrice Gini, Tomoo Matsutani, Akio Iwanami, Feng Liu, Genaro R. Villa, Yuchao Gu, Carl Campos, Shaojun Zhu, Huijun Yang, William H. Yong, Timothy F. Cloughesy, Ingo K. Mellinghoff, Webster K. Cavenee, Reuben J. Shaw, Paul S. Mischel
Cell Metabolism, 18, 726-739 (2013)
好気的な条件にもかかわらず解糖系が活性化されるワールブルグ効果はがん細胞における顕著な特徴のひとつだが,その分子的な機序についてはいまだ不明な点が多い.今回,筆者らは,mTOR複合体2が転写因子c-Mycの細胞における発現レベルを制御することにより,悪性脳腫瘍である膠芽腫においてがん細胞の代謝を制御していることを明らかにした.mTOR複合体2はc-Mycを負に制御する転写因子FoxOをアセチル化を介して不活性化し,これによりc-Mycの発現を上昇させることがわかった.さらに,mTOR複合体2,アセチル化FoxO,および,c-Mycの発現は臨床の脳腫瘍の検体において強く相関しており,また,膠芽腫の患者における予後不良因子ともなっていた.これらの結果から,mTOR複合体2のがん細胞の代謝の制御における,Aktとは独立したシグナル伝達経路による新規の役割を提唱した.また,この分子機構は膠芽腫においてPI3キナーゼあるいはAktを標的とした治療法に対する抵抗性の機序のひとつであることも示唆された.
代謝系のリプログラミングはがん細胞における大きな特徴のひとつである1).がん細胞ではグルコースの大部分は乳酸へと変換され,生体高分子の生合成に必要な炭素を含む前駆体として供給されている2).これは正常な細胞における内呼吸経路とは異なり,酸素が十分に存在しても解糖系が優先される“ワールブルグ効果”として知られ3),急速に増殖するがん細胞の同化およびエネルギー需要をみたす役割をはたしている.このワールブルグ効果の分子的な機序を明らかにすることができれば,がんの病態の解明,ひいては,新規の治療標的の同定やがんの治療に対する抵抗性の機序が明らかになるかもしれない.
正常および異常な細胞において,成長因子受容体を含む細胞の内外からのシグナルはmTORにより統合され,細胞の増殖および代謝のシグナルとして伝達される4)(図1).mTORは2種類のタンパク質複合体として存在し,そのうちmTOR複合体1はがん細胞における代謝の制御に関して主要な役割をはたしていることがこれまで数多く報告されている5).一方,Aktの上流においてはたらくmTOR複合体2のがん細胞における役割も徐々に解明されつつあるが6),がん細胞における代謝の制御でのその重要性はいまだ明らかにされていない.
そこで,筆者らは,mTOR複合体2のがん細胞における代謝でのはたらきを,ワールブルグ効果に対する重要な制御タンパク質であるc-Myc 7) との関係に注目して解析した.解析の対象としては,ヒトの腫瘍のなかでもっとも悪性度が高く,さらに,その多くでAktあるいはmTORを介したシグナル伝達経路の亢進している脳腫瘍である膠芽腫を用いた.
mTOR複合体2のがん細胞における代謝での役割を解析するため,EGF受容体の活性型変異体の強制発現によりmTOR複合体2が高く活性化された膠芽腫細胞を利用した6).mTOR複合体2の主要な構成タンパク質のひとつであるRictorの抑制系および過剰発現系においてこの膠芽腫細胞の代謝の変化および増殖能を解析した結果,mTOR複合体2はグルコースの存在のもと解糖系を亢進させ細胞の増殖を促進させるが,それと同時に,細胞の生存を解糖系に強く依存させることがわかった.c-Mycの抑制実験においても膠芽腫細胞は同様の表現型を示したことから,mTOR複合体2の解糖系に対する効果はc-Mycを介しているのではないかとの仮説をたてた.実験の結果,Rictorとc-Mycとのタンパク質レベルでの発現は強い正の相関を示し,さらに重要なことに,細胞からc-Mycを欠損させるとmTOR複合体2の解糖系に対する効果は消失した.このことは,mTOR複合体2がc-Mycを介してがん細胞における解糖系(ワールブルグ効果)を制御しているという仮説に合致した.また,これまで,mTOR複合体2の代謝に対する影響は下流に存在するAktを介したものであると考えられてきたが5,8)(図1),この実験系においてAktのc-Mycへの効果は軽度であり,Aktとは独立したmTOR複合体2の代謝における重要な役割が推測された.
転写因子FoxOはc-Mycを負に制御し,これまで,AktがFoxOをリン酸化により不活性化することでc-Mycおよび解糖系を促進することがよく知られている5,8).そこで,Aktとは独立したmTOR複合体2のc-Mycおよび代謝への影響には,FoxOに対するリン酸化とは別の翻訳後修飾がかかわっているのではないかと考えた.膠芽腫細胞を用いた解析の結果,mTOR複合体2はFoxOに対するもうひとつの抑制性の翻訳後修飾であるアセチル化を促進することがわかった.また,アセチル化に対し抵抗性をもつFoxO変異体,あるいは,恒常的なアセチル化を模倣したFoxO変異体を発現させることにより,アセチル化FoxOのc-Mycおよび解糖系に対する効果を調べたところ,リン酸化と同様に,FoxOのアセチル化もc-Mycの発現および解糖系の制御と強く関連しており,FoxOのアセチル化は膠芽腫細胞における代謝の制御において機能的に重要な翻訳後修飾であることが示された.さらには,mTOR複合体2のc-Mycおよび解糖系に対する効果はアセチル化抵抗性FoxO変異体の過剰発現により相殺された.
FoxOのアセチル化にはヒストンアセチル化酵素およびヒストン脱アセチル化酵素のバランスが重要であることが報告されている9).それらの酵素のなかで,mTOR複合体2がAktに非依存的にクラスIIaヒストン脱アセチル化酵素をリン酸化により不活性化することでFoxOのアセチル化を促進することが見い出された.このことは,クラスIIaヒストン脱アセチル化酵素がFoxOの脱アセチル化に関与しているという過去の報告と合致した9).興味深いことに,膠芽腫細胞において明らかになったこのmTOR複合体2-ヒストン脱アセチル化酵素-FoxO-c-Mycというカスケードは,肺がんの細胞系列においても確認された.したがって,このmTOR複合体2による代謝の制御は,脳腫瘍のみにとどまらず,さまざまな種類のがんに広く関与しているのかもしれない.
FoxOはmiR-145およびmiR-34cといったマイクロRNAを介してc-Mycの発現を抑制していることが知られている10,11).FoxOのリン酸化およびアセチル化といった翻訳後修飾は,これらのマイクロRNAにどのような影響をあたえるのか,リン酸化抵抗性FoxO変異体およびアセチル化抵抗性FoxO変異体を用いて解析した.その結果,リン酸化抵抗性FoxO変異体はmiR-145の制御,アセチル化抵抗性FoxO変異体はmiR-34cの発現の制御にそれぞれ強く関連していた.また,miR-145と比較して,miR-34cの発現はmTOR複合体2の活性化の状態と強く相関していた.これらの結果は,c-Mycの制御に関して,Akt-リン酸化FoxO-miR145,および,mTOR複合体2-アセチル化FoxO-miR34cを介する,2つの独立したシグナル伝達経路が存在することを示唆した.
c-Mycの制御に関して,Akt-リン酸化FoxO,および,mTOR複合体2-アセチル化FoxOを介する,2つの独立したシグナル伝達経路の存在が示された結果,これまで,臨床への応用が検討されてきたPI3キナーゼあるいはAktを標的とした治療法はmTOR複合体2-アセチル化FoxO-c-Mycシグナル伝達経路により迂回されるため,c-Mycを介する解糖系の抑制やがん細胞への細胞死の誘導に対し不十分であることが予測された.事実,Akt阻害剤の単独による膠芽腫細胞の治療では,逆に,mTOR複合体2-アセチル化FoxO-c-Mycシグナル伝達経路が活性化されることによりアセチル化FoxOが増加し,c-Mycおよび解糖系も亢進して効果的に細胞死を誘導できないことが確認された.
しかし,このことはAktおよびmTOR複合体2の両者を標的とする新たな複合的な治療法の可能性を提供した.つまり,PI3キナーゼあるいはAktおよびmTOR複合体2の両者を抑制することにより,膠芽腫細胞の細胞死を促進することに成功したのである.さらに,ヒトの患者に由来する膠芽腫細胞を移植したマウス腫瘍モデルをPI3キナーゼおよびmTORの両方の阻害剤であるXL765により治療したところ,対照と比較して,アセチル化FoxO,c-Myc,解糖系の酵素,がん細胞の増殖が有意に抑制された.これらのことから,この複合的な治療法が膠芽腫の治療における有望な選択肢のひとつとなりうることが期待された.
臨床の脳腫瘍の検体において実際に,mTOR複合体2-アセチル化FoxO-Mycシグナル伝達経路が関与しているのかどうかを調べるため,26の正常な脳の組織および80の膠芽腫の組織からなる組織マイクロアレイ法による解析,および,8件の膠芽腫の剖検の症例を利用した免疫組織化学的な解析を行った.その結果,アセチル化FoxOおよびc-Mycは膠芽腫の組織において有意に高く発現しており,mTOR複合体2の活性化の状態と強く相関していた.さらに,アセチル化FoxOおよびc-Mycを高く発現した膠芽腫のグループは,低く発現したグループと比較して予後が不良であることがわかった.これらの臨床検体における結果は,これまでの基礎実験の結果を実際の臨床の現場に応用することが可能であることを強く示唆した.
基礎医学的な実験から臨床の検体までを用いたこの横断的な研究は,がん細胞の代謝において,Aktに非依存的にc-Mycを制御するmTOR複合体2の新たな役割を明らかにした(図2).この研究結果は,膠芽腫の治療戦略において少なくとも2つの点について重要であった.ひとつは,c-Mycが膠芽腫におけるがん細胞の代謝を含めた病態に強く関与していたことである.以前に,筆者らのグループは,EGF受容体-mTORシグナル伝達経路の亢進した膠芽腫ではc-Mycを機能的に制御することによりがん細胞の代謝が制御されていることを報告した12).一方,この研究は,mTOR複合体2がc-Mycのタンパク質レベルでの発現を制御することにより膠芽腫においてがん細胞の代謝を制御することを明らかにした.つまり,EGF受容体-mTORシグナル伝達経路が亢進した膠芽腫ではc-Mycが多段階で制御されていることが推測された.これは膠芽腫のc-Mycへの依存度の高さを示すものでもあり,c-Mycの抑制がその治療戦略のひとつとなりうることを示した.もうひとつの点は,mTOR複合体2によるFoxOのアセチル化が,PI3キナーゼあるいはAktを標的とする治療法に対する抵抗性の機序となりうることである.これまで,mTOR複合体2の機能の多くはAktを介するものと考えられてきたが5,8),近年,この研究を含め,がんにおけるAktとは独立したmTOR複合体2の役割が明らかにされつつある6).現在,筆者らは,mTOR複合体2-アセチル化FoxO-c-Mycシグナル伝達経路を標的とした治療薬の開発にも取り組んでおり,がん細胞における代謝を含めたがんの制御に関して,mTOR複合体2およびPI3キナーゼあるいはAktを標的とした複合的な治療法は,今後,有望な治療戦略として期待される.
略歴:2010年 九州大学大学院医学研究院にて博士号取得,2011年より米国California大学San Diego校 ポスドク.
研究テーマ:悪性脳腫瘍の病態.
抱負:患者さんに還元できるようなトランスレーショナル研究を行っていきたい.
関心事:嫁,娘,HKT48.
Paul S. Mischel
米国California大学San Diego校Professor.
研究室URL:http://www.ludwigcancerresearch.org/location/san-diego-branch/paul-s-mischel-lab
© 2013 増井憲太・Paul S. Mischel Licensed under CC 表示 2.1 日本
(米国California大学San Diego校Ludwig Institute for Cancer Research)
email:増井憲太
DOI: 10.7875/first.author.2013.137
mTOR complex 2 controls glycolytic metabolism in glioblastoma through FoxO acetylation and upregulation of c-Myc.
Kenta Masui, Kazuhiro Tanaka, David Akhavan, Ivan Babic, Beatrice Gini, Tomoo Matsutani, Akio Iwanami, Feng Liu, Genaro R. Villa, Yuchao Gu, Carl Campos, Shaojun Zhu, Huijun Yang, William H. Yong, Timothy F. Cloughesy, Ingo K. Mellinghoff, Webster K. Cavenee, Reuben J. Shaw, Paul S. Mischel
Cell Metabolism, 18, 726-739 (2013)
要 約
好気的な条件にもかかわらず解糖系が活性化されるワールブルグ効果はがん細胞における顕著な特徴のひとつだが,その分子的な機序についてはいまだ不明な点が多い.今回,筆者らは,mTOR複合体2が転写因子c-Mycの細胞における発現レベルを制御することにより,悪性脳腫瘍である膠芽腫においてがん細胞の代謝を制御していることを明らかにした.mTOR複合体2はc-Mycを負に制御する転写因子FoxOをアセチル化を介して不活性化し,これによりc-Mycの発現を上昇させることがわかった.さらに,mTOR複合体2,アセチル化FoxO,および,c-Mycの発現は臨床の脳腫瘍の検体において強く相関しており,また,膠芽腫の患者における予後不良因子ともなっていた.これらの結果から,mTOR複合体2のがん細胞の代謝の制御における,Aktとは独立したシグナル伝達経路による新規の役割を提唱した.また,この分子機構は膠芽腫においてPI3キナーゼあるいはAktを標的とした治療法に対する抵抗性の機序のひとつであることも示唆された.
はじめに
代謝系のリプログラミングはがん細胞における大きな特徴のひとつである1).がん細胞ではグルコースの大部分は乳酸へと変換され,生体高分子の生合成に必要な炭素を含む前駆体として供給されている2).これは正常な細胞における内呼吸経路とは異なり,酸素が十分に存在しても解糖系が優先される“ワールブルグ効果”として知られ3),急速に増殖するがん細胞の同化およびエネルギー需要をみたす役割をはたしている.このワールブルグ効果の分子的な機序を明らかにすることができれば,がんの病態の解明,ひいては,新規の治療標的の同定やがんの治療に対する抵抗性の機序が明らかになるかもしれない.
正常および異常な細胞において,成長因子受容体を含む細胞の内外からのシグナルはmTORにより統合され,細胞の増殖および代謝のシグナルとして伝達される4)(図1).mTORは2種類のタンパク質複合体として存在し,そのうちmTOR複合体1はがん細胞における代謝の制御に関して主要な役割をはたしていることがこれまで数多く報告されている5).一方,Aktの上流においてはたらくmTOR複合体2のがん細胞における役割も徐々に解明されつつあるが6),がん細胞における代謝の制御でのその重要性はいまだ明らかにされていない.
そこで,筆者らは,mTOR複合体2のがん細胞における代謝でのはたらきを,ワールブルグ効果に対する重要な制御タンパク質であるc-Myc 7) との関係に注目して解析した.解析の対象としては,ヒトの腫瘍のなかでもっとも悪性度が高く,さらに,その多くでAktあるいはmTORを介したシグナル伝達経路の亢進している脳腫瘍である膠芽腫を用いた.
1.mTOR複合体2はc-Mycを介してワールブルグ効果を促進する
mTOR複合体2のがん細胞における代謝での役割を解析するため,EGF受容体の活性型変異体の強制発現によりmTOR複合体2が高く活性化された膠芽腫細胞を利用した6).mTOR複合体2の主要な構成タンパク質のひとつであるRictorの抑制系および過剰発現系においてこの膠芽腫細胞の代謝の変化および増殖能を解析した結果,mTOR複合体2はグルコースの存在のもと解糖系を亢進させ細胞の増殖を促進させるが,それと同時に,細胞の生存を解糖系に強く依存させることがわかった.c-Mycの抑制実験においても膠芽腫細胞は同様の表現型を示したことから,mTOR複合体2の解糖系に対する効果はc-Mycを介しているのではないかとの仮説をたてた.実験の結果,Rictorとc-Mycとのタンパク質レベルでの発現は強い正の相関を示し,さらに重要なことに,細胞からc-Mycを欠損させるとmTOR複合体2の解糖系に対する効果は消失した.このことは,mTOR複合体2がc-Mycを介してがん細胞における解糖系(ワールブルグ効果)を制御しているという仮説に合致した.また,これまで,mTOR複合体2の代謝に対する影響は下流に存在するAktを介したものであると考えられてきたが5,8)(図1),この実験系においてAktのc-Mycへの効果は軽度であり,Aktとは独立したmTOR複合体2の代謝における重要な役割が推測された.
2.mTOR複合体2によるc-Mycおよび解糖系の制御はFoxOのアセチル化を介する
転写因子FoxOはc-Mycを負に制御し,これまで,AktがFoxOをリン酸化により不活性化することでc-Mycおよび解糖系を促進することがよく知られている5,8).そこで,Aktとは独立したmTOR複合体2のc-Mycおよび代謝への影響には,FoxOに対するリン酸化とは別の翻訳後修飾がかかわっているのではないかと考えた.膠芽腫細胞を用いた解析の結果,mTOR複合体2はFoxOに対するもうひとつの抑制性の翻訳後修飾であるアセチル化を促進することがわかった.また,アセチル化に対し抵抗性をもつFoxO変異体,あるいは,恒常的なアセチル化を模倣したFoxO変異体を発現させることにより,アセチル化FoxOのc-Mycおよび解糖系に対する効果を調べたところ,リン酸化と同様に,FoxOのアセチル化もc-Mycの発現および解糖系の制御と強く関連しており,FoxOのアセチル化は膠芽腫細胞における代謝の制御において機能的に重要な翻訳後修飾であることが示された.さらには,mTOR複合体2のc-Mycおよび解糖系に対する効果はアセチル化抵抗性FoxO変異体の過剰発現により相殺された.
FoxOのアセチル化にはヒストンアセチル化酵素およびヒストン脱アセチル化酵素のバランスが重要であることが報告されている9).それらの酵素のなかで,mTOR複合体2がAktに非依存的にクラスIIaヒストン脱アセチル化酵素をリン酸化により不活性化することでFoxOのアセチル化を促進することが見い出された.このことは,クラスIIaヒストン脱アセチル化酵素がFoxOの脱アセチル化に関与しているという過去の報告と合致した9).興味深いことに,膠芽腫細胞において明らかになったこのmTOR複合体2-ヒストン脱アセチル化酵素-FoxO-c-Mycというカスケードは,肺がんの細胞系列においても確認された.したがって,このmTOR複合体2による代謝の制御は,脳腫瘍のみにとどまらず,さまざまな種類のがんに広く関与しているのかもしれない.
3.アセチル化FoxOによるc-Mycの制御はマイクロRNAを介する
FoxOはmiR-145およびmiR-34cといったマイクロRNAを介してc-Mycの発現を抑制していることが知られている10,11).FoxOのリン酸化およびアセチル化といった翻訳後修飾は,これらのマイクロRNAにどのような影響をあたえるのか,リン酸化抵抗性FoxO変異体およびアセチル化抵抗性FoxO変異体を用いて解析した.その結果,リン酸化抵抗性FoxO変異体はmiR-145の制御,アセチル化抵抗性FoxO変異体はmiR-34cの発現の制御にそれぞれ強く関連していた.また,miR-145と比較して,miR-34cの発現はmTOR複合体2の活性化の状態と強く相関していた.これらの結果は,c-Mycの制御に関して,Akt-リン酸化FoxO-miR145,および,mTOR複合体2-アセチル化FoxO-miR34cを介する,2つの独立したシグナル伝達経路が存在することを示唆した.
4.mTOR複合体2-アセチル化FoxO-c-Mycシグナル伝達経路はAktを標的とした治療法に対する抵抗性と関連する
c-Mycの制御に関して,Akt-リン酸化FoxO,および,mTOR複合体2-アセチル化FoxOを介する,2つの独立したシグナル伝達経路の存在が示された結果,これまで,臨床への応用が検討されてきたPI3キナーゼあるいはAktを標的とした治療法はmTOR複合体2-アセチル化FoxO-c-Mycシグナル伝達経路により迂回されるため,c-Mycを介する解糖系の抑制やがん細胞への細胞死の誘導に対し不十分であることが予測された.事実,Akt阻害剤の単独による膠芽腫細胞の治療では,逆に,mTOR複合体2-アセチル化FoxO-c-Mycシグナル伝達経路が活性化されることによりアセチル化FoxOが増加し,c-Mycおよび解糖系も亢進して効果的に細胞死を誘導できないことが確認された.
しかし,このことはAktおよびmTOR複合体2の両者を標的とする新たな複合的な治療法の可能性を提供した.つまり,PI3キナーゼあるいはAktおよびmTOR複合体2の両者を抑制することにより,膠芽腫細胞の細胞死を促進することに成功したのである.さらに,ヒトの患者に由来する膠芽腫細胞を移植したマウス腫瘍モデルをPI3キナーゼおよびmTORの両方の阻害剤であるXL765により治療したところ,対照と比較して,アセチル化FoxO,c-Myc,解糖系の酵素,がん細胞の増殖が有意に抑制された.これらのことから,この複合的な治療法が膠芽腫の治療における有望な選択肢のひとつとなりうることが期待された.
5.mTOR複合体2,アセチル化FoxO,c-Mycは膠芽腫の患者における予後不良因子である
臨床の脳腫瘍の検体において実際に,mTOR複合体2-アセチル化FoxO-Mycシグナル伝達経路が関与しているのかどうかを調べるため,26の正常な脳の組織および80の膠芽腫の組織からなる組織マイクロアレイ法による解析,および,8件の膠芽腫の剖検の症例を利用した免疫組織化学的な解析を行った.その結果,アセチル化FoxOおよびc-Mycは膠芽腫の組織において有意に高く発現しており,mTOR複合体2の活性化の状態と強く相関していた.さらに,アセチル化FoxOおよびc-Mycを高く発現した膠芽腫のグループは,低く発現したグループと比較して予後が不良であることがわかった.これらの臨床検体における結果は,これまでの基礎実験の結果を実際の臨床の現場に応用することが可能であることを強く示唆した.
おわりに
基礎医学的な実験から臨床の検体までを用いたこの横断的な研究は,がん細胞の代謝において,Aktに非依存的にc-Mycを制御するmTOR複合体2の新たな役割を明らかにした(図2).この研究結果は,膠芽腫の治療戦略において少なくとも2つの点について重要であった.ひとつは,c-Mycが膠芽腫におけるがん細胞の代謝を含めた病態に強く関与していたことである.以前に,筆者らのグループは,EGF受容体-mTORシグナル伝達経路の亢進した膠芽腫ではc-Mycを機能的に制御することによりがん細胞の代謝が制御されていることを報告した12).一方,この研究は,mTOR複合体2がc-Mycのタンパク質レベルでの発現を制御することにより膠芽腫においてがん細胞の代謝を制御することを明らかにした.つまり,EGF受容体-mTORシグナル伝達経路が亢進した膠芽腫ではc-Mycが多段階で制御されていることが推測された.これは膠芽腫のc-Mycへの依存度の高さを示すものでもあり,c-Mycの抑制がその治療戦略のひとつとなりうることを示した.もうひとつの点は,mTOR複合体2によるFoxOのアセチル化が,PI3キナーゼあるいはAktを標的とする治療法に対する抵抗性の機序となりうることである.これまで,mTOR複合体2の機能の多くはAktを介するものと考えられてきたが5,8),近年,この研究を含め,がんにおけるAktとは独立したmTOR複合体2の役割が明らかにされつつある6).現在,筆者らは,mTOR複合体2-アセチル化FoxO-c-Mycシグナル伝達経路を標的とした治療薬の開発にも取り組んでおり,がん細胞における代謝を含めたがんの制御に関して,mTOR複合体2およびPI3キナーゼあるいはAktを標的とした複合的な治療法は,今後,有望な治療戦略として期待される.
文 献
- Ward, P. S. & Thompson, C. B.: Metabolic reprogramming: a cancer hallmark even warburg did not anticipate. Cancer Cell, 21, 297-308 (2012)[PubMed]
- Vander Heiden, M. G., Cantley, L. C. & Thompson C. B.: Understanding the Warburg effect: the metabolic requirements of cell proliferation. Science, 324, 1029-1033 (2009)[PubMed]
- Warburg, O.: On the origin of cancer cells. Science, 123, 309-314 (1956)[PubMed]
- Masui, K., Cloughesy, T. F. & Mischel, P. S.: Review: molecular pathology in adult high-grade gliomas: from molecular diagnostics to target therapies. Neuropathol. Appl. Neurobiol., 38, 271-291 (2012)[PubMed]
- Laplante, M. & Sabatini, D. M.: mTOR signaling in growth control and disease. Cell, 149, 274-293 (2012)[PubMed]
- Tanaka, K., Babic, I., Nathanson, D. et al.: Oncogenic EGFR signaling activates an mTORC2-NF-κB pathway that promotes chemotherapy resistance. Cancer Discov., 1, 524-538 (2011)[PubMed]
- Dang, C. V., Le, A. & Gao, P.: MYC-induced cancer cell energy metabolism and therapeutic opportunities. Clin. Cancer Res., 15, 6479-6483 (2009)[PubMed]
- Dang, C. V.: Links between metabolism and cancer. Genes Dev., 26, 877-890 (2012)[PubMed]
- Mihaylova, M. M., Vasquez, D. S., Ravnskjaer, K. et al.: Class IIa histone deacetylases are hormone-activated regulators of FOXO and mammalian glucose homeostasis. Cell, 145, 607-621 (2011)[PubMed]
- Gan, B., Lim, C., Chu, G. et al.: FoxOs enforce a progression checkpoint to constrain mTORC1-activated renal tumorigenesis. Cancer Cell, 18, 472-484 (2010)[PubMed]
- Kress, T. R., Cannell, I. G., Brenkman, A. B. et al.: The MK5/PRAK kinase and Myc form a negative feedback loop that is disrupted during colorectal tumorigenesis. Mol. Cell, 41, 445-457 (2011)[PubMed]
- Babic, I., Anderson, E. S., Tanaka, K. et al.: EGFR mutation-induced alternative splicing of Max contributes to growth of glycolytic tumors in brain cancer. Cell Metab., 17, 1000-1008 (2013)[PubMed]
著者プロフィール
略歴:2010年 九州大学大学院医学研究院にて博士号取得,2011年より米国California大学San Diego校 ポスドク.
研究テーマ:悪性脳腫瘍の病態.
抱負:患者さんに還元できるようなトランスレーショナル研究を行っていきたい.
関心事:嫁,娘,HKT48.
Paul S. Mischel
米国California大学San Diego校Professor.
研究室URL:http://www.ludwigcancerresearch.org/location/san-diego-branch/paul-s-mischel-lab
© 2013 増井憲太・Paul S. Mischel Licensed under CC 表示 2.1 日本