非侵襲的な細胞内温度センサーによる生体における熱産生機構の可視化
清中茂樹・森 泰生
(京都大学大学院工学研究科 合成・生物化学専攻分子生物化学分野)
email:森 泰生
DOI: 10.7875/first.author.2013.135
Genetically encoded fluorescent thermosensors visualize subcellular thermoregulation in living cells.
Shigeki Kiyonaka, Taketoshi Kajimoto, Reiko Sakaguchi, Daisuke Shinmi, Mariko Omatsu-Kanbe, Hiroshi Matsuura, Hiromi Imamura, Takenao Yoshizaki, Itaru Hamachi, Takashi Morii, Yasuo Mori
Nature Methods, 10, 1232-1238 (2013)
恒温動物の体内は外気温の変化によらず37℃付近に保たれている.しかし,オルガネラからの熱の産生を直接的に評価する方法が存在しなかったため,細胞内の局所において温度がどのように制御され,生体において内温性が達成されているのかについてはほとんど明らかになっていない.筆者らは,そのような背景のもと,細胞内の局所における温度の分布を可視化できる温度センサータンパク質“tsGFP”を開発した.遺伝子工学的な手法により得られたtsGFPは,生体において37℃付近の温度の変化に対し鋭敏な蛍光の変化を示した.また,tsGFPにオルガネラへの移行シグナル配列を付加することにより,おのおののオルガネラにおける温度分布を可視化することが可能になり,褐色脂肪細胞におけるミトコンドリアからの熱産生,および,骨格筋細胞における小胞体からの熱産生の可視化に成功した.tsGFPは,生体および細胞内の温度変化を非破壊的かつ非侵襲的に評価することのできる新たなツールになると期待される.
恒温動物の体内は外気温の変化によらずつねに37℃付近に保たれている.従来の生物学の研究は,熱産生組織から産生される熱により恒温動物の体温は37℃付近に保たれ,細胞内の温度も同様に37℃付近で“均一”であるという前提のもと進められてきた.しかし,核やミトコンドリアをはじめとするオルガネラに目をむけると,それらは複雑な化学反応をともなう固有の機能を担っており,すべてのオルガネラの温度が均一であることはありえない.かりに,細胞内の温度に不均一性が存在するなら,それにより生体あるいは細胞内の局所の機能が制御されている可能性がある.そのような生命現象を解き明かすためには,細胞内の局所における温度の分布を可視化することのできる温度センサーが不可欠である.
細胞内の温度変化を可視化する方法として,蛍光性の温度センサーが注目されている.最近,アクリルアミドを骨格とした合成高分子の凝集特性を利用した温度センサーや1),ナノダイヤモンドの温度に依存した蛍光の変化を利用した温度センサー2) が報告された.しかし,これらの温度センサーは合成高分子からなるため,細胞に導入するためには細胞膜に“穴”をあけるなど侵襲的な処置が必要であり,細胞の構築に対し破壊的に作用する.また,このような合成高分子を特定のオルガネラに局在させることはきわめて困難である.くわえて,細胞内の局所において発生した熱はすぐに拡散してしまうため,細胞内の熱産生および温度分布を計測するためには,熱が産生されているまさにその場所(オルガネラ)において温度を計測する必要があった.
筆者らは,遺伝子工学的な手法を用いて,細胞内およびオルガネラにおける温度の計測を可能とする温度センサータンパク質tsGFP(thermosensor GFP)を開発した.tsGFPは,サルモネラ菌のもつ温度感知タンパク質TlpAのコイルドコイル領域と,緑色蛍光タンパク質(GFP)とを適切に融合させたものである(図1).TlpAはコイルドコイルの形成(二量体化)およびその解離(単量体化)を37℃付近において可逆的に起こす3).したがって,TlpAから得られたtsGFPは,37℃付近の温度の変化を鋭敏に感知して蛍光の変化を起こすと考えられた(図1).実際に,大腸菌による組換え発現系により得た精製tsGFPは,37℃付近において可逆的な蛍光変化を起こした.また,tsGFPの構造の変化は,コイルドコイルの形成およびその解離に由来することも確認した.
細胞内におけるtsGFPの機能評価は,tsGFPをHeLa細胞に発現させることにより行った.tsGFPは遺伝子にコードされていることから,tsGFP遺伝子をもつプラスミドを細胞にトランスフェクションすることにより,tsGFPを生細胞に非侵襲的に導入することができた.また,tsGFP遺伝子にオルガネラへの移行シグナル配列を付与することにより,おのおののオルガネラにtsGFPを局在させることができ,オルガネラにおける温度変化の観察が可能になった.興味深いことに,細胞外の溶液の温度を変えたとき,おのおののオルガネラにおいて発現させたtsGFPの感知した温度は異なっていた.この結果は,オルガネラにおいて温度分布の存在することを示唆した.
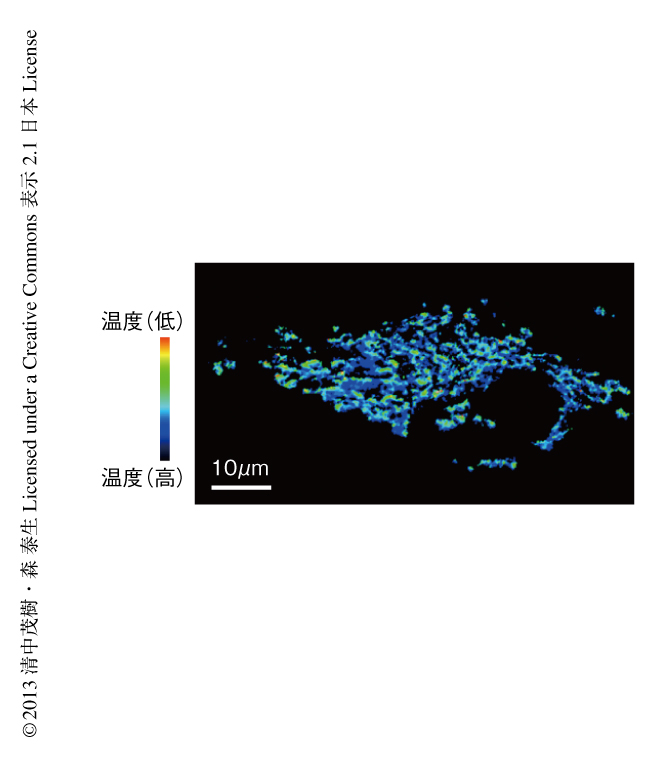
ミトコンドリアに選択的に局在することのできる温度センサータンパク質tsGFP1-mitoをHeLa細胞に発現させて蛍光を評価した結果,ミトコンドリアに温度分布の存在することが確認された(図2).興味深いことに,ミトコンドリアにおける温度分布はミトコンドリアの膜電位やATPの濃度と相関があり,ATPの合成と関連していることが示唆された.この成果は,細胞内における温度の不均一性が機能と関連することを示した世界初の発見といえた.
褐色脂肪細胞は熱産生細胞であると考えられている.従来は,細胞内における温度の計測法が知られていなかったため,酸素の消費など間接的な証拠から褐色脂肪細胞が熱産生にかかわるものと推定されてきた4).そこで,ミトコンドリアに局在する温度センサータンパク質tsGFP1-mitoを褐色脂肪細胞に発現させ,熱産生の直接的に評価した.褐色脂肪細胞からの熱産生については,UCP1によるミトコンドリア膜電位の解消により熱産生が起こると考えられている.そこで,tsGFP1-mitoを発現させた褐色脂肪細胞にUCP1に対する生理的な活性化剤として知られるノルアドレナリンを投与したところ,褐色脂肪細胞からの熱産生が可視化された.この結果は,褐色脂肪細胞のミトコンドリアから熱産生が行われていることを直接的に示したはじめての結果といえた.
非ふるえ熱産生に関しては,褐色脂肪細胞にくわえ,骨格筋の関与も提案されている5,6).その分子機構としては,小胞体に発現するCa2+-ATPaseによる,Ca2+ポンプ活性とは共役しないATPの加水分解が提唱されてきた5).しかし,この熱産生経路に関しては,筋小胞体から精製した膜画分を用いたin vitroにおける実験からしか評価されておらず,骨格筋細胞から熱産生が行われているかどうかは論争の的になっていた7).そこで,小胞体に局在する温度センサータンパク質tsGFP1-ERを発現させたC2C12細胞を筋細胞へと分化させ,熱産生を直接的に評価した.分化させた筋細胞に対しCa2+-ATPase阻害剤を投与したところ小胞体の温度は低下し,そののちCa2+-ATPase阻害剤を除いたところ小胞体の温度は阻害剤の投与のまえと同様の値を示した.一方,筋細胞に分化させるまえのC2C12細胞にtsGFP1-ERを発現させCa2+-ATPase阻害剤を投与したときには,このような温度変化は観測されなかった.すなわち,筋細胞の小胞体において,Ca2+-ATPaseを介した自発的な熱産生が起こっていることを直接的に示すことができたといえた.
筆者らは,細胞内の局所における温度変化を可視化できる温度センサータンパク質tsGFPの開発に成功し,細胞内における熱産生を可視化しただけでなく,細胞内やオルガネラにおける局所に温度分布の存在することを確認した.この研究において開発したtsGFPは,未開拓な研究領域である温度生物学において有用な研究ツールになると期待される.また,熱産生細胞は,肥満が問題となっている欧米を中心に,肥満の新たな解消法の標的として注目されている.しかしこれまで,熱産生組織からの熱産生を直接的に評価できる方法が皆無であるため,熱産生を促す創薬の開発は困難とされてきた.したがって,tsGFPは肥満解消薬の開発を加速させるための重要な研究ツールにもなると期待される.
略歴:2002年 九州大学大学院工学府博士課程 修了,京都大学大学院地球環境学堂 准教授.
研究テーマ:イオンチャネルのケミカルバイオロジー.
森 泰生(Yasuo Mori)
京都大学大学院地球環境学堂 教授.
研究室URL:http://www.sbchem.kyoto-u.ac.jp/mori-lab/
© 2013 清中茂樹・森 泰生 Licensed under CC 表示 2.1 日本
(京都大学大学院工学研究科 合成・生物化学専攻分子生物化学分野)
email:森 泰生
DOI: 10.7875/first.author.2013.135
Genetically encoded fluorescent thermosensors visualize subcellular thermoregulation in living cells.
Shigeki Kiyonaka, Taketoshi Kajimoto, Reiko Sakaguchi, Daisuke Shinmi, Mariko Omatsu-Kanbe, Hiroshi Matsuura, Hiromi Imamura, Takenao Yoshizaki, Itaru Hamachi, Takashi Morii, Yasuo Mori
Nature Methods, 10, 1232-1238 (2013)
要 約
恒温動物の体内は外気温の変化によらず37℃付近に保たれている.しかし,オルガネラからの熱の産生を直接的に評価する方法が存在しなかったため,細胞内の局所において温度がどのように制御され,生体において内温性が達成されているのかについてはほとんど明らかになっていない.筆者らは,そのような背景のもと,細胞内の局所における温度の分布を可視化できる温度センサータンパク質“tsGFP”を開発した.遺伝子工学的な手法により得られたtsGFPは,生体において37℃付近の温度の変化に対し鋭敏な蛍光の変化を示した.また,tsGFPにオルガネラへの移行シグナル配列を付加することにより,おのおののオルガネラにおける温度分布を可視化することが可能になり,褐色脂肪細胞におけるミトコンドリアからの熱産生,および,骨格筋細胞における小胞体からの熱産生の可視化に成功した.tsGFPは,生体および細胞内の温度変化を非破壊的かつ非侵襲的に評価することのできる新たなツールになると期待される.
はじめに
恒温動物の体内は外気温の変化によらずつねに37℃付近に保たれている.従来の生物学の研究は,熱産生組織から産生される熱により恒温動物の体温は37℃付近に保たれ,細胞内の温度も同様に37℃付近で“均一”であるという前提のもと進められてきた.しかし,核やミトコンドリアをはじめとするオルガネラに目をむけると,それらは複雑な化学反応をともなう固有の機能を担っており,すべてのオルガネラの温度が均一であることはありえない.かりに,細胞内の温度に不均一性が存在するなら,それにより生体あるいは細胞内の局所の機能が制御されている可能性がある.そのような生命現象を解き明かすためには,細胞内の局所における温度の分布を可視化することのできる温度センサーが不可欠である.
1.従来の細胞内温度センサー
細胞内の温度変化を可視化する方法として,蛍光性の温度センサーが注目されている.最近,アクリルアミドを骨格とした合成高分子の凝集特性を利用した温度センサーや1),ナノダイヤモンドの温度に依存した蛍光の変化を利用した温度センサー2) が報告された.しかし,これらの温度センサーは合成高分子からなるため,細胞に導入するためには細胞膜に“穴”をあけるなど侵襲的な処置が必要であり,細胞の構築に対し破壊的に作用する.また,このような合成高分子を特定のオルガネラに局在させることはきわめて困難である.くわえて,細胞内の局所において発生した熱はすぐに拡散してしまうため,細胞内の熱産生および温度分布を計測するためには,熱が産生されているまさにその場所(オルガネラ)において温度を計測する必要があった.
2.温度センサータンパク質tsGFPの開発
筆者らは,遺伝子工学的な手法を用いて,細胞内およびオルガネラにおける温度の計測を可能とする温度センサータンパク質tsGFP(thermosensor GFP)を開発した.tsGFPは,サルモネラ菌のもつ温度感知タンパク質TlpAのコイルドコイル領域と,緑色蛍光タンパク質(GFP)とを適切に融合させたものである(図1).TlpAはコイルドコイルの形成(二量体化)およびその解離(単量体化)を37℃付近において可逆的に起こす3).したがって,TlpAから得られたtsGFPは,37℃付近の温度の変化を鋭敏に感知して蛍光の変化を起こすと考えられた(図1).実際に,大腸菌による組換え発現系により得た精製tsGFPは,37℃付近において可逆的な蛍光変化を起こした.また,tsGFPの構造の変化は,コイルドコイルの形成およびその解離に由来することも確認した.
3.細胞内における温度分布の可視化
細胞内におけるtsGFPの機能評価は,tsGFPをHeLa細胞に発現させることにより行った.tsGFPは遺伝子にコードされていることから,tsGFP遺伝子をもつプラスミドを細胞にトランスフェクションすることにより,tsGFPを生細胞に非侵襲的に導入することができた.また,tsGFP遺伝子にオルガネラへの移行シグナル配列を付与することにより,おのおののオルガネラにtsGFPを局在させることができ,オルガネラにおける温度変化の観察が可能になった.興味深いことに,細胞外の溶液の温度を変えたとき,おのおののオルガネラにおいて発現させたtsGFPの感知した温度は異なっていた.この結果は,オルガネラにおいて温度分布の存在することを示唆した.
ミトコンドリアに選択的に局在することのできる温度センサータンパク質tsGFP1-mitoをHeLa細胞に発現させて蛍光を評価した結果,ミトコンドリアに温度分布の存在することが確認された(図2).興味深いことに,ミトコンドリアにおける温度分布はミトコンドリアの膜電位やATPの濃度と相関があり,ATPの合成と関連していることが示唆された.この成果は,細胞内における温度の不均一性が機能と関連することを示した世界初の発見といえた.
4.細胞内のオルガネラからの熱産生の可視化
褐色脂肪細胞は熱産生細胞であると考えられている.従来は,細胞内における温度の計測法が知られていなかったため,酸素の消費など間接的な証拠から褐色脂肪細胞が熱産生にかかわるものと推定されてきた4).そこで,ミトコンドリアに局在する温度センサータンパク質tsGFP1-mitoを褐色脂肪細胞に発現させ,熱産生の直接的に評価した.褐色脂肪細胞からの熱産生については,UCP1によるミトコンドリア膜電位の解消により熱産生が起こると考えられている.そこで,tsGFP1-mitoを発現させた褐色脂肪細胞にUCP1に対する生理的な活性化剤として知られるノルアドレナリンを投与したところ,褐色脂肪細胞からの熱産生が可視化された.この結果は,褐色脂肪細胞のミトコンドリアから熱産生が行われていることを直接的に示したはじめての結果といえた.
非ふるえ熱産生に関しては,褐色脂肪細胞にくわえ,骨格筋の関与も提案されている5,6).その分子機構としては,小胞体に発現するCa2+-ATPaseによる,Ca2+ポンプ活性とは共役しないATPの加水分解が提唱されてきた5).しかし,この熱産生経路に関しては,筋小胞体から精製した膜画分を用いたin vitroにおける実験からしか評価されておらず,骨格筋細胞から熱産生が行われているかどうかは論争の的になっていた7).そこで,小胞体に局在する温度センサータンパク質tsGFP1-ERを発現させたC2C12細胞を筋細胞へと分化させ,熱産生を直接的に評価した.分化させた筋細胞に対しCa2+-ATPase阻害剤を投与したところ小胞体の温度は低下し,そののちCa2+-ATPase阻害剤を除いたところ小胞体の温度は阻害剤の投与のまえと同様の値を示した.一方,筋細胞に分化させるまえのC2C12細胞にtsGFP1-ERを発現させCa2+-ATPase阻害剤を投与したときには,このような温度変化は観測されなかった.すなわち,筋細胞の小胞体において,Ca2+-ATPaseを介した自発的な熱産生が起こっていることを直接的に示すことができたといえた.
おわりに
筆者らは,細胞内の局所における温度変化を可視化できる温度センサータンパク質tsGFPの開発に成功し,細胞内における熱産生を可視化しただけでなく,細胞内やオルガネラにおける局所に温度分布の存在することを確認した.この研究において開発したtsGFPは,未開拓な研究領域である温度生物学において有用な研究ツールになると期待される.また,熱産生細胞は,肥満が問題となっている欧米を中心に,肥満の新たな解消法の標的として注目されている.しかしこれまで,熱産生組織からの熱産生を直接的に評価できる方法が皆無であるため,熱産生を促す創薬の開発は困難とされてきた.したがって,tsGFPは肥満解消薬の開発を加速させるための重要な研究ツールにもなると期待される.
文 献
- Okabe, K., Inada, N., Gota, C. et al.: Intracellular temperature mapping with a fluorescent polymeric thermometer and fluorescence lifetime imaging microscopy. Nat. Commun., 3, 705 (2012)[PubMed]
- Kucsko, G., Maurer, P. C., Yao, N. Y. et al.: Nanometre-scale thermometry in a living cell. Nature, 500, 54-58 (2013)[PubMed]
- Hurme, R., Berndt, K. D., Normark, S. J. et al.: A proteinaceous gene regulatory thermometer in Salmonella. Cell, 90, 55-64 (1997)[PubMed]
- Cannon, B. & Nedergaard, J.: Brown adipose tissue: function and physiological significance. Physiol. Rev., 84, 277-359 (2004)[PubMed]
- de Meis, L., Arruda, A. P. & Carvalho, D. P.: Role of sarco/endoplasmic reticulum Ca2+-ATPase in thermogenesis. Biosci. Rep., 25, 181-190 (2005)[PubMed]
- Bal, N. C., Maurya, S. K., Sopariwala, D. H. et al.: Sarcolipin is a newly identified regulator of muscle-based thermogenesis in mammals. Nat. Med., 18, 1575-1579 (2012)[PubMed]
- Cannon, B. & Nedergaard, J.: Nonshivering thermogenesis and its adequate measurement in metabolic studies. J. Exp. Biol., 214, 242-253 (2011)[PubMed]
著者プロフィール
略歴:2002年 九州大学大学院工学府博士課程 修了,京都大学大学院地球環境学堂 准教授.
研究テーマ:イオンチャネルのケミカルバイオロジー.
森 泰生(Yasuo Mori)
京都大学大学院地球環境学堂 教授.
研究室URL:http://www.sbchem.kyoto-u.ac.jp/mori-lab/
© 2013 清中茂樹・森 泰生 Licensed under CC 表示 2.1 日本