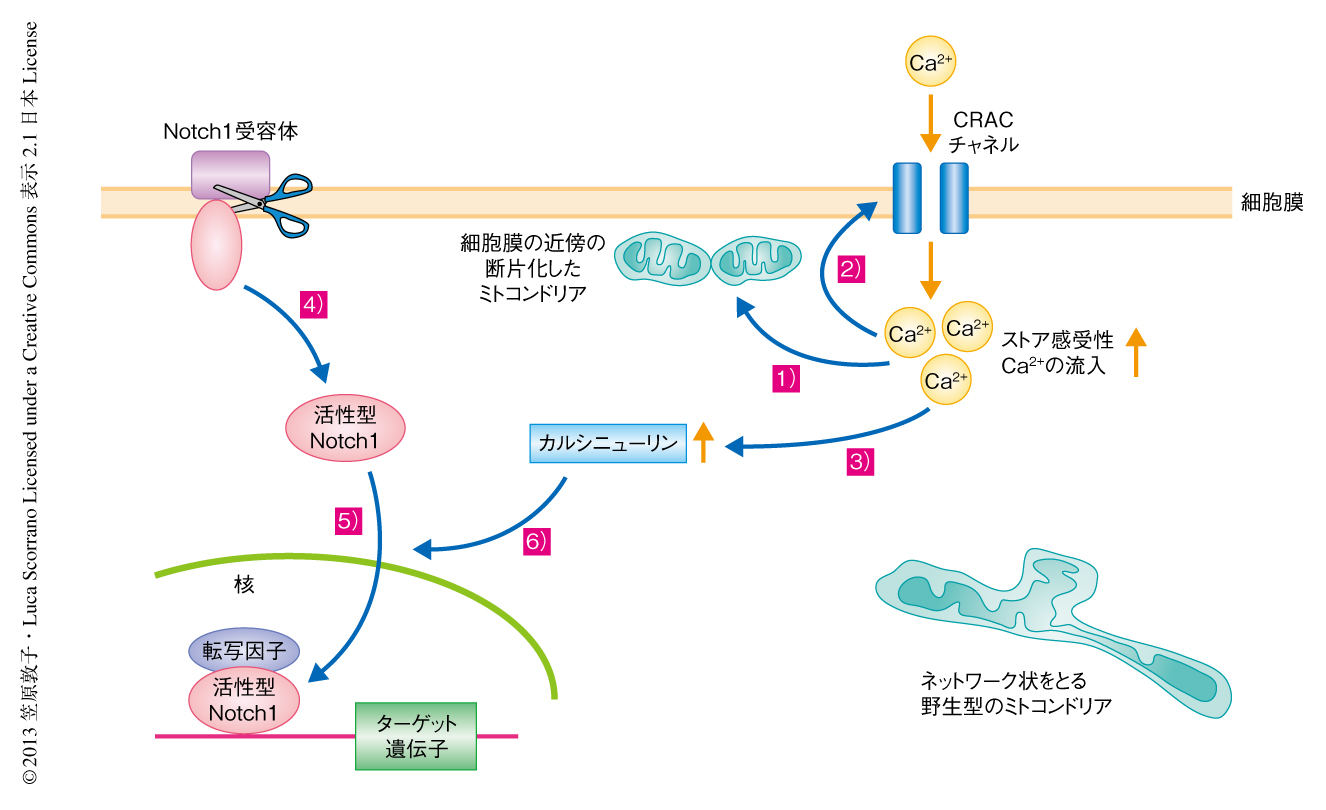
ミトコンドリアの融合は心筋細胞の分化および発生においてカルシニューリンとNotchシグナル伝達系を介し必須である
笠原敦子・Luca Scorrano
(スイスGeneva大学Department of Cell Physiology and Metabolism)
email:笠原敦子
DOI: 10.7875/first.author.2013.129
Mitochondrial fusion directs cardiomyocyte differentiation via calcineurin and Notch signaling.
Atsuko Kasahara, Sara Cipolat, Yun Chen, Gerald W. Dorn II, Luca Scorrano
Science, 342, 734-737 (2013)
ミトコンドリアは細胞の分化および発生において重要であるが,その動態の役割についてはよくわかっていない.筆者らの今回の研究により,ミトコンドリアの融合が心筋細胞の分化および発生に必須であることが明らかになった.ミトコンドリア融合タンパク質MFN1およびMFN2のマウスの胚における心筋に特異的な欠損は胚性致死をひき起こし,ミトコンドリア融合タンパク質MFN2あるいはOPA1のマウスのES細胞における発現の低下は心筋細胞への分化を阻害した.このとき,マウス胚およびマウスES細胞ともに,心筋に特異的な遺伝子であるMef2c遺伝子,Nkx2.5遺伝子,Gata4遺伝子,および,心筋型トロポニンTの発現の低下が認められた.さらに,MFN2あるいはOPA1の発現を低下させたES細胞では,心筋の分化に対し阻害的にはたらくNotch1シグナル伝達系の活性がカルシニューリンの活性により上昇しており,ミトコンドリアの形態と心筋の分化の過程とをつなぐ詳細な分子機構も解明された.カルシニューリンがNotch1シグナル伝達系を制御するという知見はまったく新しいものであった.ミトコンドリアの形態はCa2+およびカルシニューリンに依存的なNotch1シグナル伝達系を介し心筋の分化を制御していた.
細胞の分化および発生においてミトコンドリアのはたす役割は非常に大きい.ミトコンドリア内膜のクリステに存在する呼吸鎖複合体の酸化的リン酸化による,大量のATPの産生に依存する心筋細胞では,ES細胞(embryonic stem cell,胚性幹細胞)からの分化において解糖系から酸化的リン酸化への代謝の転換が必要であり1),また,ミトコンドリアはアポトーシス,Ca2+シグナル伝達系,虚血再灌流傷害による心筋細胞の障害の抑制においても重要な役割をはたしており2),まさに細胞の生と死をにぎるオルガネラである.これらミトコンドリアの多面的な機能は,その非常に動的な形態および構造に由来するといっても過言ではない.ミトコンドリアは細胞分裂のときだけでなく,つねに融合と分裂をくり返しており,内部の成分,たとえば,ミトコンドリアDNAや代謝産物を交換しあうことによりミトコンドリア自体の品質を均一に保っている.
哺乳類では,ミトコンドリアの融合と分裂はおもに4つのダイナミン関連GTPaseにより制御されている.ミトコンドリア内膜に局在するOPA1(dynamin-like GTPase optic atrophy 1)とミトコンドリア外膜に局在するMFN1およびMFN2(MFN:dynamin-like GTPase mitofusin)がミトコンドリアの融合を,DRP1(dynamin-related protein 1)とミトコンドリア外膜に局在するFis1,Mff,Mid49-51がミトコンドリアの分裂を制御する3).とくに,ミトコンドリア融合タンパク質は融合の制御だけでなく,それとは独立した異なる重要な役割も担う.OPA1はクリステ構造の再構築によりアポトーシスのときのシトクロムcの放出を制御しており4,5),MFN2はミトコンドリア外膜だけでなく小胞体膜にも局在し,ミトコンドリアと小胞体を並列に位置させて両者をつなぎ,小胞体からミトコンドリアへのCa2+の取り込みに寄与している6).OPA1およびMFN2はミトコンドリアの構造だけでなくその多彩な機能にも必須であるため,マウスの初期胚における発生の過程においても不可欠な役割をはたしており,OPA1あるいはMFN2のノックアウトマウスはともに胚性致死である.また,MFN1あるいはMFN2は心筋に特異的な欠損であっても胚性致死であり,胚発生の後期において心筋に特異的なMFN1あるいはMFN2の欠損は心筋症をひき起こすことから7),ミトコンドリア融合タンパク質が心臓の発生の初期において非常に重要であることがわかる.
しかしながら,ミトコンドリア融合タンパク質がミトコンドリアの形態を制御しながら,もしくは,それとは完全に独立して,どのように心筋の分化および発生の過程に関与しているかについてはよくわかっていない.心筋細胞の分化および特異化は,さまざまな転写因子の時期特異的な発現,および,それらを制御するさまざまなシグナル伝達系により制御されている.培養系におけるES細胞から心筋への分化はこの複雑な過程をよく再現しており,より詳細な分子機構の解明にはうってつけである.そこで,心筋細胞の分化および発生におけるミトコンドリアの動態の役割を知るため,心筋に特異的にMFN1およびMFN2を欠損したマウスと,遺伝子トラップ法によりMFN2およびOPA1の発現量がそれぞれ50%に低下したES細胞を用いて実験を行った.
心筋細胞の分化および発生の過程におけるミトコンドリア融合タンパク質の役割を知るため,マウスの胚においてMFN1およびMFN2を心筋に特異的に欠損させた.このマウスは胎生10.5日までに胚性致死となるため,胎生9.5日の胚を調べたところ,MFN1およびMFN2を欠損した心臓は,心室,心房の位置,心室の形成,心膜は全体的に正常であったが,通常,この時期の心房に認められる有核赤血球が観察されず,血液の循環が異常であることが示された.MFN1およびMFN2を欠損した心筋細胞は,筋原繊維の組織化が野生型の心筋細胞に比べ乏しく,ミトコンドリアの形態は断片化していた.
ミトコンドリアの融合と心筋細胞の分化について分子レベルで精査するため,ES細胞を用いた伝統的なハンギングドロップ法による心筋の分化の誘導実験を行った8).興味深いことに,ミトコンドリアの形態は野生型の未分化なES細胞では短く乏しいネットワーク構造をしていたのに対し,ES細胞から分化した心筋細胞ではミトコンドリアは長く相互に融合しあった複雑な構造をしていた.このミトコンドリアの形態の違いは,分化した心筋細胞では未分化なES細胞に比べ,ミトコンドリア融合タンパク質であるMFN2およびOPA1のタンパク質量が上昇していることからも確認された.一方,ミトコンドリア量のマーカーであるミトコンドリア外膜タンパク質TOM20のタンパク質量や,ミトコンドリア自体の生合成にかかわるTfamあるいはSIRTをコードするmRNAの量に違いはなかったことから,心筋の分化によりミトコンドリア自体が増加したのではなく,ミトコンドリアの融合が活発になっていることが示された.
ES細胞の心筋への分化の過程におけるMFN2およびOPA1の役割を調べるため,遺伝子トラップES細胞を用いて心筋の分化の誘導実験を行った.遺伝子トラップ法とは,対立遺伝子のうち片方の機能を失わせる方法である.片方の対立遺伝子が機能しなくなることでMFN2の発現量が50%となった未分化なES細胞,および,OPA1の発現量が50%となった未分化なES細胞は,自己増殖能,多分化能,染色体数は正常であるのに対し,拍動する胚様体の数が野生型の胚様体に比べ著しく低下しており,MFN2あるいはOPA1の発現の低下により心筋への分化能は損なわれることがわかった.MFN2あるいはOPA1の発現量が50%となったES細胞では,心筋型トロポニンTのタンパク質量,サルコメアの数,心筋に特異的な転写因子であるMef2cおよびNkx2.5をコードするmRNAの量も著しく低下していた.また,この心筋への分化能の低下はMFN2あるいはOPA1の発現の低下による特異的なものであることは,レトロウイルスによりMFN2あるいはOPA1の発現量が50%となったES細胞それぞれにMfn2遺伝子あるいはOpa1遺伝子を導入することにより,心筋への分化能が野生型のES細胞と同じレベルまで回復したことから確認した.
以上のことから,ミトコンドリアの融合はマウスの胚における心臓の発生,および,マウスのES細胞からの心筋の分化の両方において非常に重要であることがわかった.
MFN1およびMFN2を欠損したマウスの胚の心筋細胞と同様に,MFN2あるいはOPA1の発現量が50%となった未分化なES細胞ではミトコンドリアは断片化して短くなり,また,OPA1の発現量が50%となった未分化なES細胞では内膜クリステの数は少なくなりその構造も異常であった.これらミトコンドリアの異常な形態にもかかわらず,そのエネルギー産生能やアポトーシスは正常であった.一方,ミトコンドリアのかかわるもうひとつの重要な現象であるCa2+について調べると,MFN2あるいはOPA1の発現量が50%となったES細胞ではストア感受性Ca2+流入が上昇していた.このストア感受性Ca2+流入は,小胞体におけるCa2+の貯蔵が欠乏したときに起こる細胞の外からのCa2+の流入である.
ミトコンドリアは細胞膜のCRACチャネルに近い局所的なCa2+を緩衝することにより,ストア感受性Ca2+流入を維持することが知られている9)(図1).そこで,MFN2あるいはOPA1の発現量が50%となったES細胞におけるミトコンドリアの局在について,全反射照明蛍光顕微鏡を用いて細胞膜に近接するミトコンドリアだけを観察したところ,野生型のES細胞に比べ,全体のミトコンドリアに対する割合は著しく高かった.つまり,MFN2あるいはOPA1の発現の低下によりミトコンドリアは断片化し短い形態を示しただけでなく,その細胞内での局在も細胞膜の近傍へと変化していた.このストア感受性Ca2+流入により上昇した細胞内のCa2+は,Ca2+依存性プロテインホスファターゼであるカルシニューリンを活性化させることがわかっている.そこで,カルシニューリンの活性を組換えリン酸ペプチドを用いて測定したところ,MFN2あるいはOPA1の発現量が50%となったES細胞では野生型のES細胞に比べ上昇していた.
心筋に特異的にMFN1およびMFN2を欠損したマウスの胚において,Notch1シグナル伝達系のターゲット遺伝子であるMef2c遺伝子およびGata4遺伝子のmRNA量が低下していたこと,また,Notch1シグナル伝達系は細胞の分化,発達の過程,細胞間コミュニケーションにおいて非常に重要な役割をはたしており,とくに,ES細胞から心筋細胞への分化を阻害することが知られていたことから10),ES細胞から心筋への分化の過程におけるNotch1の活性を調べることにした.古典的Notchシグナル伝達系においては,細胞膜にてNotch受容体にそのリガンドが結合し,γセクレターゼ活性によるNotch受容体の切断により活性型Notchが産生されて,この活性型Notchが核へと移行し,転写因子へと結合することによりNotchシグナル伝達系のターゲット遺伝子が発現する.活性型Notch1のレポータープラスミドを用いて未分化なES細胞および分化の過程にあるES細胞におけるNotch1の活性を測定したところ,MFN2あるいはOPA1の発現量が50%となったES細胞では野生型のES細胞に比べ,未分化な状態および分化の過程においてつねに高いNotch1活性を維持していた.活性型Notch1の産生量に差はなかったが,MFN2あるいはOPA1の発現量が50%となったES細胞では活性型Notch1が核画分に蓄積していた.これらの結果は,ミトコンドリア融合タンパク質がNotch1の活性にかかわっていることを示唆する非常に新しい知見であった.
それでは,どのような分子機構によりミトコンドリア融合タンパク質はNotch1シグナル伝達系の活性化にかかわっているのだろうか? MFN2あるいはOPA1の発現量が50%になることにより,ミトコンドリアのエネルギー産生にかかわる機能は維持されていたが,ストア感受性Ca2+流入は上昇し,カルシニューリンは活性化されていた.そこで,野生型のES細胞においてカルシニューリンの活性を恒常的に活性化したうえで同様にNotch1の活性を測定したところ,Notch1の活性は対照に比べ高くなっていた.さらに非常に興味深いことに,このNotch1の活性化はカルシニューリンの活性を上昇させるCa2+イオノホアであるイオノマイシンによっても生じた.一方,カルシニューリンに特異的な阻害剤であるFK506はイオノマイシンによるNotch1の活性化を阻害した.これらの結果は,細胞内Ca2+およびカルシニューリンの活性とNotch1シグナル伝達系とを結ぶはじめての知見であった.さらに,カルシニューリンシグナル伝達系の下流に存在することが知られるNFATはこのカルシニューリンによるNotch1の活性化とは無関係であることが,NFATの特異的な阻害剤であるVIVITを用いてもイオノマイシンによるNotch1の活性化は影響をうけないことから確かめられた.カルシニューリンの活性は活性型Notch1の産生量には影響をあたえなかったが,活性型Notch1の核画分への蓄積を増大させた.つまり,細胞内Ca2+およびカルシニューリンの活性は,活性型Notch1の核への蓄積とそれによるNotch1の活性化を制御していることがわかった.以上から,ミトコンドリア融合タンパク質はカルシニューリンの活性を介しNotch1シグナル伝達系を制御していることがわかった.
ミトコンドリア融合タンパク質MFN2およびOPA1はES細胞から心筋への分化に必須である.一方,ミトコンドリア融合タンパク質MFN2あるいはOPA1の発現の低下により,カルシニューリンの活性を介したNotch1の活性化が観察された.カルシニューリンに特異的な阻害剤FK506,カルシニューリンの機能阻害変異体の発現,Notchシグナル伝達系の特異的な阻害剤DAPTにより,MFN2あるいはOPA1の発現量が50%となったES細胞の心筋への分化能は野生型のES細胞と同じレベルまで回復した.カルシニューリンはミトコンドリア分裂タンパク質DRP1を脱リン酸化することにより,DRP1の細胞質からミトコンドリアへの移行を制御する,すなわち,ミトコンドリアの分裂を誘導することが知られている11).ところが,MFN2あるいはOPA1の発現量が50%となった未分化なES細胞におけるミトコンドリアの形態は,カルシニューリンに特異的な阻害剤FK506により断片化から改善されることはなく,この心筋への分化能の回復は,カルシニューリンの活性の阻害によりNotch1の活性が野生型のES細胞と同じレベルまで低下したことによることが示された.
今回の研究により,ミトコンドリアの融合が心筋の分化および発生に必須であることが示された.マウスの胚におけるMFN1あるいはMFN2の心筋に特異的な欠損,また,マウスのES細胞におけるMFN2あるいはOPA1の発現の低下により,心筋細胞の分化の異常は中胚葉の発生よりあとに起こっていることを同定することができた.詳細な分子機構として,ミトコンドリアの動態,Ca2+シグナル伝達系,カルシニューリン,そして,中胚葉からの心筋細胞の分化に対し阻害的にはたらくNotch1シグナル伝達系の予想外の関連が見い出された(図1).MFN2あるいはOPA1の発現量が50%となったES細胞では活性型Notch1が核に蓄積し,また,筋に特異的な転写因子であるMef2をコードするmRNAの量は低下していたが,これまでに,活性型Notch1はMEF2とDNAとの結合において拮抗的にはたらいて筋の形成を阻害することが示されている12).今回,はじめてカルシニューリンの活性によるNotch1シグナル伝達系の活性化が示されたわけだが,これがどのような分子機構により起こっているかについては今後の興味深い研究テーマになるだろう.
略歴:2006年 筑波大学大学院生命環境科学研究科 修了,同年 同 博士研究員,同 助教を経て,2008年よりスイスGeneva大学 博士研究員.
研究テーマ:幹細胞からの細胞の分化におけるミトコンドリアの役割.
抱負:視覚的に美しいミトコンドリアの動態が,さまざまな生命現象においてはたす意味を研究していきたい.
Luca Scorrano
イタリアPadua大学 教授.
© 2013 笠原敦子・Luca Scorrano Licensed under CC 表示 2.1 日本
(スイスGeneva大学Department of Cell Physiology and Metabolism)
email:笠原敦子
DOI: 10.7875/first.author.2013.129
Mitochondrial fusion directs cardiomyocyte differentiation via calcineurin and Notch signaling.
Atsuko Kasahara, Sara Cipolat, Yun Chen, Gerald W. Dorn II, Luca Scorrano
Science, 342, 734-737 (2013)
要 約
ミトコンドリアは細胞の分化および発生において重要であるが,その動態の役割についてはよくわかっていない.筆者らの今回の研究により,ミトコンドリアの融合が心筋細胞の分化および発生に必須であることが明らかになった.ミトコンドリア融合タンパク質MFN1およびMFN2のマウスの胚における心筋に特異的な欠損は胚性致死をひき起こし,ミトコンドリア融合タンパク質MFN2あるいはOPA1のマウスのES細胞における発現の低下は心筋細胞への分化を阻害した.このとき,マウス胚およびマウスES細胞ともに,心筋に特異的な遺伝子であるMef2c遺伝子,Nkx2.5遺伝子,Gata4遺伝子,および,心筋型トロポニンTの発現の低下が認められた.さらに,MFN2あるいはOPA1の発現を低下させたES細胞では,心筋の分化に対し阻害的にはたらくNotch1シグナル伝達系の活性がカルシニューリンの活性により上昇しており,ミトコンドリアの形態と心筋の分化の過程とをつなぐ詳細な分子機構も解明された.カルシニューリンがNotch1シグナル伝達系を制御するという知見はまったく新しいものであった.ミトコンドリアの形態はCa2+およびカルシニューリンに依存的なNotch1シグナル伝達系を介し心筋の分化を制御していた.
はじめに
細胞の分化および発生においてミトコンドリアのはたす役割は非常に大きい.ミトコンドリア内膜のクリステに存在する呼吸鎖複合体の酸化的リン酸化による,大量のATPの産生に依存する心筋細胞では,ES細胞(embryonic stem cell,胚性幹細胞)からの分化において解糖系から酸化的リン酸化への代謝の転換が必要であり1),また,ミトコンドリアはアポトーシス,Ca2+シグナル伝達系,虚血再灌流傷害による心筋細胞の障害の抑制においても重要な役割をはたしており2),まさに細胞の生と死をにぎるオルガネラである.これらミトコンドリアの多面的な機能は,その非常に動的な形態および構造に由来するといっても過言ではない.ミトコンドリアは細胞分裂のときだけでなく,つねに融合と分裂をくり返しており,内部の成分,たとえば,ミトコンドリアDNAや代謝産物を交換しあうことによりミトコンドリア自体の品質を均一に保っている.
哺乳類では,ミトコンドリアの融合と分裂はおもに4つのダイナミン関連GTPaseにより制御されている.ミトコンドリア内膜に局在するOPA1(dynamin-like GTPase optic atrophy 1)とミトコンドリア外膜に局在するMFN1およびMFN2(MFN:dynamin-like GTPase mitofusin)がミトコンドリアの融合を,DRP1(dynamin-related protein 1)とミトコンドリア外膜に局在するFis1,Mff,Mid49-51がミトコンドリアの分裂を制御する3).とくに,ミトコンドリア融合タンパク質は融合の制御だけでなく,それとは独立した異なる重要な役割も担う.OPA1はクリステ構造の再構築によりアポトーシスのときのシトクロムcの放出を制御しており4,5),MFN2はミトコンドリア外膜だけでなく小胞体膜にも局在し,ミトコンドリアと小胞体を並列に位置させて両者をつなぎ,小胞体からミトコンドリアへのCa2+の取り込みに寄与している6).OPA1およびMFN2はミトコンドリアの構造だけでなくその多彩な機能にも必須であるため,マウスの初期胚における発生の過程においても不可欠な役割をはたしており,OPA1あるいはMFN2のノックアウトマウスはともに胚性致死である.また,MFN1あるいはMFN2は心筋に特異的な欠損であっても胚性致死であり,胚発生の後期において心筋に特異的なMFN1あるいはMFN2の欠損は心筋症をひき起こすことから7),ミトコンドリア融合タンパク質が心臓の発生の初期において非常に重要であることがわかる.
しかしながら,ミトコンドリア融合タンパク質がミトコンドリアの形態を制御しながら,もしくは,それとは完全に独立して,どのように心筋の分化および発生の過程に関与しているかについてはよくわかっていない.心筋細胞の分化および特異化は,さまざまな転写因子の時期特異的な発現,および,それらを制御するさまざまなシグナル伝達系により制御されている.培養系におけるES細胞から心筋への分化はこの複雑な過程をよく再現しており,より詳細な分子機構の解明にはうってつけである.そこで,心筋細胞の分化および発生におけるミトコンドリアの動態の役割を知るため,心筋に特異的にMFN1およびMFN2を欠損したマウスと,遺伝子トラップ法によりMFN2およびOPA1の発現量がそれぞれ50%に低下したES細胞を用いて実験を行った.
1.ミトコンドリア融合タンパク質は心筋細胞の分化および発生において重要である
心筋細胞の分化および発生の過程におけるミトコンドリア融合タンパク質の役割を知るため,マウスの胚においてMFN1およびMFN2を心筋に特異的に欠損させた.このマウスは胎生10.5日までに胚性致死となるため,胎生9.5日の胚を調べたところ,MFN1およびMFN2を欠損した心臓は,心室,心房の位置,心室の形成,心膜は全体的に正常であったが,通常,この時期の心房に認められる有核赤血球が観察されず,血液の循環が異常であることが示された.MFN1およびMFN2を欠損した心筋細胞は,筋原繊維の組織化が野生型の心筋細胞に比べ乏しく,ミトコンドリアの形態は断片化していた.
ミトコンドリアの融合と心筋細胞の分化について分子レベルで精査するため,ES細胞を用いた伝統的なハンギングドロップ法による心筋の分化の誘導実験を行った8).興味深いことに,ミトコンドリアの形態は野生型の未分化なES細胞では短く乏しいネットワーク構造をしていたのに対し,ES細胞から分化した心筋細胞ではミトコンドリアは長く相互に融合しあった複雑な構造をしていた.このミトコンドリアの形態の違いは,分化した心筋細胞では未分化なES細胞に比べ,ミトコンドリア融合タンパク質であるMFN2およびOPA1のタンパク質量が上昇していることからも確認された.一方,ミトコンドリア量のマーカーであるミトコンドリア外膜タンパク質TOM20のタンパク質量や,ミトコンドリア自体の生合成にかかわるTfamあるいはSIRTをコードするmRNAの量に違いはなかったことから,心筋の分化によりミトコンドリア自体が増加したのではなく,ミトコンドリアの融合が活発になっていることが示された.
ES細胞の心筋への分化の過程におけるMFN2およびOPA1の役割を調べるため,遺伝子トラップES細胞を用いて心筋の分化の誘導実験を行った.遺伝子トラップ法とは,対立遺伝子のうち片方の機能を失わせる方法である.片方の対立遺伝子が機能しなくなることでMFN2の発現量が50%となった未分化なES細胞,および,OPA1の発現量が50%となった未分化なES細胞は,自己増殖能,多分化能,染色体数は正常であるのに対し,拍動する胚様体の数が野生型の胚様体に比べ著しく低下しており,MFN2あるいはOPA1の発現の低下により心筋への分化能は損なわれることがわかった.MFN2あるいはOPA1の発現量が50%となったES細胞では,心筋型トロポニンTのタンパク質量,サルコメアの数,心筋に特異的な転写因子であるMef2cおよびNkx2.5をコードするmRNAの量も著しく低下していた.また,この心筋への分化能の低下はMFN2あるいはOPA1の発現の低下による特異的なものであることは,レトロウイルスによりMFN2あるいはOPA1の発現量が50%となったES細胞それぞれにMfn2遺伝子あるいはOpa1遺伝子を導入することにより,心筋への分化能が野生型のES細胞と同じレベルまで回復したことから確認した.
以上のことから,ミトコンドリアの融合はマウスの胚における心臓の発生,および,マウスのES細胞からの心筋の分化の両方において非常に重要であることがわかった.
2.ミトコンドリアの形態の異常はストア感受性Ca2+の流入およびカルシニューリンの活性を上昇させる
MFN1およびMFN2を欠損したマウスの胚の心筋細胞と同様に,MFN2あるいはOPA1の発現量が50%となった未分化なES細胞ではミトコンドリアは断片化して短くなり,また,OPA1の発現量が50%となった未分化なES細胞では内膜クリステの数は少なくなりその構造も異常であった.これらミトコンドリアの異常な形態にもかかわらず,そのエネルギー産生能やアポトーシスは正常であった.一方,ミトコンドリアのかかわるもうひとつの重要な現象であるCa2+について調べると,MFN2あるいはOPA1の発現量が50%となったES細胞ではストア感受性Ca2+流入が上昇していた.このストア感受性Ca2+流入は,小胞体におけるCa2+の貯蔵が欠乏したときに起こる細胞の外からのCa2+の流入である.
ミトコンドリアは細胞膜のCRACチャネルに近い局所的なCa2+を緩衝することにより,ストア感受性Ca2+流入を維持することが知られている9)(図1).そこで,MFN2あるいはOPA1の発現量が50%となったES細胞におけるミトコンドリアの局在について,全反射照明蛍光顕微鏡を用いて細胞膜に近接するミトコンドリアだけを観察したところ,野生型のES細胞に比べ,全体のミトコンドリアに対する割合は著しく高かった.つまり,MFN2あるいはOPA1の発現の低下によりミトコンドリアは断片化し短い形態を示しただけでなく,その細胞内での局在も細胞膜の近傍へと変化していた.このストア感受性Ca2+流入により上昇した細胞内のCa2+は,Ca2+依存性プロテインホスファターゼであるカルシニューリンを活性化させることがわかっている.そこで,カルシニューリンの活性を組換えリン酸ペプチドを用いて測定したところ,MFN2あるいはOPA1の発現量が50%となったES細胞では野生型のES細胞に比べ上昇していた.
3.ミトコンドリアの形態の異常はカルシニューリン活性を介しNotch1シグナル伝達系を活性化する
心筋に特異的にMFN1およびMFN2を欠損したマウスの胚において,Notch1シグナル伝達系のターゲット遺伝子であるMef2c遺伝子およびGata4遺伝子のmRNA量が低下していたこと,また,Notch1シグナル伝達系は細胞の分化,発達の過程,細胞間コミュニケーションにおいて非常に重要な役割をはたしており,とくに,ES細胞から心筋細胞への分化を阻害することが知られていたことから10),ES細胞から心筋への分化の過程におけるNotch1の活性を調べることにした.古典的Notchシグナル伝達系においては,細胞膜にてNotch受容体にそのリガンドが結合し,γセクレターゼ活性によるNotch受容体の切断により活性型Notchが産生されて,この活性型Notchが核へと移行し,転写因子へと結合することによりNotchシグナル伝達系のターゲット遺伝子が発現する.活性型Notch1のレポータープラスミドを用いて未分化なES細胞および分化の過程にあるES細胞におけるNotch1の活性を測定したところ,MFN2あるいはOPA1の発現量が50%となったES細胞では野生型のES細胞に比べ,未分化な状態および分化の過程においてつねに高いNotch1活性を維持していた.活性型Notch1の産生量に差はなかったが,MFN2あるいはOPA1の発現量が50%となったES細胞では活性型Notch1が核画分に蓄積していた.これらの結果は,ミトコンドリア融合タンパク質がNotch1の活性にかかわっていることを示唆する非常に新しい知見であった.
それでは,どのような分子機構によりミトコンドリア融合タンパク質はNotch1シグナル伝達系の活性化にかかわっているのだろうか? MFN2あるいはOPA1の発現量が50%になることにより,ミトコンドリアのエネルギー産生にかかわる機能は維持されていたが,ストア感受性Ca2+流入は上昇し,カルシニューリンは活性化されていた.そこで,野生型のES細胞においてカルシニューリンの活性を恒常的に活性化したうえで同様にNotch1の活性を測定したところ,Notch1の活性は対照に比べ高くなっていた.さらに非常に興味深いことに,このNotch1の活性化はカルシニューリンの活性を上昇させるCa2+イオノホアであるイオノマイシンによっても生じた.一方,カルシニューリンに特異的な阻害剤であるFK506はイオノマイシンによるNotch1の活性化を阻害した.これらの結果は,細胞内Ca2+およびカルシニューリンの活性とNotch1シグナル伝達系とを結ぶはじめての知見であった.さらに,カルシニューリンシグナル伝達系の下流に存在することが知られるNFATはこのカルシニューリンによるNotch1の活性化とは無関係であることが,NFATの特異的な阻害剤であるVIVITを用いてもイオノマイシンによるNotch1の活性化は影響をうけないことから確かめられた.カルシニューリンの活性は活性型Notch1の産生量には影響をあたえなかったが,活性型Notch1の核画分への蓄積を増大させた.つまり,細胞内Ca2+およびカルシニューリンの活性は,活性型Notch1の核への蓄積とそれによるNotch1の活性化を制御していることがわかった.以上から,ミトコンドリア融合タンパク質はカルシニューリンの活性を介しNotch1シグナル伝達系を制御していることがわかった.
4.カルシニューリンの阻害あるいはNotch1シグナル伝達系の阻害により心筋への分化の低下は回復する
ミトコンドリア融合タンパク質MFN2およびOPA1はES細胞から心筋への分化に必須である.一方,ミトコンドリア融合タンパク質MFN2あるいはOPA1の発現の低下により,カルシニューリンの活性を介したNotch1の活性化が観察された.カルシニューリンに特異的な阻害剤FK506,カルシニューリンの機能阻害変異体の発現,Notchシグナル伝達系の特異的な阻害剤DAPTにより,MFN2あるいはOPA1の発現量が50%となったES細胞の心筋への分化能は野生型のES細胞と同じレベルまで回復した.カルシニューリンはミトコンドリア分裂タンパク質DRP1を脱リン酸化することにより,DRP1の細胞質からミトコンドリアへの移行を制御する,すなわち,ミトコンドリアの分裂を誘導することが知られている11).ところが,MFN2あるいはOPA1の発現量が50%となった未分化なES細胞におけるミトコンドリアの形態は,カルシニューリンに特異的な阻害剤FK506により断片化から改善されることはなく,この心筋への分化能の回復は,カルシニューリンの活性の阻害によりNotch1の活性が野生型のES細胞と同じレベルまで低下したことによることが示された.
おわりに
今回の研究により,ミトコンドリアの融合が心筋の分化および発生に必須であることが示された.マウスの胚におけるMFN1あるいはMFN2の心筋に特異的な欠損,また,マウスのES細胞におけるMFN2あるいはOPA1の発現の低下により,心筋細胞の分化の異常は中胚葉の発生よりあとに起こっていることを同定することができた.詳細な分子機構として,ミトコンドリアの動態,Ca2+シグナル伝達系,カルシニューリン,そして,中胚葉からの心筋細胞の分化に対し阻害的にはたらくNotch1シグナル伝達系の予想外の関連が見い出された(図1).MFN2あるいはOPA1の発現量が50%となったES細胞では活性型Notch1が核に蓄積し,また,筋に特異的な転写因子であるMef2をコードするmRNAの量は低下していたが,これまでに,活性型Notch1はMEF2とDNAとの結合において拮抗的にはたらいて筋の形成を阻害することが示されている12).今回,はじめてカルシニューリンの活性によるNotch1シグナル伝達系の活性化が示されたわけだが,これがどのような分子機構により起こっているかについては今後の興味深い研究テーマになるだろう.
文 献
- Chung, S., Dzeja, P. P., Faustino, R. S. et al.: Mitochondrial oxidative metabolism is required for the cardiac differentiation of stem cells. Nat. Clin. Pract. Cardiovasc. Med., Suppl. 1, S60-S67 (2007)[PubMed]
- Ong, S. B., Subrayan, S., Lim, S. Y. et al.: Inhibiting mitochondrial fission protects the heart against ischemia/reperfusion injury. Circulation, 121, 2012-2022 (2010)[PubMed]
- Westermann, B.: Mitochondrial fusion and fission in cell life and death. Nat. Rev. Mol. Cell Biol., 11, 872-884 (2010)[PubMed]
- Cipolat, S., Rudka, T., Hartmann, D. et al.: Mitochondrial rhomboid PARL regulates cytochrome c release during apoptosis via OPA1-dependent cristae remodeling. Cell, 126, 163-175 (2006)[PubMed]
- Frezza, C., Cipolat, S., Martins de Brito, O. et al.: OPA1 controls apoptotic cristae remodeling independently from mitochondrial fusion. Cell, 126, 177-189 (2006)[PubMed]
- de Brito, O. M. & Scorrano, L.: Mitofusin 2 tethers endoplasmic reticulum to mitochondria. Nature, 456, 605-610 (2008)[PubMed]
- Chen, Y., Liu, Y. & Dorn, G. W. 2nd.: Mitochondrial fusion is essential for organelle function and cardiac homeostasis. Circ. Res., 109, 1327-1331 (2011)[PubMed]
- Keller, G. M.: In vitro differentiation of embryonic stem cells. Curr. Opin. Cell Biol., 7, 862-869 (1995)[PubMed]
- Hoth, M., Fanger, C. M. & Lewis, R. S.: Mitochondrial regulation of store-operated calcium signaling in T lymphocytes. J. Cell Biol., 137, 633-648 (1997)[PubMed]
- Nemir, M., Croquelois, A., Pedrazzini, T. et al.: Induction of cardiogenesis in embryonic stem cells via downregulation of Notch1 signaling. Circ. Res., 98, 1471-1478 (2006)[PubMed]
- Cereghetti, G. M., Stangherlin, A., Martins, de Brito, O. et al.: Dephosphorylation by calcineurin regulates translocation of Drp1 to mitochondria. Proc. Natl. Acad. Sci. USA, 105, 15803-15808 (2008)[PubMed]
- Wilson-Rawls, J., Molkentin, J. D., Black, B. L. et al.: Activated notch inhibits myogenic activity of the MADS-Box transcription factor myocyte enhancer factor 2C. Mol. Cell. Biol., 19, 2853-2862 (1999)[PubMed]
著者プロフィール
略歴:2006年 筑波大学大学院生命環境科学研究科 修了,同年 同 博士研究員,同 助教を経て,2008年よりスイスGeneva大学 博士研究員.
研究テーマ:幹細胞からの細胞の分化におけるミトコンドリアの役割.
抱負:視覚的に美しいミトコンドリアの動態が,さまざまな生命現象においてはたす意味を研究していきたい.
Luca Scorrano
イタリアPadua大学 教授.
© 2013 笠原敦子・Luca Scorrano Licensed under CC 表示 2.1 日本