TOR複合体2からのシグナル伝達系はDNA鎖の切断に対しゲノムを保護する
島田健士・Susan M. Gasser
(スイスFriedrich Miescher Institute for Biomedical Research)
email:島田健士
DOI: 10.7875/first.author.2013.128
TORC2 signaling pathway guarantees genome stability in the face of DNA strand breaks.
Kenji Shimada, Ireos Filipuzzi, Michael Stahl, Stephen B. Helliwell, Christian Studer, Dominic Hoepfner, Andrew Seeber, Robbie Loewith, N. Rao Movva, Susan M. Gasser
Molecular Cell, 51, 829-839 (2013)
DNA複製フォークの安定性に異常を示す出芽酵母株を用いて,ヒドロキシ尿素による複製ストレスの存在のもと化合物をスクリーニングした.そのなかのひとつNVP-BHS345は,出芽酵母のRecQヘリカーゼであるSgs1の欠損株においてヒドロキシ尿素に対する感受性を高めたことからスクリーニングされた.また,NVP-BHS345は出芽酵母のTOR複合体1およびTOR複合体2のもつキナーゼ活性を阻害することが示された.驚くべきことに,DNA鎖の切断をひき起こす薬剤Zeocinがわずかに存在する条件において,NVP-BHS345を同時にくわえると細胞の増殖が著しく阻害されること,また,きわめて短時間のあいだに染色体の断片化の起こることが観察された.TOR複合体2あるいはその下流のキナーゼYpk1およびYpk2の遺伝的な阻害とZeocinの投与とを組み合わせることにより,同様に染色体の断片化がひき起こされたことから,TOR複合体2からのシグナル伝達系の阻害がDNA鎖の切断の原因となっていることが示された.TOR複合体2とYpk1およびYpk2は細胞質においてアクチン骨格の形成を制御することが知られているが,興味深いことに,アクチンのダイナミクスを阻害するラトラキュリンAあるいはジャスプラキノリドとZeocinとを共投与すると,NVP-BHS345の作用と同様に,染色体の断片化がひき起こされた.これらの実験結果は,TOR複合体2の下流のアクチン骨格の形成を介した制御がDNA鎖の過剰な切断を抑制していることを示唆した.
遺伝情報をつかさどるDNAはつねに危険にさらされており,1日1細胞あたり起こるDNA変異の数は4万にも及ぶといわれる.しかし,細胞はDNA修復機構を備えており,変異を効率よくすみやかに除いている.これらのDNA修復機構は酵母からヒトまで保存されており,酵母における遺伝学的な手法を用いた解析はDNA修復の分子機構を探求するうえで重要な役割をはたしてきた.DNA損傷が過剰に存在する場合,キナーゼのカスケードから構成されるDNA損傷チェックポイントが活性化され,細胞周期の一時的な停止とともにDNA修復が促進される.DNA損傷チェックポイントは真核生物において高度に保存されており,PIKK(phosphatidylinositol 3-kinase-related kinase,ホスファチジルイノシトール3-キナーゼ様キナーゼ)ファミリーに属するATR(出芽酵母ではMec1)およびATM(出芽酵母ではTel1)はセンサーキナーゼとしてはたらいている1).PIKKファミリーのほかのメンバーであるTOR(target of rapamycin)は細胞の外界の栄養状態を検知し,細胞の増殖と成長を協調し促進する役割をはたしている.TORは構成サブユニットおよび機能の異なる2つの複合体を形成する.TOR複合体1(TORC1)はタンパク質の合成や分解を制御し,一方で,TOR複合体2(TORC2)は細胞質におけるアクチン骨格の形成,細胞の極性,スフィンゴ脂質の生合成を制御することが知られている2).また,TOR複合体1およびTOR複合体2のもつキナーゼ活性は,ともに細胞の生存に必須である.これまで,DNA損傷応答にTORが関係するという報告はあるが,その詳細な分子機構は不明であった3,4).今回,筆者らは,化合物のスクリーニングにより得られたTORの阻害剤を手がかりに,TOR複合体2からのシグナル伝達系の下流のアクチン骨格の制御がDNA修復機構に関与していることを示唆する結果を示した.
出芽酵母のDNA損傷チェックポイントにおいてはたらくキナーゼMec1とRecQヘリカーゼであるSgs1は,細胞内のdNTPプールを枯渇させるヒドロキシ尿素の処理によるDNA複製の停止から複製フォークの回復と細胞の生存を促すため協調的にはたらくことが知られている5).そこで,Mec1あるいはSgs1の変異株の生育を特異的に阻害する化合物のスクリーニングを低濃度のヒドロキシ尿素の存在のもとで行った.スクリーニングされた化合物のターゲットは,Mec1,Sgs1,あるいは,新規のタンパク質であることが予想された.
NVP-BHS345は,ヒドロキシ尿素の存在のもとSgs1の欠損株の生育を阻害することからスクリーニングされた.興味深いことに,DNA鎖の切断をひき起こす薬剤Zeocinについて,細胞の増殖に影響をあたえない程度のきわめて低濃度のZeocinとNVP-BHS345とがともに存在すると,細胞の増殖が相乗的に阻害されることが示された.同様な効果はDNA鎖の切断をひき起こすγ線の照射とNVP-BHS345との組合せでも観察されたことから,NVP-BHS345はDNA損傷応答を著しく高めていると予想された.実際に,DNA損傷チェックポイントにはたらくキナーゼRad53の活性やDNA二本鎖切断を修復する相同組換えタンパク質Rad52の反応は,NVP-BHS345とZeocinの共存在のもと著しく高まることが観察され,細胞内においてDNA損傷が増大していることが示唆された.高分子DNAを分離するパルスフィールドゲル電気泳動法を用いて実際に出芽酵母の染色体を観察したところ,NVP-BHS345とZeocinそれぞれ単独の作用では起こらないが,NVP-BHS345とZeocinをともに作用させた場合,30分から1時間というきわめて短時間で染色体の断片化の起こることが示された.
興味深いことに,この染色体の断片化は短時間で起こるほか,細胞周期の進行とは無関係,DNA二本鎖切断修復機構の阻害とは無関係,アポトーシスとは異なる,といった特徴を示した.つまり,細胞周期をG1期に停止させた場合にも染色体の断片化がひき起こされたことから,S期あるいはM期におけるイベントは染色体の断片化に必要でないことが示された.DNA二本鎖切断修復タンパク質の欠損株においても,野生株と同様にNVP-BHS345とZeocinとが同時に存在する条件において染色体の断片化が起こったことから,NVP-BHS345がDNA二本鎖切断修復機構を阻害することは染色体の断片化の原因でないことが明らかになった.出芽酵母のアポトーシスヌクレアーゼの欠損株においてもNVP-BHS345とZeocinの共投与による染色体の断片化は阻害されなかったこと,また,アポトーシスにおいて典型的にみられる細胞内膜の断片化の観察されなかったことから,アポトーシスは染色体の断片化には無関係であると考えられた.
出芽酵母におけるNVP-BHS345のターゲットを探るため,酵母における遺伝学的な手法であるハプロ不全プロファイリング(haploinsufficiency profiling)解析を行った.ハプロ不全プロファイリング解析とは,二倍体の出芽酵母につき1つの対立遺伝子を欠損させた全遺伝子をカバーする欠損株ライブラリーを用いて,化学物質,薬剤,培養条件などに対応した細胞の増殖を調べ,感受性を示す欠損株を特定する手法である.ハプロ不全プロファイリング解析によりNVP-BHS345に感受性を示した欠損株の多くは,TOR複合体1およびTOR複合体2の構成サブユニットの欠損株であることが示され,NVP-BHS345のターゲットはTOR複合体1およびTOR複合体2であると推測された.実際に,TOR複合体1およびTOR複合体2の標的タンパク質のリン酸化はNVP-BHS345により阻害されることが,in vivoの系,および,精製したTOR複合体1あるいはTOR複合体2を用いたin vitroの系において示され,NVP-BHS345がTOR複合体1およびTOR複合体2のもつキナーゼ活性を直接に抑制していることが明らかになった.
ZeocinとNVP-BHS345の共投与により染色体の断片化の起こることが示されたが,実際に,NVP-BHS345によるTORシグナル伝達系の阻害がこのことに反映しているのだろうか,あるいは,NVP-BHS345の非特異的なターゲットが関与しているのであろうか? このことを明らかにするため,NVP-BHS345に耐性を示す出芽酵母の変異株のスクリーニングを試みた.そして,NVP-BHS345に対する耐性の原因遺伝子はTOR複合体1およびTOR複合体2の両方に含まれるキナーゼサブユニットをコードするTOR2遺伝子であること,そして,その変異はTor2のキナーゼ活性をつかさどる領域にあることを同定した.また,その変異により,NVP-BHS345とTor2との結合が阻害されるあるいは親和性が弱くなることが構造モデルから推定された.NVP-BHS345に耐性を示すTOR2変異株を用いて染色体の状態を調べたところ,この変異により染色体の断片化は完全に抑制された.この実験により,NVP-BHS345の非特異的なターゲットではなく,NVP-BHS345によるTor2の阻害が原因となり染色体の断片化がひき起こされることが証明された.それでは,TOR複合体1あるいはTOR複合体2のどちらのキナーゼ活性に対する阻害が染色体の断片化に関与しているのだろうか? TOR複合体1の阻害剤であるラパマイシンとZeocinの投与との組合せでは染色体の断片化はみられなかったことから,TOR複合体2の阻害が原因であることが示唆された.TOR複合体2に特異的な阻害を誘導できるよう設計した細胞株を用いて,TOR複合体2の特異的な阻害とZeocinの投与とを組み合わせた場合には染色体の断片化がひき起こされたことから,実際に,TOR複合体2のもつキナーゼ活性の阻害が染色体の断片化をひき起こしていることが示された.
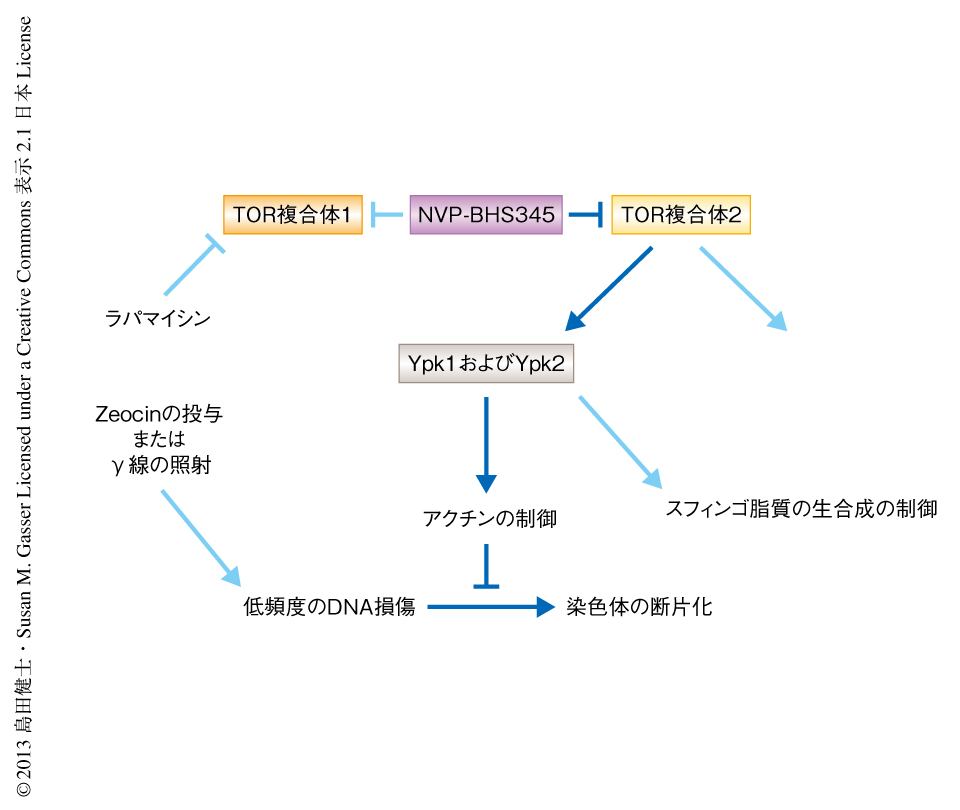
出芽酵母のTOR複合体2の下流のキナーゼとして,重複した機能をもつYpk1およびYpk2が知られている6).Ypk1およびYpk2の阻害が染色体の断片化に関与しているかどうかを調べるため,YPK2遺伝子の欠損とATPアナログに感受性を示すYPK1遺伝子の変異をもつ二重変異株を用いて,ATPアナログの存在のもと染色体の状態を調べた.その結果,Ypk1およびYpk2の阻害は,NVP-BHS345と同様に,Zeocinの投与との組合せにより染色体の断片化をひき起こしたことから,TOR複合体2からYpk1およびYpk2にいたるシグナル伝達系の阻害が染色体の断片化に関係していることが明らかになった.それでは,Ypk1およびYpk2のどのような機能が染色体の断片化に関係しているのだろうか? Ypk1およびYpk2はアクチン骨格の形成,スフィンゴ脂質の生合成を制御することが知られている6,7)(図1).RNAポリメラーゼIIによる転写の阻害剤であるαアマニチン,アクチン重合の阻害剤であるラトラキュリンA,あるいは,チューブリン重合の阻害剤であるノコダゾールとZeocinとの共投与により染色体の断片化は起こるかどうか調べたところ,ラトランキュリンAとZeocinとをともに作用させた場合に染色体の断片化が観察された.このことは,Ypk1およびYpk2の下流のアクチン骨格の形成の制御と染色体の断片化とが関連していることを示唆した.ラトランキュリンAはアクチン単量体に結合してアクチンファイバーの生成を阻害するが,興味深いことに,アクチンファイバーに結合しこれを安定化するジャスプラキノライドとZeocinとをともに作用させた場合にも染色体の断片化がひき起こされた.アクチンの細胞内における機能の阻害,とくに,アクチンのターンオーバーあるいはダイナミクスの阻害が染色体の断片化の原因になると考えられた.
筆者らは,出芽酵母におけるTOR複合体1およびTOR複合体2の阻害剤の発見を手がかりに,TOR複合体2とYpk1およびYpk2を介したアクチン骨格の形成の制御により,DNA鎖の過剰な切断が抑制されることを支持する実験結果を得た(図1).それでは,アクチンの機能の制御とDNA修復とはどのようにかかわっているのだろうか? その分子機構を明らかにすることは今後の研究の重要な課題であるが,考えられるモデルを簡潔に述べたい.アクチンは細胞質と核の両方に存在し,つねにシャトルしていると考えられる8).また,アクチン単量体とアクチンファイバーとの交換反応はダイナミックに行われており,その反応を阻害することにより核におけるアクチンの状態は変化すると考えられる.クロマチンリモデリングタンパク質であるINO80複合体およびSWR1複合体,ヒストンアセチル化酵素NuA4は,構成サブユニットとしてアクチンを含んでいる.これらのタンパク質はDNA二本鎖切断部位にリクルートされDNA修復に関与することが示されており9),アクチンのダイナミクスの阻害がこれらのタンパク質の活性に影響を及ぼすことが推測される.また最近,アクチンファイバーはDNA末端修復タンパク質であるKuに結合しその活性を高めていることが示された10).筆者らによる結果では,DNA二本鎖切断修復機構の阻害が染色体の断片化の原因であることは否定されているが,アクチンが核においてほかのDNA修復機構,たとえば,ZeocinによるDNA酸化損傷によりひき起こされる塩基除去修復などの過程に影響を及ぼしている可能性も考えられ,今後の研究が期待される.もうひとつの課題として,ここで示された出芽酵母におけるTOR複合体2によるアクチンの制御とゲノムの安定性とのかかわりは,ほかの真核生物やヒトにおいても保存されているのかという論点がある.これまでの知見により,高等生物においてもTOR複合体2がDNA修復に関連しているというヒントは得られているが,さらに詳細な解明が期待される.
略歴:1997年 東北大学大学院農学研究科 修了,1998年 スイスInstitute for Experimental Cancer Researchポストドクトラルフェロー,2004年 スイスFriedrich Miescher Institute for Biomedical Researchポストドクトラルアシスタントを経て,2007年より同 プロジェクトリーダー.
研究テーマ:DNA複製,DNA損傷チェックポイント,DNA修復機構.
関心事:DNA複製フォークがDNA損傷に面した際の反応,また,DNA損傷チェックポイントがいかにDNA複製フォークのリスタートにかかわっているか.核においてアクチンの関与するDNA修復機構.
Susan M. Gasser
スイスFriedrich Miescher Institute for Biomedical Research所長.
研究室URL:http://www.fmi.ch/research/groupleader/website/gasserlab/
© 2013 島田健士・Susan M. Gasser Licensed under CC 表示 2.1 日本
(スイスFriedrich Miescher Institute for Biomedical Research)
email:島田健士
DOI: 10.7875/first.author.2013.128
TORC2 signaling pathway guarantees genome stability in the face of DNA strand breaks.
Kenji Shimada, Ireos Filipuzzi, Michael Stahl, Stephen B. Helliwell, Christian Studer, Dominic Hoepfner, Andrew Seeber, Robbie Loewith, N. Rao Movva, Susan M. Gasser
Molecular Cell, 51, 829-839 (2013)
要 約
DNA複製フォークの安定性に異常を示す出芽酵母株を用いて,ヒドロキシ尿素による複製ストレスの存在のもと化合物をスクリーニングした.そのなかのひとつNVP-BHS345は,出芽酵母のRecQヘリカーゼであるSgs1の欠損株においてヒドロキシ尿素に対する感受性を高めたことからスクリーニングされた.また,NVP-BHS345は出芽酵母のTOR複合体1およびTOR複合体2のもつキナーゼ活性を阻害することが示された.驚くべきことに,DNA鎖の切断をひき起こす薬剤Zeocinがわずかに存在する条件において,NVP-BHS345を同時にくわえると細胞の増殖が著しく阻害されること,また,きわめて短時間のあいだに染色体の断片化の起こることが観察された.TOR複合体2あるいはその下流のキナーゼYpk1およびYpk2の遺伝的な阻害とZeocinの投与とを組み合わせることにより,同様に染色体の断片化がひき起こされたことから,TOR複合体2からのシグナル伝達系の阻害がDNA鎖の切断の原因となっていることが示された.TOR複合体2とYpk1およびYpk2は細胞質においてアクチン骨格の形成を制御することが知られているが,興味深いことに,アクチンのダイナミクスを阻害するラトラキュリンAあるいはジャスプラキノリドとZeocinとを共投与すると,NVP-BHS345の作用と同様に,染色体の断片化がひき起こされた.これらの実験結果は,TOR複合体2の下流のアクチン骨格の形成を介した制御がDNA鎖の過剰な切断を抑制していることを示唆した.
はじめに
遺伝情報をつかさどるDNAはつねに危険にさらされており,1日1細胞あたり起こるDNA変異の数は4万にも及ぶといわれる.しかし,細胞はDNA修復機構を備えており,変異を効率よくすみやかに除いている.これらのDNA修復機構は酵母からヒトまで保存されており,酵母における遺伝学的な手法を用いた解析はDNA修復の分子機構を探求するうえで重要な役割をはたしてきた.DNA損傷が過剰に存在する場合,キナーゼのカスケードから構成されるDNA損傷チェックポイントが活性化され,細胞周期の一時的な停止とともにDNA修復が促進される.DNA損傷チェックポイントは真核生物において高度に保存されており,PIKK(phosphatidylinositol 3-kinase-related kinase,ホスファチジルイノシトール3-キナーゼ様キナーゼ)ファミリーに属するATR(出芽酵母ではMec1)およびATM(出芽酵母ではTel1)はセンサーキナーゼとしてはたらいている1).PIKKファミリーのほかのメンバーであるTOR(target of rapamycin)は細胞の外界の栄養状態を検知し,細胞の増殖と成長を協調し促進する役割をはたしている.TORは構成サブユニットおよび機能の異なる2つの複合体を形成する.TOR複合体1(TORC1)はタンパク質の合成や分解を制御し,一方で,TOR複合体2(TORC2)は細胞質におけるアクチン骨格の形成,細胞の極性,スフィンゴ脂質の生合成を制御することが知られている2).また,TOR複合体1およびTOR複合体2のもつキナーゼ活性は,ともに細胞の生存に必須である.これまで,DNA損傷応答にTORが関係するという報告はあるが,その詳細な分子機構は不明であった3,4).今回,筆者らは,化合物のスクリーニングにより得られたTORの阻害剤を手がかりに,TOR複合体2からのシグナル伝達系の下流のアクチン骨格の制御がDNA修復機構に関与していることを示唆する結果を示した.
1.NVP-BHS345とZeocinとの組合せは短時間で染色体の断片化をひき起こす
出芽酵母のDNA損傷チェックポイントにおいてはたらくキナーゼMec1とRecQヘリカーゼであるSgs1は,細胞内のdNTPプールを枯渇させるヒドロキシ尿素の処理によるDNA複製の停止から複製フォークの回復と細胞の生存を促すため協調的にはたらくことが知られている5).そこで,Mec1あるいはSgs1の変異株の生育を特異的に阻害する化合物のスクリーニングを低濃度のヒドロキシ尿素の存在のもとで行った.スクリーニングされた化合物のターゲットは,Mec1,Sgs1,あるいは,新規のタンパク質であることが予想された.
NVP-BHS345は,ヒドロキシ尿素の存在のもとSgs1の欠損株の生育を阻害することからスクリーニングされた.興味深いことに,DNA鎖の切断をひき起こす薬剤Zeocinについて,細胞の増殖に影響をあたえない程度のきわめて低濃度のZeocinとNVP-BHS345とがともに存在すると,細胞の増殖が相乗的に阻害されることが示された.同様な効果はDNA鎖の切断をひき起こすγ線の照射とNVP-BHS345との組合せでも観察されたことから,NVP-BHS345はDNA損傷応答を著しく高めていると予想された.実際に,DNA損傷チェックポイントにはたらくキナーゼRad53の活性やDNA二本鎖切断を修復する相同組換えタンパク質Rad52の反応は,NVP-BHS345とZeocinの共存在のもと著しく高まることが観察され,細胞内においてDNA損傷が増大していることが示唆された.高分子DNAを分離するパルスフィールドゲル電気泳動法を用いて実際に出芽酵母の染色体を観察したところ,NVP-BHS345とZeocinそれぞれ単独の作用では起こらないが,NVP-BHS345とZeocinをともに作用させた場合,30分から1時間というきわめて短時間で染色体の断片化の起こることが示された.
興味深いことに,この染色体の断片化は短時間で起こるほか,細胞周期の進行とは無関係,DNA二本鎖切断修復機構の阻害とは無関係,アポトーシスとは異なる,といった特徴を示した.つまり,細胞周期をG1期に停止させた場合にも染色体の断片化がひき起こされたことから,S期あるいはM期におけるイベントは染色体の断片化に必要でないことが示された.DNA二本鎖切断修復タンパク質の欠損株においても,野生株と同様にNVP-BHS345とZeocinとが同時に存在する条件において染色体の断片化が起こったことから,NVP-BHS345がDNA二本鎖切断修復機構を阻害することは染色体の断片化の原因でないことが明らかになった.出芽酵母のアポトーシスヌクレアーゼの欠損株においてもNVP-BHS345とZeocinの共投与による染色体の断片化は阻害されなかったこと,また,アポトーシスにおいて典型的にみられる細胞内膜の断片化の観察されなかったことから,アポトーシスは染色体の断片化には無関係であると考えられた.
2.NVP-BHS345は出芽酵母のTOR複合体1およびTOR複合体2のもつキナーゼ活性を阻害する
出芽酵母におけるNVP-BHS345のターゲットを探るため,酵母における遺伝学的な手法であるハプロ不全プロファイリング(haploinsufficiency profiling)解析を行った.ハプロ不全プロファイリング解析とは,二倍体の出芽酵母につき1つの対立遺伝子を欠損させた全遺伝子をカバーする欠損株ライブラリーを用いて,化学物質,薬剤,培養条件などに対応した細胞の増殖を調べ,感受性を示す欠損株を特定する手法である.ハプロ不全プロファイリング解析によりNVP-BHS345に感受性を示した欠損株の多くは,TOR複合体1およびTOR複合体2の構成サブユニットの欠損株であることが示され,NVP-BHS345のターゲットはTOR複合体1およびTOR複合体2であると推測された.実際に,TOR複合体1およびTOR複合体2の標的タンパク質のリン酸化はNVP-BHS345により阻害されることが,in vivoの系,および,精製したTOR複合体1あるいはTOR複合体2を用いたin vitroの系において示され,NVP-BHS345がTOR複合体1およびTOR複合体2のもつキナーゼ活性を直接に抑制していることが明らかになった.
3.TOR複合体2とYpk1およびYpk2を介したアクチン骨格の形成の制御が染色体の断片化に関与する
ZeocinとNVP-BHS345の共投与により染色体の断片化の起こることが示されたが,実際に,NVP-BHS345によるTORシグナル伝達系の阻害がこのことに反映しているのだろうか,あるいは,NVP-BHS345の非特異的なターゲットが関与しているのであろうか? このことを明らかにするため,NVP-BHS345に耐性を示す出芽酵母の変異株のスクリーニングを試みた.そして,NVP-BHS345に対する耐性の原因遺伝子はTOR複合体1およびTOR複合体2の両方に含まれるキナーゼサブユニットをコードするTOR2遺伝子であること,そして,その変異はTor2のキナーゼ活性をつかさどる領域にあることを同定した.また,その変異により,NVP-BHS345とTor2との結合が阻害されるあるいは親和性が弱くなることが構造モデルから推定された.NVP-BHS345に耐性を示すTOR2変異株を用いて染色体の状態を調べたところ,この変異により染色体の断片化は完全に抑制された.この実験により,NVP-BHS345の非特異的なターゲットではなく,NVP-BHS345によるTor2の阻害が原因となり染色体の断片化がひき起こされることが証明された.それでは,TOR複合体1あるいはTOR複合体2のどちらのキナーゼ活性に対する阻害が染色体の断片化に関与しているのだろうか? TOR複合体1の阻害剤であるラパマイシンとZeocinの投与との組合せでは染色体の断片化はみられなかったことから,TOR複合体2の阻害が原因であることが示唆された.TOR複合体2に特異的な阻害を誘導できるよう設計した細胞株を用いて,TOR複合体2の特異的な阻害とZeocinの投与とを組み合わせた場合には染色体の断片化がひき起こされたことから,実際に,TOR複合体2のもつキナーゼ活性の阻害が染色体の断片化をひき起こしていることが示された.
出芽酵母のTOR複合体2の下流のキナーゼとして,重複した機能をもつYpk1およびYpk2が知られている6).Ypk1およびYpk2の阻害が染色体の断片化に関与しているかどうかを調べるため,YPK2遺伝子の欠損とATPアナログに感受性を示すYPK1遺伝子の変異をもつ二重変異株を用いて,ATPアナログの存在のもと染色体の状態を調べた.その結果,Ypk1およびYpk2の阻害は,NVP-BHS345と同様に,Zeocinの投与との組合せにより染色体の断片化をひき起こしたことから,TOR複合体2からYpk1およびYpk2にいたるシグナル伝達系の阻害が染色体の断片化に関係していることが明らかになった.それでは,Ypk1およびYpk2のどのような機能が染色体の断片化に関係しているのだろうか? Ypk1およびYpk2はアクチン骨格の形成,スフィンゴ脂質の生合成を制御することが知られている6,7)(図1).RNAポリメラーゼIIによる転写の阻害剤であるαアマニチン,アクチン重合の阻害剤であるラトラキュリンA,あるいは,チューブリン重合の阻害剤であるノコダゾールとZeocinとの共投与により染色体の断片化は起こるかどうか調べたところ,ラトランキュリンAとZeocinとをともに作用させた場合に染色体の断片化が観察された.このことは,Ypk1およびYpk2の下流のアクチン骨格の形成の制御と染色体の断片化とが関連していることを示唆した.ラトランキュリンAはアクチン単量体に結合してアクチンファイバーの生成を阻害するが,興味深いことに,アクチンファイバーに結合しこれを安定化するジャスプラキノライドとZeocinとをともに作用させた場合にも染色体の断片化がひき起こされた.アクチンの細胞内における機能の阻害,とくに,アクチンのターンオーバーあるいはダイナミクスの阻害が染色体の断片化の原因になると考えられた.
おわりに
筆者らは,出芽酵母におけるTOR複合体1およびTOR複合体2の阻害剤の発見を手がかりに,TOR複合体2とYpk1およびYpk2を介したアクチン骨格の形成の制御により,DNA鎖の過剰な切断が抑制されることを支持する実験結果を得た(図1).それでは,アクチンの機能の制御とDNA修復とはどのようにかかわっているのだろうか? その分子機構を明らかにすることは今後の研究の重要な課題であるが,考えられるモデルを簡潔に述べたい.アクチンは細胞質と核の両方に存在し,つねにシャトルしていると考えられる8).また,アクチン単量体とアクチンファイバーとの交換反応はダイナミックに行われており,その反応を阻害することにより核におけるアクチンの状態は変化すると考えられる.クロマチンリモデリングタンパク質であるINO80複合体およびSWR1複合体,ヒストンアセチル化酵素NuA4は,構成サブユニットとしてアクチンを含んでいる.これらのタンパク質はDNA二本鎖切断部位にリクルートされDNA修復に関与することが示されており9),アクチンのダイナミクスの阻害がこれらのタンパク質の活性に影響を及ぼすことが推測される.また最近,アクチンファイバーはDNA末端修復タンパク質であるKuに結合しその活性を高めていることが示された10).筆者らによる結果では,DNA二本鎖切断修復機構の阻害が染色体の断片化の原因であることは否定されているが,アクチンが核においてほかのDNA修復機構,たとえば,ZeocinによるDNA酸化損傷によりひき起こされる塩基除去修復などの過程に影響を及ぼしている可能性も考えられ,今後の研究が期待される.もうひとつの課題として,ここで示された出芽酵母におけるTOR複合体2によるアクチンの制御とゲノムの安定性とのかかわりは,ほかの真核生物やヒトにおいても保存されているのかという論点がある.これまでの知見により,高等生物においてもTOR複合体2がDNA修復に関連しているというヒントは得られているが,さらに詳細な解明が期待される.
文 献
- Hustedt, N., Gasser, S. M. & Shimada, K.: Replication checkpoint: tuning and coordination of replication forks in S phase. Genes, 4, 388-434 (2013)
- Loewith, R. & Hall, M. N.: Target of rapamycin (TOR) in nutrient signaling and growth control. Genetics, 189, 1177-1201 (2011)[PubMed]
- Shen, C., Lancaster, C. S., Shi, B. et al.: TOR signaling is a determinant of cell survival in response to DNA damage. Mol. Cell. Biol., 27, 7007-7017 (2007)[PubMed]
- Schonbrun, M., Laor, D., Lopez-Maury, L. et al.: TOR complex 2 controls gene silencing, telomere length maintenance, and survival under DNA-damaging conditions. Mol. Cell. Biol., 29, 4584-4594 (2009)[PubMed]
- Cobb, J. A., Schleker, T., Rojas, V. et al.: Replisome instability, fork collapse, and gross chromosomal rearrangements arise synergistically from Mec1 kinase and RecQ helicase mutations. Genes Dev., 19, 3055-3069 (2005)[PubMed]
- Niles, B. J., Mogri, H., Hill, A. et al.: Plasma membrane recruitment and activation of the AGC kinase Ypk1 is mediated by target of rapamycin complex 2 (TORC2) and its effector proteins Slm1 and Slm2. Proc. Natl. Acad. Sci. USA, 109, 1536-1541 (2012)[PubMed]
- Schmelzle, T., Helliwell, S. B. & Hall, M. N.: Yeast protein kinases and the RHO1 exchange factor TUS1 are novel components of the cell integrity pathway in yeast. Mol. Cell Biol., 22, 1329-1339 (2002)[PubMed]
- Stuven, T., Hartmann, E. & Gorlich, D.: Exportin 6: a novel nuclear export receptor that is specific for profilin.actin complexes. EMBO J., 22, 5928-5940 (2003)[PubMed]
- van Attikum, H. & Gasser, S. M.: Crosstalk between histone modifications during the DNA damage response. Trends Cell Biol., 19, 207-217 (2009)[PubMed]
- Andrin, C., McDonald, D., Attwood, K. M. et al.: A requirement for polymerized actin in DNA double-strand break repair. Nucleus, 3, 384-395 (2012)[PubMed]
著者プロフィール
略歴:1997年 東北大学大学院農学研究科 修了,1998年 スイスInstitute for Experimental Cancer Researchポストドクトラルフェロー,2004年 スイスFriedrich Miescher Institute for Biomedical Researchポストドクトラルアシスタントを経て,2007年より同 プロジェクトリーダー.
研究テーマ:DNA複製,DNA損傷チェックポイント,DNA修復機構.
関心事:DNA複製フォークがDNA損傷に面した際の反応,また,DNA損傷チェックポイントがいかにDNA複製フォークのリスタートにかかわっているか.核においてアクチンの関与するDNA修復機構.
Susan M. Gasser
スイスFriedrich Miescher Institute for Biomedical Research所長.
研究室URL:http://www.fmi.ch/research/groupleader/website/gasserlab/
© 2013 島田健士・Susan M. Gasser Licensed under CC 表示 2.1 日本