酵素と基質との相互作用に対するシミュレーションをオペロンに適用することによるタンパク質の機能および代謝経路の解明
酒井 綾乃
(米国Illinois大学Urbana-Champaign校Institute for Genomic Biology)
email:酒井綾乃
DOI: 10.7875/first.author.2013.126
Discovery of new enzymes and metabolic pathways by using structure and genome context.
Suwen Zhao, Ritesh Kumar, Ayano Sakai, Matthew W. Vetting, B. McKay Wood, Shoshana Brown, Jeffery B. Bonanno, Brandan S. Hillerich, Ronald D. Seidel, Patricia C. Babbitt, Steven C. Almo, Jonathan V. Sweedler, John A. Gerlt, John E. Cronan, Matthew P. Jacobson
Nature, 502, 698-702 (2013)
同じ代謝経路にある複数のタンパク質にメタボライトドッキング法を適用した結果,これまで報告のなかったヒドロキシプロリンベタイン-2-エピメラーゼという酵素,および,ヒドロキシプロリンベタインをαケトグルタル酸へと異化する代謝経路が解明された.機能が未解明でありリガンドとの結合のないタンパク質のX線結晶構造回折法により決定された構造とともに,相同性モデリング法により決定した構造から,ヒドロキシプロリンベタイン-2-エピメラーゼの機能,および,その代謝経路の下流に存在する酵素の機能を解明することに成功した.
ゲノム解析により見い出だされた新規のタンパク質の機能をin silico解析のみにたより推測することは,データベースによる機械的なアノテーションにおけるエラーの問題もあり,いまだ大きな課題である1).これまでの筆者らの研究において2),X線結晶構造回折法あるいは相同性モデリング法によるタンパク質の立体構造に対し3,4),メタボライトドッキング法という酵素と基質との相互作用のシミュレーションにより,タンパク質の機能をより正確に予測する方法を確立させてきた5).細菌のゲノムではオペロンとよばれる遺伝子の集合体にコードされるタンパク質が一連の代謝経路を担うことがよく確認されており,このオペロンがタンパク質の機能を知るうえで重要な手がかりとなりうることは周知である.代謝経路において産生する中間体は化学構造が類似しているため,一連の代謝経路に関与していると考えられるオペロンにコードされる複数のタンパク質に対しこのメタボライトドッキング法を適用することにより,コンピューターによる機能予測の精度をあげることが可能と考えられた.
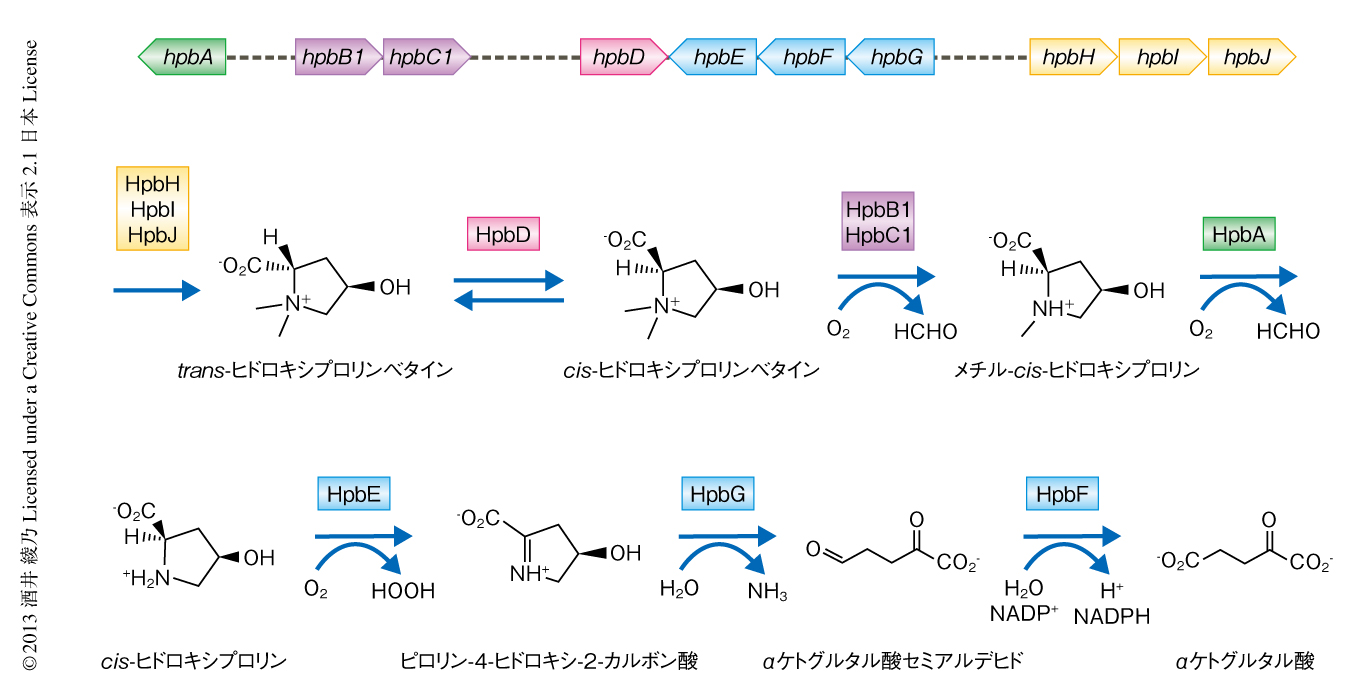
海洋性細菌Pelagibaca bermudensisのもつエノラーゼスーパーファミリー6) に属する機能の未解明のタンパク質HpbDは,TIMバレル構造をとり活性中心には2つのLysがあることがわかっていて,また,その立体構造はすでに解明されていた(PDB ID:2PMQ).しかし,その活性部位には,触媒反応によるαプロトンの除去ののち,陰電荷を帯びたエノラーゼ反応中間体を安定化させるMg2+が認められるだけで,機能の解明のための手がかりは得られないでいた.HpbDをコードするhpbDを含むオペロン(図1)については,機械的にアノテーションされたデータベースであるTrEMBLによる予測では,in vitroにおける機能も,また,その代謝経路も決定することは不可能であった.P. bermudensisは遺伝子操作が不可能であったため,土壌細菌であり類似のオペロンをもつParacoccus denitrificansを使い研究を進めることにした.このP. denitrificansにはhpbDのオルソログの遺伝子とP. bermudensisのhpbD遺伝子に近接する遺伝子のオルソログの遺伝子からなるオペロンの存在が確認された.
KEGGメタボライトライブラリー7) に登録されている化学物質だけでなく,エノラーゼスーパーファミリーの基質であるジペプチド,N-サクシニルアミノ酸,酸性糖,また,高エネルギー物質であるエノラーゼ反応中間体を含む87,098種の物質を含む基質のライブラリーを用いて,HpbDの活性部位に対しメタボライトドッキング法を適用した.結合アフィニティーの結果によりスコアを定めたところ,上位にはアミノ酸に類似した物質,とくに,プロリン類似物質とアミノ基修飾のあるアミノ酸がランクインした.この結果により,HpbDはアミノ基修飾されたアミノ酸のラセマーゼあるいはエピメラーゼであると推測された.
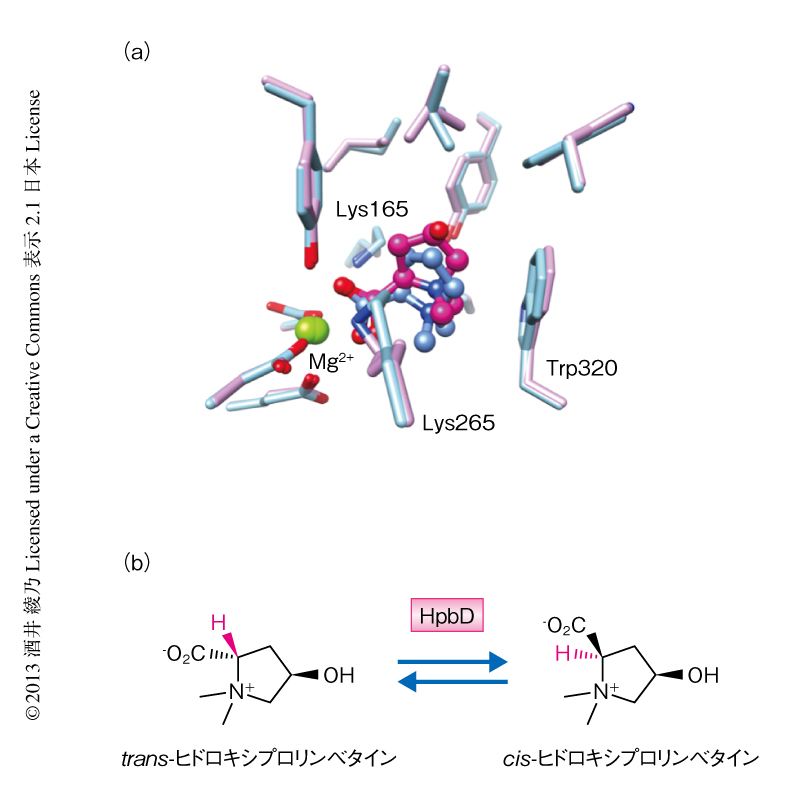
グリシンベタインおよびプロリンと結合すると推測されたABCトランスポーターであるHpbJの遺伝子もこのオペロンに確認された.相同性モデリング法により,このHpbJの構造を48%の相同性を示すグリシンベタイン結合タンパク質(PDB ID:1R9L)をモデルとして作製したところ,その活性部位においてベタインの陽電荷を帯びたアンモニウム基をπ陽イオンの相互作用でかこむよう3つのTrpが位置していたようすから,ベタインが基質である可能性があると思われた.ベタインと似た31の化合物を収集してこのモデルに対し新たにメタボライトドッキング法を適用したところ,trans-ヒドロキシプロリンベタインが高いスコアを示したためHpbJはその輸送に関与すると推測された.また,HpbDの活性部位にはこのHpbJのモデルと同様にTrpが確認されたため(図2a),HpbDの基質もtrans-ヒドロキシプロリンベタインのようなプロリンベタインであろうと推測された.
HpbB1と60%の相同性を示すタンパク質(PDB ID:3N0Q)をモデルとし,相同性モデリング法によりHpbB1の構造を求めた.HpbB1にはベタイン結合タンパク質にみられる特徴のある活性部位が確認された.また実際に,HpbB1の属するRieske型タンパク質のメンバーにはベタインの脱メチル化活性が報告されている.これらの情報より,HpbB1の基質もベタインであると推測した.
X線結晶構造回折法によるHpbDのアポ構造(PDB ID:2PMQ)と,相同性モデリング法により作製したHpbJおよびHpbB1の構造に対し適用したメタボライトドッキング法の結果から,HpbDはヒドロキシプロリンベタインおよびプロリンベタインに対し1,1-プロトン交換反応を行うものと推測した.グリシンベタインおよびカルニチンも同じく基質になりうるという結果も得られたが,この2つのアミノ酸は光学的に不活性なためプロトン交換反応ののち基質と産物とで変化は観察できない.
trans-ヒドロキシプロリンベタイン,プロリンベタイン,グリシンベタイン,カルニチンの4つのアミノ酸をHpbDとともに重水においてインキュベーションした.trans-ヒドロキシプロリンベタイン,プロリンベタイン,グリシンベタインのαプロトンは溶媒の重水素と交換されたことがプロトンNMR法により確かめられた.それにくわえ,trans-ヒドロキシプロリンベタインの2-エピマー異性体であるcis-ヒドロキシプロリンベタインも,trans-ヒドロキシプロリンベタインとHpbDとの反応において確認された(図2b).これらは,活性部位に位置する2つのLysの2位炭素における1,1-プロトン交換によるものであった.
trans-ヒドロキシプロリンベタインおよびプロリンベタインを用いてHpbDのヒドロキシプロリンベタイン-2-エピメラーゼ活性およびプロリンベタイン-2-ラセマーゼ活性について酵素反応速度を測定した.kcat値は高かったがKm値も高かったため,触媒効率kcat/Kmは102~103 M-1 s-1であった.海洋性細菌や植物寄生性細菌は周辺の環境によりtrans-ヒドロキシプロリンベタインを含むベタインを浸透圧の制御物質として必要とするため,ベタインは細胞内において高濃度に維持されている8).0.5 M NaClおよび20 mM trans-ヒドロキシプロリンベタインを含むグルコース培養において,P. denitrificansの細胞内におけるヒドロキシプロリンベタインの濃度は170 mMであった.このような高濃度のtrans-ヒドロキシプロリンベタインの存在する細胞内においては,HpbDによる触媒効率の測定値も生理学的に妥当であると考えられた.実験はtrans-ヒドロキシプロリンベタイン,プロリンベタイン,グリシンベタイン,カルニチンの4つのアミノ酸に対してのみ行ったが,そのうち2つが生理学的に妥当な測定値を示したことから,このメタボライトドッキング法は酵素の機能を的確に予測したものと考えられた.
trans-ヒドロキシプロリンベタインがリガンドとして結合したHpbDの構造を分解能1.7Åで解明した(PDB ID:4H2H,図2a).リガンドは電子密度からtrans-ヒドロキシプロリンベタイン(基質)とcis-ヒドロキシプロリンベタイン(産物)との混合物であると推測された.この活性部位に確認されるベタインは,グリシンベタイン結合タンパク質と似たようなTrp320とのπ陽イオンの相互作用を示した.活性部位にプロリンベタインの結合したメタボライトドッキング法による結果と,実際のX線結晶構造回折法により確認された結合とはほぼ同じであり,コンピューターによる予測は正しかったことが確認された.
in vitroにおいてだけではなく,in vivoにおいてもHpbDはtrans-ヒドロキシプロリンベタインからcis-ヒドロキシプロリンベタインへのエピマー化を触媒しているのではないか,また,この反応はhpbDに近接する遺伝子とともにtrans-ヒドロキシプロリンベタインからαケトグルタル酸への代謝経路の最初の反応を担っているのではないかと推測した.この代謝経路は,HpbDによるエピマー化につづき,HpbB1およびHpbC1がcis-ヒドロキシプロリンベタインをメチル-cis-ヒドロキシプロリンへと脱メチル化し,フラビン依存性酵素であるHpbAがメチル-cis-ヒドロキシプロリンをcis-ヒドロキシプロリンへと変換して,D-アミノ酸酸化酵素であるHpbEがcis-ヒドロキシプロリンをピロリン-4-ヒドロキシ-2-カルボン酸へと酸化,ジヒドロジピコリン酸シンターゼスーパーファミリーのメンバーである酵素HpbGがαケトグルタル酸セミアルデヒドへの脱水反応を担い,そして,アルデヒドデヒドロゲナーゼがαケトグルタル酸セミアルデヒドをαケトグルタル酸へと酸化するものである(図1).この代謝経路は,trans-ヒドロキシプロリンベタインの炭素源および窒素源としての利用を可能にする.
海水の塩濃度は0.6 M NaClであるが,そのような高い塩濃度においては細胞内における浸透圧の制御のためにtrans-ヒドロキシプロリンベタインが必要とされ,その異化反応は抑制されるはずである.しかし反対に,そのような浸透圧の制御が必要とされないのであれば,trans-ヒドロキシプロリンベタインは代謝の対象となり細菌の炭素源および窒素源となる.ここまでのオペロンの解析による仮説が正しければ,低い塩濃度においてはtrans-ヒドロキシプロリンベタインおよびcis-ヒドロキシプロリンベタインがP. denitrificansの炭素源および窒素源となるはずである.さらに,グルコースを炭素源として補給してやれば,高い塩濃度においてtrans-ヒドロキシプロリンベタインが浸透圧の制御物質として使われたとしてもP. denitrificansの増殖は抑制されないだろう.この仮説を確かめるため,hpbA遺伝子を欠損した変異株を用いた.このhpbA変異株はメチルヒドロキシプロリンベタインの異性体を脱メチル化できないため,trans-ヒドロキシプロリンベタインおよびcis-ヒドロキシプロリンベタインを炭素源とできない.hpbA変異株はtrans-ヒドロキシプロリンベタインあるいはcis-ヒドロキシプロリンベタインのどちらかを含むグルコース培地では塩濃度にかかわらず増殖が可能であったが,trans-ヒドロキシプロリンベタインおよびcis-ヒドロキシプロリンベタインのどちらも含まないグルコース培地において,高い塩濃度のもとでは増殖が抑制された.この結果から,trans-ヒドロキシプロリンベタインおよびcis-ヒドロキシプロリンベタインが浸透圧の制御物質としての役割をはたしていることが明らかになった.
低い塩濃度におけるtrans-ヒドロキシプロリンベタインの異化反応から得られる代謝産物も,メタボローム解析により解明された.この解析により,ヒドロキシプロリンベタインのほか,メチルヒドロキシプロリン,ヒドロキシプロリン,そして,推測された代謝経路の下流に存在するピロリン-4-ヒドロキシ-2-カルボン酸,αケトグルタル酸セミアルデヒド,αケトグルタル酸が確認された.これらの代謝産物はコハク酸を炭素源として用いた場合は検出されなかった.また,高い塩濃度におけるグルコース培養においては,trans-ヒドロキシプロリンベタインの濃度を170 mMとしてもtrans-ヒドロキシプロリンベタインの異化反応により生じるこれらの代謝産物は検出されなかった.この結果からも,trans-ヒドロキシプロリンベタインが浸透圧の制御物質として必要であるときには,この代謝経路は抑制されることが判明した.
定量的RT-PCR法によりP. denitrificansにおいてこの代謝経路にかかわる遺伝子の発現を解析したところ,trans-ヒドロキシプロリンベタインの輸送を担うオルソログの遺伝子と,この代謝経路に関与するオルソログの遺伝子は,trans-ヒドロキシプロリンベタインおよびcis-ヒドロキシプロリンベタインにより発現が上昇することが確認された.これらの結果より,hpbDを含むオペロンがこの代謝経路に関係していることが明らかになった.
同様の実験を高い塩濃度においてtrans-ヒドロキシプロリンベタインあるいはcis-ヒドロキシプロリンベタインの一方とグルコースによる培養のもと行ったところ,trans-ヒドロキシプロリンベタインの輸送を担うHpbHおよびHpbJの発現の上昇が確認されると同時に,ヒドロキシプロリンベタインの2-エピマー化を担うHpbD,cis-ヒドロキシプロリンベタインの脱メチル化を担うHpbB1およびHpbC1,メチルヒドロキシプロリンの脱メチル化を担うHpbAの遺伝子は発現が抑制された.この結果は,trans-ヒドロキシプロリンベタインおよびcis-ヒドロキシプロリンベタインの輸送は炭素源および窒素源の補給と同時に,浸透圧の制御物質として機能する際にも必要であることを示しており,異化反応の下流の遺伝子とは異なり,高い塩濃度においてもtrans-ヒドロキシプロリンベタインの輸送を担うHpbHおよびHpbJの発現は上昇した.
この研究においては,遺伝子がオペロンを構成する複数のタンパク質に相同性モデリング法およびメタボライトドッキング法を適用することにより,機能の未知であったタンパク質HpbDについてヒドロキシプロリンベタイン-2-エピメラーゼという新規の機能を解明することに成功した.また,このHpbDの属するスーパーファミリーのもつ触媒反応の特徴から,cis-ヒドロキシプロリンベタインからαケトグルタル酸への代謝経路の存在を推測し,メタボローム解析とゲノム解析からこれらの仮説が実際の機能と合致することを証明した.さらに,トランスクリプトーム解析によりHpbDがtrans-ヒドロキシプロリンベタインを浸透圧の制御物質として利用するか,あるいは,炭素源および窒素源として利用するかを制御するスイッチとして機能することも明らかにした.
略歴:2009年 米国Illinois大学Urbana-Champaign校にて博士号取得,同年 同Postdoctoral Research Fellow,2011年より同Research Specialist.
研究テーマ:新規の酵素の機能をin silico解析からより正確に推測するアルゴリズムをつくりあげること,また,酵素の反応機構とその進化の過程を解明することによりタンパク質工学にその結果を応用していくこと.
© 2013 酒井 綾乃 Licensed under CC 表示 2.1 日本
(米国Illinois大学Urbana-Champaign校Institute for Genomic Biology)
email:酒井綾乃
DOI: 10.7875/first.author.2013.126
Discovery of new enzymes and metabolic pathways by using structure and genome context.
Suwen Zhao, Ritesh Kumar, Ayano Sakai, Matthew W. Vetting, B. McKay Wood, Shoshana Brown, Jeffery B. Bonanno, Brandan S. Hillerich, Ronald D. Seidel, Patricia C. Babbitt, Steven C. Almo, Jonathan V. Sweedler, John A. Gerlt, John E. Cronan, Matthew P. Jacobson
Nature, 502, 698-702 (2013)
要 約
同じ代謝経路にある複数のタンパク質にメタボライトドッキング法を適用した結果,これまで報告のなかったヒドロキシプロリンベタイン-2-エピメラーゼという酵素,および,ヒドロキシプロリンベタインをαケトグルタル酸へと異化する代謝経路が解明された.機能が未解明でありリガンドとの結合のないタンパク質のX線結晶構造回折法により決定された構造とともに,相同性モデリング法により決定した構造から,ヒドロキシプロリンベタイン-2-エピメラーゼの機能,および,その代謝経路の下流に存在する酵素の機能を解明することに成功した.
はじめに
ゲノム解析により見い出だされた新規のタンパク質の機能をin silico解析のみにたより推測することは,データベースによる機械的なアノテーションにおけるエラーの問題もあり,いまだ大きな課題である1).これまでの筆者らの研究において2),X線結晶構造回折法あるいは相同性モデリング法によるタンパク質の立体構造に対し3,4),メタボライトドッキング法という酵素と基質との相互作用のシミュレーションにより,タンパク質の機能をより正確に予測する方法を確立させてきた5).細菌のゲノムではオペロンとよばれる遺伝子の集合体にコードされるタンパク質が一連の代謝経路を担うことがよく確認されており,このオペロンがタンパク質の機能を知るうえで重要な手がかりとなりうることは周知である.代謝経路において産生する中間体は化学構造が類似しているため,一連の代謝経路に関与していると考えられるオペロンにコードされる複数のタンパク質に対しこのメタボライトドッキング法を適用することにより,コンピューターによる機能予測の精度をあげることが可能と考えられた.
1.hpbDを含むオペロンの解析
海洋性細菌Pelagibaca bermudensisのもつエノラーゼスーパーファミリー6) に属する機能の未解明のタンパク質HpbDは,TIMバレル構造をとり活性中心には2つのLysがあることがわかっていて,また,その立体構造はすでに解明されていた(PDB ID:2PMQ).しかし,その活性部位には,触媒反応によるαプロトンの除去ののち,陰電荷を帯びたエノラーゼ反応中間体を安定化させるMg2+が認められるだけで,機能の解明のための手がかりは得られないでいた.HpbDをコードするhpbDを含むオペロン(図1)については,機械的にアノテーションされたデータベースであるTrEMBLによる予測では,in vitroにおける機能も,また,その代謝経路も決定することは不可能であった.P. bermudensisは遺伝子操作が不可能であったため,土壌細菌であり類似のオペロンをもつParacoccus denitrificansを使い研究を進めることにした.このP. denitrificansにはhpbDのオルソログの遺伝子とP. bermudensisのhpbD遺伝子に近接する遺伝子のオルソログの遺伝子からなるオペロンの存在が確認された.
2.メタボライトドッキング法によるHpbDの基質の特定
KEGGメタボライトライブラリー7) に登録されている化学物質だけでなく,エノラーゼスーパーファミリーの基質であるジペプチド,N-サクシニルアミノ酸,酸性糖,また,高エネルギー物質であるエノラーゼ反応中間体を含む87,098種の物質を含む基質のライブラリーを用いて,HpbDの活性部位に対しメタボライトドッキング法を適用した.結合アフィニティーの結果によりスコアを定めたところ,上位にはアミノ酸に類似した物質,とくに,プロリン類似物質とアミノ基修飾のあるアミノ酸がランクインした.この結果により,HpbDはアミノ基修飾されたアミノ酸のラセマーゼあるいはエピメラーゼであると推測された.
グリシンベタインおよびプロリンと結合すると推測されたABCトランスポーターであるHpbJの遺伝子もこのオペロンに確認された.相同性モデリング法により,このHpbJの構造を48%の相同性を示すグリシンベタイン結合タンパク質(PDB ID:1R9L)をモデルとして作製したところ,その活性部位においてベタインの陽電荷を帯びたアンモニウム基をπ陽イオンの相互作用でかこむよう3つのTrpが位置していたようすから,ベタインが基質である可能性があると思われた.ベタインと似た31の化合物を収集してこのモデルに対し新たにメタボライトドッキング法を適用したところ,trans-ヒドロキシプロリンベタインが高いスコアを示したためHpbJはその輸送に関与すると推測された.また,HpbDの活性部位にはこのHpbJのモデルと同様にTrpが確認されたため(図2a),HpbDの基質もtrans-ヒドロキシプロリンベタインのようなプロリンベタインであろうと推測された.
HpbB1と60%の相同性を示すタンパク質(PDB ID:3N0Q)をモデルとし,相同性モデリング法によりHpbB1の構造を求めた.HpbB1にはベタイン結合タンパク質にみられる特徴のある活性部位が確認された.また実際に,HpbB1の属するRieske型タンパク質のメンバーにはベタインの脱メチル化活性が報告されている.これらの情報より,HpbB1の基質もベタインであると推測した.
X線結晶構造回折法によるHpbDのアポ構造(PDB ID:2PMQ)と,相同性モデリング法により作製したHpbJおよびHpbB1の構造に対し適用したメタボライトドッキング法の結果から,HpbDはヒドロキシプロリンベタインおよびプロリンベタインに対し1,1-プロトン交換反応を行うものと推測した.グリシンベタインおよびカルニチンも同じく基質になりうるという結果も得られたが,この2つのアミノ酸は光学的に不活性なためプロトン交換反応ののち基質と産物とで変化は観察できない.
3.実験によるコンピューター予測の証明
trans-ヒドロキシプロリンベタイン,プロリンベタイン,グリシンベタイン,カルニチンの4つのアミノ酸をHpbDとともに重水においてインキュベーションした.trans-ヒドロキシプロリンベタイン,プロリンベタイン,グリシンベタインのαプロトンは溶媒の重水素と交換されたことがプロトンNMR法により確かめられた.それにくわえ,trans-ヒドロキシプロリンベタインの2-エピマー異性体であるcis-ヒドロキシプロリンベタインも,trans-ヒドロキシプロリンベタインとHpbDとの反応において確認された(図2b).これらは,活性部位に位置する2つのLysの2位炭素における1,1-プロトン交換によるものであった.
trans-ヒドロキシプロリンベタインおよびプロリンベタインを用いてHpbDのヒドロキシプロリンベタイン-2-エピメラーゼ活性およびプロリンベタイン-2-ラセマーゼ活性について酵素反応速度を測定した.kcat値は高かったがKm値も高かったため,触媒効率kcat/Kmは102~103 M-1 s-1であった.海洋性細菌や植物寄生性細菌は周辺の環境によりtrans-ヒドロキシプロリンベタインを含むベタインを浸透圧の制御物質として必要とするため,ベタインは細胞内において高濃度に維持されている8).0.5 M NaClおよび20 mM trans-ヒドロキシプロリンベタインを含むグルコース培養において,P. denitrificansの細胞内におけるヒドロキシプロリンベタインの濃度は170 mMであった.このような高濃度のtrans-ヒドロキシプロリンベタインの存在する細胞内においては,HpbDによる触媒効率の測定値も生理学的に妥当であると考えられた.実験はtrans-ヒドロキシプロリンベタイン,プロリンベタイン,グリシンベタイン,カルニチンの4つのアミノ酸に対してのみ行ったが,そのうち2つが生理学的に妥当な測定値を示したことから,このメタボライトドッキング法は酵素の機能を的確に予測したものと考えられた.
trans-ヒドロキシプロリンベタインがリガンドとして結合したHpbDの構造を分解能1.7Åで解明した(PDB ID:4H2H,図2a).リガンドは電子密度からtrans-ヒドロキシプロリンベタイン(基質)とcis-ヒドロキシプロリンベタイン(産物)との混合物であると推測された.この活性部位に確認されるベタインは,グリシンベタイン結合タンパク質と似たようなTrp320とのπ陽イオンの相互作用を示した.活性部位にプロリンベタインの結合したメタボライトドッキング法による結果と,実際のX線結晶構造回折法により確認された結合とはほぼ同じであり,コンピューターによる予測は正しかったことが確認された.
4.in vivoにおけるHpbDの機能
in vitroにおいてだけではなく,in vivoにおいてもHpbDはtrans-ヒドロキシプロリンベタインからcis-ヒドロキシプロリンベタインへのエピマー化を触媒しているのではないか,また,この反応はhpbDに近接する遺伝子とともにtrans-ヒドロキシプロリンベタインからαケトグルタル酸への代謝経路の最初の反応を担っているのではないかと推測した.この代謝経路は,HpbDによるエピマー化につづき,HpbB1およびHpbC1がcis-ヒドロキシプロリンベタインをメチル-cis-ヒドロキシプロリンへと脱メチル化し,フラビン依存性酵素であるHpbAがメチル-cis-ヒドロキシプロリンをcis-ヒドロキシプロリンへと変換して,D-アミノ酸酸化酵素であるHpbEがcis-ヒドロキシプロリンをピロリン-4-ヒドロキシ-2-カルボン酸へと酸化,ジヒドロジピコリン酸シンターゼスーパーファミリーのメンバーである酵素HpbGがαケトグルタル酸セミアルデヒドへの脱水反応を担い,そして,アルデヒドデヒドロゲナーゼがαケトグルタル酸セミアルデヒドをαケトグルタル酸へと酸化するものである(図1).この代謝経路は,trans-ヒドロキシプロリンベタインの炭素源および窒素源としての利用を可能にする.
海水の塩濃度は0.6 M NaClであるが,そのような高い塩濃度においては細胞内における浸透圧の制御のためにtrans-ヒドロキシプロリンベタインが必要とされ,その異化反応は抑制されるはずである.しかし反対に,そのような浸透圧の制御が必要とされないのであれば,trans-ヒドロキシプロリンベタインは代謝の対象となり細菌の炭素源および窒素源となる.ここまでのオペロンの解析による仮説が正しければ,低い塩濃度においてはtrans-ヒドロキシプロリンベタインおよびcis-ヒドロキシプロリンベタインがP. denitrificansの炭素源および窒素源となるはずである.さらに,グルコースを炭素源として補給してやれば,高い塩濃度においてtrans-ヒドロキシプロリンベタインが浸透圧の制御物質として使われたとしてもP. denitrificansの増殖は抑制されないだろう.この仮説を確かめるため,hpbA遺伝子を欠損した変異株を用いた.このhpbA変異株はメチルヒドロキシプロリンベタインの異性体を脱メチル化できないため,trans-ヒドロキシプロリンベタインおよびcis-ヒドロキシプロリンベタインを炭素源とできない.hpbA変異株はtrans-ヒドロキシプロリンベタインあるいはcis-ヒドロキシプロリンベタインのどちらかを含むグルコース培地では塩濃度にかかわらず増殖が可能であったが,trans-ヒドロキシプロリンベタインおよびcis-ヒドロキシプロリンベタインのどちらも含まないグルコース培地において,高い塩濃度のもとでは増殖が抑制された.この結果から,trans-ヒドロキシプロリンベタインおよびcis-ヒドロキシプロリンベタインが浸透圧の制御物質としての役割をはたしていることが明らかになった.
5.trans-ヒドロキシプロリンベタインの代謝経路の解析
低い塩濃度におけるtrans-ヒドロキシプロリンベタインの異化反応から得られる代謝産物も,メタボローム解析により解明された.この解析により,ヒドロキシプロリンベタインのほか,メチルヒドロキシプロリン,ヒドロキシプロリン,そして,推測された代謝経路の下流に存在するピロリン-4-ヒドロキシ-2-カルボン酸,αケトグルタル酸セミアルデヒド,αケトグルタル酸が確認された.これらの代謝産物はコハク酸を炭素源として用いた場合は検出されなかった.また,高い塩濃度におけるグルコース培養においては,trans-ヒドロキシプロリンベタインの濃度を170 mMとしてもtrans-ヒドロキシプロリンベタインの異化反応により生じるこれらの代謝産物は検出されなかった.この結果からも,trans-ヒドロキシプロリンベタインが浸透圧の制御物質として必要であるときには,この代謝経路は抑制されることが判明した.
6.HpbDの遺伝子スイッチ
定量的RT-PCR法によりP. denitrificansにおいてこの代謝経路にかかわる遺伝子の発現を解析したところ,trans-ヒドロキシプロリンベタインの輸送を担うオルソログの遺伝子と,この代謝経路に関与するオルソログの遺伝子は,trans-ヒドロキシプロリンベタインおよびcis-ヒドロキシプロリンベタインにより発現が上昇することが確認された.これらの結果より,hpbDを含むオペロンがこの代謝経路に関係していることが明らかになった.
同様の実験を高い塩濃度においてtrans-ヒドロキシプロリンベタインあるいはcis-ヒドロキシプロリンベタインの一方とグルコースによる培養のもと行ったところ,trans-ヒドロキシプロリンベタインの輸送を担うHpbHおよびHpbJの発現の上昇が確認されると同時に,ヒドロキシプロリンベタインの2-エピマー化を担うHpbD,cis-ヒドロキシプロリンベタインの脱メチル化を担うHpbB1およびHpbC1,メチルヒドロキシプロリンの脱メチル化を担うHpbAの遺伝子は発現が抑制された.この結果は,trans-ヒドロキシプロリンベタインおよびcis-ヒドロキシプロリンベタインの輸送は炭素源および窒素源の補給と同時に,浸透圧の制御物質として機能する際にも必要であることを示しており,異化反応の下流の遺伝子とは異なり,高い塩濃度においてもtrans-ヒドロキシプロリンベタインの輸送を担うHpbHおよびHpbJの発現は上昇した.
おわりに
この研究においては,遺伝子がオペロンを構成する複数のタンパク質に相同性モデリング法およびメタボライトドッキング法を適用することにより,機能の未知であったタンパク質HpbDについてヒドロキシプロリンベタイン-2-エピメラーゼという新規の機能を解明することに成功した.また,このHpbDの属するスーパーファミリーのもつ触媒反応の特徴から,cis-ヒドロキシプロリンベタインからαケトグルタル酸への代謝経路の存在を推測し,メタボローム解析とゲノム解析からこれらの仮説が実際の機能と合致することを証明した.さらに,トランスクリプトーム解析によりHpbDがtrans-ヒドロキシプロリンベタインを浸透圧の制御物質として利用するか,あるいは,炭素源および窒素源として利用するかを制御するスイッチとして機能することも明らかにした.
文 献
- Schnoes, A. M., Brown, S. D., Dodevski, I. et al.: Annotation error in public databases: misannotation of molecular function in enzyme superfamilies. PLOS Comput. Biol., 5, e1000605 (2009)[PubMed]
- Gerlt, J. A., Allen, K. N., Almo, S. C. et al.: The Enzyme Function Initiative. Biochemistry, 50, 9950-9962 (2011)[PubMed]
- Hermann, J. C., Marti-Arbona, R., Fedorov, A. A. et al.: Structure-based activity prediction for an enzyme of unknown function. Nature, 448, 775-779 (2007)[PubMed]
- Song, L., Kalyanaraman, C., Fedorov, A. A. et al.: Prediction and assignment of function for a divergent N-succinyl amino acid racemase. Nat. Chem. Biol., 3, 486-491 (2007)[PubMed]
- Kalyanaraman, C. & Jacobson, M. P.: Studying enzyme-substrate specificity in silico: a case study of the Escherichia coli glycolysis pathway. Biochemistry, 49, 4003-4005 (2010)[PubMed]
- Babbitt, P. C., Hasson, M. S., Wedekind, J. E. et al.: The enolase superfamily: a general strategy for enzymecatalyzed abstraction of the a-protons of carboxylic acids. Biochemistry, 35, 16489-16501 (1996)[PubMed]
- Tanabe, M. & Kanehisa, M.: Using the KEGG database resource. Curr. Protoc. Bioinformatics, Chapter 1:Unit1.12 (2012)[PubMed]
- Hermann, J. C., Ghanem, E., Li, Y. et al.: Predicting substrates bydockinghigh-energy intermediates to enzyme structures. J. Am. Chem. Soc., 128, 15882-15891 (2006)[PubMed]
著者プロフィール
略歴:2009年 米国Illinois大学Urbana-Champaign校にて博士号取得,同年 同Postdoctoral Research Fellow,2011年より同Research Specialist.
研究テーマ:新規の酵素の機能をin silico解析からより正確に推測するアルゴリズムをつくりあげること,また,酵素の反応機構とその進化の過程を解明することによりタンパク質工学にその結果を応用していくこと.
© 2013 酒井 綾乃 Licensed under CC 表示 2.1 日本