シロイヌナズナにおけるヒドロキシプロリン・アラビノシル化酵素の同定
小川 (大西) 真理・松林嘉克
(基礎生物学研究所 細胞間シグナル研究部門)
email:小川 (大西) 真理,松林嘉克
DOI: 10.7875/first.author.2013.125
Identification of three hydroxyproline O-arabinosyltransferases in Arabidopsis thaliana.
Mari Ogawa-Ohnishi, Wataru Matsushita, Yoshikatsu Matsubayashi
Nature Chemical Biology, 9, 726-730 (2013)
ヒドロキシプロリン残基にアラビノース糖鎖を付加するO-アラビノシル化修飾は,細胞外ペプチドおよび細胞外タンパク質にしばしば見い出される,植物に特異的な翻訳後修飾のひとつである.アラビノース糖鎖の付加は,ペプチドあるいはタンパク質の骨格のコンホメーション変化をつうじ生理機能に大きな影響をあたえる.しかし,O-アラビノシル化修飾が最初に見い出されてから50年をむかえようとしているにもかかわらず,ヒドロキシプロリン残基の水酸基にL-アラビノースを付加する酵素,ヒドロキシプロリン-O-アラビノシル化酵素の実体は明らかになっていなかった.筆者らは,シロイヌナズナ培養細胞に由来する膜画分を可溶化したものから,基質となるペプチドを固定化したアフィニティーカラムを用いてヒドロキシプロリン-O-アラビノシル化酵素を精製し同定することに成功した.ヒドロキシプロリン-O-アラビノシル化酵素はゴルジ体に局在する約42 kDaの比較的小さな膜タンパク質であり,植物体の全体において発現がみられたが,1次配列そのものは既知のどの糖転移酵素とも類似性はなかった.ヒドロキシプロリン-O-アラビノシル化酵素の遺伝子はシロイヌナズナにおいて3つ存在し,それらを欠損させると組合せにより,胚軸の徒長,細胞壁の薄化,花成の促進,葉の老化の促進,花粉管の伸長の異常など,さまざまな表現型が観察された.三重変異株は花粉管の伸長異常のためホモ接合変異株を単離できなかった.これらの結果は,O-アラビノシル化ペプチドあるいはO-アラビノシル化タンパク質が植物の栄養成長および生殖成長のどちらにも重要であることを示した.
ヒドロキシプロリン残基は動物あるいは植物をとわず細胞外に分泌されるタンパク質に多く存在する翻訳後修飾アミノ酸残基であるが,植物ではヒドロキシプロリン残基にさらに五炭糖の一種であるL-アラビノースの付加する事例が多く報告されている.O-アラビノシル化タンパク質は1960年代に細胞壁のアルカリ加水分解物においてはじめて発見され1),そののちの生化学的および分子生物学的な研究により,このO-アラビノシル化修飾はヒドロキシプロリンリッチ糖タンパク質と総称されるタンパク質2) において顕著にみられることが明らかになった.ヒドロキシプロリンリッチ糖タンパク質のおもなものはエクステンシン,プロリンリッチタンパク質,アラビノガラクタンタンパク質などの細胞外タンパク質であり,植物の栄養成長や分化,細胞壁の形成や細胞の増殖,細胞の伸長や細胞間シグナル伝達など,生命活動の多様な場面にかかわることが知られている.こうしたタンパク質のなかでも,とくにエクステンシンはしばしばアラビノース糖鎖が重量の約半分にも達し,タンパク質骨格の機能的な立体コンホメーションの維持に非常に重要な役割をはたしていると考えられている3).また,O-アラビノシル化修飾は幹細胞数の制御4) や共生5),細胞の増殖,防御応答などにかかわる分泌型のペプチドシグナルにおいてもいくつか報告されている.これらのペプチドにおいてもまた,O-アラビノシル化修飾は立体構造の維持に貢献しており,生物学的な機能や受容体との結合活性に影響をあたえている6).
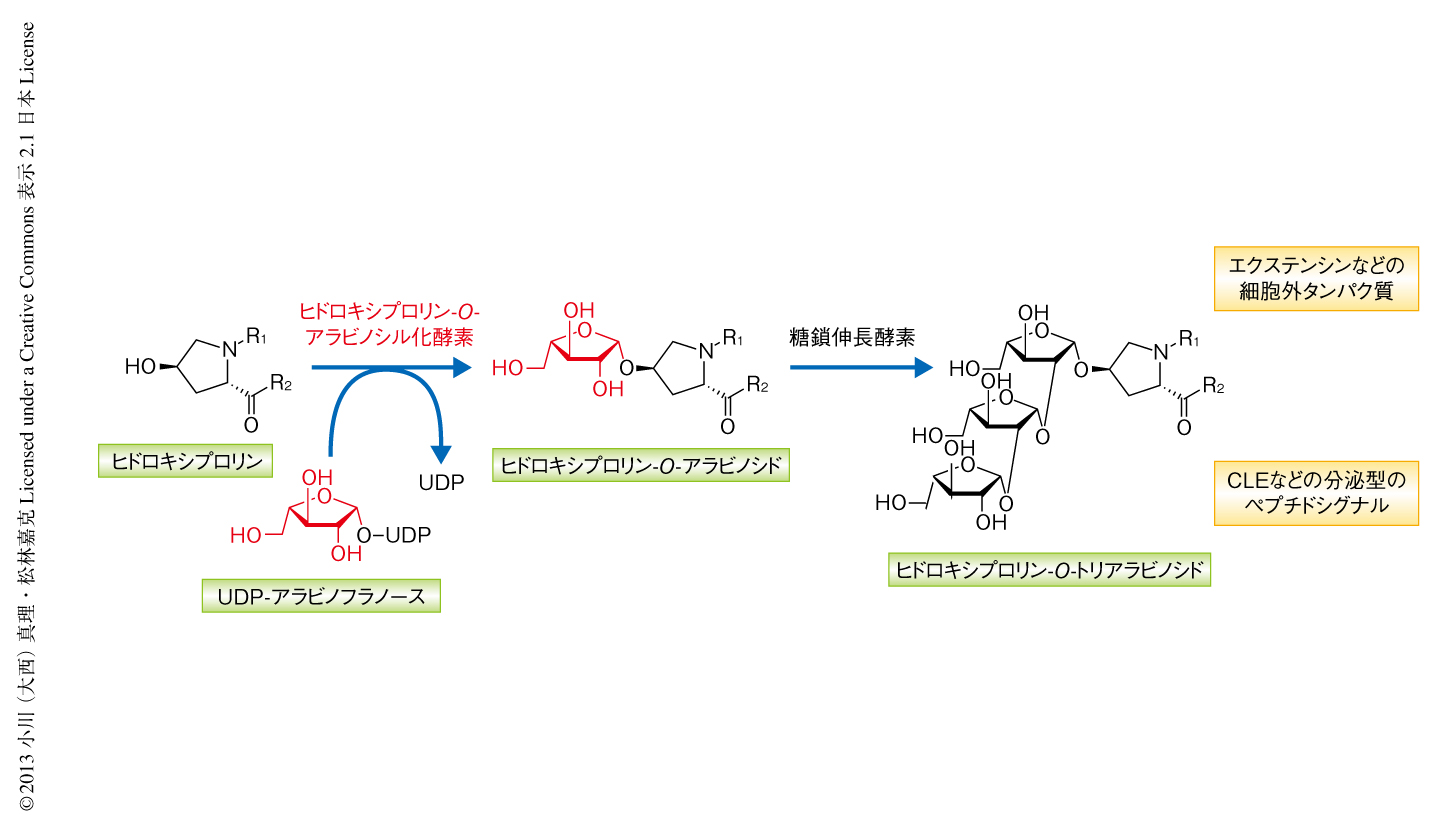
ヒドロキシプロリン残基のO-アラビノシル化修飾は,最初にL-アラビノースがヒドロキシプロリン残基の水酸基にβ結合により付加したのち,さらにそこにL-アラビノースがβ-1,2結合により付加し,最終的に3残基から4残基のL-アラビノースが直鎖状に連なった構造になる(図1).しかし,O-アラビノシル化修飾の最初のステップであるL-アラビノースをヒドロキシプロリン残基の水酸基へと転移させる酵素,ヒドロキシプロリン-O-アラビノシル化酵素(hydroxyproline-O-arabinosyltransferase:HPAT)の正体は長いあいだ不明のままであった.
ヒドロキシプロリン-O-アラビノシル化酵素はUDP-β-L-アラビノフラノースを糖供与体としてL-アラビノフラノシル残基をヒドロキシプロリン残基の水酸基にβ結合により転移させる酵素と想定されている.筆者らは,シロイヌナズナT-87培養細胞に由来する膜画分を可溶化したものを粗酵素画分としてUDP-β-L-アラビノフラノースと基質ペプチドを反応させ,液体クロマトグラフィー-質量分析計(LC-MS)により基質ペプチドの分子量の変化を調べることによりヒドロキシプロリン-O-アラビノシル化酵素の活性を測定する方法を確立した.ヒドロキシプロリン-O-アラビノシル化酵素を精製するため,まず,PSY1という既知のO-アラビノシル化ペプチドの配列をもとにした合成ペプチドを用いてO-アラビノシル化修飾の最小モチーフを探索した.その結果,Ala-Ala-Ala-Ala-Ala-Ala-Pro-Gly-Val-Hyp-Hyp-Ser(Hyp:ヒドロキシプロリン)が基質となる最短のものであった.また,このペプチドのC末端の6残基を3回くり返したペプチド,(Pro-Gly-Val-Hyp-Hyp-Ser)3がとりわけ高い効率でO-アラビノシル化修飾された.そこで,この合成ペプチドをSepharoseビーズに固定化したアフィニティーカラムを作製し,シロイヌナズナT-87培養細胞に由来する膜画分を可溶化したものからヒドロキシプロリン-O-アラビノシル化酵素の精製を試みた.糖転移酵素はしばしば高濃度のUDPの存在のもと安定な基質-酵素複合体を形成することが知られているが7),今回はこの性質をうまく利用した.高い活性をもつ溶出画分を限外ろ過により濃縮し,SDS-ポリアクリルアミドゲル電気泳動により解析したところ,活性をもつ画分に特異的な42 kDaのバンドが検出された.このバンドをトリプシンにより処理しナノ液体クロマトグラフィー-タンデム質量分析計(nano-LC/MS/MS)により分析した結果,At5g25265およびAt2g25265に由来するペプチドの断片がいくつか検出された.At5g25265とAt2g25265は高い類似性から同じファミリーの一員と考えられ,BLAST検索によりさらにAt5g13500も同じファミリーに属すことがわかった.そこで,これら3つのタンパク質にFLAGタグを付加し出芽酵母において発現させヒドロキシプロリン-O-アラビノシル化酵素の活性を測定したところ,その強さに差はみられたものの,基質として用いた合成ペプチドに対し明確な活性が検出された.この結果は,これら3つのタンパク質こそがシロイヌナズナにおけるヒドロキシプロリン-O-アラビノシル化酵素であることを示していた.At5g25265,At2g25260,At5g13500をそれぞれHPAT1,HPAT2,HPAT3と命名した.
ヒドロキシプロリン-O-アラビノシル化酵素は約40 kDaの比較的小さな膜タンパク質であり,藻類であるクラミドモナスやボルボックスから,シロイヌナズナ,イネにまで保存されていた.これは,O-アラビノシル化修飾が植物界において広く保存されていることを示していた.また,ヒドロキシプロリン-O-アラビノシル化酵素の1次配列は,欠損株が根粒過剰着生の形質を示すエンドウのNOD3やタルウマゴヤシのRDN1の1次配列ときわめて高い類似性を示した8).これまで,明確な表現型を示すにもかかわらず生化学的な機能は未知であったNOD3やRDN1がヒドロキシプロリン-O-アラビノシル化酵素であったという事実は,根粒菌の着生により根粒が形成されはじめると,O-アラビノシル化修飾されたCLEペプチドが根粒形成の抑制シグナルとして分泌され,根粒の数が一定に保たれるという分子機構を解き明かした最近の報告をみごとに裏づけた5).なお,ヒドロキシプロリン-O-アラビノシル化酵素の1次配列そのものは既存のどの糖転移酵素とも類似性を示さなかったが,いくつかの糖転移酵素の結晶構造を考慮した構造分類から,GT8ファミリーに属する可能性が指摘されている9).
ヒドロキシプロリン-O-アラビノシル化酵素の細胞内における局在を調べるため,蛍光タンパク質GFPとの融合タンパク質をシロイヌナズナT-87培養細胞のプロトプラストに一過性に発現させたところ,ゴルジ体において特徴的なドット状のGFPの蛍光がみられた.また,Brefeldin Aによる処理やシスゴルジのマーカーであるSYP31との共発現の結果から,ヒドロキシプロリン-O-アラビノシル化酵素はシスゴルジの側に局在していることが明らかになった.HPAT1遺伝子,HPAT2遺伝子,HPAT3遺伝子のRT-PCR解析では,それぞれシロイヌナズナ植物体の全体における発現が確認された.
HPAT1遺伝子,HPAT2遺伝子,HPAT3遺伝子の植物体における機能を明らかにするため,それぞれのT-DNA挿入変異株を解析した.それぞれの変異株の植物体における基質となる合成ペプチドに対するヒドロキシプロリン-O-アラビノシル化酵素の活性を測定したところ,hpat1-1変異株では活性はかなり減少し,hpat1-1とhpat2-1との二重変異株ではさらに大幅な活性の減少がみられた.一方,hpat3-1変異株では活性に大きな差異は認められなかった.これらの結果は,それぞれの基質特異性の違いを反映していると思われた.
HPAT1遺伝子,HPAT2遺伝子,HPAT3遺伝子の単独での変異株は野生株と見分けがつかなかったが,hpat1-1 hpat2-1二重変異株は野生型に比べ明所でも胚軸が長くなる表現型を示した.また,透過型電子顕微鏡により芽生えの胚軸の部分を観察したところ,hpat1-1 hpat2-1二重変異株では野生株の約半分にまで細胞壁が薄くなることが明らかになった.さらに成長が進んだ段階においては,hpat1-1 hpat2-1二重変異株では花成が早まるとともに葉の老化が促進された.これらの結果は,HPAT1とHPAT2は植物の成長のさまざまな段階において重複して機能していることを示した.
hpat1-1 hpat2-1 hpat3-1三重変異株を得るため,hpat1-1 hpat2-1二重変異株とhpat3-1変異株とを掛け合わせたF2株の遺伝子型を解析した.しかし,500株以上のF2株を解析したにもかかわらず,hpat1-1 hpat2-1 hpat3-1三重変異株もhpat1-1 hpat3-1二重変異株も得られなかった.その原因を探るため,hpat1-1 hpat2-1 hpat3-1三重ヘテロ接合変異株と野生株との掛け合わせをオス側およびメス側をそれぞれ変えて行い,そのF1株の遺伝子型を解析したところ,オス側(花粉側)からはHPAT1遺伝子とHPAT3遺伝子の両方を欠損したものは遺伝しないことが判明した.
hpat1-1 hpat3-1二重変異が花粉の機能にどのような影響を及ぼしているかを調べるため,hpat1-1 hpat3-1二重ヘテロ接合変異株および野生株の花粉をin vitroにおいて培養したところ,どちらの花粉も同じ程度の効率で発芽したが,発芽の16時間のちになると,hpat1-1 hpat3-1二重ヘテロ接合変異株では著しく短い花粉管が多く観察されるようになった.また,in vivoでは,受粉の8時間のちには野生株の花粉管は花柱を通過し花粉管誘導組織にまで到達していたが,hpat1-1 hpat3-1二重ヘテロ接合変異株では多くの花粉管は柱頭あるいは花柱のなかで伸長が停止していた.これらの結果から,hpat1-1 hpat3-1二重変異株は花粉管が正常に伸長できないため雄性不稔を示すことが明らかになった.
冒頭にも述べたように,O-アラビノシル化修飾はヒドロキシプロリンリッチ糖タンパク質およびペプチドシグナルの両方に見い出される.3つあるヒドロキシプロリン-O-アラビノシル化酵素がそれぞれどのような特異性でこれら基質の修飾に関与しているのか,HPAT1遺伝子,HPAT2遺伝子,HPAT3遺伝子の変異株におけるO-アラビノシル化修飾の程度を解析した.
エクステンシンはヒドロキシプロリンリッチ糖タンパク質のなかでもっともO-アラビノシル化修飾の顕著なタンパク質であり,酸化的な架橋により網目状の構造となって細胞壁の形成の足場になると考えられている10).そこで,hpat1-1 hpat2-1二重変異株あるいはhpat3-1変異株からエクステンシンのひとつEXT3を抽出し,アルカリ加水分解によりO-アラビノシル化修飾されたヒドロキシプロリンの量を定量した結果,hpat1-1 hpat2-1二重変異株に由来するEXT3により顕著な減少が認められた.すなわち,EXT3のO-アラビノシル化修飾はおもにHPAT1およびHPAT2により行われていた.一方,ペプチドシグナルの代表として,マメ科植物においてO-アラビノシル化修飾されて根粒形成の抑制シグナルとしてはたらくCLEペプチドに配列がもっとも類似しているシロイヌナズナのCLE2ペプチドに着目した.CLE2遺伝子を過剰に発現させたシロイヌナズナから分泌されたCLE2ペプチドを分析した結果,CLE2ペプチドのO-アラビノシル化修飾はおもにHPAT3により行なわれていることが示された.以上の結果から,3つのヒドロキシプロリン-O-アラビノシル化酵素は重複して機能するものの,それぞれにはある程度の基質特異性のあることが明らかになった.
一般的に,翻訳後修飾はタンパク質の機能に大きな影響をあたえる.翻訳後修飾を失うとタンパク質の本来の機能も完全に失われることが少なくないことから,ヒドロキシプロリン-O-アラビノシル化酵素の欠損株の表現型はO-アラビノシル化タンパク質およびO-アラビノシル化ペプチドの機能が失われている状態を反映しているはずである.したがって,欠損株の表現型からは重複性の壁をこえて未知のO-アラビノシル化タンパク質あるいはO-アラビノシル化ペプチドの機能を垣間みることができる.ヒドロキシプロリン-O-アラビノシル化酵素が同定されたことの真の価値はここにある.
近年,植物において成長や分化,共生,防御応答などさまざまな場面に関係するO-アラビノシル化ペプチドの発見があいついでいるが,はたして,どれくらいのO-アラビノシル化ペプチドが細胞間シグナルとしてはたらいているのか,いまだよくわかっていない.エクステンシンがどのように細胞壁の構築に関係するかについても,謎はまだ多く残されている.ヒドロキシプロリン残基のO-アラビノシル化修飾がみつかってからまもなく50年,待望のヒドロキシプロリン-O-アラビノシル化酵素がようやく同定されたいま,これらの欠損株を用いた解析を端緒として,O-アラビノシル化タンパク質およびO-アラビノシル化ペプチドの機能の解明や新たな因子の発見が期待される.
略歴:基礎生物学研究所 研究員(ポスドクではなくてポスマスです).
研究テーマ:植物成長を制御するシグナル分子の探索と機能.
関心事:応用研究につながる基礎研究,マラソン,育児,アンチエイジング.
松林 嘉克(Yoshikatsu Matsubayashi)
基礎生物学研究所 教授.
研究室URL:http://www.nibb.ac.jp/ligand/
© 2013 小川 (大西) 真理・松林嘉克 Licensed under CC 表示 2.1 日本
(基礎生物学研究所 細胞間シグナル研究部門)
email:小川 (大西) 真理,松林嘉克
DOI: 10.7875/first.author.2013.125
Identification of three hydroxyproline O-arabinosyltransferases in Arabidopsis thaliana.
Mari Ogawa-Ohnishi, Wataru Matsushita, Yoshikatsu Matsubayashi
Nature Chemical Biology, 9, 726-730 (2013)
要 約
ヒドロキシプロリン残基にアラビノース糖鎖を付加するO-アラビノシル化修飾は,細胞外ペプチドおよび細胞外タンパク質にしばしば見い出される,植物に特異的な翻訳後修飾のひとつである.アラビノース糖鎖の付加は,ペプチドあるいはタンパク質の骨格のコンホメーション変化をつうじ生理機能に大きな影響をあたえる.しかし,O-アラビノシル化修飾が最初に見い出されてから50年をむかえようとしているにもかかわらず,ヒドロキシプロリン残基の水酸基にL-アラビノースを付加する酵素,ヒドロキシプロリン-O-アラビノシル化酵素の実体は明らかになっていなかった.筆者らは,シロイヌナズナ培養細胞に由来する膜画分を可溶化したものから,基質となるペプチドを固定化したアフィニティーカラムを用いてヒドロキシプロリン-O-アラビノシル化酵素を精製し同定することに成功した.ヒドロキシプロリン-O-アラビノシル化酵素はゴルジ体に局在する約42 kDaの比較的小さな膜タンパク質であり,植物体の全体において発現がみられたが,1次配列そのものは既知のどの糖転移酵素とも類似性はなかった.ヒドロキシプロリン-O-アラビノシル化酵素の遺伝子はシロイヌナズナにおいて3つ存在し,それらを欠損させると組合せにより,胚軸の徒長,細胞壁の薄化,花成の促進,葉の老化の促進,花粉管の伸長の異常など,さまざまな表現型が観察された.三重変異株は花粉管の伸長異常のためホモ接合変異株を単離できなかった.これらの結果は,O-アラビノシル化ペプチドあるいはO-アラビノシル化タンパク質が植物の栄養成長および生殖成長のどちらにも重要であることを示した.
はじめに
ヒドロキシプロリン残基は動物あるいは植物をとわず細胞外に分泌されるタンパク質に多く存在する翻訳後修飾アミノ酸残基であるが,植物ではヒドロキシプロリン残基にさらに五炭糖の一種であるL-アラビノースの付加する事例が多く報告されている.O-アラビノシル化タンパク質は1960年代に細胞壁のアルカリ加水分解物においてはじめて発見され1),そののちの生化学的および分子生物学的な研究により,このO-アラビノシル化修飾はヒドロキシプロリンリッチ糖タンパク質と総称されるタンパク質2) において顕著にみられることが明らかになった.ヒドロキシプロリンリッチ糖タンパク質のおもなものはエクステンシン,プロリンリッチタンパク質,アラビノガラクタンタンパク質などの細胞外タンパク質であり,植物の栄養成長や分化,細胞壁の形成や細胞の増殖,細胞の伸長や細胞間シグナル伝達など,生命活動の多様な場面にかかわることが知られている.こうしたタンパク質のなかでも,とくにエクステンシンはしばしばアラビノース糖鎖が重量の約半分にも達し,タンパク質骨格の機能的な立体コンホメーションの維持に非常に重要な役割をはたしていると考えられている3).また,O-アラビノシル化修飾は幹細胞数の制御4) や共生5),細胞の増殖,防御応答などにかかわる分泌型のペプチドシグナルにおいてもいくつか報告されている.これらのペプチドにおいてもまた,O-アラビノシル化修飾は立体構造の維持に貢献しており,生物学的な機能や受容体との結合活性に影響をあたえている6).
ヒドロキシプロリン残基のO-アラビノシル化修飾は,最初にL-アラビノースがヒドロキシプロリン残基の水酸基にβ結合により付加したのち,さらにそこにL-アラビノースがβ-1,2結合により付加し,最終的に3残基から4残基のL-アラビノースが直鎖状に連なった構造になる(図1).しかし,O-アラビノシル化修飾の最初のステップであるL-アラビノースをヒドロキシプロリン残基の水酸基へと転移させる酵素,ヒドロキシプロリン-O-アラビノシル化酵素(hydroxyproline-O-arabinosyltransferase:HPAT)の正体は長いあいだ不明のままであった.
1.シロイヌナズナにおけるヒドロキシプロリン-O-アラビノシル化酵素のアフィニティー精製と同定
ヒドロキシプロリン-O-アラビノシル化酵素はUDP-β-L-アラビノフラノースを糖供与体としてL-アラビノフラノシル残基をヒドロキシプロリン残基の水酸基にβ結合により転移させる酵素と想定されている.筆者らは,シロイヌナズナT-87培養細胞に由来する膜画分を可溶化したものを粗酵素画分としてUDP-β-L-アラビノフラノースと基質ペプチドを反応させ,液体クロマトグラフィー-質量分析計(LC-MS)により基質ペプチドの分子量の変化を調べることによりヒドロキシプロリン-O-アラビノシル化酵素の活性を測定する方法を確立した.ヒドロキシプロリン-O-アラビノシル化酵素を精製するため,まず,PSY1という既知のO-アラビノシル化ペプチドの配列をもとにした合成ペプチドを用いてO-アラビノシル化修飾の最小モチーフを探索した.その結果,Ala-Ala-Ala-Ala-Ala-Ala-Pro-Gly-Val-Hyp-Hyp-Ser(Hyp:ヒドロキシプロリン)が基質となる最短のものであった.また,このペプチドのC末端の6残基を3回くり返したペプチド,(Pro-Gly-Val-Hyp-Hyp-Ser)3がとりわけ高い効率でO-アラビノシル化修飾された.そこで,この合成ペプチドをSepharoseビーズに固定化したアフィニティーカラムを作製し,シロイヌナズナT-87培養細胞に由来する膜画分を可溶化したものからヒドロキシプロリン-O-アラビノシル化酵素の精製を試みた.糖転移酵素はしばしば高濃度のUDPの存在のもと安定な基質-酵素複合体を形成することが知られているが7),今回はこの性質をうまく利用した.高い活性をもつ溶出画分を限外ろ過により濃縮し,SDS-ポリアクリルアミドゲル電気泳動により解析したところ,活性をもつ画分に特異的な42 kDaのバンドが検出された.このバンドをトリプシンにより処理しナノ液体クロマトグラフィー-タンデム質量分析計(nano-LC/MS/MS)により分析した結果,At5g25265およびAt2g25265に由来するペプチドの断片がいくつか検出された.At5g25265とAt2g25265は高い類似性から同じファミリーの一員と考えられ,BLAST検索によりさらにAt5g13500も同じファミリーに属すことがわかった.そこで,これら3つのタンパク質にFLAGタグを付加し出芽酵母において発現させヒドロキシプロリン-O-アラビノシル化酵素の活性を測定したところ,その強さに差はみられたものの,基質として用いた合成ペプチドに対し明確な活性が検出された.この結果は,これら3つのタンパク質こそがシロイヌナズナにおけるヒドロキシプロリン-O-アラビノシル化酵素であることを示していた.At5g25265,At2g25260,At5g13500をそれぞれHPAT1,HPAT2,HPAT3と命名した.
2.ヒドロキシプロリン-O-アラビノシル化酵素の分子系統学的な解析とその発現部位
ヒドロキシプロリン-O-アラビノシル化酵素は約40 kDaの比較的小さな膜タンパク質であり,藻類であるクラミドモナスやボルボックスから,シロイヌナズナ,イネにまで保存されていた.これは,O-アラビノシル化修飾が植物界において広く保存されていることを示していた.また,ヒドロキシプロリン-O-アラビノシル化酵素の1次配列は,欠損株が根粒過剰着生の形質を示すエンドウのNOD3やタルウマゴヤシのRDN1の1次配列ときわめて高い類似性を示した8).これまで,明確な表現型を示すにもかかわらず生化学的な機能は未知であったNOD3やRDN1がヒドロキシプロリン-O-アラビノシル化酵素であったという事実は,根粒菌の着生により根粒が形成されはじめると,O-アラビノシル化修飾されたCLEペプチドが根粒形成の抑制シグナルとして分泌され,根粒の数が一定に保たれるという分子機構を解き明かした最近の報告をみごとに裏づけた5).なお,ヒドロキシプロリン-O-アラビノシル化酵素の1次配列そのものは既存のどの糖転移酵素とも類似性を示さなかったが,いくつかの糖転移酵素の結晶構造を考慮した構造分類から,GT8ファミリーに属する可能性が指摘されている9).
ヒドロキシプロリン-O-アラビノシル化酵素の細胞内における局在を調べるため,蛍光タンパク質GFPとの融合タンパク質をシロイヌナズナT-87培養細胞のプロトプラストに一過性に発現させたところ,ゴルジ体において特徴的なドット状のGFPの蛍光がみられた.また,Brefeldin Aによる処理やシスゴルジのマーカーであるSYP31との共発現の結果から,ヒドロキシプロリン-O-アラビノシル化酵素はシスゴルジの側に局在していることが明らかになった.HPAT1遺伝子,HPAT2遺伝子,HPAT3遺伝子のRT-PCR解析では,それぞれシロイヌナズナ植物体の全体における発現が確認された.
3.ヒドロキシプロリン-O-アラビノシル化酵素の欠損株の解析
HPAT1遺伝子,HPAT2遺伝子,HPAT3遺伝子の植物体における機能を明らかにするため,それぞれのT-DNA挿入変異株を解析した.それぞれの変異株の植物体における基質となる合成ペプチドに対するヒドロキシプロリン-O-アラビノシル化酵素の活性を測定したところ,hpat1-1変異株では活性はかなり減少し,hpat1-1とhpat2-1との二重変異株ではさらに大幅な活性の減少がみられた.一方,hpat3-1変異株では活性に大きな差異は認められなかった.これらの結果は,それぞれの基質特異性の違いを反映していると思われた.
HPAT1遺伝子,HPAT2遺伝子,HPAT3遺伝子の単独での変異株は野生株と見分けがつかなかったが,hpat1-1 hpat2-1二重変異株は野生型に比べ明所でも胚軸が長くなる表現型を示した.また,透過型電子顕微鏡により芽生えの胚軸の部分を観察したところ,hpat1-1 hpat2-1二重変異株では野生株の約半分にまで細胞壁が薄くなることが明らかになった.さらに成長が進んだ段階においては,hpat1-1 hpat2-1二重変異株では花成が早まるとともに葉の老化が促進された.これらの結果は,HPAT1とHPAT2は植物の成長のさまざまな段階において重複して機能していることを示した.
4.HPAT1遺伝子とHPAT3遺伝子の二重欠損では花粉管の伸長に異常が生じる
hpat1-1 hpat2-1 hpat3-1三重変異株を得るため,hpat1-1 hpat2-1二重変異株とhpat3-1変異株とを掛け合わせたF2株の遺伝子型を解析した.しかし,500株以上のF2株を解析したにもかかわらず,hpat1-1 hpat2-1 hpat3-1三重変異株もhpat1-1 hpat3-1二重変異株も得られなかった.その原因を探るため,hpat1-1 hpat2-1 hpat3-1三重ヘテロ接合変異株と野生株との掛け合わせをオス側およびメス側をそれぞれ変えて行い,そのF1株の遺伝子型を解析したところ,オス側(花粉側)からはHPAT1遺伝子とHPAT3遺伝子の両方を欠損したものは遺伝しないことが判明した.
hpat1-1 hpat3-1二重変異が花粉の機能にどのような影響を及ぼしているかを調べるため,hpat1-1 hpat3-1二重ヘテロ接合変異株および野生株の花粉をin vitroにおいて培養したところ,どちらの花粉も同じ程度の効率で発芽したが,発芽の16時間のちになると,hpat1-1 hpat3-1二重ヘテロ接合変異株では著しく短い花粉管が多く観察されるようになった.また,in vivoでは,受粉の8時間のちには野生株の花粉管は花柱を通過し花粉管誘導組織にまで到達していたが,hpat1-1 hpat3-1二重ヘテロ接合変異株では多くの花粉管は柱頭あるいは花柱のなかで伸長が停止していた.これらの結果から,hpat1-1 hpat3-1二重変異株は花粉管が正常に伸長できないため雄性不稔を示すことが明らかになった.
5.ヒドロキシプロリン-O-アラビノシル化酵素の基質特異性
冒頭にも述べたように,O-アラビノシル化修飾はヒドロキシプロリンリッチ糖タンパク質およびペプチドシグナルの両方に見い出される.3つあるヒドロキシプロリン-O-アラビノシル化酵素がそれぞれどのような特異性でこれら基質の修飾に関与しているのか,HPAT1遺伝子,HPAT2遺伝子,HPAT3遺伝子の変異株におけるO-アラビノシル化修飾の程度を解析した.
エクステンシンはヒドロキシプロリンリッチ糖タンパク質のなかでもっともO-アラビノシル化修飾の顕著なタンパク質であり,酸化的な架橋により網目状の構造となって細胞壁の形成の足場になると考えられている10).そこで,hpat1-1 hpat2-1二重変異株あるいはhpat3-1変異株からエクステンシンのひとつEXT3を抽出し,アルカリ加水分解によりO-アラビノシル化修飾されたヒドロキシプロリンの量を定量した結果,hpat1-1 hpat2-1二重変異株に由来するEXT3により顕著な減少が認められた.すなわち,EXT3のO-アラビノシル化修飾はおもにHPAT1およびHPAT2により行われていた.一方,ペプチドシグナルの代表として,マメ科植物においてO-アラビノシル化修飾されて根粒形成の抑制シグナルとしてはたらくCLEペプチドに配列がもっとも類似しているシロイヌナズナのCLE2ペプチドに着目した.CLE2遺伝子を過剰に発現させたシロイヌナズナから分泌されたCLE2ペプチドを分析した結果,CLE2ペプチドのO-アラビノシル化修飾はおもにHPAT3により行なわれていることが示された.以上の結果から,3つのヒドロキシプロリン-O-アラビノシル化酵素は重複して機能するものの,それぞれにはある程度の基質特異性のあることが明らかになった.
おわりに
一般的に,翻訳後修飾はタンパク質の機能に大きな影響をあたえる.翻訳後修飾を失うとタンパク質の本来の機能も完全に失われることが少なくないことから,ヒドロキシプロリン-O-アラビノシル化酵素の欠損株の表現型はO-アラビノシル化タンパク質およびO-アラビノシル化ペプチドの機能が失われている状態を反映しているはずである.したがって,欠損株の表現型からは重複性の壁をこえて未知のO-アラビノシル化タンパク質あるいはO-アラビノシル化ペプチドの機能を垣間みることができる.ヒドロキシプロリン-O-アラビノシル化酵素が同定されたことの真の価値はここにある.
近年,植物において成長や分化,共生,防御応答などさまざまな場面に関係するO-アラビノシル化ペプチドの発見があいついでいるが,はたして,どれくらいのO-アラビノシル化ペプチドが細胞間シグナルとしてはたらいているのか,いまだよくわかっていない.エクステンシンがどのように細胞壁の構築に関係するかについても,謎はまだ多く残されている.ヒドロキシプロリン残基のO-アラビノシル化修飾がみつかってからまもなく50年,待望のヒドロキシプロリン-O-アラビノシル化酵素がようやく同定されたいま,これらの欠損株を用いた解析を端緒として,O-アラビノシル化タンパク質およびO-アラビノシル化ペプチドの機能の解明や新たな因子の発見が期待される.
文 献
- Lamport, D. T. A.: Hydroxyproline-O-glycosidic linkage of the plant cell wall glycoprotein extensin. Nature, 216, 1322-1324 (1967)
- Kieliszewski, M. J., Lamport, D. T., Tan, L. et al.: Hydroxyproline-rich glycoproteins: form and function. Annu. Plant Rev., 41, 321-342 (2010)
- van Holst, G. J. & Varner, J. E.: Reinforced polyproline II conformation in a hydroxyproline-rich cell wall glycoprotein from carrot root. Plant Physiol., 74, 247-251 (1984)[PubMed]
- Ohyama, K., Shinohara, H., Ogawa-Ohnishi, M. et al.: A glycopeptide regulating stem cell fate in Arabidopsis thaliana. Nat. Chem. Biol., 5, 578-580 (2009)[PubMed]
- Okamoto, S., Shinohara, H., Mori, T. et al.: Root-derived CLE glycopeptides control nodulation by direct binding to HAR1 receptor kinase. Nat. Commun., 4, 2191 (2013)[PubMed]
- Shinohara, H. & Matsubayashi, Y.: Chemical synthesis of Arabidopsis CLV3 glycopeptide reveals the impact of Hyp arabinosylation on peptide conformation and activity. Plant Cell Physiol., 54, 369-374 (2013)[PubMed]
- Lairson, L. L., Henrissat, B., Davies, G. J. et al.: Glycosyltransferases: structures, functions, and mechanisms. Annu. Rev. Biochem., 77, 521-555 (2008)[PubMed]
- Schnabel, E. L., Kassaw, T. K., Smith, L. S. et al.: The ROOT DETERMINED NODULATION1 gene regulates nodule number in roots of Medicago truncatula and defines a highly conserved, uncharacterized plant gene family. Plant Physiol., 157, 328-340 (2011)[PubMed]
- Nikolovski, N., Rubtsov, D., Segura, M. P. et al.: Putative glycosyltransferases and other plant Golgi apparatus proteins are revealed by LOPIT proteomics. Plant Physiol., 160, 1037-1051 (2012)[PubMed]
- Kieliszewski, M. J. & Lamport, D. T.: Extensin: repetitive motifs, functional sites, post-translational codes, and phylogeny. Plant J., 5, 157-172 (1994)[PubMed]
著者プロフィール
略歴:基礎生物学研究所 研究員(ポスドクではなくてポスマスです).
研究テーマ:植物成長を制御するシグナル分子の探索と機能.
関心事:応用研究につながる基礎研究,マラソン,育児,アンチエイジング.
松林 嘉克(Yoshikatsu Matsubayashi)
基礎生物学研究所 教授.
研究室URL:http://www.nibb.ac.jp/ligand/
© 2013 小川 (大西) 真理・松林嘉克 Licensed under CC 表示 2.1 日本