Hippo経路の標的であるYAPおよびTAZは核におけるSHP2の機能を制御する
堤 良平・畠山昌則
(東京大学大学院医学系研究科 微生物学分野)
email:堤 良平,畠山昌則
DOI: 10.7875/first.author.2013.123
YAP and TAZ, Hippo signaling targets, act as a rheostat for nuclear SHP2 function.
Ryouhei Tsutsumi, Mohammad Masoudi, Atsushi Takahashi, Yumiko Fujii, Takeru Hayashi, Ippei Kikuchi, Yumeko Satou, Masanori Taira, Masanori Hatakeyama
Developmental Cell, 26, 658-665 (2013)
チロシンホスファターゼSHP2の機能の亢進はがんや発達障害などの疾病をひき起こす.SHP2は細胞膜の近傍や細胞質において機能し,RAS-Erk経路の活性化に関与することが知られている.最近,筆者らは,SHP2が核にも分布し,ゲノムの機能制御に重要な役割を担うPAF複合体の構成タンパク質であるparafibrominを脱リン酸化することにより,Wnt/βカテニン経路の標的遺伝子の転写の活性化を促進することを明らかにした.これらRAS-Erk経路およびWnt/βカテニン経路の異常な活性化はSHP2の変異に起因する各種の病変の発症に寄与していることが推察されるが,細胞内におけるSHP2の局在を制御する分子機構はこれまでまったく明らかにされていなかった.この研究では,SHP2の細胞質と核とのあいだの移行に焦点をあて,その分子機構の解明を試みた.その結果,SHP2が細胞の密度に依存して増殖を制御するHippo経路の標的タンパク質であるYAPおよびTAZと複合体を形成することを見い出した.Hippo経路が活性化していないときには,SHP2は脱リン酸化の状態にあるYAPおよびTAZとともに核へと移行し,βカテニンならびにYAPおよびTAZに依存的な転写の活性化を促進する.一方,Hippo経路が活性化すると,リン酸化に依存したYAPおよびTAZの細胞質から核への移行の阻止にともないSHP2も細胞質にとどまり,核における転写制御にかかわるSHP2の機能は抑制されることが明らかになった.
SH2ドメインをもつチロシンホスファターゼSHP2(SH2-domain containing protein tyrosine phosphatase 2)の機能獲得型の変異は,高発がん性の先天奇形症候群として知られるNoonan症候群にくわえ,孤発性の白血病および固形がんの発症にもかかわることが報告されている1,2).これまでの研究から,SHP2は細胞膜の近傍や細胞質においてRAS-Erk経路の活性化を著しく増強することが知られている3).一方,筆者らは最近,SHP2が核にも分布し,多様な転写の制御機能を担うPAF複合体の構成タンパク質のひとつparafibromin(別名CDC73)をチロシン脱リン酸化する結果,Wnt/βカテニン経路の標的遺伝子の転写を促進することを明らかにした4)(新着論文レビュー でも掲載).これらの事実から,機能獲得型SHP2変異体はRAS-Erk経路およびWnt/βカテニン経路の脱制御を介して発がんなどの病変の発症に寄与していることが推察されたが,核におけるSHP2の活性制御機構はこれまでまったく知られていなかった.一方で,筆者らは,SHP2の細胞内における局在が細胞の密度に依存して変化することを見い出した.SHP2は低密度では細胞質ならびに核に,高密度では細胞質のみに局在し,さらに,この細胞内局在の変化により核におけるSHP2の活性が変化することを明らかにした4).
この研究では,SHP2の細胞質と核とのあいだの移行に焦点をあて,その分子機構の解明を試みた.
免疫染色法ならびに細胞分画法によりSHP2の細胞内における局在について検討したところ,ヒトの胃上皮に由来するAGS細胞をはじめ,ヒトの肺がんに由来するA549細胞,ヒトの子宮頸がんに由来するHeLa細胞,マウスに由来するNIH3T3細胞など,検討を行ったすべての細胞において,低密度の培養では細胞質ならびに核に,一方,高密度の培養では細胞質にのみ,SHP2の分布が観察された.このことから,培養細胞株の種類や生物種に依存しない,密度に依存的なSHP2の細胞内局在の制御機構の存在が示唆された.そこで,各種の阻害剤を用いて細胞を処理し,SHP2の細胞内局在に関与する既知のシグナル伝達経路の特定を試みた.その結果,低分子量GTPaseであるRhoA,RhoB,RhoCの特異的な阻害剤であるClostridium botulinum C3毒素の処理により,低密度培養におけるSHP2の核への局在が著しく阻害された.一方,広範なセリン-スレオニンキナーゼの阻害剤であるスタウロスポリンの処理により,高密度培養においてもSHP2の核への局在が誘導された.
細胞内局在に関与するSHP2の分子内領域について探索を行った.SHP2は2つのSH2ドメイン,チロシンホスファターゼドメイン,C末端側の尾部から構成される.各部位の欠損変異型SHP2変異体の細胞内局在を観察したところ,C末端領域が低密度培養におけるSHP2の核への集積に必須であった.さらに,この領域に存在するプロリン残基クラスターが核への移行において重要な役割をになうことが明らかになった.SHP2のアミノ酸配列には古典的な核局在化シグナルや核外移行シグナルは存在しないことから,同定したプロリン残基に富むC末端領域になんらかのタンパク質が結合しSHP2の細胞内局在を制御していることが予想された.
Hippo経路は細胞の密度を感知するシグナル伝達系であり,培養細胞における接触阻害や個体における臓器の大きさの決定,さらには,その異常が発がんにかかわることから,近年,大きな注目をあつめている5).哺乳類におけるHippo経路は細胞質セリン-スレオニンキナーゼであるMST1およびMST2ならびにLATS1およびLATS2からなるキナーゼカスケードを含む.いまだ分子的な機序の詳細は不明ながら,これらのキナーゼは細胞密度の増大により活性化され,YAP(Yes-associated protein)およびそのホモログであるTAZ(transcriptional co-activator with PDZ-binding motif)をリン酸化する.低密度状態にある細胞ではYAPおよびTAZはリン酸化されず,細胞質から核へと移行することによりTEADファミリー転写因子のコアクチベーターとして機能し,標的遺伝子の転写の促進を介し細胞の増殖や生存をサポートする.一方,Hippo経路が活性化された細胞ではYAPおよびTAZはLATS1およびLATS2によりリン酸化される結果,細胞質にとどまりユビキチン化されてプロテアソームに依存的な分解をうける.くわえて,Rhoファミリー低分子量GTPaseを介したHippo経路の制御系の存在も報告されている6).
さきに述べたように,SHP2の細胞内局在の制御には,1)細胞の密度に依存的なシグナル伝達系,2)Rhoファミリー低分子量GTPase,3)セリン-スレオニンキナーゼの活性,が関与している.これらの特徴はHippo経路の性状と酷似し,とくに,SHP2の濃度に依存的な細胞内局在の変動は,Hippo経路の標的タンパク質であるYAPならびにTAZの細胞内局在パターンときわめて強い類似性を示す.そこで,SHP2の細胞内局在とYAPおよびTAZとの関連について検討した.免疫染色の結果,解析したすべての細胞株において,低密度培養ならびに高密度培養におけるSHP2とYAPおよびTAZの細胞内局在は一致した.さらに,免疫沈降法によりSHP2とYAPあるいはTAZとの複合体の形成が認められた.これらの実験結果から,SHP2は細胞においてYAPおよびTAZと物理的に相互作用して存在すると結論づけた.
低密度培養におけるSHP2の核への局在に必須のC末端領域やこの領域に存在するプロリン残基クラスターを欠くSHP2変異体はYAPおよびTAZと複合体を形成しなかったことから,YAPおよびTAZとの相互作用がSHP2の細胞内局在の制御に深くかかわることが推察された.そこで,RNAi法により細胞においてYAPおよびTAZをノックダウンしたところ,低密度培養におけるSHP2の核への集積ならびに高密度培養におけるSHP2の細胞質への移行はともに消失した.また,YAPおよびTAZの上流のキナーゼであるLATS2を異所性に発現させた細胞ではYAPおよびTAZの細胞質への移行および分解が観察されるとともに,低密度培養におけるSHP2の核への移行が阻止された.さらに,Hippo経路に依存したリン酸化に抵抗するTAZ変異体を異所性に発現させた細胞では,高密度培養においてもTAZならびにSHP2の核への集積が観察された.以上の結果から,SHP2の細胞内局在はHippo経路の標的タンパク質であるYAPならびにTAZにより制御されていることが明らかになった.
SHP2は核においてparafibrominのチロシン脱リン酸化を介してparafibrominとβカテニンとの複合体の形成を亢進し,Wntの標的遺伝子の活性化を促進する5).そこで,Hippo経路のオンおよびオフに依存したSHP2の細胞内局在の変動がSHP2の核における活性の制御に関与しているかどうかを検討した.低密度培養している細胞においてYAPおよびTAZをノックダウンしたところ,SHP2の核への集積の抑制ならびに核におけるparafibrominのチロシンリン酸化レベルの上昇がみられた.また,YAPおよびTAZのノックダウンはSHP2によるWnt/βカテニン経路に依存的なレポーターの活性化を阻止した.さらに,リン酸化抵抗性TAZ変異体の発現によりWnt/βカテニン経路が活性化することを見い出すとともに,このTAZに依存したWnt/βカテニン経路の活性化にはSHP2が必須であった.以上の結果から,YAPおよびTAZはSHP2の核への移行を制御することにより核におけるSHP2の活性を制御していると結論づけた.
マウスの大腸を用いた免疫組織化学的な解析の結果,Wnt/βカテニン経路の活性化が報告されている陰窩部ではSHP2とYAPおよびTAZの両方がおもに核に分布する一方,Wnt/βカテニン経路が不活性化している絨毛部ではSHP2とYAPおよびTAZはいずれも細胞質に局在した.この結果は,in vivoにおいてSHP2の細胞内局在がYAPおよびTAZにより制御されていることを示す所見と考えられた.
一連の結果から,YAPおよびTAZがSHP2に依存したWntの標的遺伝子の活性化に重要な役割を担っていることが明らかになった.そこで,SHP2がこれまでに報告されているYAPおよびTAZの機能に影響をあたえる可能性について検討した.YAPおよびTAZは核においてTEADファミリー転写因子と共役し細胞の増殖や生存に関与する遺伝子の転写を活性化する5).TEADファミリー転写因子に特異的なレポーターアッセイにおいて,細胞密度ならびにTAZに依存したレポーターの活性の上昇はSHP2のノックダウンにより著しく低下した.また,TEADファミリー転写因子の標的遺伝子として知られるCtgf遺伝子ならびにCyr61遺伝子の転写はSHP2のノックダウンにより強く抑制された.さらに,リン酸化抵抗性TAZ変異体の異所性の発現が誘導する足場に非依存的な細胞増殖や細胞運動の亢進が,SHP2のノックダウンにより減弱することも示された.以上の結果より,SHP2はYAPおよびTAZの活性を増強すると考えられた.
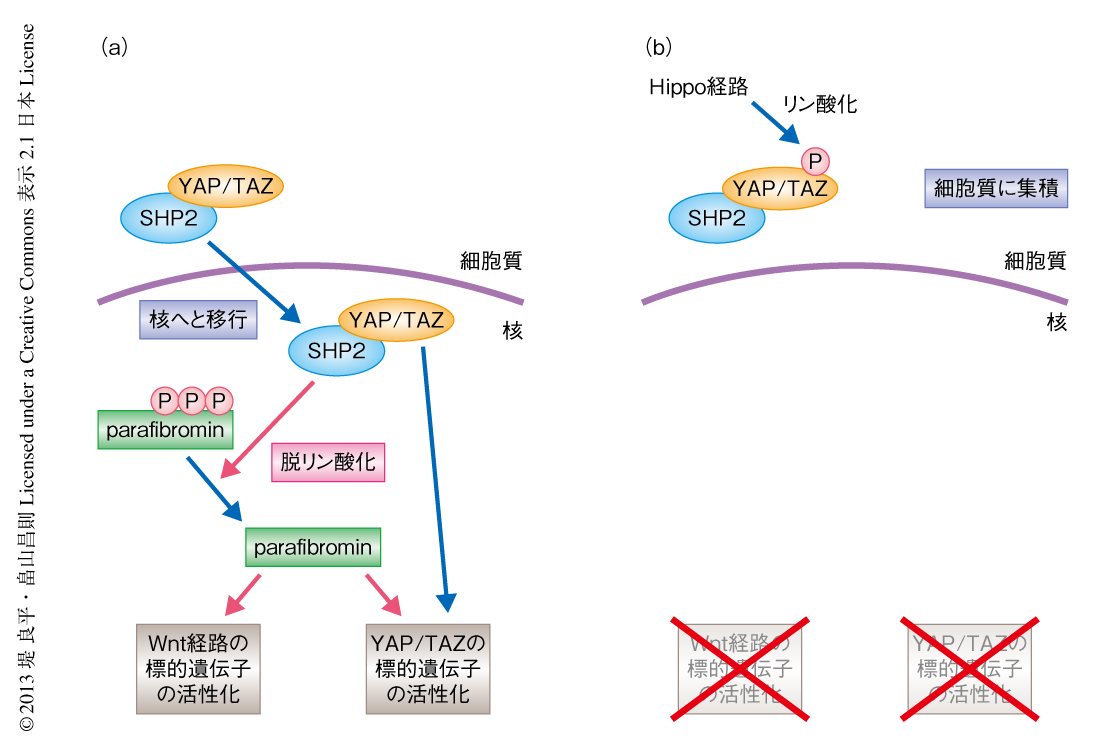
この研究により,これまで不明であったチロシンホスファターゼSHP2の細胞内局在の制御機構が明らかになった.SHP2はYAPおよびTAZと複合体を形成し,Hippo経路が活性化していないときには,脱リン酸化状態のYAPおよびTAZとともに核へと移行してβカテニンならびにTEADファミリー転写因子に依存的な転写の活性化を促進する(図1a).一方,細胞密度の増大などによりHippo経路が活性化すると,リン酸化によるYAPおよびTAZの細胞質から核への移行の阻止にともないSHP2も細胞質にとどまる(図1b).YAPおよびTAZに依存したSHP2の細胞内局在の制御は,これまでに報告されている複数のYAPおよびTAZに依存的なWnt/βカテニン経路の制御機構とともに,Hippo経路とWnt/βカテニン経路とのあいだの密接かつ複雑なクロストークを構成すると推測される7-9).SHP2は発がんに重要な役割を担う2つの主要なシグナル伝達経路RAS-Erk経路ならびにWnt/βカテニン経路を正に制御する.これに対し,Hippo経路は培養細胞における接触阻害や個体における臓器あるいは組織の大きさの決定,さらには,発がんにも深くかかわるシグナル伝達経路として注目をあつめている5).この研究から得られた成果は,発がん促進性のシグナル伝達経路であるRAS-Erk経路ならびにWnt/βカテニン経路が,SHP2の細胞内局在の制御を介してがん抑制性のシグナル伝達経路であるHippo経路により制御されるという新たな概念を提示した.くわえて,SHP2がHippo経路に依存的なシグナル伝達の一翼を担うという事実から,SHP2の生理学的および病態生理学的な多彩な機能の発現におけるYAPおよびTAZの標的遺伝子の関与が推測された.
略歴:2006年 北海道大学大学院理学研究科 修了,2006年 国立長寿医療センター研究所 研究員,2007年 生理学研究所 研究員,2009年 東京大学大学院医学系研究科 助教を経て,2013年よりカナダOntario Institute for Cancer Research博士研究員.
研究テーマ:チロシンホスファターゼによる細胞内シグナル伝達.
畠山 昌則(Masanori Hatakeyama)
東京大学大学院医学系研究科 教授.
研究室URL:http://www.microbiol.m.u-tokyo.ac.jp/
© 2013 堤 良平・畠山昌則 Licensed under CC 表示 2.1 日本
(東京大学大学院医学系研究科 微生物学分野)
email:堤 良平,畠山昌則
DOI: 10.7875/first.author.2013.123
YAP and TAZ, Hippo signaling targets, act as a rheostat for nuclear SHP2 function.
Ryouhei Tsutsumi, Mohammad Masoudi, Atsushi Takahashi, Yumiko Fujii, Takeru Hayashi, Ippei Kikuchi, Yumeko Satou, Masanori Taira, Masanori Hatakeyama
Developmental Cell, 26, 658-665 (2013)
要 約
チロシンホスファターゼSHP2の機能の亢進はがんや発達障害などの疾病をひき起こす.SHP2は細胞膜の近傍や細胞質において機能し,RAS-Erk経路の活性化に関与することが知られている.最近,筆者らは,SHP2が核にも分布し,ゲノムの機能制御に重要な役割を担うPAF複合体の構成タンパク質であるparafibrominを脱リン酸化することにより,Wnt/βカテニン経路の標的遺伝子の転写の活性化を促進することを明らかにした.これらRAS-Erk経路およびWnt/βカテニン経路の異常な活性化はSHP2の変異に起因する各種の病変の発症に寄与していることが推察されるが,細胞内におけるSHP2の局在を制御する分子機構はこれまでまったく明らかにされていなかった.この研究では,SHP2の細胞質と核とのあいだの移行に焦点をあて,その分子機構の解明を試みた.その結果,SHP2が細胞の密度に依存して増殖を制御するHippo経路の標的タンパク質であるYAPおよびTAZと複合体を形成することを見い出した.Hippo経路が活性化していないときには,SHP2は脱リン酸化の状態にあるYAPおよびTAZとともに核へと移行し,βカテニンならびにYAPおよびTAZに依存的な転写の活性化を促進する.一方,Hippo経路が活性化すると,リン酸化に依存したYAPおよびTAZの細胞質から核への移行の阻止にともないSHP2も細胞質にとどまり,核における転写制御にかかわるSHP2の機能は抑制されることが明らかになった.
はじめに
SH2ドメインをもつチロシンホスファターゼSHP2(SH2-domain containing protein tyrosine phosphatase 2)の機能獲得型の変異は,高発がん性の先天奇形症候群として知られるNoonan症候群にくわえ,孤発性の白血病および固形がんの発症にもかかわることが報告されている1,2).これまでの研究から,SHP2は細胞膜の近傍や細胞質においてRAS-Erk経路の活性化を著しく増強することが知られている3).一方,筆者らは最近,SHP2が核にも分布し,多様な転写の制御機能を担うPAF複合体の構成タンパク質のひとつparafibromin(別名CDC73)をチロシン脱リン酸化する結果,Wnt/βカテニン経路の標的遺伝子の転写を促進することを明らかにした4)(新着論文レビュー でも掲載).これらの事実から,機能獲得型SHP2変異体はRAS-Erk経路およびWnt/βカテニン経路の脱制御を介して発がんなどの病変の発症に寄与していることが推察されたが,核におけるSHP2の活性制御機構はこれまでまったく知られていなかった.一方で,筆者らは,SHP2の細胞内における局在が細胞の密度に依存して変化することを見い出した.SHP2は低密度では細胞質ならびに核に,高密度では細胞質のみに局在し,さらに,この細胞内局在の変化により核におけるSHP2の活性が変化することを明らかにした4).
この研究では,SHP2の細胞質と核とのあいだの移行に焦点をあて,その分子機構の解明を試みた.
1.SHP2の細胞内局在の制御に関与するシグナル伝達経路の探索
免疫染色法ならびに細胞分画法によりSHP2の細胞内における局在について検討したところ,ヒトの胃上皮に由来するAGS細胞をはじめ,ヒトの肺がんに由来するA549細胞,ヒトの子宮頸がんに由来するHeLa細胞,マウスに由来するNIH3T3細胞など,検討を行ったすべての細胞において,低密度の培養では細胞質ならびに核に,一方,高密度の培養では細胞質にのみ,SHP2の分布が観察された.このことから,培養細胞株の種類や生物種に依存しない,密度に依存的なSHP2の細胞内局在の制御機構の存在が示唆された.そこで,各種の阻害剤を用いて細胞を処理し,SHP2の細胞内局在に関与する既知のシグナル伝達経路の特定を試みた.その結果,低分子量GTPaseであるRhoA,RhoB,RhoCの特異的な阻害剤であるClostridium botulinum C3毒素の処理により,低密度培養におけるSHP2の核への局在が著しく阻害された.一方,広範なセリン-スレオニンキナーゼの阻害剤であるスタウロスポリンの処理により,高密度培養においてもSHP2の核への局在が誘導された.
2.C末端領域が関与するSHP2の核への集積
細胞内局在に関与するSHP2の分子内領域について探索を行った.SHP2は2つのSH2ドメイン,チロシンホスファターゼドメイン,C末端側の尾部から構成される.各部位の欠損変異型SHP2変異体の細胞内局在を観察したところ,C末端領域が低密度培養におけるSHP2の核への集積に必須であった.さらに,この領域に存在するプロリン残基クラスターが核への移行において重要な役割をになうことが明らかになった.SHP2のアミノ酸配列には古典的な核局在化シグナルや核外移行シグナルは存在しないことから,同定したプロリン残基に富むC末端領域になんらかのタンパク質が結合しSHP2の細胞内局在を制御していることが予想された.
3.SHP2とYAPおよびTAZとのあいだの物理的な相互作用
Hippo経路は細胞の密度を感知するシグナル伝達系であり,培養細胞における接触阻害や個体における臓器の大きさの決定,さらには,その異常が発がんにかかわることから,近年,大きな注目をあつめている5).哺乳類におけるHippo経路は細胞質セリン-スレオニンキナーゼであるMST1およびMST2ならびにLATS1およびLATS2からなるキナーゼカスケードを含む.いまだ分子的な機序の詳細は不明ながら,これらのキナーゼは細胞密度の増大により活性化され,YAP(Yes-associated protein)およびそのホモログであるTAZ(transcriptional co-activator with PDZ-binding motif)をリン酸化する.低密度状態にある細胞ではYAPおよびTAZはリン酸化されず,細胞質から核へと移行することによりTEADファミリー転写因子のコアクチベーターとして機能し,標的遺伝子の転写の促進を介し細胞の増殖や生存をサポートする.一方,Hippo経路が活性化された細胞ではYAPおよびTAZはLATS1およびLATS2によりリン酸化される結果,細胞質にとどまりユビキチン化されてプロテアソームに依存的な分解をうける.くわえて,Rhoファミリー低分子量GTPaseを介したHippo経路の制御系の存在も報告されている6).
さきに述べたように,SHP2の細胞内局在の制御には,1)細胞の密度に依存的なシグナル伝達系,2)Rhoファミリー低分子量GTPase,3)セリン-スレオニンキナーゼの活性,が関与している.これらの特徴はHippo経路の性状と酷似し,とくに,SHP2の濃度に依存的な細胞内局在の変動は,Hippo経路の標的タンパク質であるYAPならびにTAZの細胞内局在パターンときわめて強い類似性を示す.そこで,SHP2の細胞内局在とYAPおよびTAZとの関連について検討した.免疫染色の結果,解析したすべての細胞株において,低密度培養ならびに高密度培養におけるSHP2とYAPおよびTAZの細胞内局在は一致した.さらに,免疫沈降法によりSHP2とYAPあるいはTAZとの複合体の形成が認められた.これらの実験結果から,SHP2は細胞においてYAPおよびTAZと物理的に相互作用して存在すると結論づけた.
4.YAPおよびTAZによるSHP2の細胞内局在の制御
低密度培養におけるSHP2の核への局在に必須のC末端領域やこの領域に存在するプロリン残基クラスターを欠くSHP2変異体はYAPおよびTAZと複合体を形成しなかったことから,YAPおよびTAZとの相互作用がSHP2の細胞内局在の制御に深くかかわることが推察された.そこで,RNAi法により細胞においてYAPおよびTAZをノックダウンしたところ,低密度培養におけるSHP2の核への集積ならびに高密度培養におけるSHP2の細胞質への移行はともに消失した.また,YAPおよびTAZの上流のキナーゼであるLATS2を異所性に発現させた細胞ではYAPおよびTAZの細胞質への移行および分解が観察されるとともに,低密度培養におけるSHP2の核への移行が阻止された.さらに,Hippo経路に依存したリン酸化に抵抗するTAZ変異体を異所性に発現させた細胞では,高密度培養においてもTAZならびにSHP2の核への集積が観察された.以上の結果から,SHP2の細胞内局在はHippo経路の標的タンパク質であるYAPならびにTAZにより制御されていることが明らかになった.
5.YAPおよびTAZはSHP2に依存的なWnt/βカテニン経路の活性化に寄与する
SHP2は核においてparafibrominのチロシン脱リン酸化を介してparafibrominとβカテニンとの複合体の形成を亢進し,Wntの標的遺伝子の活性化を促進する5).そこで,Hippo経路のオンおよびオフに依存したSHP2の細胞内局在の変動がSHP2の核における活性の制御に関与しているかどうかを検討した.低密度培養している細胞においてYAPおよびTAZをノックダウンしたところ,SHP2の核への集積の抑制ならびに核におけるparafibrominのチロシンリン酸化レベルの上昇がみられた.また,YAPおよびTAZのノックダウンはSHP2によるWnt/βカテニン経路に依存的なレポーターの活性化を阻止した.さらに,リン酸化抵抗性TAZ変異体の発現によりWnt/βカテニン経路が活性化することを見い出すとともに,このTAZに依存したWnt/βカテニン経路の活性化にはSHP2が必須であった.以上の結果から,YAPおよびTAZはSHP2の核への移行を制御することにより核におけるSHP2の活性を制御していると結論づけた.
マウスの大腸を用いた免疫組織化学的な解析の結果,Wnt/βカテニン経路の活性化が報告されている陰窩部ではSHP2とYAPおよびTAZの両方がおもに核に分布する一方,Wnt/βカテニン経路が不活性化している絨毛部ではSHP2とYAPおよびTAZはいずれも細胞質に局在した.この結果は,in vivoにおいてSHP2の細胞内局在がYAPおよびTAZにより制御されていることを示す所見と考えられた.
6.SHP2によるYAPおよびTAZの機能の亢進
一連の結果から,YAPおよびTAZがSHP2に依存したWntの標的遺伝子の活性化に重要な役割を担っていることが明らかになった.そこで,SHP2がこれまでに報告されているYAPおよびTAZの機能に影響をあたえる可能性について検討した.YAPおよびTAZは核においてTEADファミリー転写因子と共役し細胞の増殖や生存に関与する遺伝子の転写を活性化する5).TEADファミリー転写因子に特異的なレポーターアッセイにおいて,細胞密度ならびにTAZに依存したレポーターの活性の上昇はSHP2のノックダウンにより著しく低下した.また,TEADファミリー転写因子の標的遺伝子として知られるCtgf遺伝子ならびにCyr61遺伝子の転写はSHP2のノックダウンにより強く抑制された.さらに,リン酸化抵抗性TAZ変異体の異所性の発現が誘導する足場に非依存的な細胞増殖や細胞運動の亢進が,SHP2のノックダウンにより減弱することも示された.以上の結果より,SHP2はYAPおよびTAZの活性を増強すると考えられた.
おわりに
この研究により,これまで不明であったチロシンホスファターゼSHP2の細胞内局在の制御機構が明らかになった.SHP2はYAPおよびTAZと複合体を形成し,Hippo経路が活性化していないときには,脱リン酸化状態のYAPおよびTAZとともに核へと移行してβカテニンならびにTEADファミリー転写因子に依存的な転写の活性化を促進する(図1a).一方,細胞密度の増大などによりHippo経路が活性化すると,リン酸化によるYAPおよびTAZの細胞質から核への移行の阻止にともないSHP2も細胞質にとどまる(図1b).YAPおよびTAZに依存したSHP2の細胞内局在の制御は,これまでに報告されている複数のYAPおよびTAZに依存的なWnt/βカテニン経路の制御機構とともに,Hippo経路とWnt/βカテニン経路とのあいだの密接かつ複雑なクロストークを構成すると推測される7-9).SHP2は発がんに重要な役割を担う2つの主要なシグナル伝達経路RAS-Erk経路ならびにWnt/βカテニン経路を正に制御する.これに対し,Hippo経路は培養細胞における接触阻害や個体における臓器あるいは組織の大きさの決定,さらには,発がんにも深くかかわるシグナル伝達経路として注目をあつめている5).この研究から得られた成果は,発がん促進性のシグナル伝達経路であるRAS-Erk経路ならびにWnt/βカテニン経路が,SHP2の細胞内局在の制御を介してがん抑制性のシグナル伝達経路であるHippo経路により制御されるという新たな概念を提示した.くわえて,SHP2がHippo経路に依存的なシグナル伝達の一翼を担うという事実から,SHP2の生理学的および病態生理学的な多彩な機能の発現におけるYAPおよびTAZの標的遺伝子の関与が推測された.
文 献
- Mohi, M. G. & Neel, B. G.: The role of Shp2 (PTPN11) in cancer. Curr. Opin. Genet. Dev., 17, 23-30 (2007)[PubMed]
- Tidyman, W. E. & Rauen K. A.: The RASopathies: developmental syndromes of Ras/MAPK pathway dysregulation. Curr. Opin. Genet. Dev., 19, 230-236 (2009)[PubMed]
- Neel, B. G., Gu, H. & Pao, L.: The ‘Shp’ing news: SH2 domain-containing tyrosine phosphatases in cell signaling. Trends Biochem. Sci., 28, 284-293 (2003)[PubMed]
- Takahashi, A., Tsutsumi, R., Kikuchi, I. et al.: SHP2 tyrosine phosphatase converts parafibromin/Cdc73 from a tumor suppressor to an oncogenic driver. Mol. Cell, 43, 45-56 (2011)[PubMed] [新着論文レビュー]
- Pan, D.: The hippo signaling pathway in development and cancer. Dev. Cell, 19, 491-505 (2010)[PubMed]
- Dupont, S., Morsut, L., Aragona, M. et al.: Role of YAP/TAZ in mechanotransduction. Nature, 474, 179-183 (2011)[PubMed]
- Varelas, X., Miller, B. W., Sopko, R. et al.: The Hippo pathway regulates Wnt/β-catenin signaling. Dev. Cell, 18, 579-591 (2010)[PubMed]
- Heallen, T., Zhang, M., Wang, J. et al.: Hippo pathway inhibits Wnt signaling to restrain cardiomyocyte proliferation and heart size. Science, 332, 458-461 (2011)[PubMed]
- Imajo, M., Miyatake, K., Iimura, A. et al.: A molecular mechanism that links Hippo signalling to the inhibition of Wnt/β-catenin signaling. EMBO J., 31, 1109-1122 (2012)[PubMed]
著者プロフィール
略歴:2006年 北海道大学大学院理学研究科 修了,2006年 国立長寿医療センター研究所 研究員,2007年 生理学研究所 研究員,2009年 東京大学大学院医学系研究科 助教を経て,2013年よりカナダOntario Institute for Cancer Research博士研究員.
研究テーマ:チロシンホスファターゼによる細胞内シグナル伝達.
畠山 昌則(Masanori Hatakeyama)
東京大学大学院医学系研究科 教授.
研究室URL:http://www.microbiol.m.u-tokyo.ac.jp/
© 2013 堤 良平・畠山昌則 Licensed under CC 表示 2.1 日本