単球に由来する樹状細胞による血球の貪食と免疫反応の制御
小内伸幸・樗木俊聡
(東京医科歯科大学難治疾患研究所 生体防御学分野)
email:小内伸幸,樗木俊聡
DOI: 10.7875/first.author.2013.122
Monocyte-derived dendritic cells perform hemophagocytosis to fine-tune excessive immune responses.
Hideaki Ohyagi, Nobuyuki Onai, Taku Sato, Satoshi Yotsumoto, Jiajia Liu, Hisaya Akiba, Hideo Yagita, Koji Atarashi, Kenya Honda, Axel Roers, Werner Müller, Kazutaka Kurabayashi, Mayuka Hosoi-Amaike, Naoto Takahashi, Makoto Hirokawa, Kouji Matsushima, Kenichi Sawada, Toshiaki Ohteki
Immunity, 39, 584-598 (2013)
免疫反応は諸刃の刃である.すなわち,病原性微生物を排除する一方で,同時に,自己組織障害の原因ともなりうる.筆者らは,マウスにToll様受容体のひとつTLR9のリガンドであるCpGを高濃度に投与,あるいは,リンパ球性脈絡髄膜炎ウイルスC13株を感染させることにより,活性化した単球に由来する樹状細胞がアポトーシスを起こした赤芽球を貪食することを見い出した.この血球の貪食の過程では,赤芽球の細胞膜の外側へのホスファチジルセリンの露出,および,単球に由来する樹状細胞におけるホスファチジルセリン受容体の発現が,I型インターフェロンにより誘導されていた.また,単球に由来する樹状細胞は血球の貪食に依存して抑制性サイトカインであるインターロイキン10を産生していた.さらに,リンパ球性脈絡髄膜炎ウイルスC13株に感染したマウスにおいて単球に由来する樹状細胞による血球の貪食を抑制したり,単球に由来する樹状細胞からインターロイキン10が産生されないようなコンディショナルノックアウトマウスにリンパ球性脈絡髄膜炎ウイルスC13株を感染させたりすると,このウイルス株に特異的な細胞傷害性T細胞の活性が上昇する一方で,肝障害のマーカーの亢進および肝障害が誘導され,半数のマウスが2週間以内に死亡した.これらの結果は,単球に由来する樹状細胞による血球の貪食は,重篤な炎症状態やウイルスの感染において過剰な免疫応答を制御する新たな免疫抑制機構であることを示唆した.
病原性微生物の感染した宿主では樹状細胞およびそのほかの免疫担当細胞が,病原微生物の構成成分(pathogen-associated molecular pattern:PMAP,病原微生物関連分子パターン)や,宿主に由来する生理活性物質(damage-associated molecular pattern:DAMP,損傷関連分子パターン)を介し,これらの侵入を感知する1).これらのシグナルは樹状細胞を活性化し,炎症性サイトカインの産生を誘導して,自然免疫および獲得免疫を始動させる成熟した樹状細胞への分化を誘導する2,3).獲得免疫は病原性微生物に由来する抗原を認識し,これらを排除して2次感染から宿主を守る.しかし,感染により誘導される免疫反応,とくに,ウイルスに特異的な細胞傷害性T細胞や炎症性サイトカインの産生は自己組織障害の原因となりうる4).これらを防ぐため,免疫反応には病原性微生物の排除と自己組織障害の抑制とのバランスを保つ免疫寛容および免疫制御機構が必要である5).しかしながら,炎症を生じた際あるいは病原性微生物に感染した際における誘導性の免疫制御機構に関しては,研究は進展していない.
この研究において,筆者らは,マウスにおいて,Toll様受容体(Toll-like receptor:TLR)のひとつTLR9のリガンドであるCpGの高濃度の投与による炎症状態,あるいは,リンパ球性脈絡髄膜炎ウイルスC13株の感染により,単球に由来する樹状細胞による血球の貪食が誘導されることを見い出し,その分子機構を明らかにした.さらに,この血球の貪食が過剰な免疫反応を制御する新規の免疫制御機構であることを明らかにした.
マウスに重篤な炎症反応を誘導する目的で,TLR9のリガンドであるCpGを高濃度で投与したところ,末梢血において血球の貪食が誘導された.この血球の貪食はフローサイトメーター解析により検出することができ,この細胞を分画しDiff-Quick染色あるいは電子顕微鏡にて解析したところ,骨髄系細胞により赤芽球が貪食されている像が確認された.この血球の貪食は,末梢血にくわえ骨髄および脾臓と,全身において検出された.さらに詳細な解析により,CpGの投与により発熱,脾腫,血球の減少,高トリグリセリド症,炎症性サイトカインの産生が誘導され,これらの結果はヒトの血球貪食症候群の診断基準をみたし,マウスにおいて血球貪食症候群モデルが樹立されたものと判定した.
血球を貪食している細胞を明らかにするため,この細胞の表面抗原を解析したところ,炎症性の単球に由来する樹状細胞であることが判明した6).炎症状態やウイルスの感染のときにおけるこれら炎症性の単球の骨髄から末梢組織への動員は,ケモカイン受容体CCR2に依存することが報告されている6).そこで,CpGを投与したのちの血清におけるCCR2のリガンドであるCCL2,CCL7,CCL12の濃度をELISA法により測定したところ,これらのリガンドは投与ののち3時間ですみやかに産生されていた.CCR2ノックアウトマウスにCpGを投与したところ,末梢血における血球の貪食は野生型マウスと比較して著しく減少していた.一方で,CCR2ノックアウトマウスの骨髄における血球の貪食は野生型マウスと同じように誘導されていた.これらの結果から,CpGの投与ののち,単球に由来する樹状細胞はケモカイン受容体CCR2に依存的に骨髄から末梢組織へと動員され,血球を貪食していることが明らかになった.
アポトーシスを起こした細胞は“find me”シグナルとよばれる細胞外ATPや細胞外UTPを放出することにより貪食細胞をひきよせ,“eat me”シグナルとよばれるホスファチジルセリンを細胞膜の外側に露出し,これを貪食細胞が認識することにより貪食が起こっている7).そこで,樹立された血球貪食症候群モデルにおいて,これら分子の関与について検討した.CpGを投与したのち血清におけるATPの濃度を測定したところ,投与ののち6時間をピークに,対照のマウスと比べ約8倍に上昇した.また,単球に由来する樹状細胞は細胞外ATPの受容体であるP2Y2を発現していることが定量PCR法により確認された.さらに,P2Y2の結合阻害剤であるスラミンをマウスに投与すると,末梢血における血球の貪食は抑制された.一方,CpGの投与ののち2時間で赤芽球にアポトーシスが誘導され,細胞膜の外側にはホスファチジルセリンが露出していることが明らかになった.また,単球に由来する樹状細胞はホスファチジルセリン受容体として,αVインテグリン,β3インテグリン,および,Tim-1,Tim-4を発現していた.さらに,これらのホスファチジルセリン受容体に対する中和抗体を投与したところ,血球の貪食は有意に抑制された.これらの結果から,単球に由来する樹状細胞は“find me”シグナルおよび“eat me”シグナルを介してアポトーシスを起こした赤芽球を貪食していることが明らかになった.
ヒトでは,慢性感染をひき起こすEpstein-Barrウイルスやサイトメガロウイルスの感染などにより血球貪食症候群が誘導される8).そこで,マウスに慢性感染をひき起こすリンパ球性脈絡髄膜炎ウイルスC13株を感染させたところ,CpGを投与したマウスと同様に,単球に由来する樹状細胞による血球の貪食が誘導された.リンパ球性脈絡髄膜炎ウイルスC13株に感染したマウスにおいても赤芽球はアポトーシスを起こし,単球に由来する樹状細胞はホスファチジルセリン受容体を発現していた.I型インターフェロン受容体を欠損したマウスにリンパ球性脈絡髄膜炎ウイルスC13株を感染させたところ,赤芽球における細胞膜へのホスファチジルセリンの露出,および,単球に由来する樹状細胞におけるホスファチジルセリン受容体の発現はともに低下し,血球の貪食はほとんど誘導されなかった.さらに,ex vivoにおいて,I型インターフェロンは赤芽球におけるアポトーシスの誘導および単球に由来する樹状細胞におけるホスファチジルセリン受容体の発現を直接に誘導していることが明らかになった.これらの結果から,マウスがリンパ球性脈絡髄膜炎ウイルスC13株に感染したときの血球の貪食には,I型インターフェロンが必須であることが示唆された.
これまで,炎症の際にアポトーシスを起こした細胞を貪食した貪食細胞は抑制性サイトカインであるインターロイキン10やTGFβを産生することにより,炎症性サイトカインの産生を抑制していることが報告されている9).また,マウスへのリンパ球性脈絡髄膜炎ウイルスC13株の感染においてはインターロイキン10が産生され,このウイルスに特異的な細胞傷害性T細胞の疲弊が誘導されて慢性感染につながることが報告されているが,インターロイキン10の産生機構は不明である10).筆者らも,リンパ球性脈絡髄膜炎ウイルスC13株の感染によりマウスにおいてインターロイキン10およびTGFβが産生されることを確認した.そこで,マウスへのリンパ球性脈絡髄膜炎ウイルスC13株の感染における血球の貪食およびインターロイキン10の産生の免疫学的な意義について検討した.リンパ球性脈絡髄膜炎ウイルスC13株に感染したマウスに抗ホスファチジルセリン受容体中和抗体を投与すると,血球の貪食とインターロイキン10の産生が低下した.さらに,インターロイキン10を産生する細胞を同定するため,インターロイキン10のレポーターマウスにリンパ球性脈絡髄膜炎ウイルスC13株を感染させ解析したところ,単球に由来する樹状細胞がインターロイキン10のおもな産生細胞であった.また,リンパ球性脈絡髄膜炎ウイルスC13株への感染ののち12時間の骨髄から炎症性単球と赤芽球を純化しこれらを共培養したところ,単球に由来する樹状細胞による貪食が誘導されインターロイキン10が産生されることを見い出した.このex vivoモデルに抗ホスファチジルセリン受容体中和抗体をくわえると,血球の貪食およびインターロイキン10の産生が抑制され,単球に由来する樹状細胞は貪食に依存して抑制性サイトカインであるインターロイキン10を産生することが明らかになった.
また興味深いことに,リンパ球性脈絡髄膜炎ウイルスC13株に感染したマウスに抗ホスファチジルセリン受容体中和抗体を投与し血球の貪食を抑制すると,このウイルスに特異的な細胞傷害性T細胞が対照となるマウスに比べ増加し,かつ,この細胞傷害性T細胞からのインターフェロンγの産生が増加し,その結果,血中のウイルス力価は著しく低下した.しかし,このマウスでは血中の肝障害のマーカーの値が上昇し,肝臓へのリンパ球の浸潤および重度の肝障害が誘導され,2週間以内に半数のマウスが死亡した.さらに,単球に由来する樹状細胞の産生するインターロイキン10の免疫学的な意義を検討するため,この樹状細胞からインターロイキン10が産生されないようなコンディショナルノックアウトマウスにリンパ球性脈絡髄膜炎ウイルスC13株を感染させたところ,抗ホスファチジルセリン受容体中和抗体の投与により血球の貪食を抑制したリンパ球性脈絡髄膜炎ウイルスC13株に感染したマウスと同様に,血中のインターロイキン10の有意な低下にともない,リンパ球性脈絡髄膜炎ウイルスC13株に特異的な細胞傷害性T細胞の活性の亢進と,細胞傷害性T細胞に依存性の肝障害の誘導,さらに,このマウスの死亡率の上昇が観察された.
これらの結果,単球に由来する樹状細胞は血球を貪食し,抑制性サイトカインであるインターロイキン10を産生して,ウイルスの感染における過剰な免疫応答を制御していることが明らかになった.
血球貪食症候群は,重篤な炎症反応,微生物の感染,また,さまざまな疾患においてしばしば観察される病態であり,貪食は重度の炎症の指標として考えられていたが,その機構および免疫学的な意義については不明であった.この研究において,I型インターフェロンに依存しておもに赤芽球にアポトーシスが誘導され,細胞外ATP(あるいは,細胞外UTP)を放出し単球に由来する樹状細胞をひきよせ,一方,骨髄からケモカイン受容体CCR2に依存して動員された炎症性の単球は単球に由来する樹状細胞へと分化して活性化し,I型インターフェロンの刺激に依存してホスファチジルセリン受容体を発現しアポトーシスを起こした赤芽球を貪食し,抑制性サイトカインであるインターロイキン10を産生することが明らかになった(図1).また,これまで,炎症の刺激をうけた貪食細胞がネクローシスを起こした細胞を貪食した場合には炎症性サイトカインを産生し,アポトーシスを起こした細胞を貪食した場合には抑制性サイトカインを産生することがex vivoの実験結果から示されていたが,この研究において,アポトーシスを起こした赤芽球を貪食した単球に由来する樹状細胞が抑制性サイトカインであるインターロイキン10を産生することが,in vivoにおいてはじめて明らかにされた.
免疫系は外来のさまざまな病原性微生物から自己を守るため,また,自己と非自己を特異的に認識するため多様性を獲得し,病原性微生物をより効率よく排除するよう進化してきた.一方で,全身性の重度なウイルス感染の場合,これらのウイルスをすべて排除しようとすると細胞傷害性T細胞により自己の組織も攻撃され,場合によっては死にいたる.そこで,宿主は免疫反応を適度に制御し,病原性微生物の完全な排除ではなく共存というかたちを選択したのではないかと推測される.実際,リンパ球性脈絡髄膜炎ウイルスC13株のほかのウイルス,単純ヘルペスウイルス,インフルエンザウイルスPR8,ワクシニアウイルスの感染において,血球の貪食およびインターロイキン10の産生が誘導されることが見い出されている.この研究において発見された新規の免疫制御機構が,炎症状態や病原性微生物の感染において普遍的な機構であるかどうか,今後,さらなる解析が必要である.一方で,この発見が慢性感染の成立機構の解明や治療法の開発へと貢献できれば幸いである.
略歴:2000年 東京大学大学院医学系研究科博士課程 修了,同年 同 助手,2001年 スイスInstitute for Research in Biomedicineポスドク,2006年 秋田大学大学院医学系研究科 助手,2008年 同 講師を経て,2009年より東京医科歯科大学難治疾患研究所 講師.
研究テーマ:樹状細胞の分化の機構.
抱負:樹状細胞の分化の研究にくわえ,新たな研究テーマに挑みたい.
樗木 俊聡(Toshiaki Ohteki)
東京医科歯科大学難治疾患研究所 教授.
研究室URL:http://www.tmd.ac.jp/mri/bre/index.html
© 2013 小内伸幸・樗木俊聡 Licensed under CC 表示 2.1 日本
(東京医科歯科大学難治疾患研究所 生体防御学分野)
email:小内伸幸,樗木俊聡
DOI: 10.7875/first.author.2013.122
Monocyte-derived dendritic cells perform hemophagocytosis to fine-tune excessive immune responses.
Hideaki Ohyagi, Nobuyuki Onai, Taku Sato, Satoshi Yotsumoto, Jiajia Liu, Hisaya Akiba, Hideo Yagita, Koji Atarashi, Kenya Honda, Axel Roers, Werner Müller, Kazutaka Kurabayashi, Mayuka Hosoi-Amaike, Naoto Takahashi, Makoto Hirokawa, Kouji Matsushima, Kenichi Sawada, Toshiaki Ohteki
Immunity, 39, 584-598 (2013)
要 約
免疫反応は諸刃の刃である.すなわち,病原性微生物を排除する一方で,同時に,自己組織障害の原因ともなりうる.筆者らは,マウスにToll様受容体のひとつTLR9のリガンドであるCpGを高濃度に投与,あるいは,リンパ球性脈絡髄膜炎ウイルスC13株を感染させることにより,活性化した単球に由来する樹状細胞がアポトーシスを起こした赤芽球を貪食することを見い出した.この血球の貪食の過程では,赤芽球の細胞膜の外側へのホスファチジルセリンの露出,および,単球に由来する樹状細胞におけるホスファチジルセリン受容体の発現が,I型インターフェロンにより誘導されていた.また,単球に由来する樹状細胞は血球の貪食に依存して抑制性サイトカインであるインターロイキン10を産生していた.さらに,リンパ球性脈絡髄膜炎ウイルスC13株に感染したマウスにおいて単球に由来する樹状細胞による血球の貪食を抑制したり,単球に由来する樹状細胞からインターロイキン10が産生されないようなコンディショナルノックアウトマウスにリンパ球性脈絡髄膜炎ウイルスC13株を感染させたりすると,このウイルス株に特異的な細胞傷害性T細胞の活性が上昇する一方で,肝障害のマーカーの亢進および肝障害が誘導され,半数のマウスが2週間以内に死亡した.これらの結果は,単球に由来する樹状細胞による血球の貪食は,重篤な炎症状態やウイルスの感染において過剰な免疫応答を制御する新たな免疫抑制機構であることを示唆した.
はじめに
病原性微生物の感染した宿主では樹状細胞およびそのほかの免疫担当細胞が,病原微生物の構成成分(pathogen-associated molecular pattern:PMAP,病原微生物関連分子パターン)や,宿主に由来する生理活性物質(damage-associated molecular pattern:DAMP,損傷関連分子パターン)を介し,これらの侵入を感知する1).これらのシグナルは樹状細胞を活性化し,炎症性サイトカインの産生を誘導して,自然免疫および獲得免疫を始動させる成熟した樹状細胞への分化を誘導する2,3).獲得免疫は病原性微生物に由来する抗原を認識し,これらを排除して2次感染から宿主を守る.しかし,感染により誘導される免疫反応,とくに,ウイルスに特異的な細胞傷害性T細胞や炎症性サイトカインの産生は自己組織障害の原因となりうる4).これらを防ぐため,免疫反応には病原性微生物の排除と自己組織障害の抑制とのバランスを保つ免疫寛容および免疫制御機構が必要である5).しかしながら,炎症を生じた際あるいは病原性微生物に感染した際における誘導性の免疫制御機構に関しては,研究は進展していない.
この研究において,筆者らは,マウスにおいて,Toll様受容体(Toll-like receptor:TLR)のひとつTLR9のリガンドであるCpGの高濃度の投与による炎症状態,あるいは,リンパ球性脈絡髄膜炎ウイルスC13株の感染により,単球に由来する樹状細胞による血球の貪食が誘導されることを見い出し,その分子機構を明らかにした.さらに,この血球の貪食が過剰な免疫反応を制御する新規の免疫制御機構であることを明らかにした.
1.Toll様受容体のリガンドは血球の貪食を誘導する
マウスに重篤な炎症反応を誘導する目的で,TLR9のリガンドであるCpGを高濃度で投与したところ,末梢血において血球の貪食が誘導された.この血球の貪食はフローサイトメーター解析により検出することができ,この細胞を分画しDiff-Quick染色あるいは電子顕微鏡にて解析したところ,骨髄系細胞により赤芽球が貪食されている像が確認された.この血球の貪食は,末梢血にくわえ骨髄および脾臓と,全身において検出された.さらに詳細な解析により,CpGの投与により発熱,脾腫,血球の減少,高トリグリセリド症,炎症性サイトカインの産生が誘導され,これらの結果はヒトの血球貪食症候群の診断基準をみたし,マウスにおいて血球貪食症候群モデルが樹立されたものと判定した.
血球を貪食している細胞を明らかにするため,この細胞の表面抗原を解析したところ,炎症性の単球に由来する樹状細胞であることが判明した6).炎症状態やウイルスの感染のときにおけるこれら炎症性の単球の骨髄から末梢組織への動員は,ケモカイン受容体CCR2に依存することが報告されている6).そこで,CpGを投与したのちの血清におけるCCR2のリガンドであるCCL2,CCL7,CCL12の濃度をELISA法により測定したところ,これらのリガンドは投与ののち3時間ですみやかに産生されていた.CCR2ノックアウトマウスにCpGを投与したところ,末梢血における血球の貪食は野生型マウスと比較して著しく減少していた.一方で,CCR2ノックアウトマウスの骨髄における血球の貪食は野生型マウスと同じように誘導されていた.これらの結果から,CpGの投与ののち,単球に由来する樹状細胞はケモカイン受容体CCR2に依存的に骨髄から末梢組織へと動員され,血球を貪食していることが明らかになった.
2.血球の貪食の分子機構
アポトーシスを起こした細胞は“find me”シグナルとよばれる細胞外ATPや細胞外UTPを放出することにより貪食細胞をひきよせ,“eat me”シグナルとよばれるホスファチジルセリンを細胞膜の外側に露出し,これを貪食細胞が認識することにより貪食が起こっている7).そこで,樹立された血球貪食症候群モデルにおいて,これら分子の関与について検討した.CpGを投与したのち血清におけるATPの濃度を測定したところ,投与ののち6時間をピークに,対照のマウスと比べ約8倍に上昇した.また,単球に由来する樹状細胞は細胞外ATPの受容体であるP2Y2を発現していることが定量PCR法により確認された.さらに,P2Y2の結合阻害剤であるスラミンをマウスに投与すると,末梢血における血球の貪食は抑制された.一方,CpGの投与ののち2時間で赤芽球にアポトーシスが誘導され,細胞膜の外側にはホスファチジルセリンが露出していることが明らかになった.また,単球に由来する樹状細胞はホスファチジルセリン受容体として,αVインテグリン,β3インテグリン,および,Tim-1,Tim-4を発現していた.さらに,これらのホスファチジルセリン受容体に対する中和抗体を投与したところ,血球の貪食は有意に抑制された.これらの結果から,単球に由来する樹状細胞は“find me”シグナルおよび“eat me”シグナルを介してアポトーシスを起こした赤芽球を貪食していることが明らかになった.
3.ウイルスに感染したときの血球の貪食
ヒトでは,慢性感染をひき起こすEpstein-Barrウイルスやサイトメガロウイルスの感染などにより血球貪食症候群が誘導される8).そこで,マウスに慢性感染をひき起こすリンパ球性脈絡髄膜炎ウイルスC13株を感染させたところ,CpGを投与したマウスと同様に,単球に由来する樹状細胞による血球の貪食が誘導された.リンパ球性脈絡髄膜炎ウイルスC13株に感染したマウスにおいても赤芽球はアポトーシスを起こし,単球に由来する樹状細胞はホスファチジルセリン受容体を発現していた.I型インターフェロン受容体を欠損したマウスにリンパ球性脈絡髄膜炎ウイルスC13株を感染させたところ,赤芽球における細胞膜へのホスファチジルセリンの露出,および,単球に由来する樹状細胞におけるホスファチジルセリン受容体の発現はともに低下し,血球の貪食はほとんど誘導されなかった.さらに,ex vivoにおいて,I型インターフェロンは赤芽球におけるアポトーシスの誘導および単球に由来する樹状細胞におけるホスファチジルセリン受容体の発現を直接に誘導していることが明らかになった.これらの結果から,マウスがリンパ球性脈絡髄膜炎ウイルスC13株に感染したときの血球の貪食には,I型インターフェロンが必須であることが示唆された.
4.ウイルスの感染における血球の貪食の免疫学的な意義
これまで,炎症の際にアポトーシスを起こした細胞を貪食した貪食細胞は抑制性サイトカインであるインターロイキン10やTGFβを産生することにより,炎症性サイトカインの産生を抑制していることが報告されている9).また,マウスへのリンパ球性脈絡髄膜炎ウイルスC13株の感染においてはインターロイキン10が産生され,このウイルスに特異的な細胞傷害性T細胞の疲弊が誘導されて慢性感染につながることが報告されているが,インターロイキン10の産生機構は不明である10).筆者らも,リンパ球性脈絡髄膜炎ウイルスC13株の感染によりマウスにおいてインターロイキン10およびTGFβが産生されることを確認した.そこで,マウスへのリンパ球性脈絡髄膜炎ウイルスC13株の感染における血球の貪食およびインターロイキン10の産生の免疫学的な意義について検討した.リンパ球性脈絡髄膜炎ウイルスC13株に感染したマウスに抗ホスファチジルセリン受容体中和抗体を投与すると,血球の貪食とインターロイキン10の産生が低下した.さらに,インターロイキン10を産生する細胞を同定するため,インターロイキン10のレポーターマウスにリンパ球性脈絡髄膜炎ウイルスC13株を感染させ解析したところ,単球に由来する樹状細胞がインターロイキン10のおもな産生細胞であった.また,リンパ球性脈絡髄膜炎ウイルスC13株への感染ののち12時間の骨髄から炎症性単球と赤芽球を純化しこれらを共培養したところ,単球に由来する樹状細胞による貪食が誘導されインターロイキン10が産生されることを見い出した.このex vivoモデルに抗ホスファチジルセリン受容体中和抗体をくわえると,血球の貪食およびインターロイキン10の産生が抑制され,単球に由来する樹状細胞は貪食に依存して抑制性サイトカインであるインターロイキン10を産生することが明らかになった.
また興味深いことに,リンパ球性脈絡髄膜炎ウイルスC13株に感染したマウスに抗ホスファチジルセリン受容体中和抗体を投与し血球の貪食を抑制すると,このウイルスに特異的な細胞傷害性T細胞が対照となるマウスに比べ増加し,かつ,この細胞傷害性T細胞からのインターフェロンγの産生が増加し,その結果,血中のウイルス力価は著しく低下した.しかし,このマウスでは血中の肝障害のマーカーの値が上昇し,肝臓へのリンパ球の浸潤および重度の肝障害が誘導され,2週間以内に半数のマウスが死亡した.さらに,単球に由来する樹状細胞の産生するインターロイキン10の免疫学的な意義を検討するため,この樹状細胞からインターロイキン10が産生されないようなコンディショナルノックアウトマウスにリンパ球性脈絡髄膜炎ウイルスC13株を感染させたところ,抗ホスファチジルセリン受容体中和抗体の投与により血球の貪食を抑制したリンパ球性脈絡髄膜炎ウイルスC13株に感染したマウスと同様に,血中のインターロイキン10の有意な低下にともない,リンパ球性脈絡髄膜炎ウイルスC13株に特異的な細胞傷害性T細胞の活性の亢進と,細胞傷害性T細胞に依存性の肝障害の誘導,さらに,このマウスの死亡率の上昇が観察された.
これらの結果,単球に由来する樹状細胞は血球を貪食し,抑制性サイトカインであるインターロイキン10を産生して,ウイルスの感染における過剰な免疫応答を制御していることが明らかになった.
おわりに
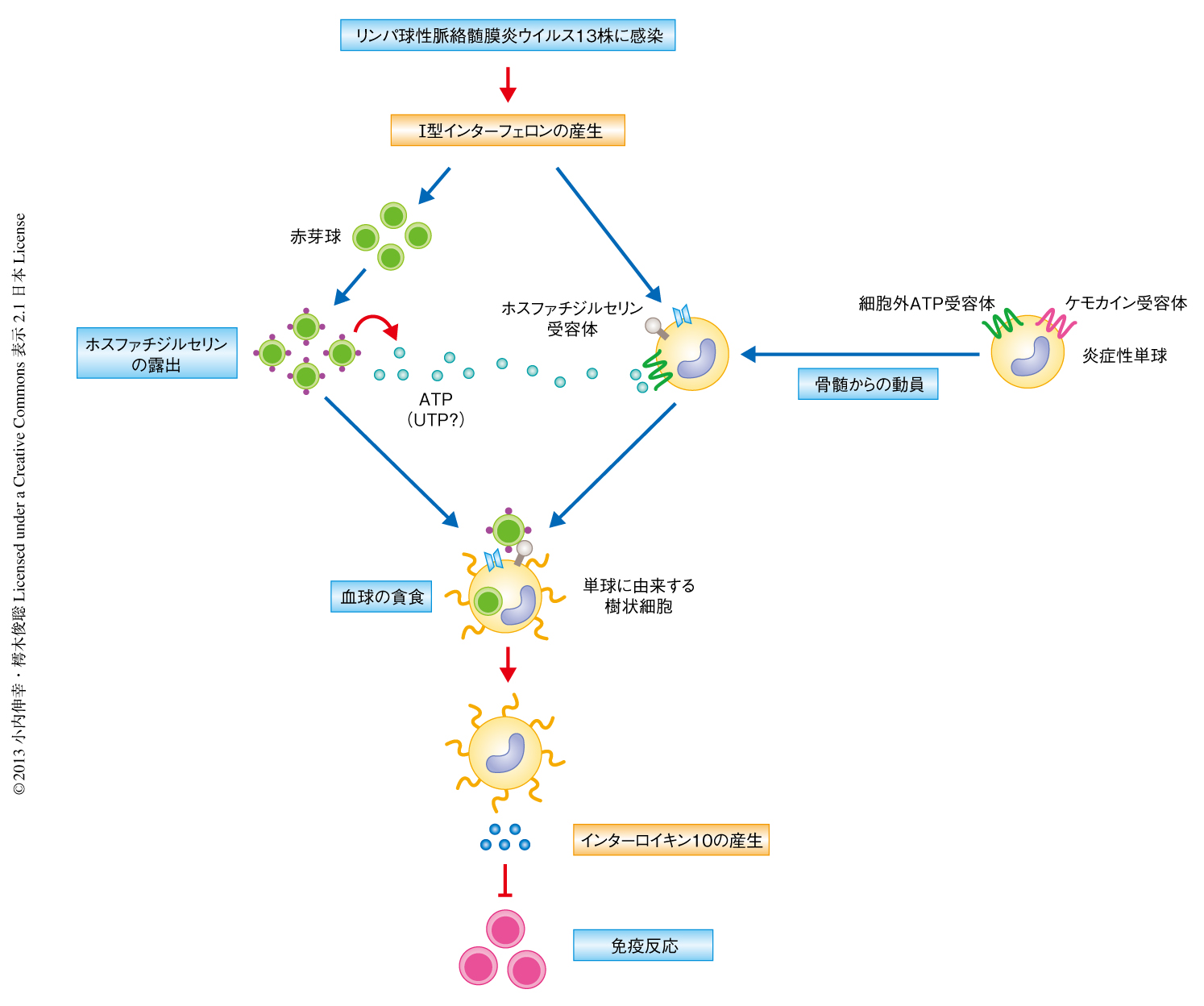
血球貪食症候群は,重篤な炎症反応,微生物の感染,また,さまざまな疾患においてしばしば観察される病態であり,貪食は重度の炎症の指標として考えられていたが,その機構および免疫学的な意義については不明であった.この研究において,I型インターフェロンに依存しておもに赤芽球にアポトーシスが誘導され,細胞外ATP(あるいは,細胞外UTP)を放出し単球に由来する樹状細胞をひきよせ,一方,骨髄からケモカイン受容体CCR2に依存して動員された炎症性の単球は単球に由来する樹状細胞へと分化して活性化し,I型インターフェロンの刺激に依存してホスファチジルセリン受容体を発現しアポトーシスを起こした赤芽球を貪食し,抑制性サイトカインであるインターロイキン10を産生することが明らかになった(図1).また,これまで,炎症の刺激をうけた貪食細胞がネクローシスを起こした細胞を貪食した場合には炎症性サイトカインを産生し,アポトーシスを起こした細胞を貪食した場合には抑制性サイトカインを産生することがex vivoの実験結果から示されていたが,この研究において,アポトーシスを起こした赤芽球を貪食した単球に由来する樹状細胞が抑制性サイトカインであるインターロイキン10を産生することが,in vivoにおいてはじめて明らかにされた.
図1 血球の貪食の分子機構と免疫制御機構
リンパ球性脈絡髄膜炎ウイルス13株の感染により産生されたI型インターフェロンにより,赤芽球の細胞膜の外側にホスファチジルセリンが露出し,これが単球に由来する樹状細胞のもつホスファチジルセリン受容体に認識されて血球の貪食が誘導される.その結果,単球に由来する樹状細胞から抑制性サイトカインであるインターロイキン10が産生され,過剰な免疫反応が抑制される.
[Download]
リンパ球性脈絡髄膜炎ウイルス13株の感染により産生されたI型インターフェロンにより,赤芽球の細胞膜の外側にホスファチジルセリンが露出し,これが単球に由来する樹状細胞のもつホスファチジルセリン受容体に認識されて血球の貪食が誘導される.その結果,単球に由来する樹状細胞から抑制性サイトカインであるインターロイキン10が産生され,過剰な免疫反応が抑制される.
[Download]
免疫系は外来のさまざまな病原性微生物から自己を守るため,また,自己と非自己を特異的に認識するため多様性を獲得し,病原性微生物をより効率よく排除するよう進化してきた.一方で,全身性の重度なウイルス感染の場合,これらのウイルスをすべて排除しようとすると細胞傷害性T細胞により自己の組織も攻撃され,場合によっては死にいたる.そこで,宿主は免疫反応を適度に制御し,病原性微生物の完全な排除ではなく共存というかたちを選択したのではないかと推測される.実際,リンパ球性脈絡髄膜炎ウイルスC13株のほかのウイルス,単純ヘルペスウイルス,インフルエンザウイルスPR8,ワクシニアウイルスの感染において,血球の貪食およびインターロイキン10の産生が誘導されることが見い出されている.この研究において発見された新規の免疫制御機構が,炎症状態や病原性微生物の感染において普遍的な機構であるかどうか,今後,さらなる解析が必要である.一方で,この発見が慢性感染の成立機構の解明や治療法の開発へと貢献できれば幸いである.
文 献
- Kawai, T. & Akira, S.: The role of pattern-recognition receptors in innate immunity: update on Toll-like receptors. Nat. Immunol., 11, 373-384 (2010)[PubMed]
- Medzhitov, R. & Janeway, C. A. Jr.: Innate immunity: the virtues of a nonclonal system of recognition. Cell, 91, 295-298 (1997)[PubMed]
- Banchereau, J. J., Briere, F., Caux, C. et al.: Immunobiology of dendritic cells. Annu. Rev. Immunol., 18, 767-811 (2000)[PubMed]
- Rouse, B. T. & Sehrawat, S.: Immunity and immunopathology to viruses: what decides the outcome? Nat. Rev. Immunol., 10, 514-526 (2010)[PubMed]
- Schneider, D. S. & Ayres, J. S.: Two ways to survive infection: what resistance and tolerance can teach us about treating infectious diseases. Nat. Rev. Immunol., 8, 889-895 (2008)[PubMed]
- Serbina, N. V., Jia T., Hohl, T. M. et al.: Monocyte-mediated defense against microbial pathogens. Annu. Rev. Immunol., 26, 421-452 (2008)[PubMed]
- Nagata, S., Hanayama, R. & Kawane, K.: Autoimmunity and the clearance of dead cells. Cell, 140, 619-630 (2010)[PubMed]
- Maakaroun, N. R., Moanna, A., Jacob, J. T. et al.: Viral infections associated with haemophagocytic syndrome. Rev. Med. Virol., 20, 93-105 (2010)[PubMed]
- Byrne, A. & Reen, D. J.: Lipopolysaccharide induces rapid production of IL-10 by monocytes in the presence of apoptotic neutrophils. J. Immunol., 168, 1968-1977 (2002)[PubMed]
- Brooks, D. G., Trifilo, M. J., Edelmann, K. H. et al.: Interleukin-10 determines viral clearance or persistence in vivo. Nat. Med., 12, 1301-1309 (2006)[PubMed]
著者プロフィール
略歴:2000年 東京大学大学院医学系研究科博士課程 修了,同年 同 助手,2001年 スイスInstitute for Research in Biomedicineポスドク,2006年 秋田大学大学院医学系研究科 助手,2008年 同 講師を経て,2009年より東京医科歯科大学難治疾患研究所 講師.
研究テーマ:樹状細胞の分化の機構.
抱負:樹状細胞の分化の研究にくわえ,新たな研究テーマに挑みたい.
樗木 俊聡(Toshiaki Ohteki)
東京医科歯科大学難治疾患研究所 教授.
研究室URL:http://www.tmd.ac.jp/mri/bre/index.html
© 2013 小内伸幸・樗木俊聡 Licensed under CC 表示 2.1 日本