骨髄系の腫瘍におけるコヒーシン複合体の変異
昆 彩奈・小川誠司
(東京大学医学部附属病院 がんゲノミクスプロジェクト)
email:小川誠司
DOI: 10.7875/first.author.2013.120
Recurrent mutations in multiple components of the cohesin complex in myeloid neoplasms.
Ayana Kon, Lee-Yung Shih, Masashi Minamino, Masashi Sanada, Yuichi Shiraishi, Yasunobu Nagata, Kenichi Yoshida, Yusuke Okuno, Masashige Bando, Ryuichiro Nakato, Shumpei Ishikawa, Aiko Sato-Otsubo, Genta Nagae, Aiko Nishimoto, Claudia Haferlach, Daniel Nowak, Yusuke Sato, Tamara Alpermann, Masao Nagasaki, Teppei Shimamura, Hiroko Tanaka, Kenichi Chiba, Ryo Yamamoto, Tomoyuki Yamaguchi, Makoto Otsu, Naoshi Obara, Mamiko Sakata-Yanagimoto, Tsuyoshi Nakamaki, Ken Ishiyama, Florian Nolte, Wolf-Karsten Hofmann, Shuichi Miyawaki, Shigeru Chiba, Hiraku Mori, Hiromitsu Nakauchi, H Phillip Koeffler, Hiroyuki Aburatani, Torsten Haferlach, Katsuhiko Shirahige, Satoru Miyano, Seishi Ogawa
Nature Genetics, 45, 1232-1237 (2013)
コヒーシン複合体は細胞分裂における姉妹染色体の接着,DNA複製ののちの修復,遺伝子発現の制御などにかかわると考えられているタンパク質複合体である.今回,筆者らは,コヒーシン複合体の構成タンパク質であるSTAG2,RAD21,SMC1A,SMC3がさまざまな骨髄系の腫瘍において変異を生じていることを見い出した.これらの変異は互いに排他的に生じており,急性骨髄性白血病の12.1%,骨髄異形成症候群の8.0%,慢性骨髄単球性白血病の10.2%,慢性骨髄性白血病の6.3%,そのほかの骨髄増殖性疾患の1.3%において認められた.コヒーシン複合体の構成タンパク質に変異をもつ細胞では,クロマチン画分に結合するコヒーシン複合体の構成タンパク質が減少していたことから,クロマチンにおけるコヒーシン複合体の結合部位の減少が示唆された.RAD21遺伝子に変異をもつ白血病細胞株あるいはRAD21およびSTAG2の発現の低下を認める白血病細胞株に対し,変異あるいは欠失したコヒーシン複合体の構成タンパク質を発現させることにより増殖の抑制が認められた.これらの結果は,コヒーシン複合体の機能不全が骨髄系腫瘍の発症にかかわっていることを示唆すると考えられた.
近年,骨髄系の腫瘍に対する網羅的なゲノム解析による一連の遺伝子変異の解明により,その病態の解明において大きな進展が認められ,ヒストンの修飾やDNAメチル化にかかわる遺伝子の変異が白血病の発症において重要な役割を担うことが明らかにされつつあるが1),骨髄系腫瘍における遺伝子変異の標的に関する知見についてはいまだ不十分と考えられる.以前に,筆者らは,骨髄系腫瘍における主要な遺伝子変異を同定することを目的として,29例の骨髄異形成症候群において全エキソン解析を行った.その結果,RNAスプライシングにかかわる一群の遺伝子が骨髄の異形成をともなう腫瘍において高頻度かつ特異的に変異を生じていることが明らかになったが2)(新着論文レビュー でも掲載),そのほかにも,これまで報告されてない多数の遺伝子変異が見い出された.それらのほとんどは単一の症例にのみ認められる変異であり,おそらくは白血病とは機能的な関連のない変異と考えられたが,全エキソン解析について検証を進めた結果,複数の症例において変異をもつ新たな遺伝子として,コヒーシン複合体の主要な構成タンパク質のひとつをコードするSTAG2遺伝子を見い出した.くわえて,単一の症例のみにみとめられた変異であったが,コヒーシン複合体に関連するほかの遺伝子としてSTAG1遺伝子およびPDS5B遺伝子に変異が認められた.
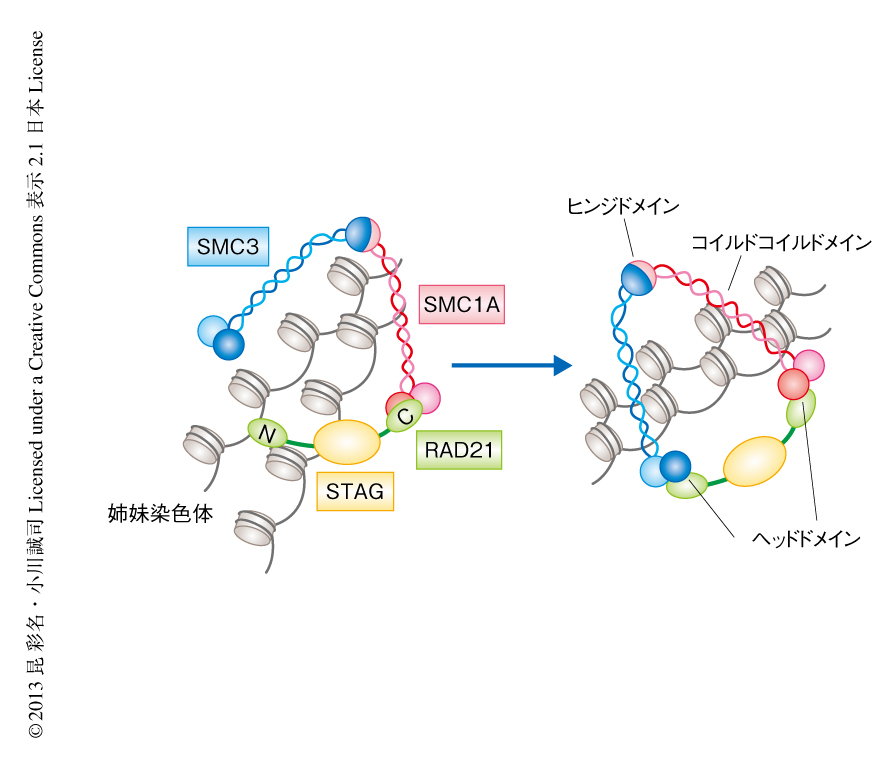
コヒーシン複合体は種間において保存されたタンパク質複合体であり,主要な構成タンパク質であるSMC1A,SMC3,RAD21,STAG1,STAG2と,これに関連してコヒーシン複合体の機能の制御にかかわると考えられるPDS5B,NIPBL,ESCO1,ESCO2が存在する3)(図1).現在,広く受け入れられているモデルによれば,コヒーシン複合体の主要な構成タンパク質は2本のクロマチン鎖を束ねるリング様の構造を形成し,細胞分裂における姉妹染色体の接着や,DNA複製ののちのDNA修復,また,長距離に及ぶシスの相互作用をつうじたゲノムワイドな遺伝子発現の制御にかかわると推測されている3).また,コヒーシン複合体の構成タンパク質の杯細胞における変異は,先天性の多臓器形成不全症を呈するCornelia de Lange症候群やRoberts症候群の原因であることが明らかにされている4).そこで,筆者らは,骨髄系の腫瘍においてコヒーシン複合体における変異の意義を明らかにすることを目的として,さまざまな病型を含む601例の骨髄系腫瘍の検体について,コヒーシン複合体の構成タンパク質および関連タンパク質における遺伝子変異を高速シークエンシング法により検討した.452例の試料については,SNPアレイによるゲノムコピー数の変化の解析もあわせて行った.
dbSNP131データベースおよび1000ゲノム計画に登録のある既知の多型,および,機能予測プログラムにより多型の疑われる変異を除いたのち,Sanger法による塩基配列決定により60個の非同義変異を確認した(図2).骨髄異形成症候群における全エキソン解析の結果から予測されたゲノムの全域におけるランダムな変異率により補正した結果,STAG2遺伝子,RAD21遺伝子,SMC1A遺伝子,SMC3遺伝子が統計的に有意に変異を生じていると考えられた.これらの遺伝子のうち,STAG2遺伝子およびRAD21遺伝子についてはSNPアレイによるゲノムコピー数の解析において5つの欠失が同定された.また,骨髄系白血病に由来する34個の細胞株において,これらの4つの遺伝子に5つの変異が見い出された.変異は互いに排他的であり,急性骨髄性白血病,慢性骨髄単球性白血病,骨髄異形成症候群,慢性骨髄性白血病を含むさまざまな骨髄系の腫瘍において認められたが,骨髄増殖性疾患における変異はまれであった.
杯細胞に由来するDNAの解析が可能であった17個の変異については,変異の体細胞性の起源が確認された.また,20の症例に認められた23個の男性例におけるSTAG2遺伝子およびSMC1A遺伝子(ともに,X染色体にコードされる遺伝子で,男性では1つの対立遺伝子のみ存在する)の変異については,正常な細胞に由来すると思われる野生型の対立遺伝子が腫瘍の検体に確認されたことから,体細胞に由来することが推定された.20個の変異については,パイロシークエンシング法,ディープシークエンシング法,デジタルPCR法により測定された対立遺伝子の頻度がSNPから予測された対立遺伝子の頻度と有意な解離が認められたことから,その体細胞性の起源が推測された.さらに,33個のSTAG2遺伝子の変異のうち32個,および,全9個のRAD21遺伝子の変異は,タンパク質の異常な短小化をきたすと予測されるナンセンス変異,フレームシフト変異,スプライス部位の変異であった.これらの結果より,コヒーシン複合体における変異の大多数は,タンパク質の機能的な障害をともなう体細胞性の変異であると考えられた.X染色体にコードされるSTAG2遺伝子およびSMC1A遺伝子の男性例における変異を除き,コヒーシン複合体におけるほとんどの変異および欠失はヘテロ接合性であった.女性例においては,変異の状態にかかわらずSTAG2遺伝子のプロモーターはX染色体の不活性化に関連して高度にDNAメチル化をうけており,不活性化されていないほうのSTAG2遺伝子のDNAメチル化はSTAG2遺伝子の両方の対立遺伝子の不活性化を生じると考えられた.
コヒーシン複合体における変異の機能的な効果について検討した.4個のコヒーシン複合体の変異細胞株を含む17個の骨髄性白血病に由来する細胞株において,STAG1,STAG2,RAD21,SMC3,SMC1A,NIPBLの発現をウェスタンブロット法により検討したところ,RAD21遺伝子のフレームシフト変異をもつ細胞株ではRAD21の発現低下が認められたが,コヒーシン複合体の遺伝子にほかの変異をもつ細胞株では変異遺伝子の発現の有意な低下は認められなかった.一方,コヒーシン複合体の遺伝子に変異は認められないにもかかわらず,STAG2,および,STAG1,STAG2,RAD21,NIPBLの発現の有意な低下の認められる細胞株が存在した.これらの例を除くと,全可溶化画分におけるコヒーシン複合体の構成タンパク質の発現とコヒーシン複合体の変異に有意な相関は認められなかったが,クロマチン結合画分においては,1つ以上のコヒーシン複合体の構成タンパク質の変異あるいは発現の低下をともなう細胞株において,SMC1A,SMC3,RAD21,STAG2を含む1つ以上のコヒーシン複合体の構成タンパク質の発現の有意な低下が認められた.すなわち,コヒーシン複合体の構成タンパク質ひとつにおける障害により,クロマチンに結合するコヒーシン複合体が減少する可能性が示唆された.
RAD21遺伝子の変異をもつ白血病細胞株,および,RAD21およびSTAG2の発現の低下を認める細胞株に,野生型のRAD21,および,野生型のRAD21あるいは野生型のSTAG2を強制発現させることにより,コヒーシン複合体における変異および発現低下の細胞増殖に及ぼす効果について検討した.野生型の対立遺伝子の発現によりそれら細胞株の増殖は有意に抑制されたが,これらの変異あるいは発現低下を認めない細胞株においては増殖の有意な抑制は観察されなかったことから,これらのコヒーシン複合体の構成タンパク質の変異あるいは発現低下は,コヒーシン複合体の異常をともなうこれらの白血病細胞の増殖に関与している可能性が示された.
発現アレイ法およびqPCR法により,RAD21遺伝子の変異をもつ白血病細胞株において,野生型のRAD21遺伝子の発現による遺伝子発現プロファイルの変化について検討した.一般に,コヒーシン複合体の遺伝子の導入による遺伝子発現の変化は小さいことが報告されているが5),今回の検討においても,遺伝子発現の変化は全体として小さいことが確認された.しかし,63個の遺伝子については再現性のある遺伝子発現の変化が確認され,コヒーシン複合体に変異をもつ白血病細胞ではコヒーシン複合体の機能的な異常により遺伝子発現の変化が誘導される可能性が示唆された.
急性骨髄性白血病および骨髄異形成症候群におけるコヒーシン複合体に関連する遺伝子変異は,近年,ほかのグループからも報告されており6,7),また,より低頻度ではあるが,グリオブラストーマ,メラノーマ,Ewing肉腫におけるSTAG2遺伝子の変異や5),大腸がんにおけるSMC1A遺伝子,NIPBL遺伝子,STAG3遺伝子,SMC3遺伝子の変異が報告されている8).従来,固形腫瘍における報告では,コヒーシン複合体の機能低下により細胞分裂における姉妹染色体の接合の異常が生じる結果,染色体の異数性が惹起され,このことが細胞のがん化にかかわる可能性が示唆されてきた.一方,骨髄系の腫瘍においては,コヒーシン複合体における変異と染色体の異数性に明確な関連はなく,実際に今回の解析においても,コヒーシン複合体に変異を認める43例の染色体の核型は二倍体あるいは近二倍体を示し,23例では完全に正常な核型が認められた.したがって,少なくともこうした正常な核型をもつ症例においては,コヒーシン複合体の変異は染色体の異数性により選択されているわけではない.このことと関連して,RAD21遺伝子の出芽酵母における相同遺伝子であるscc1p遺伝子では,その発現が正常の13%程度に低下しても姉妹染色体の接着の機能は正常に維持されることが示されている9).また,コヒーシン複合体の変異あるいは発現低下を認める細胞株においても,姉妹染色体の接着はほぼ正常に保たれていた.
近年,コヒーシン複合体が長距離に及ぶシスの相互作用をつうじてグローバルな遺伝子発現の制御にかかわることを示唆する証拠が得られつつある.ゼブラフィッシュにおいては,Rad21およびSmc3が造血系の制御に不可欠なRunx1の発現制御に関与することが示されており,また,ショウジョウバエにおける実験結果では,NIPBL遺伝子の相同遺伝子であるNipped-B遺伝子の発現が80%まで障害されても染色体の分配に異常は生じないが,遺伝子発現の制御に障害が認められる.さらに筆者らは,コヒーシン複合体の結合部位を中等度(17~28%)に消失する場合においても,グローバルな遺伝子発現の異常の生じることを報告している10).こうした観察結果は,コヒーシン複合体の変異が遺伝子発現の異常をつうじて骨髄系細胞の正常な産生を障害することにより,白血病化にかかわる可能性を示唆する.
今回,筆者らは,コヒーシン複合体の構成タンパク質がさまざまな骨髄系腫瘍において遺伝子変異を生じていることを報告した.細胞遺伝学的な観察結果によれば,これらのコヒーシン複合体の変異による白血病化の分子機構は,少なくともin vivoにおいては染色体の異数性を誘導する結果ではなく,おそらくは,遺伝子発現の制御にかかわるコヒーシン複合体の機能異常に関連していることが示唆された.最後に,コヒーシン複合体に変異をもつがん細胞ではコヒーシン複合体のさらなる阻害に対する感受性が亢進している可能性が示唆されたことから,これを標的とした白血病の治療薬の開発にも期待がもたれる.
略歴:東京大学大学院医学系研究科博士課程 在学中.
研究テーマ:造血器腫瘍のゲノム解析および分子生物学.
抱負:白血病に代表される造血器腫瘍の発症機構を解明し新しい治療法を確立するために,最先端のゲノム解析技術や,分子レベルでの機能解析,動物モデルの解析などの手法を駆使して研究していきたい.
小川 誠司(Seishi Ogawa)
京都大学大学院医学研究科 教授.
© 2013 昆 彩奈・小川誠司 Licensed under CC 表示 2.1 日本
(東京大学医学部附属病院 がんゲノミクスプロジェクト)
email:小川誠司
DOI: 10.7875/first.author.2013.120
Recurrent mutations in multiple components of the cohesin complex in myeloid neoplasms.
Ayana Kon, Lee-Yung Shih, Masashi Minamino, Masashi Sanada, Yuichi Shiraishi, Yasunobu Nagata, Kenichi Yoshida, Yusuke Okuno, Masashige Bando, Ryuichiro Nakato, Shumpei Ishikawa, Aiko Sato-Otsubo, Genta Nagae, Aiko Nishimoto, Claudia Haferlach, Daniel Nowak, Yusuke Sato, Tamara Alpermann, Masao Nagasaki, Teppei Shimamura, Hiroko Tanaka, Kenichi Chiba, Ryo Yamamoto, Tomoyuki Yamaguchi, Makoto Otsu, Naoshi Obara, Mamiko Sakata-Yanagimoto, Tsuyoshi Nakamaki, Ken Ishiyama, Florian Nolte, Wolf-Karsten Hofmann, Shuichi Miyawaki, Shigeru Chiba, Hiraku Mori, Hiromitsu Nakauchi, H Phillip Koeffler, Hiroyuki Aburatani, Torsten Haferlach, Katsuhiko Shirahige, Satoru Miyano, Seishi Ogawa
Nature Genetics, 45, 1232-1237 (2013)
要 約
コヒーシン複合体は細胞分裂における姉妹染色体の接着,DNA複製ののちの修復,遺伝子発現の制御などにかかわると考えられているタンパク質複合体である.今回,筆者らは,コヒーシン複合体の構成タンパク質であるSTAG2,RAD21,SMC1A,SMC3がさまざまな骨髄系の腫瘍において変異を生じていることを見い出した.これらの変異は互いに排他的に生じており,急性骨髄性白血病の12.1%,骨髄異形成症候群の8.0%,慢性骨髄単球性白血病の10.2%,慢性骨髄性白血病の6.3%,そのほかの骨髄増殖性疾患の1.3%において認められた.コヒーシン複合体の構成タンパク質に変異をもつ細胞では,クロマチン画分に結合するコヒーシン複合体の構成タンパク質が減少していたことから,クロマチンにおけるコヒーシン複合体の結合部位の減少が示唆された.RAD21遺伝子に変異をもつ白血病細胞株あるいはRAD21およびSTAG2の発現の低下を認める白血病細胞株に対し,変異あるいは欠失したコヒーシン複合体の構成タンパク質を発現させることにより増殖の抑制が認められた.これらの結果は,コヒーシン複合体の機能不全が骨髄系腫瘍の発症にかかわっていることを示唆すると考えられた.
はじめに
近年,骨髄系の腫瘍に対する網羅的なゲノム解析による一連の遺伝子変異の解明により,その病態の解明において大きな進展が認められ,ヒストンの修飾やDNAメチル化にかかわる遺伝子の変異が白血病の発症において重要な役割を担うことが明らかにされつつあるが1),骨髄系腫瘍における遺伝子変異の標的に関する知見についてはいまだ不十分と考えられる.以前に,筆者らは,骨髄系腫瘍における主要な遺伝子変異を同定することを目的として,29例の骨髄異形成症候群において全エキソン解析を行った.その結果,RNAスプライシングにかかわる一群の遺伝子が骨髄の異形成をともなう腫瘍において高頻度かつ特異的に変異を生じていることが明らかになったが2)(新着論文レビュー でも掲載),そのほかにも,これまで報告されてない多数の遺伝子変異が見い出された.それらのほとんどは単一の症例にのみ認められる変異であり,おそらくは白血病とは機能的な関連のない変異と考えられたが,全エキソン解析について検証を進めた結果,複数の症例において変異をもつ新たな遺伝子として,コヒーシン複合体の主要な構成タンパク質のひとつをコードするSTAG2遺伝子を見い出した.くわえて,単一の症例のみにみとめられた変異であったが,コヒーシン複合体に関連するほかの遺伝子としてSTAG1遺伝子およびPDS5B遺伝子に変異が認められた.
コヒーシン複合体は種間において保存されたタンパク質複合体であり,主要な構成タンパク質であるSMC1A,SMC3,RAD21,STAG1,STAG2と,これに関連してコヒーシン複合体の機能の制御にかかわると考えられるPDS5B,NIPBL,ESCO1,ESCO2が存在する3)(図1).現在,広く受け入れられているモデルによれば,コヒーシン複合体の主要な構成タンパク質は2本のクロマチン鎖を束ねるリング様の構造を形成し,細胞分裂における姉妹染色体の接着や,DNA複製ののちのDNA修復,また,長距離に及ぶシスの相互作用をつうじたゲノムワイドな遺伝子発現の制御にかかわると推測されている3).また,コヒーシン複合体の構成タンパク質の杯細胞における変異は,先天性の多臓器形成不全症を呈するCornelia de Lange症候群やRoberts症候群の原因であることが明らかにされている4).そこで,筆者らは,骨髄系の腫瘍においてコヒーシン複合体における変異の意義を明らかにすることを目的として,さまざまな病型を含む601例の骨髄系腫瘍の検体について,コヒーシン複合体の構成タンパク質および関連タンパク質における遺伝子変異を高速シークエンシング法により検討した.452例の試料については,SNPアレイによるゲノムコピー数の変化の解析もあわせて行った.
1.コヒーシン複合体における変異
dbSNP131データベースおよび1000ゲノム計画に登録のある既知の多型,および,機能予測プログラムにより多型の疑われる変異を除いたのち,Sanger法による塩基配列決定により60個の非同義変異を確認した(図2).骨髄異形成症候群における全エキソン解析の結果から予測されたゲノムの全域におけるランダムな変異率により補正した結果,STAG2遺伝子,RAD21遺伝子,SMC1A遺伝子,SMC3遺伝子が統計的に有意に変異を生じていると考えられた.これらの遺伝子のうち,STAG2遺伝子およびRAD21遺伝子についてはSNPアレイによるゲノムコピー数の解析において5つの欠失が同定された.また,骨髄系白血病に由来する34個の細胞株において,これらの4つの遺伝子に5つの変異が見い出された.変異は互いに排他的であり,急性骨髄性白血病,慢性骨髄単球性白血病,骨髄異形成症候群,慢性骨髄性白血病を含むさまざまな骨髄系の腫瘍において認められたが,骨髄増殖性疾患における変異はまれであった.
杯細胞に由来するDNAの解析が可能であった17個の変異については,変異の体細胞性の起源が確認された.また,20の症例に認められた23個の男性例におけるSTAG2遺伝子およびSMC1A遺伝子(ともに,X染色体にコードされる遺伝子で,男性では1つの対立遺伝子のみ存在する)の変異については,正常な細胞に由来すると思われる野生型の対立遺伝子が腫瘍の検体に確認されたことから,体細胞に由来することが推定された.20個の変異については,パイロシークエンシング法,ディープシークエンシング法,デジタルPCR法により測定された対立遺伝子の頻度がSNPから予測された対立遺伝子の頻度と有意な解離が認められたことから,その体細胞性の起源が推測された.さらに,33個のSTAG2遺伝子の変異のうち32個,および,全9個のRAD21遺伝子の変異は,タンパク質の異常な短小化をきたすと予測されるナンセンス変異,フレームシフト変異,スプライス部位の変異であった.これらの結果より,コヒーシン複合体における変異の大多数は,タンパク質の機能的な障害をともなう体細胞性の変異であると考えられた.X染色体にコードされるSTAG2遺伝子およびSMC1A遺伝子の男性例における変異を除き,コヒーシン複合体におけるほとんどの変異および欠失はヘテロ接合性であった.女性例においては,変異の状態にかかわらずSTAG2遺伝子のプロモーターはX染色体の不活性化に関連して高度にDNAメチル化をうけており,不活性化されていないほうのSTAG2遺伝子のDNAメチル化はSTAG2遺伝子の両方の対立遺伝子の不活性化を生じると考えられた.
2.コヒーシン複合体における変異の機能
コヒーシン複合体における変異の機能的な効果について検討した.4個のコヒーシン複合体の変異細胞株を含む17個の骨髄性白血病に由来する細胞株において,STAG1,STAG2,RAD21,SMC3,SMC1A,NIPBLの発現をウェスタンブロット法により検討したところ,RAD21遺伝子のフレームシフト変異をもつ細胞株ではRAD21の発現低下が認められたが,コヒーシン複合体の遺伝子にほかの変異をもつ細胞株では変異遺伝子の発現の有意な低下は認められなかった.一方,コヒーシン複合体の遺伝子に変異は認められないにもかかわらず,STAG2,および,STAG1,STAG2,RAD21,NIPBLの発現の有意な低下の認められる細胞株が存在した.これらの例を除くと,全可溶化画分におけるコヒーシン複合体の構成タンパク質の発現とコヒーシン複合体の変異に有意な相関は認められなかったが,クロマチン結合画分においては,1つ以上のコヒーシン複合体の構成タンパク質の変異あるいは発現の低下をともなう細胞株において,SMC1A,SMC3,RAD21,STAG2を含む1つ以上のコヒーシン複合体の構成タンパク質の発現の有意な低下が認められた.すなわち,コヒーシン複合体の構成タンパク質ひとつにおける障害により,クロマチンに結合するコヒーシン複合体が減少する可能性が示唆された.
RAD21遺伝子の変異をもつ白血病細胞株,および,RAD21およびSTAG2の発現の低下を認める細胞株に,野生型のRAD21,および,野生型のRAD21あるいは野生型のSTAG2を強制発現させることにより,コヒーシン複合体における変異および発現低下の細胞増殖に及ぼす効果について検討した.野生型の対立遺伝子の発現によりそれら細胞株の増殖は有意に抑制されたが,これらの変異あるいは発現低下を認めない細胞株においては増殖の有意な抑制は観察されなかったことから,これらのコヒーシン複合体の構成タンパク質の変異あるいは発現低下は,コヒーシン複合体の異常をともなうこれらの白血病細胞の増殖に関与している可能性が示された.
発現アレイ法およびqPCR法により,RAD21遺伝子の変異をもつ白血病細胞株において,野生型のRAD21遺伝子の発現による遺伝子発現プロファイルの変化について検討した.一般に,コヒーシン複合体の遺伝子の導入による遺伝子発現の変化は小さいことが報告されているが5),今回の検討においても,遺伝子発現の変化は全体として小さいことが確認された.しかし,63個の遺伝子については再現性のある遺伝子発現の変化が確認され,コヒーシン複合体に変異をもつ白血病細胞ではコヒーシン複合体の機能的な異常により遺伝子発現の変化が誘導される可能性が示唆された.
急性骨髄性白血病および骨髄異形成症候群におけるコヒーシン複合体に関連する遺伝子変異は,近年,ほかのグループからも報告されており6,7),また,より低頻度ではあるが,グリオブラストーマ,メラノーマ,Ewing肉腫におけるSTAG2遺伝子の変異や5),大腸がんにおけるSMC1A遺伝子,NIPBL遺伝子,STAG3遺伝子,SMC3遺伝子の変異が報告されている8).従来,固形腫瘍における報告では,コヒーシン複合体の機能低下により細胞分裂における姉妹染色体の接合の異常が生じる結果,染色体の異数性が惹起され,このことが細胞のがん化にかかわる可能性が示唆されてきた.一方,骨髄系の腫瘍においては,コヒーシン複合体における変異と染色体の異数性に明確な関連はなく,実際に今回の解析においても,コヒーシン複合体に変異を認める43例の染色体の核型は二倍体あるいは近二倍体を示し,23例では完全に正常な核型が認められた.したがって,少なくともこうした正常な核型をもつ症例においては,コヒーシン複合体の変異は染色体の異数性により選択されているわけではない.このことと関連して,RAD21遺伝子の出芽酵母における相同遺伝子であるscc1p遺伝子では,その発現が正常の13%程度に低下しても姉妹染色体の接着の機能は正常に維持されることが示されている9).また,コヒーシン複合体の変異あるいは発現低下を認める細胞株においても,姉妹染色体の接着はほぼ正常に保たれていた.
近年,コヒーシン複合体が長距離に及ぶシスの相互作用をつうじてグローバルな遺伝子発現の制御にかかわることを示唆する証拠が得られつつある.ゼブラフィッシュにおいては,Rad21およびSmc3が造血系の制御に不可欠なRunx1の発現制御に関与することが示されており,また,ショウジョウバエにおける実験結果では,NIPBL遺伝子の相同遺伝子であるNipped-B遺伝子の発現が80%まで障害されても染色体の分配に異常は生じないが,遺伝子発現の制御に障害が認められる.さらに筆者らは,コヒーシン複合体の結合部位を中等度(17~28%)に消失する場合においても,グローバルな遺伝子発現の異常の生じることを報告している10).こうした観察結果は,コヒーシン複合体の変異が遺伝子発現の異常をつうじて骨髄系細胞の正常な産生を障害することにより,白血病化にかかわる可能性を示唆する.
おわりに
今回,筆者らは,コヒーシン複合体の構成タンパク質がさまざまな骨髄系腫瘍において遺伝子変異を生じていることを報告した.細胞遺伝学的な観察結果によれば,これらのコヒーシン複合体の変異による白血病化の分子機構は,少なくともin vivoにおいては染色体の異数性を誘導する結果ではなく,おそらくは,遺伝子発現の制御にかかわるコヒーシン複合体の機能異常に関連していることが示唆された.最後に,コヒーシン複合体に変異をもつがん細胞ではコヒーシン複合体のさらなる阻害に対する感受性が亢進している可能性が示唆されたことから,これを標的とした白血病の治療薬の開発にも期待がもたれる.
文 献
- Bejar, R., Levine, R. & Ebert, B. L.: Unraveling the molecular pathophysiology of myelodysplastic syndromes. J. Clin. Oncol., 29, 504-515 (2011)[PubMed]
- Yoshida, K., Sanada, M., Shiraishi, Y. et al.: Frequent pathway mutations of splicing machinery in myelodysplasia. Nature, 478, 64-69 (2011)[PubMed] [新着論文レビュー]
- Nasmyth, K. & Haering, C. H.: Cohesin: its roles and mechanisms. Annu. Rev. Genet., 43, 525-558 (2009)[PubMed]
- Deardorff, M. A., Wilde, J. J., Albrecht, M. et al.: RAD21 mutations cause a human cohesinopathy. Am. J. Hum. Genet., 90, 1014-1027 (2012)[PubMed]
- Solomon, D. A., Kim, T., Diaz-Martinez, L. A. et al.: Mutational inactivation of STAG2 causes aneuploidy in human cancer. Science, 333, 1039-1043 (2011)[PubMed]
- Welch, J. S., Ley, T. J., Link, D. C. et al.: The origin and evolution of mutations in acute myeloid leukemia. Cell, 150, 264-278 (2012)[PubMed]
- The Cancer Genome Atlas Research Network.: Genomic and epigenomic landscapes of adult de novo acute myeloid leukemia. New Engl. J. Med., 368, 2059-2074 (2013)[PubMed]
- Barber, T. D., McManus, K., Yuen, K. W. et al.: Chromatid cohesion defects may underlie chromosome instability in human colorectal cancers. Proc. Natl. Acad. Sci. USA, 105, 3443-3448 (2008)[PubMed]
- Heidinger-Pauli, J. M., Mert, O., Davenport, C. et al.: Systematic reduction of cohesin differentially affects chromosome segregation, condensation, and DNA repair. Curr. Biol., 20, 957-963 (2010)[PubMed]
- Liu, J., Zhang, Z., Bando, M. et al.: Transcriptional dysregulation in NIPBL and cohesin mutant human cells. PLoS Biol., 7, e1000119 (2009)[PubMed]
著者プロフィール
略歴:東京大学大学院医学系研究科博士課程 在学中.
研究テーマ:造血器腫瘍のゲノム解析および分子生物学.
抱負:白血病に代表される造血器腫瘍の発症機構を解明し新しい治療法を確立するために,最先端のゲノム解析技術や,分子レベルでの機能解析,動物モデルの解析などの手法を駆使して研究していきたい.
小川 誠司(Seishi Ogawa)
京都大学大学院医学研究科 教授.
© 2013 昆 彩奈・小川誠司 Licensed under CC 表示 2.1 日本