ヒストン脱メチル化酵素Jmjd1aによるマウスにおける性決定のエピジェネティックな制御
黒木俊介・立花 誠
(京都大学ウイルス研究所 附属感染症モデル研究センターゲノム改変マウス研究領域)
email:黒木俊介,立花 誠
DOI: 10.7875/first.author.2013.116
Epigenetic regulation of mouse sex determination by the histone demethylase Jmjd1a.
Shunsuke Kuroki, Shogo Matoba, Mika Akiyoshi, Yasuko Matsumura, Hitoshi Miyachi, Nathan Mise, Kuniya Abe, Atsuo Ogura, Dagmar Wilhelm, Peter Koopman, Masami Nozaki, Yoshiakira Kanai, Yoichi Shinkai, Makoto Tachibana
Science, 341, 1106-1109 (2013)
発生における遺伝子の発現は,転写因子とヒストンの修飾を含めたエピゲノム状態とのあいだの相互作用により制御されている.哺乳類の性決定における遺伝子の発現制御については,重要な転写因子はいくつも明らかにされているものの,エピジェネティックな制御機構の関与についてはほとんど明らかになっていない.筆者らは,ヒストン脱メチル化酵素Jmjd1aを欠損させたマウスを作製したところ,このマウスは性染色体がXY型であるにもかかわらず雄から雌への性転換を起こすことを見い出した.さらに,Jmjd1aは胎仔期の未分化な性線に強く発現しており,性決定遺伝子であるSry遺伝子のプロモーター領域のヒストンから転写抑制のマークであるヒストンH3の9番目のリジン残基のメチル化を脱メチル化することにより,Sry遺伝子の発現を正に制御していることが示された.今回の研究により,ヒストンの修飾を介した遺伝子のエピジェネティックな発現制御が哺乳類の性決定において重要な役割をもつことが明らかになった.
ヒトを含むほとんどの哺乳類は,性染色体の組合せがXY型だと雄,XX型だと雌になる.Y染色体には性決定遺伝子であるSry遺伝子が存在し,胎児期のまだ未分化な性腺にSry遺伝子が発現すると性腺は精巣へと分化を開始し個体は雄になる.一方,XX型の胎児にはSry遺伝子が存在しないので性腺は卵巣へと分化し個体は雌になる1-3).哺乳類の性決定の過程においては,Sry遺伝子を頂点とする雄化のシグナルカスケード,および,そこに含まれる多くの転写因子の重要性が明らかになっているが,この過程における遺伝子のエピジェネティックな発現制御の関与についてはほとんどわかっていなかった.
DNAはヒストンとよばれるタンパク質複合体に巻きつきヌクレオソームを形成する.ヒストンは外的な環境の変化に応じ多様な化学修飾をうけ,それぞれの修飾はクロマチンの機能的な構造変換を介して遺伝子の発現を正または負に制御する.ヒストンの修飾のうち,ヒストンH3の9番目のリジン残基のメチル化は,遺伝子発現の抑制やヘテロクロマチン化に重要なエピジェネティックなマークである4).
ヒストンを脱メチル化する酵素としてはこれまで約20種類が同定されている.その多くはJmmonji-C(JmjC)ドメインを触媒ドメインとしてもつJmjd(Jmmonji domain-containing)ファミリーに属しており,共通の反応機構をもちながらもそれぞれ異なるリジン残基に対しはたらく.Jmjdファミリーのうち,Jmjd1a(別名Jhdm2a,Kdm3a,Tsga)はヒストンH3の9番目のリジン残基のモノメチル化およびジメチル化に対する脱メチル化酵素である5).
筆者らの研究により,Jmjd1aがSry遺伝子領域のヒストンからヒストンH3の9番目のリジン残基のメチル化を除去することにより転写抑制の状態を解除し,性決定の時期においてSry遺伝子の発現を誘導することにより,性決定を制御していることが明らかになった.
個体の発生におけるJmjd1aの役割を明らかにするため,Jmjd1aのノックアウトマウスを作製したところ,このマウスは雄から雌への性転換を高頻度にひき起こした.すなわち,XY型の性染色体をもつJmjd1aノックアウトマウス58匹のうち,12匹が精巣と卵巣を1個ずつもつ部分的な性転換,34匹が2個の卵巣をもつ完全な性転換を起こした.特筆すべき点として,完全な性転換を起こした個体の一部は雄との交配により仔を出産し,正常な生殖能力をもつことが確認された.
Jmjd1aは別名のTsga(testis-specific gene A)が示すとおり,マウスの精巣から作製されたcDNAライブラリーから精巣に特異的に発現するタンパク質として遺伝子クローニングされた.実際に,Jmjd1aは精子の形成の過程(おもにパキテン期)において発現し,精細胞においてヒストンの脱メチル化に機能する.筆者らとは別の2つのグループからも,Jmjd1aノックアウトマウスの報告がなされており,いずれのマウスも精子の形成に異常をきたし不妊となった6,7).筆者らのグループが作製したJmjd1aノックアウトマウスでも,性転換を起こさなかった雄の個体はほかのグループと同じ表現型を示し不妊であった.筆者らのグループだけが,性転換という表現型を見い出すことができたのは,Y染色体の由来するマウスの系統に依存してノックアウトマウスにおける性転換の頻度が異なることが理由であった.すなわち,Y染色体がCBA系統に由来するときには約80%の頻度で性転換が起こるのに対し,Y染色体をC57BL/6系統に置き換えると性転換の頻度は約10%にまで低下した.筆者らがノックアウトマウスの作製に使用したES細胞は,偶然にもY染色体がCBA系統に由来するTT2細胞であったので,高頻度で性転換に遭遇するという幸運があった.
性転換の原因を明らかにするため,性決定ののちまもない胎生13.5日において生殖腺の組織学的な解析を行った.Jmjd1aを欠損したXY型のマウスの生殖腺は,精細管が形成されず,精巣の体細胞(セルトリ細胞)のマーカーであるSox9に陽性の細胞(30%)と,卵巣の体細胞のマーカーであるFoxl2に陽性の細胞(70%)が混在する“卵精巣”とよばれる状態であった.つまり,Jmjd1aの欠損による性転換は性分化の初期の段階からすでに起こっていることが示唆された.
さらに発生をさかのぼり,マウスの性決定の時期である胎生11.5日において生殖腺の解析を行った.正常なXY型のマウスの生殖腺は,胎生11.0~12.0日にかけてY染色体に存在する性決定遺伝子であるSry遺伝子が生殖腺の体細胞の一部(セルトリ前駆細胞)において発現することにより,精巣への分化を開始する8).その際に,Sry遺伝子はSox9遺伝子,Fgf9遺伝子,Amh遺伝子など生殖腺において雄に特異的な遺伝子の発現を誘導する.Jmjd1aを欠損した生殖腺についてSry遺伝子の発現をmRNAレベルで定量的に調べたところ,対照と比較して約30%まで低下していた.組織免疫染色を用いてSryのタンパク質レベルでの発現を検討した結果,Sry陽性細胞の割合は対照に対し約25%まで低下していた.また,Sry遺伝子の下流に存在するSox9に陽性の細胞の割合も約20%まで減少していた.この結果から,Jmd1aノックアウトマウスの性転換は,胎仔の性決定の時期においてSry遺伝子が十分に発現できず,それより下流の雄化のシグナルカスケードの活性化が不完全になることが原因である可能性が示唆された.Jmjd1aを欠損しても生殖腺の体細胞の数は変わらなかった.アポトーシスや細胞増殖の異常は観察されなかったことから,Jmjd1aは細胞増殖など生殖腺の形成の過程には関与せず,性決定の過程についてのみ機能すると考えられた.
雄化のシグナルカスケードのなかでJmjd1aにより制御をうける作用点はどこかを明らかにするため,以下の2つの実験を行った.
1つ目に,Jmjd1aを欠損した胎生11.5日目のマウスの性腺から体細胞のRNAを精製し,これを用いてマイクロアレイ法による解析を行い,Jmjd1aにより発現の制御をうける遺伝子のなかに性分化にかかわる既知の遺伝子が含まれるかどうかを調べた.Jmjd1aの欠損により発現が対照の50%以下に低下する遺伝子は131個あり,このなかにはSry遺伝子が含まれていた.また,Sry遺伝子の下流に存在するSox9遺伝子の発現もおよそ60%まで低下していた.しかしながら,性分化にかかわるそれ以外の遺伝子は131個の遺伝子のなかにはみつからなかった.
2つ目に,Sry遺伝子を外来的に強制発現するトランスジェニックマウスの系統(Hsp-Sry系統)を用い9),レスキュー実験を行った.組織学的な解析の結果,Sry遺伝子を強制発現させたXY型のJmjd1aノックアウトマウスの胎生13.5日目の生殖腺は,精細管の形成が対照と同じ程度にまで回復していた.また,Jmjd1aを欠損した卵精巣において体細胞の70%をしめていたFoxl2陽性細胞は観察されず,Sox9陽性細胞の割合がほぼ100%に回復したことから,Sry遺伝子の強制発現により性転換の表現型は完全にレスキューされたと結論した.この結果は,雄化のシグナルカスケードにおいてSry遺伝子より下流に位置する遺伝子の発現について,Jmjd1aは少なくとも必須ではないことを示唆した.
これらの結果を総合すると,Jmjd1aが標的とする雄化のシグナルカスケードにおける作用点はSry遺伝子である可能性が強く示唆された.
生殖腺の発生および性決定の時期(胎生10.5日~12.5日)におけるJmjd1aの発現パターンを解析した.免疫染色によりJmjd1aのタンパク質レベルでの局在を確認したところ,Jmjd1aは生殖腺の体細胞および生殖細胞に観察された.一方,生殖腺に隣接する中腎においてはJmjd1aの局在は観察されなかった.生殖腺の体細胞および中腎細胞において,ヒストンH3の9番目のリジン残基に対する既知のメチル化酵素または脱メチル化酵素につき網羅的にmRNAレベルでの発現を定量したところ,Jmd1aのみが生殖腺の体細胞において特異的に高い発現を示した.生殖腺の体細胞において胎生10.5~12.5日にかけてJmjd1aのmRNAレベルでの発現を定量すると,Jmd1aの発現は胎生10.5日から上昇し胎生11.5日にピークになった.これらの実験から得られたJmjd1aの発現部位および発現時期のパターンは,Sry遺伝子のパターンに近かった.
免疫染色により,胎生11.5日の生殖腺および中腎におけるヒストンH3の9番目のリジン残基のメチル化を定量した.Jmjd1aを欠損すると,生殖腺においてのみ対照と比較して約2倍のメチル化の増加が観察された.一方,中腎においては対照との差はなかった.つまり,Jmjd1aは実際に生殖腺においてヒストンH3の9番目のリジン残基に対する脱メチル化酵素として機能していることが確認された.
これらの結果から,Jmjd1aは性決定の時期である胎生11.5日目において,生殖腺の体細胞から転写抑制のマークであるヒストンH3の9番目のリジン残基のメチル化を脱メチル化することにより,Sry遺伝子の発現を正に制御している可能性が示唆された.
Jmjd1aがSry遺伝子の発現を直接に制御していることを確認するため,胎生11.5日のマウスから性腺の体細胞を精製しクロマチン免疫沈降を行った.その結果,Jmd1aはSry遺伝子のプロモーター領域に局在していることが確認された.さらに,Jmjd1aを欠損した性腺の体細胞ではSry遺伝子のプロモーター領域のヒストンにおいてヒストンH3の9番目のリジン残基のメチル化が増加すること,逆に,転写活性化のマークであるヒストンH3の4番目のリジン残基のメチル化が減少することが示された.Jmj1aはヒストンH3の9番目のリジン残基のメチル化を脱メチル化する酵素であることから,Sry遺伝子はJmjd1aの直接の標的であることが示された.Sox9遺伝子のプロモーター領域についても同様の実験を行ったが,Jmjd1aを欠損してもヒストンH3の9番目のリジン残基のメチル化の状態に変化はなかったことから,Sox9遺伝子はJmjd1aによる制御の標的ではないことが示唆された.
Sry遺伝子の発現のエピジェネティックな制御機構は,まずJmjd1aがSry遺伝子のプロモーター領域のヒストンにおいてヒストンH3の9番目のリジン残基のメチル化を除去し,転写抑制の状態を解除したのち,未同定のヒストンメチル化酵素がヒストンH3の4番目のリジン残基をメチル化することにより,Sry遺伝子を転写活性化の状態へと誘導していると考えられた.
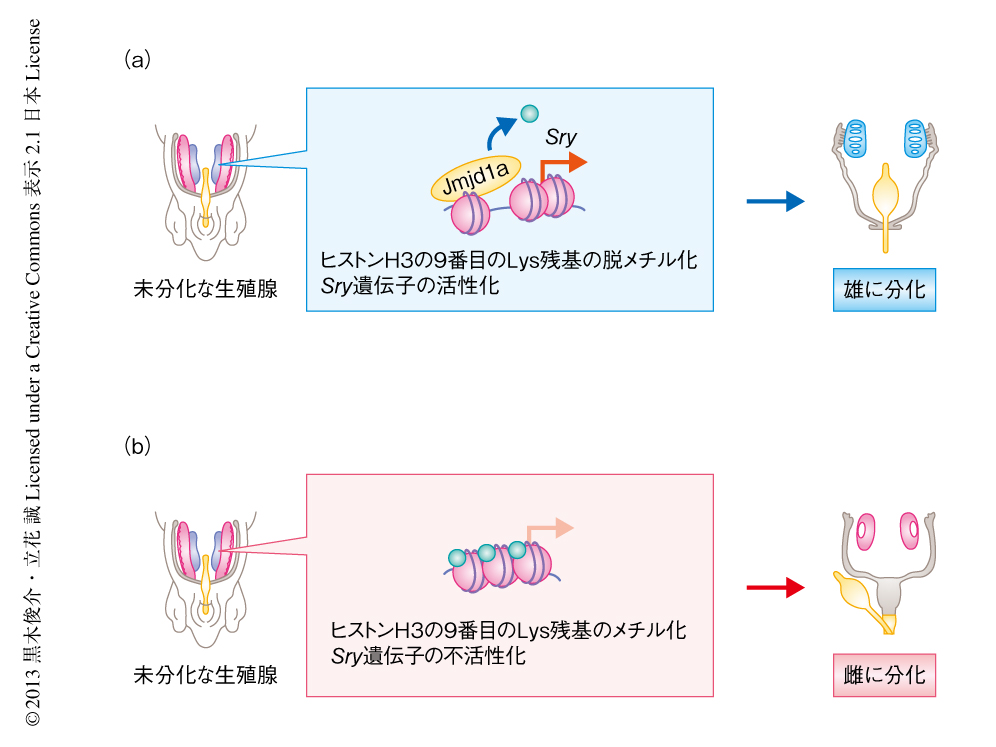
今回のマウスを用いた研究から.ヒストン脱メチル化酵素であるJmjd1aは性決定遺伝子であるSry遺伝子の発現を正に制御し,生殖腺の精巣への分化および個体の雄化に寄与していることが明らかになった(図1).Jmjd1a遺伝子の構造はヒトにおいてもマウスと同様に保存されていることから,ヒトでも同じ分子機構により性決定が制御されていることが予想された.
ヒトにおいて性分化が正しく進行しない疾患を性分化疾患とよび,そのうち原因のわからない症例はおよそ半分をしめている.今回の研究により,胎児期におけるヒストン修飾の異常が性分化疾患の新たな原因のひとつである可能性が示された.
略歴:京都大学ウイルス研究所 教務補佐.
研究テーマ:ヒストン修飾酵素によるエピゲノムの制御の生理的な機能.
立花 誠(Makoto Tachibana)
京都大学ウイルス研究所 准教授.
研究室URL:http://www.virus.kyoto-u.ac.jp/Lab/mousemodel/index.html
© 2013 黒木俊介・立花 誠 Licensed under CC 表示 2.1 日本
(京都大学ウイルス研究所 附属感染症モデル研究センターゲノム改変マウス研究領域)
email:黒木俊介,立花 誠
DOI: 10.7875/first.author.2013.116
Epigenetic regulation of mouse sex determination by the histone demethylase Jmjd1a.
Shunsuke Kuroki, Shogo Matoba, Mika Akiyoshi, Yasuko Matsumura, Hitoshi Miyachi, Nathan Mise, Kuniya Abe, Atsuo Ogura, Dagmar Wilhelm, Peter Koopman, Masami Nozaki, Yoshiakira Kanai, Yoichi Shinkai, Makoto Tachibana
Science, 341, 1106-1109 (2013)
要 約
発生における遺伝子の発現は,転写因子とヒストンの修飾を含めたエピゲノム状態とのあいだの相互作用により制御されている.哺乳類の性決定における遺伝子の発現制御については,重要な転写因子はいくつも明らかにされているものの,エピジェネティックな制御機構の関与についてはほとんど明らかになっていない.筆者らは,ヒストン脱メチル化酵素Jmjd1aを欠損させたマウスを作製したところ,このマウスは性染色体がXY型であるにもかかわらず雄から雌への性転換を起こすことを見い出した.さらに,Jmjd1aは胎仔期の未分化な性線に強く発現しており,性決定遺伝子であるSry遺伝子のプロモーター領域のヒストンから転写抑制のマークであるヒストンH3の9番目のリジン残基のメチル化を脱メチル化することにより,Sry遺伝子の発現を正に制御していることが示された.今回の研究により,ヒストンの修飾を介した遺伝子のエピジェネティックな発現制御が哺乳類の性決定において重要な役割をもつことが明らかになった.
はじめに
ヒトを含むほとんどの哺乳類は,性染色体の組合せがXY型だと雄,XX型だと雌になる.Y染色体には性決定遺伝子であるSry遺伝子が存在し,胎児期のまだ未分化な性腺にSry遺伝子が発現すると性腺は精巣へと分化を開始し個体は雄になる.一方,XX型の胎児にはSry遺伝子が存在しないので性腺は卵巣へと分化し個体は雌になる1-3).哺乳類の性決定の過程においては,Sry遺伝子を頂点とする雄化のシグナルカスケード,および,そこに含まれる多くの転写因子の重要性が明らかになっているが,この過程における遺伝子のエピジェネティックな発現制御の関与についてはほとんどわかっていなかった.
DNAはヒストンとよばれるタンパク質複合体に巻きつきヌクレオソームを形成する.ヒストンは外的な環境の変化に応じ多様な化学修飾をうけ,それぞれの修飾はクロマチンの機能的な構造変換を介して遺伝子の発現を正または負に制御する.ヒストンの修飾のうち,ヒストンH3の9番目のリジン残基のメチル化は,遺伝子発現の抑制やヘテロクロマチン化に重要なエピジェネティックなマークである4).
ヒストンを脱メチル化する酵素としてはこれまで約20種類が同定されている.その多くはJmmonji-C(JmjC)ドメインを触媒ドメインとしてもつJmjd(Jmmonji domain-containing)ファミリーに属しており,共通の反応機構をもちながらもそれぞれ異なるリジン残基に対しはたらく.Jmjdファミリーのうち,Jmjd1a(別名Jhdm2a,Kdm3a,Tsga)はヒストンH3の9番目のリジン残基のモノメチル化およびジメチル化に対する脱メチル化酵素である5).
筆者らの研究により,Jmjd1aがSry遺伝子領域のヒストンからヒストンH3の9番目のリジン残基のメチル化を除去することにより転写抑制の状態を解除し,性決定の時期においてSry遺伝子の発現を誘導することにより,性決定を制御していることが明らかになった.
1.Jmjd1aノックアウトマウスは雄から雌への性転換をひき起こす
個体の発生におけるJmjd1aの役割を明らかにするため,Jmjd1aのノックアウトマウスを作製したところ,このマウスは雄から雌への性転換を高頻度にひき起こした.すなわち,XY型の性染色体をもつJmjd1aノックアウトマウス58匹のうち,12匹が精巣と卵巣を1個ずつもつ部分的な性転換,34匹が2個の卵巣をもつ完全な性転換を起こした.特筆すべき点として,完全な性転換を起こした個体の一部は雄との交配により仔を出産し,正常な生殖能力をもつことが確認された.
Jmjd1aは別名のTsga(testis-specific gene A)が示すとおり,マウスの精巣から作製されたcDNAライブラリーから精巣に特異的に発現するタンパク質として遺伝子クローニングされた.実際に,Jmjd1aは精子の形成の過程(おもにパキテン期)において発現し,精細胞においてヒストンの脱メチル化に機能する.筆者らとは別の2つのグループからも,Jmjd1aノックアウトマウスの報告がなされており,いずれのマウスも精子の形成に異常をきたし不妊となった6,7).筆者らのグループが作製したJmjd1aノックアウトマウスでも,性転換を起こさなかった雄の個体はほかのグループと同じ表現型を示し不妊であった.筆者らのグループだけが,性転換という表現型を見い出すことができたのは,Y染色体の由来するマウスの系統に依存してノックアウトマウスにおける性転換の頻度が異なることが理由であった.すなわち,Y染色体がCBA系統に由来するときには約80%の頻度で性転換が起こるのに対し,Y染色体をC57BL/6系統に置き換えると性転換の頻度は約10%にまで低下した.筆者らがノックアウトマウスの作製に使用したES細胞は,偶然にもY染色体がCBA系統に由来するTT2細胞であったので,高頻度で性転換に遭遇するという幸運があった.
2.Jmad1aを欠損した生殖腺では性決定遺伝子であるSry遺伝子の発現が低下する
性転換の原因を明らかにするため,性決定ののちまもない胎生13.5日において生殖腺の組織学的な解析を行った.Jmjd1aを欠損したXY型のマウスの生殖腺は,精細管が形成されず,精巣の体細胞(セルトリ細胞)のマーカーであるSox9に陽性の細胞(30%)と,卵巣の体細胞のマーカーであるFoxl2に陽性の細胞(70%)が混在する“卵精巣”とよばれる状態であった.つまり,Jmjd1aの欠損による性転換は性分化の初期の段階からすでに起こっていることが示唆された.
さらに発生をさかのぼり,マウスの性決定の時期である胎生11.5日において生殖腺の解析を行った.正常なXY型のマウスの生殖腺は,胎生11.0~12.0日にかけてY染色体に存在する性決定遺伝子であるSry遺伝子が生殖腺の体細胞の一部(セルトリ前駆細胞)において発現することにより,精巣への分化を開始する8).その際に,Sry遺伝子はSox9遺伝子,Fgf9遺伝子,Amh遺伝子など生殖腺において雄に特異的な遺伝子の発現を誘導する.Jmjd1aを欠損した生殖腺についてSry遺伝子の発現をmRNAレベルで定量的に調べたところ,対照と比較して約30%まで低下していた.組織免疫染色を用いてSryのタンパク質レベルでの発現を検討した結果,Sry陽性細胞の割合は対照に対し約25%まで低下していた.また,Sry遺伝子の下流に存在するSox9に陽性の細胞の割合も約20%まで減少していた.この結果から,Jmd1aノックアウトマウスの性転換は,胎仔の性決定の時期においてSry遺伝子が十分に発現できず,それより下流の雄化のシグナルカスケードの活性化が不完全になることが原因である可能性が示唆された.Jmjd1aを欠損しても生殖腺の体細胞の数は変わらなかった.アポトーシスや細胞増殖の異常は観察されなかったことから,Jmjd1aは細胞増殖など生殖腺の形成の過程には関与せず,性決定の過程についてのみ機能すると考えられた.
3.Jmjd1aはどの遺伝子を標的としているのか?
雄化のシグナルカスケードのなかでJmjd1aにより制御をうける作用点はどこかを明らかにするため,以下の2つの実験を行った.
1つ目に,Jmjd1aを欠損した胎生11.5日目のマウスの性腺から体細胞のRNAを精製し,これを用いてマイクロアレイ法による解析を行い,Jmjd1aにより発現の制御をうける遺伝子のなかに性分化にかかわる既知の遺伝子が含まれるかどうかを調べた.Jmjd1aの欠損により発現が対照の50%以下に低下する遺伝子は131個あり,このなかにはSry遺伝子が含まれていた.また,Sry遺伝子の下流に存在するSox9遺伝子の発現もおよそ60%まで低下していた.しかしながら,性分化にかかわるそれ以外の遺伝子は131個の遺伝子のなかにはみつからなかった.
2つ目に,Sry遺伝子を外来的に強制発現するトランスジェニックマウスの系統(Hsp-Sry系統)を用い9),レスキュー実験を行った.組織学的な解析の結果,Sry遺伝子を強制発現させたXY型のJmjd1aノックアウトマウスの胎生13.5日目の生殖腺は,精細管の形成が対照と同じ程度にまで回復していた.また,Jmjd1aを欠損した卵精巣において体細胞の70%をしめていたFoxl2陽性細胞は観察されず,Sox9陽性細胞の割合がほぼ100%に回復したことから,Sry遺伝子の強制発現により性転換の表現型は完全にレスキューされたと結論した.この結果は,雄化のシグナルカスケードにおいてSry遺伝子より下流に位置する遺伝子の発現について,Jmjd1aは少なくとも必須ではないことを示唆した.
これらの結果を総合すると,Jmjd1aが標的とする雄化のシグナルカスケードにおける作用点はSry遺伝子である可能性が強く示唆された.
4.Jmjd1aは性決定の時期において性腺の体細胞に発現する
生殖腺の発生および性決定の時期(胎生10.5日~12.5日)におけるJmjd1aの発現パターンを解析した.免疫染色によりJmjd1aのタンパク質レベルでの局在を確認したところ,Jmjd1aは生殖腺の体細胞および生殖細胞に観察された.一方,生殖腺に隣接する中腎においてはJmjd1aの局在は観察されなかった.生殖腺の体細胞および中腎細胞において,ヒストンH3の9番目のリジン残基に対する既知のメチル化酵素または脱メチル化酵素につき網羅的にmRNAレベルでの発現を定量したところ,Jmd1aのみが生殖腺の体細胞において特異的に高い発現を示した.生殖腺の体細胞において胎生10.5~12.5日にかけてJmjd1aのmRNAレベルでの発現を定量すると,Jmd1aの発現は胎生10.5日から上昇し胎生11.5日にピークになった.これらの実験から得られたJmjd1aの発現部位および発現時期のパターンは,Sry遺伝子のパターンに近かった.
免疫染色により,胎生11.5日の生殖腺および中腎におけるヒストンH3の9番目のリジン残基のメチル化を定量した.Jmjd1aを欠損すると,生殖腺においてのみ対照と比較して約2倍のメチル化の増加が観察された.一方,中腎においては対照との差はなかった.つまり,Jmjd1aは実際に生殖腺においてヒストンH3の9番目のリジン残基に対する脱メチル化酵素として機能していることが確認された.
これらの結果から,Jmjd1aは性決定の時期である胎生11.5日目において,生殖腺の体細胞から転写抑制のマークであるヒストンH3の9番目のリジン残基のメチル化を脱メチル化することにより,Sry遺伝子の発現を正に制御している可能性が示唆された.
5.Jmjd1aはSry遺伝子の発現を直接に制御する
Jmjd1aがSry遺伝子の発現を直接に制御していることを確認するため,胎生11.5日のマウスから性腺の体細胞を精製しクロマチン免疫沈降を行った.その結果,Jmd1aはSry遺伝子のプロモーター領域に局在していることが確認された.さらに,Jmjd1aを欠損した性腺の体細胞ではSry遺伝子のプロモーター領域のヒストンにおいてヒストンH3の9番目のリジン残基のメチル化が増加すること,逆に,転写活性化のマークであるヒストンH3の4番目のリジン残基のメチル化が減少することが示された.Jmj1aはヒストンH3の9番目のリジン残基のメチル化を脱メチル化する酵素であることから,Sry遺伝子はJmjd1aの直接の標的であることが示された.Sox9遺伝子のプロモーター領域についても同様の実験を行ったが,Jmjd1aを欠損してもヒストンH3の9番目のリジン残基のメチル化の状態に変化はなかったことから,Sox9遺伝子はJmjd1aによる制御の標的ではないことが示唆された.
Sry遺伝子の発現のエピジェネティックな制御機構は,まずJmjd1aがSry遺伝子のプロモーター領域のヒストンにおいてヒストンH3の9番目のリジン残基のメチル化を除去し,転写抑制の状態を解除したのち,未同定のヒストンメチル化酵素がヒストンH3の4番目のリジン残基をメチル化することにより,Sry遺伝子を転写活性化の状態へと誘導していると考えられた.
おわりに
今回のマウスを用いた研究から.ヒストン脱メチル化酵素であるJmjd1aは性決定遺伝子であるSry遺伝子の発現を正に制御し,生殖腺の精巣への分化および個体の雄化に寄与していることが明らかになった(図1).Jmjd1a遺伝子の構造はヒトにおいてもマウスと同様に保存されていることから,ヒトでも同じ分子機構により性決定が制御されていることが予想された.
ヒトにおいて性分化が正しく進行しない疾患を性分化疾患とよび,そのうち原因のわからない症例はおよそ半分をしめている.今回の研究により,胎児期におけるヒストン修飾の異常が性分化疾患の新たな原因のひとつである可能性が示された.
文 献
- Sekido, R. & Lovell-Badge, R.: Sex determination and SRY: down to a wink and a nudge? Trends Genet., 25, 19-29 (2009)[PubMed]
- Kashimada, K. & Koopman, P.: Sry: the master switch in mammalian sex determination. Development, 137, 3921-3930 (2010)[PubMed]
- Koopman, P., Gubbay, J., Vivian, N. et al.: Male development of chromosomally female mice transgenic for Sry. Nature 351, 117-121 (1991)[PubMed]
- Kooistra, S. M. & Helin, K.: Molecular mechanisms and potential functions of histone demethylases. Nat. Rev. Mol. Cell Biol., 13, 297-311 (2012)[PubMed]
- Yamane, K., Toumazou, C., Tsukada, Y. et al.: JHDM2A, a JmjC-containing H3K9 demethylase, facilitates transcription activation by androgen receptor. Cell, 125, 483-495 (2006)[PubMed]
- Okada, Y., Scott, G., Ray, M. K. et al.: Histone demethylase JHDM2A is critical for Tnp1 and Prm1 transcription and spermatogenesis. Nature, 450, 119-123 (2007)[PubMed]
- Liu, Z., Zhou, S., Liao, L. et al.: Jmjd1a demethylase-regulated histone modification is essential for cAMP-response element modulator-regulated gene expression and spermatogenesis. J. Biol. Chem., 285, 2758-2770 (2010)[PubMed]
- Hiramatsu, R., Matoba, S., Kanai-Azuma, M. et al.: A critical time window of Sry action in gonadal sex determination in mice. Development, 136, 129-138 (2009)[PubMed]
- Kidokoro, T., Matoba, S., Hiramatsu, R. et al.: Influence on spatiotemporal patterns of a male-specific Sox9 activation by ectopic Sry expression during early phases of testis differentiation in mice. Dev. Biol., 278, 511-525 (2005)[PubMed]
著者プロフィール
略歴:京都大学ウイルス研究所 教務補佐.
研究テーマ:ヒストン修飾酵素によるエピゲノムの制御の生理的な機能.
立花 誠(Makoto Tachibana)
京都大学ウイルス研究所 准教授.
研究室URL:http://www.virus.kyoto-u.ac.jp/Lab/mousemodel/index.html
© 2013 黒木俊介・立花 誠 Licensed under CC 表示 2.1 日本