レプチンは視床下部における神経ネットワークを介しインスリンの欠損による高血糖および致死を防ぐ
藤川 哲兵
(米国Texas大学Southwestern Medical Center,Department of Internal Medicine)
email:藤川哲兵
DOI: 10.7875/first.author.2013.115
Leptin engages a hypothalamic neurocircuitry to permit survival in the absence of insulin.
Teppei Fujikawa, Eric D. Berglund, Vishal R. Patel, Giorgio Ramadori, Claudia R. Vianna, Linh Vong, Fabrizio Thorel, Simona Chera, Pedro L. Herrera, Bradford B. Lowell, Joel K. Elmquist, Pierre Baldi, Roberto Coppari
Cell Metabolism, 18, 431-444 (2013)
筆者らを含むいくつかの研究グループは,インスリンを欠損する動物に脂肪細胞から分泌されるホルモンであるレプチンを投与することにより,致死,高血糖,高血脂症,グルカゴンの過剰分泌などの代謝異常を防げることを明らかにしてきたが,その詳細な分子機構は不明であった.筆者らの以前の報告により,インスリンの非存在下におけるレプチンによる糖代謝の制御においては脳が重要な器官であることが明らかになっていたが,今回,さらにその詳細な機構を調べるため,遺伝子改変マウスを駆使して重要なニューロンの同定を試みた.その結果,視床下部に存在するプロオピオメラノコルチン産生ニューロンおよびγアミノ酪酸作動性ニューロンに発現するレプチン受容体が非常に重要であることが明らかにされた.また,末梢の組織における分子機構についても,脳へのレプチンの投与は骨格筋および褐色脂肪細胞における糖の取り込みを促進し,また,膵臓からのグルカゴンの分泌を抑制し,肝臓における糖代謝および脂肪代謝を改善することが確認された.興味深いことに,インスリンの存在下と非存在下とではレプチンは異なる分子機構により糖代謝を制御していることが明らかになった.以上の結果は,これまでの糖尿病の治療とは一線を画した,インスリンに依存しない新たな治療法の開発につながる可能性がある.
インスリンは生命維持活動に必須であり,インスリンの欠損は高血糖など代謝異常をもたらし最終的に死につながる,というのがこれまでのドグマであった.確かに,発生の過程においてインスリンは必須である.しかし,成体において,少なくともラットおよびマウスでは,インスリンが生命の維持に必須であるというドグマはくずれつつある.筆者らを含むいくつかのグループは,膵臓のβ細胞を薬理的に破壊したラットあるいはマウスなどの1型糖尿病のモデル動物に脂肪細胞から分泌されるホルモンであるレプチンを投与すると,インスリンの欠損によるこれらの代謝異常を改善することができ,また,驚くべきことに,インスリンの欠損による致死をも防げることを明らかにしてきた1,2).これまで,インスリンの存在下においては,プロオピオメラノコルチン産生ニューロンにおけるレプチン受容体の存在が糖代謝の恒常性の維持に対し十分であることが示されていた.つまり,レプチン受容体を全身で欠損するマウスにおいてプロオピオメラノコルチン産生ニューロンにのみレプチン受容体を発現させるだけで,このマウスにみられた高血糖が正常になったのである3).しかしながら,プロオピオメラノコルチン産生ニューロンにおいてレプチン受容体はインスリンに依存して糖代謝を改善していると示唆されており,インスリンの欠損下においてはどのニューロンが重要なのか,その詳細な神経ネットワークは不明であった.この研究では,レプチン受容体を任意のニューロンにおいて欠損あるいは再発現させた遺伝子改変マウスを駆使して,レプチンのインスリンの欠損による代謝異常を改善する作用において,レプチン受容体を発現するどのニューロンが重要であるのかを調べた.また同時に,末梢の組織においてどのような分子機構がはたらくことで,レプチンによりインスリンの欠損による代謝異常が改善されているのかを検討した.
レプチンのインスリンの欠損による代謝異常を改善する作用において重要なニューロンを同定するにさきだち,新たな1型糖尿病モデルマウスの導入を試みた.一般的に用いられるストレプトゾトシンなどによる薬理的な1型糖尿病モデルにおいては,わずかではあるが膵臓β細胞が残存しており,そこから分泌される少量のインスリンが関与する可能性を排除できない.そこで,ラットのインスリン遺伝子のプロモーターのもとでジフテリア毒素受容体を発現し,ジフテリア毒素の投与により膵臓β細胞をほぼ完全に破壊できるようなトランスジェニックマウスを用いて4),脳へのレプチンの投与によるインスリンの欠損による代謝異常の改善1) を再現できるかどうか調べた.ちなみに,ジフテリア毒素受容体は野生型のマウスには発現していないため,人為的にジフテリア毒素受容体を発現させた細胞のほかにはいっさい影響はない.膵臓β細胞を破壊することによりインスリンを欠損させたこのトランスジェニックマウスの血糖値は,レプチンを側脳室に連続投与することにより正常に維持された一方,対照としてリン酸緩衝生理食塩水を投与したトランスジェニックマウスは15日以内にすべて死亡した.以前の筆者らの報告と同じく,インスリンの欠損により過剰に分泌されるようになった血中のグルカゴンの濃度は,脳へのレプチンの投与により正常となった.グルカゴン受容体のノックアウトマウスはストレプトゾトシンを投与しても1型糖尿病を発症しないことが示唆されており5),レプチンのインスリンの欠損による代謝異常を改善する作用の一部も,過剰なグルカゴン分泌の抑制によるものと推察された.また,膵臓においてインスリンは測定不可能な濃度にまで低下しており,以前の結果とあわせて,脳においてレプチンはインスリンから完全に独立して糖代謝を制御していることが示された.
レプチンのインスリンの欠損による代謝異常を改善する作用において,脳のどのニューロンが重要なのか同定を試みた.さきに述べたように,インスリンの存在下ではプロオピオメラノコルチン産生ニューロンが糖代謝の恒常性の維持に重要であることがわかっていた3).また,ほかにも,レプチンによる糖の取り込みの亢進には視床下部の腹内側核が重要であることが示唆されていた6).転写因子SF1(steroidgenic factor 1)は中枢神経系において視床下部の腹内側核にのみ発現しており,筆者らの未発表のデータでは,SF1産生ニューロンが糖代謝に関与していることが示唆されていた.そこで,プロオピオメラノコルチン産生ニューロンあるいはSF1産生ニューロンに発現するレプチン受容体は,レプチンのインスリンの欠損による代謝異常を改善する作用において必須であるかどうか検討した.レプチン受容体をプロオピオメラノコルチン産生ニューロンあるいはSF1産生ニューロンにおいて特異的にノックアウトしたマウスを使用した.ストレプトゾトシンの投与によりインスリンを欠損させ,脳へのレプチンの投与から10日目の血糖値を測定した.その結果,プロオピオメラノコルチン産生ニューロンにおいてレプチン受容体を特異的にノックアウトしたマウスの血糖値は,野生型マウスに比べ高い値を示した.しかし,SF1産生ニューロンにおいてレプチン受容体を特異的にノックアウトしたマウスでは野生型マウスと同じように高血糖が改善された.つづいて,脳へのレプチンの投与による致死性の回避についてプロオピオメラノコルチン産生ニューロン特異的レプチン受容体ノックアウトマウスにおいて検討した.驚いたことに,このノックアウトマウスは野生型マウスに比べ高い血糖値を示したにもかかわらず,両者で生存率に差はなかった.さらに,さきに述べたジフテリア毒素受容体を用いた1型糖尿病モデルマウスにおけるプロオピオメラノコルチン産生ニューロン特異的レプチン受容体ノックアウトマウスにおいても同様の実験を行ったが,やはり同じ結果が得られた.以上より,SF1産生ニューロンに存在するレプチン受容体はレプチンのインスリンの欠損による代謝異常を改善する作用には関与しないこと,また,プロオピオメラノコルチン産生ニューロンに存在するレプチン受容体のインスリンの欠損下における役割は限定的なものであり,インスリンの存在下と非存在下では異なる分子機構により糖代謝を制御していることが明らかになった.
プロオピオメラノコルチン産生ニューロン特異的レプチン受容体ノックアウトマウスを用いた実験により,レプチン受容体がプロオピオメラノコルチン産生ニューロンにおいてレプチンのインスリンの欠損による代謝異常を改善する作用に必須であるかどうかを調べることはできたが,それが十分であるかどうかについては検討できない.そこで,レプチン受容体をプロオピオメラノコルチン産生ニューロンのみに発現させたトランスジェニックマウスを用いて,プロオピオメラノコルチン産生ニューロンにおいてレプチン受容体がレプチンのインスリンの欠損による代謝異常を改善する作用に十分であるかどうかを検討した.このトランスジェニックマウスはプロオピオメラノコルチン産生ニューロンのほかの細胞ではレプチン受容体をいっさい発現していない.さきに述べたように,以前の研究により,インスリンの存在下においてはプロオピオメラノコルチン産生ニューロンのみにレプチン受容体を発現させたトランスジェニックマウスは通常の血糖値を示すことが明らかになっている3).驚くべきことに,ジフテリア毒素受容体を用いた1型糖尿病モデルマウスにおけるプロオピオメラノコルチン産生ニューロンのみにレプチン受容体を発現させたトランスジェニックマウスでは,レプチンによるインスリンの欠損による代謝異常の改善はいっさいみられなかった.したがって,インスリンの非存在下においてプロオピオメラノコルチン産生ニューロンに発現するレプチン受容体は,レプチンのインスリンの欠損による代謝異常を改善する作用において十分でないことが明らかになった.それでは,どのニューロンがレプチンのインスリンの欠損による代謝異常を改善する作用において重要なのだろうか?
プロオピオメラノコルチン産生ニューロンおよびSF1産生ニューロンはそのほとんどがグルタミン酸作動性である.また,レプチン受容体をγアミノ酪酸作動性ニューロンにおいて特異的にノックアウトしたマウスは,レプチン受容体を全身で欠損しているdb/dbマウスとほぼ同じような肥満,過食,糖尿病などの代謝異常を示すことが明らかになっている7).これらの事実より,γアミノ酪酸作動性ニューロンに発現するレプチン受容体がレプチンのインスリンの欠損による代謝異常を改善する作用に重要であるとの仮説をたて,γアミノ酪酸作動性ニューロンのみにレプチン受容体を発現させたトランスジェニックマウスを作製してこれを検証した.ジフテリア毒素受容体を用いた1型糖尿病モデルマウスにおけるγアミノ酪酸作動性ニューロンのみにレプチン受容体を発現させたトランスジェニックマウスの脳にレプチンを投与したところ,野生型マウスの場合の約半分まで致死率が改善し,また,血糖値も大幅に改善した.しかしながら,依然としてレプチンのインスリンの欠損による代謝異常を改善する作用は完全には発揮されなかった.そこで,γアミノ酪酸作動性ニューロンおよびプロオピオメラノコルチン産生ニューロンの両方のみにレプチン受容体が発現したトランスジェニックマウスを作製した.その結果,ジフテリア毒素受容体を用いた1型糖尿病モデルマウスにおけるγアミノ酪酸作動性ニューロンおよびプロオピオメラノコルチン産生ニューロンの両方のみにレプチン受容体を発現させたトランスジェニックマウスでは,野生型マウスとまったく同様に,レプチンによるインスリンの欠損による代謝異常の改善がみられた.これらの実験により,γアミノ酪酸作動性ニューロンおよびプロオピオメラノコルチン産生ニューロンに発現するレプチン受容体がレプチンのインスリンの欠損による代謝異常を改善する作用において非常に重要であることが明らかになった.
末梢の組織においてはどのような分子機構によりレプチンのインスリンの欠損による代謝異常を改善する作用が発揮されているのかを検討した.レプチンはインスリンの存在下において骨格筋などへの糖の取り込みを促進することが明らかになっていたが,インスリンの非存在下においても同様の現象が起こっているのかは不明であった.そこで,ジフテリア毒素受容体を用いた1型糖尿病モデルマウスにおいて,脳へレプチンを投与したのちの末梢の組織への糖の取り込みを測定した.その結果,骨格筋および褐色脂肪細胞において糖の取り込みが促進されていた.とくに,褐色脂肪細胞における糖の取り込みは大きく増加していた.以前の報告より,レプチンによる糖の取り込みの促進作用は交感神経-βアドレナリン受容体経路を介し行われることが示唆されていた6).そこで,βアドレナリン受容体がレプチンのインスリンの欠損による代謝異常を改善する作用において重要であるかどうかを,βアドレナリン受容体のすべてのサブタイプを欠損したマウスを用いて検討した.ストレプトゾトシンの投与によりインスリンを欠損させたβアドレナリン受容体のすべてのサブタイプを欠損したマウスにおいて,レプチンによるインスリンの欠損による代謝異常の改善がみられた.さらに,βアドレナリン受容体を薬理的に阻害しても,レプチンによるインスリンの欠損による代謝異常の改善がみられた.これらの結果より,末梢の組織においても,インスリンの存在下と非存在下ではレプチンは異なる分子機構により糖代謝を制御していることが示唆された.
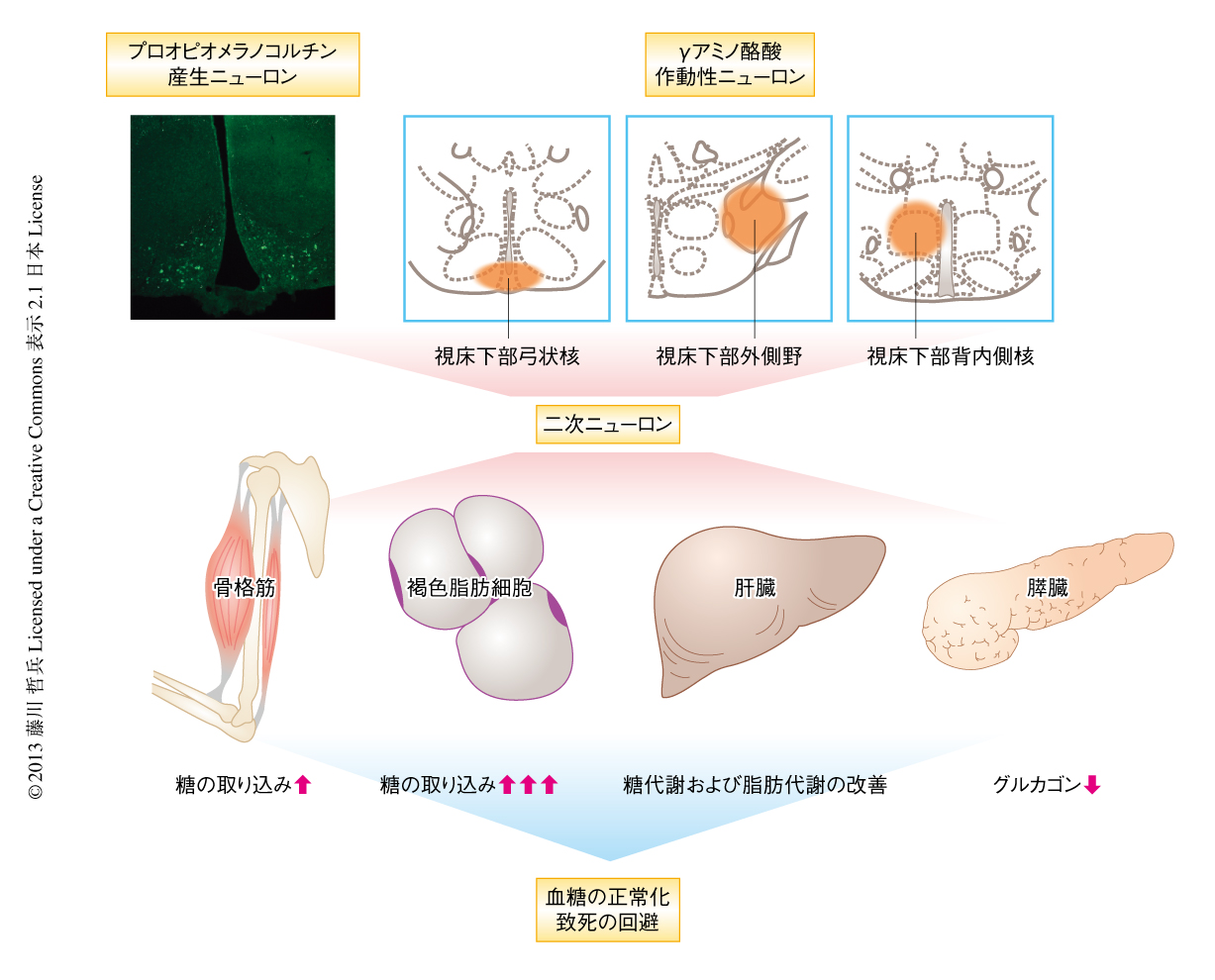
一連の実験により,レプチンはインスリンの非存在下においては,これまで考えられていたインスリンの存在下とは異なる分子機構により糖代謝を制御していることが明らかになった(図1).脳においては視床下部におけるγアミノ酪酸作動性神経およびプロオピオメラノコルチン産生ニューロンが重要であること,また,末梢の組織においては骨格筋,褐色脂肪細胞,肝臓,膵臓において,レプチンがなんらかのかたちで作用していることが明らかになった.しかし,なおいくつか未解明かつ重要な疑問点が残っている.たとえば,視床下部においてどのγアミノ酪酸作動性ニューロンが重要なのかを同定することが今後の課題であろう.レプチンに反応するγアミノ酪酸作動性ニューロンは,視床下部でも弓状核,背内側核,外側野に限定されていることが以前の研究7),さらに,筆者らのデータでも明らかになっている.今後は,これらの3つの領域のうちどこに存在するγアミノ酪酸作動性ニューロンが重要なのか(または,複数の領域が重要なのか),今後の研究の進展が待たれる.また,インスリンの非存在下において,中枢神経系がいったいどのように末梢の組織を制御しているのかも課題であろう.これまでの糖尿病に対する治療薬は,インスリン自体やインスリンの効果を高めるものが主体であった.しかし,インスリンとは独立して糖代謝を制御できる機構が動物(少なくとも,マウスおよびラット)には存在しうることが,筆者らを含むいくつかの研究グループにより明確になってきている.これらの分子機構を詳細に明らかにすることが,新しい糖尿病の治療薬の開発につながることを期待している.
略歴:2008年 京都大学大学院農学研究科博士課程 修了,同年より米国Texas大学Southwestern Medical CenterにてPostdoctoral Fellow.
研究テーマ:中枢神経系による代謝の制御機構.
抱負:おいしいものをいくら食べても病気にならない薬を開発する.
© 2013 藤川 哲兵 Licensed under CC 表示 2.1 日本
(米国Texas大学Southwestern Medical Center,Department of Internal Medicine)
email:藤川哲兵
DOI: 10.7875/first.author.2013.115
Leptin engages a hypothalamic neurocircuitry to permit survival in the absence of insulin.
Teppei Fujikawa, Eric D. Berglund, Vishal R. Patel, Giorgio Ramadori, Claudia R. Vianna, Linh Vong, Fabrizio Thorel, Simona Chera, Pedro L. Herrera, Bradford B. Lowell, Joel K. Elmquist, Pierre Baldi, Roberto Coppari
Cell Metabolism, 18, 431-444 (2013)
要 約
筆者らを含むいくつかの研究グループは,インスリンを欠損する動物に脂肪細胞から分泌されるホルモンであるレプチンを投与することにより,致死,高血糖,高血脂症,グルカゴンの過剰分泌などの代謝異常を防げることを明らかにしてきたが,その詳細な分子機構は不明であった.筆者らの以前の報告により,インスリンの非存在下におけるレプチンによる糖代謝の制御においては脳が重要な器官であることが明らかになっていたが,今回,さらにその詳細な機構を調べるため,遺伝子改変マウスを駆使して重要なニューロンの同定を試みた.その結果,視床下部に存在するプロオピオメラノコルチン産生ニューロンおよびγアミノ酪酸作動性ニューロンに発現するレプチン受容体が非常に重要であることが明らかにされた.また,末梢の組織における分子機構についても,脳へのレプチンの投与は骨格筋および褐色脂肪細胞における糖の取り込みを促進し,また,膵臓からのグルカゴンの分泌を抑制し,肝臓における糖代謝および脂肪代謝を改善することが確認された.興味深いことに,インスリンの存在下と非存在下とではレプチンは異なる分子機構により糖代謝を制御していることが明らかになった.以上の結果は,これまでの糖尿病の治療とは一線を画した,インスリンに依存しない新たな治療法の開発につながる可能性がある.
はじめに
インスリンは生命維持活動に必須であり,インスリンの欠損は高血糖など代謝異常をもたらし最終的に死につながる,というのがこれまでのドグマであった.確かに,発生の過程においてインスリンは必須である.しかし,成体において,少なくともラットおよびマウスでは,インスリンが生命の維持に必須であるというドグマはくずれつつある.筆者らを含むいくつかのグループは,膵臓のβ細胞を薬理的に破壊したラットあるいはマウスなどの1型糖尿病のモデル動物に脂肪細胞から分泌されるホルモンであるレプチンを投与すると,インスリンの欠損によるこれらの代謝異常を改善することができ,また,驚くべきことに,インスリンの欠損による致死をも防げることを明らかにしてきた1,2).これまで,インスリンの存在下においては,プロオピオメラノコルチン産生ニューロンにおけるレプチン受容体の存在が糖代謝の恒常性の維持に対し十分であることが示されていた.つまり,レプチン受容体を全身で欠損するマウスにおいてプロオピオメラノコルチン産生ニューロンにのみレプチン受容体を発現させるだけで,このマウスにみられた高血糖が正常になったのである3).しかしながら,プロオピオメラノコルチン産生ニューロンにおいてレプチン受容体はインスリンに依存して糖代謝を改善していると示唆されており,インスリンの欠損下においてはどのニューロンが重要なのか,その詳細な神経ネットワークは不明であった.この研究では,レプチン受容体を任意のニューロンにおいて欠損あるいは再発現させた遺伝子改変マウスを駆使して,レプチンのインスリンの欠損による代謝異常を改善する作用において,レプチン受容体を発現するどのニューロンが重要であるのかを調べた.また同時に,末梢の組織においてどのような分子機構がはたらくことで,レプチンによりインスリンの欠損による代謝異常が改善されているのかを検討した.
1.新たな1型糖尿病モデルマウス
レプチンのインスリンの欠損による代謝異常を改善する作用において重要なニューロンを同定するにさきだち,新たな1型糖尿病モデルマウスの導入を試みた.一般的に用いられるストレプトゾトシンなどによる薬理的な1型糖尿病モデルにおいては,わずかではあるが膵臓β細胞が残存しており,そこから分泌される少量のインスリンが関与する可能性を排除できない.そこで,ラットのインスリン遺伝子のプロモーターのもとでジフテリア毒素受容体を発現し,ジフテリア毒素の投与により膵臓β細胞をほぼ完全に破壊できるようなトランスジェニックマウスを用いて4),脳へのレプチンの投与によるインスリンの欠損による代謝異常の改善1) を再現できるかどうか調べた.ちなみに,ジフテリア毒素受容体は野生型のマウスには発現していないため,人為的にジフテリア毒素受容体を発現させた細胞のほかにはいっさい影響はない.膵臓β細胞を破壊することによりインスリンを欠損させたこのトランスジェニックマウスの血糖値は,レプチンを側脳室に連続投与することにより正常に維持された一方,対照としてリン酸緩衝生理食塩水を投与したトランスジェニックマウスは15日以内にすべて死亡した.以前の筆者らの報告と同じく,インスリンの欠損により過剰に分泌されるようになった血中のグルカゴンの濃度は,脳へのレプチンの投与により正常となった.グルカゴン受容体のノックアウトマウスはストレプトゾトシンを投与しても1型糖尿病を発症しないことが示唆されており5),レプチンのインスリンの欠損による代謝異常を改善する作用の一部も,過剰なグルカゴン分泌の抑制によるものと推察された.また,膵臓においてインスリンは測定不可能な濃度にまで低下しており,以前の結果とあわせて,脳においてレプチンはインスリンから完全に独立して糖代謝を制御していることが示された.
2.プロオピオメラノコルチン産生ニューロンに存在するレプチン受容体の役割はレプチンのインスリンの欠損による代謝異常を改善する作用に対し限定的である
レプチンのインスリンの欠損による代謝異常を改善する作用において,脳のどのニューロンが重要なのか同定を試みた.さきに述べたように,インスリンの存在下ではプロオピオメラノコルチン産生ニューロンが糖代謝の恒常性の維持に重要であることがわかっていた3).また,ほかにも,レプチンによる糖の取り込みの亢進には視床下部の腹内側核が重要であることが示唆されていた6).転写因子SF1(steroidgenic factor 1)は中枢神経系において視床下部の腹内側核にのみ発現しており,筆者らの未発表のデータでは,SF1産生ニューロンが糖代謝に関与していることが示唆されていた.そこで,プロオピオメラノコルチン産生ニューロンあるいはSF1産生ニューロンに発現するレプチン受容体は,レプチンのインスリンの欠損による代謝異常を改善する作用において必須であるかどうか検討した.レプチン受容体をプロオピオメラノコルチン産生ニューロンあるいはSF1産生ニューロンにおいて特異的にノックアウトしたマウスを使用した.ストレプトゾトシンの投与によりインスリンを欠損させ,脳へのレプチンの投与から10日目の血糖値を測定した.その結果,プロオピオメラノコルチン産生ニューロンにおいてレプチン受容体を特異的にノックアウトしたマウスの血糖値は,野生型マウスに比べ高い値を示した.しかし,SF1産生ニューロンにおいてレプチン受容体を特異的にノックアウトしたマウスでは野生型マウスと同じように高血糖が改善された.つづいて,脳へのレプチンの投与による致死性の回避についてプロオピオメラノコルチン産生ニューロン特異的レプチン受容体ノックアウトマウスにおいて検討した.驚いたことに,このノックアウトマウスは野生型マウスに比べ高い血糖値を示したにもかかわらず,両者で生存率に差はなかった.さらに,さきに述べたジフテリア毒素受容体を用いた1型糖尿病モデルマウスにおけるプロオピオメラノコルチン産生ニューロン特異的レプチン受容体ノックアウトマウスにおいても同様の実験を行ったが,やはり同じ結果が得られた.以上より,SF1産生ニューロンに存在するレプチン受容体はレプチンのインスリンの欠損による代謝異常を改善する作用には関与しないこと,また,プロオピオメラノコルチン産生ニューロンに存在するレプチン受容体のインスリンの欠損下における役割は限定的なものであり,インスリンの存在下と非存在下では異なる分子機構により糖代謝を制御していることが明らかになった.
3.プロオピオメラノコルチン産生ニューロンに存在するレプチン受容体はレプチンのインスリンの欠損による代謝異常を改善する作用において十分ではない
プロオピオメラノコルチン産生ニューロン特異的レプチン受容体ノックアウトマウスを用いた実験により,レプチン受容体がプロオピオメラノコルチン産生ニューロンにおいてレプチンのインスリンの欠損による代謝異常を改善する作用に必須であるかどうかを調べることはできたが,それが十分であるかどうかについては検討できない.そこで,レプチン受容体をプロオピオメラノコルチン産生ニューロンのみに発現させたトランスジェニックマウスを用いて,プロオピオメラノコルチン産生ニューロンにおいてレプチン受容体がレプチンのインスリンの欠損による代謝異常を改善する作用に十分であるかどうかを検討した.このトランスジェニックマウスはプロオピオメラノコルチン産生ニューロンのほかの細胞ではレプチン受容体をいっさい発現していない.さきに述べたように,以前の研究により,インスリンの存在下においてはプロオピオメラノコルチン産生ニューロンのみにレプチン受容体を発現させたトランスジェニックマウスは通常の血糖値を示すことが明らかになっている3).驚くべきことに,ジフテリア毒素受容体を用いた1型糖尿病モデルマウスにおけるプロオピオメラノコルチン産生ニューロンのみにレプチン受容体を発現させたトランスジェニックマウスでは,レプチンによるインスリンの欠損による代謝異常の改善はいっさいみられなかった.したがって,インスリンの非存在下においてプロオピオメラノコルチン産生ニューロンに発現するレプチン受容体は,レプチンのインスリンの欠損による代謝異常を改善する作用において十分でないことが明らかになった.それでは,どのニューロンがレプチンのインスリンの欠損による代謝異常を改善する作用において重要なのだろうか?
4.γアミノ酪酸作動性ニューロンおよびプロオピオメラノコルチン産生ニューロンに発現するレプチン受容体がレプチンのインスリンの欠損による代謝異常を改善する作用において重要である
プロオピオメラノコルチン産生ニューロンおよびSF1産生ニューロンはそのほとんどがグルタミン酸作動性である.また,レプチン受容体をγアミノ酪酸作動性ニューロンにおいて特異的にノックアウトしたマウスは,レプチン受容体を全身で欠損しているdb/dbマウスとほぼ同じような肥満,過食,糖尿病などの代謝異常を示すことが明らかになっている7).これらの事実より,γアミノ酪酸作動性ニューロンに発現するレプチン受容体がレプチンのインスリンの欠損による代謝異常を改善する作用に重要であるとの仮説をたて,γアミノ酪酸作動性ニューロンのみにレプチン受容体を発現させたトランスジェニックマウスを作製してこれを検証した.ジフテリア毒素受容体を用いた1型糖尿病モデルマウスにおけるγアミノ酪酸作動性ニューロンのみにレプチン受容体を発現させたトランスジェニックマウスの脳にレプチンを投与したところ,野生型マウスの場合の約半分まで致死率が改善し,また,血糖値も大幅に改善した.しかしながら,依然としてレプチンのインスリンの欠損による代謝異常を改善する作用は完全には発揮されなかった.そこで,γアミノ酪酸作動性ニューロンおよびプロオピオメラノコルチン産生ニューロンの両方のみにレプチン受容体が発現したトランスジェニックマウスを作製した.その結果,ジフテリア毒素受容体を用いた1型糖尿病モデルマウスにおけるγアミノ酪酸作動性ニューロンおよびプロオピオメラノコルチン産生ニューロンの両方のみにレプチン受容体を発現させたトランスジェニックマウスでは,野生型マウスとまったく同様に,レプチンによるインスリンの欠損による代謝異常の改善がみられた.これらの実験により,γアミノ酪酸作動性ニューロンおよびプロオピオメラノコルチン産生ニューロンに発現するレプチン受容体がレプチンのインスリンの欠損による代謝異常を改善する作用において非常に重要であることが明らかになった.
5.末梢の組織におけるレプチンによる糖代謝の制御
末梢の組織においてはどのような分子機構によりレプチンのインスリンの欠損による代謝異常を改善する作用が発揮されているのかを検討した.レプチンはインスリンの存在下において骨格筋などへの糖の取り込みを促進することが明らかになっていたが,インスリンの非存在下においても同様の現象が起こっているのかは不明であった.そこで,ジフテリア毒素受容体を用いた1型糖尿病モデルマウスにおいて,脳へレプチンを投与したのちの末梢の組織への糖の取り込みを測定した.その結果,骨格筋および褐色脂肪細胞において糖の取り込みが促進されていた.とくに,褐色脂肪細胞における糖の取り込みは大きく増加していた.以前の報告より,レプチンによる糖の取り込みの促進作用は交感神経-βアドレナリン受容体経路を介し行われることが示唆されていた6).そこで,βアドレナリン受容体がレプチンのインスリンの欠損による代謝異常を改善する作用において重要であるかどうかを,βアドレナリン受容体のすべてのサブタイプを欠損したマウスを用いて検討した.ストレプトゾトシンの投与によりインスリンを欠損させたβアドレナリン受容体のすべてのサブタイプを欠損したマウスにおいて,レプチンによるインスリンの欠損による代謝異常の改善がみられた.さらに,βアドレナリン受容体を薬理的に阻害しても,レプチンによるインスリンの欠損による代謝異常の改善がみられた.これらの結果より,末梢の組織においても,インスリンの存在下と非存在下ではレプチンは異なる分子機構により糖代謝を制御していることが示唆された.
おわりに
一連の実験により,レプチンはインスリンの非存在下においては,これまで考えられていたインスリンの存在下とは異なる分子機構により糖代謝を制御していることが明らかになった(図1).脳においては視床下部におけるγアミノ酪酸作動性神経およびプロオピオメラノコルチン産生ニューロンが重要であること,また,末梢の組織においては骨格筋,褐色脂肪細胞,肝臓,膵臓において,レプチンがなんらかのかたちで作用していることが明らかになった.しかし,なおいくつか未解明かつ重要な疑問点が残っている.たとえば,視床下部においてどのγアミノ酪酸作動性ニューロンが重要なのかを同定することが今後の課題であろう.レプチンに反応するγアミノ酪酸作動性ニューロンは,視床下部でも弓状核,背内側核,外側野に限定されていることが以前の研究7),さらに,筆者らのデータでも明らかになっている.今後は,これらの3つの領域のうちどこに存在するγアミノ酪酸作動性ニューロンが重要なのか(または,複数の領域が重要なのか),今後の研究の進展が待たれる.また,インスリンの非存在下において,中枢神経系がいったいどのように末梢の組織を制御しているのかも課題であろう.これまでの糖尿病に対する治療薬は,インスリン自体やインスリンの効果を高めるものが主体であった.しかし,インスリンとは独立して糖代謝を制御できる機構が動物(少なくとも,マウスおよびラット)には存在しうることが,筆者らを含むいくつかの研究グループにより明確になってきている.これらの分子機構を詳細に明らかにすることが,新しい糖尿病の治療薬の開発につながることを期待している.
文 献
- Fujikawa, T., Chuang, J. C., Sakata, I. et al.: Leptin therapy improves insulin-deficient type 1 diabetes by CNS-dependent mechanisms in mice. Proc. Natl. Acad. Sci. USA, 107, 17391-17396 (2010)[PubMed]
- Coppari, R. & Bjorbaek, C.: Leptin revisited: its mechanism of action and potential for treating diabetes. Nat. Rev. Drug Discov., 11, 692-708 (2012)[PubMed]
- Berglund, E. D., Vianna, C. R., Donato, J. Jr. et al.: Direct leptin action on POMC neurons regulates glucose homeostasis and hepatic insulin sensitivity in mice. J. Clin. Invest., 122, 1000-1009 (2012)[PubMed]
- Thorel, F., Nepote, V., Avril, I. et al.: Conversion of adult pancreatic α-cells to β-cells after extreme β-cell loss. Nature, 464, 1149-1154 (2010)[PubMed]
- Lee, Y., Berglund, E. D., Wang, M. Y. et al.: Metabolic manifestations of insulin deficiency do not occur without glucagon action. Proc. Natl. Acad. Sci. USA, 109, 14972-14976 (2012)[PubMed]
- Haque, M. S., Minokoshi, Y., Hamai, M. et al.: Role of the sympathetic nervous system and insulin in enhancing glucose uptake in peripheral tissues after intrahypothalamic injection of leptin in rats. Diabetes, 48, 1706-1712 (1999)[PubMed]
- Vong, L., Ye, C., Yang, Z. et al.: Leptin action on GABAergic neurons prevents obesity and reduces inhibitory tone to POMC neurons. Neuron, 71, 142-154 (2011)[PubMed]
著者プロフィール
略歴:2008年 京都大学大学院農学研究科博士課程 修了,同年より米国Texas大学Southwestern Medical CenterにてPostdoctoral Fellow.
研究テーマ:中枢神経系による代謝の制御機構.
抱負:おいしいものをいくら食べても病気にならない薬を開発する.
© 2013 藤川 哲兵 Licensed under CC 表示 2.1 日本