光受容体メラノプシンに対する阻害薬の同定および視覚以外の光応答にあたえる影響の解析
羽鳥 恵
(米国Salk Institute for Biological Studies,Regulatory Biology Laboratory)
email:羽鳥 恵
DOI: 10.7875/first.author.2013.110
Small-molecule antagonists of melanopsin-mediated phototransduction.
Kenneth A. Jones, Megumi Hatori, Ludovic S. Mure, Jayne R. Bramley, Roman Artymyshyn, Sang-Phyo Hong, Mohammad Marzabadi, Huailing Zhong, Jeffrey Sprouse, Quansheng Zhu, Andrew T. E. Hartwick, Patricia J. Sollars, Gary E. Pickard, Satchidananda Panda
Nature Chemical Biology, 9, 630-635 (2013)
哺乳類の眼の網膜には桿体,錐体,そして,メラノプシン発現網膜神経節細胞という3種類の光受容細胞が存在する.桿体および錐体はおもに視覚を担う一方,Gタンパク質共役受容体であるメラノプシンを発現するごく一部の網膜神経節細胞は,概日時計の明暗周期への同調,瞳孔の収縮,偏頭痛の光による悪化など,視覚以外の光応答を担う.筆者らは,メラノプシンの機能を薬理学的に制御することにより,メラノプシン発現網膜神経節細胞の関与する生理現象を操作することができるのではないかと考えた.化合物スクリーニングからメラノプシンに特異的に作用する拮抗薬としてスルホンアミド系化合物を同定し,オプシナミドと命名した.オプシナミドは桿体あるいは錐体に由来する光応答には影響をあたえず,瞳孔の収縮や光回避行動などメラノプシンに依存する視覚以外の光応答のみを減弱させ,その効果は可逆的であった.
生物は体内に時計をもち,約1日周期の生体リズム(概日リズム)を制御する体内の自己発振系を概日時計という.哺乳類のほぼ全身の組織および細胞に存在する概日時計は末梢時計とよばれ,食事による影響を強くうける.筆者らは,そのことを応用して,食事を摂取する時間帯の制限は概日時計の振幅を大きくし,食事の量を減らすことなく高脂肪食による肥満やそれに関連する病態をふせぐことを見い出した1)(新着論文レビュー でも掲載).一方,行動リズムを支配する概日時計は脳の視床下部の視交差上核に存在して中枢時計とよばれ,食事ではなく光の影響を強くうける2).
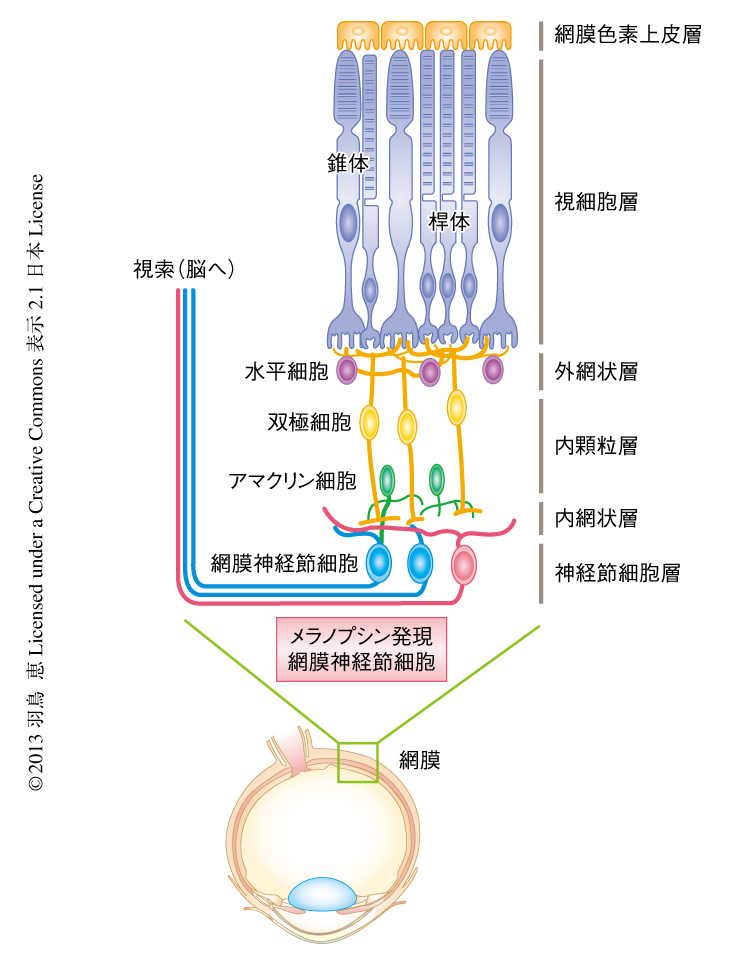
概日時計への光入力を担うのが眼の網膜である.網膜神経節細胞のうち数%の細胞にはメラノプシン(melanopsin)というGタンパク質共役受容体である光受容タンパク質が発現している3,4)(図1).メラノプシンの吸収極大波長は460~480 nm付近の青色光にあり,無脊椎動物の光受容体に類似したシグナル伝達系をもつことが示唆されている.メラノプシンの発現した網膜神経節細胞はメラノプシン発現網膜神経節細胞(melanopsin-expressing retinal ganglion cell:mRGC)とよばれ,桿体,錐体につぐ第3の光受容細胞として機能する.メラノプシン発現網膜神経節細胞はそれ自体,光受容能を保持することから光感受性網膜神経節細胞(intrinsically photosensitive RGC:ipRGC)ともよばれる.メラノプシン発現網膜神経節細胞のおもな投射先は視交差上核であり,概日時計の位相の制御を担う.さらに,膝状間小葉や視蓋前域オリーブ核などにも投射し5,6),瞳孔の反射や光による片頭痛の悪化など視覚以外の光応答(非視覚応答)を制御する.一方,メラノプシンノックアウトマウスでも非視覚応答は完全には失われていないことから7),桿体および錐体も非視覚応答に寄与することが判明していた.メラノプシン発現網膜神経節細胞を後天的に失う遺伝子改変マウスでは網膜から視交差上核への投射がほぼすべて消失し,この結果と一致して,概日時計の位相は明暗周期に同調されなくなり,さらに,瞳孔の反射や光による行動抑制など非視覚応答も完全に失われる8).つまり,メラノプシン発現網膜神経節細胞はそれ自体で光を感じると同時に桿体および錐体からの投射もうけ,網膜からの膨大な情報がメラノプシン発現網膜神経節細胞に集約され非視覚応答が制御されている.そのため,メラノプシン発現網膜神経節細胞の機能を制御することは非視覚応答の制御につながると考えられた.
メラノプシンの機能を薬剤を用いて制御しようと考え,約80,000種類の低分子化合物についてメラノプシンに作用するかどうか検証した.メラノプシンは青色光に吸収極大をもち,光の照射によりイノシトールトリスリン酸経路が活性化され細胞内のCa2+濃度が上昇することが知られている3).哺乳類培養細胞にヒトのメラノプシンを安定的に発現させ,青色光を照射したのち細胞内のCa2+濃度を測定してメラノプシンの活性化レベルの変化を評価する系を利用した9).384ウェルプレートを用いたアッセイから,拮抗薬(アンタゴニスト)の候補として最終的に数種類のスルホンアミド系化合物を同定し,オプシナミド(opsinamide)と命名した.約70種類のGタンパク質共役受容体に対するカウンターアッセイから,オプシナミドはメラノプシンに特異的に作用すると考えられた.さらに,過剰発現系ではなくメラノプシン発現網膜神経節細胞それ自体に対しオプシナミドが阻害薬として作用するかどうか調べた.ラットの網膜から単離したメラノプシン発現網膜神経節細胞にオプシナミドを添加したところ,溶媒のみを添加した対照と比較して光応答は顕著に減弱した.
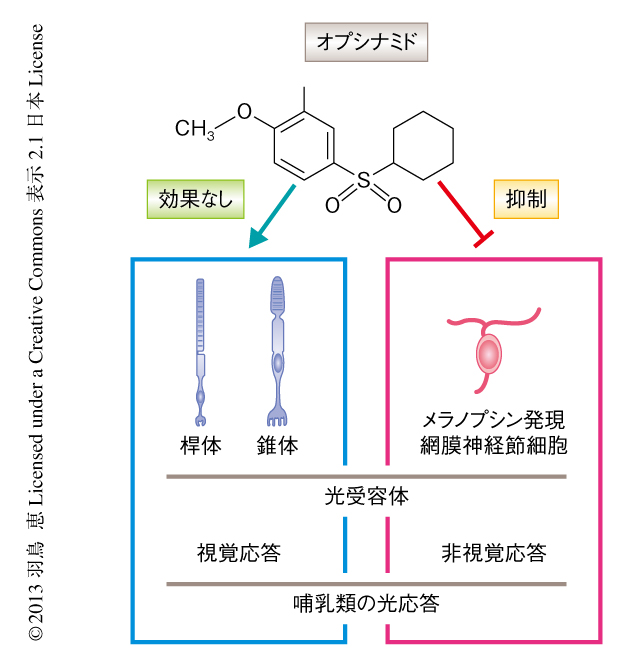
生体においてもオプシナミドは桿体あるいは錐体には影響をあたえず,メラノプシンに特異的に作用するのだろうか? 個体レベルでの実験を行うため,オプシナミドが腹腔内投与ののち体内にどの程度の時間にわたり存在するのか調べたところ,脳および網膜ともに,投与から30分後までは作用を示すのに十分な量が存在していたが,60分後には大幅に減少することがわかった.そこで,オプシナミドの投与から30分以内に網膜電位を測定し,桿体および錐体への影響を解析した.その結果,オプシナミドの投与は網膜電位に影響をあたえなかったことから,桿体および錐体には作用しないと考えられた(図2).また,オプシナミドの投与により,桿体に発現する光受容体であるロドプシンの吸収スペクトルにも変化はみられなかった.
非視覚応答に対しオプシナミドは影響をあたえるだろうか? 光回避行動と瞳孔の収縮の2種類の非視覚応答について測定した.
光回避行動の測定には生後7~9日齢のマウスを用いた.この日齢のマウスにおいて桿体および錐体は完全には発達しておらず,メラノプシン発現網膜神経節細胞が唯一の光受容細胞である.直径2~3 cm,長さ15 cm程度の透明なグラスチューブに生後7~9日齢のマウスを入れ,その動きをモニターした.マウスは暗条件下ではチューブの内部を動き回り,チューブの一方の端から青色光を照射すると光を避けて動きを止めた.それに対し,オプシナミドを投与した野生型マウスは青色光を照射したのちも動きを止めることなく,何もなかったかのように動きつづけた.光を避けずに動きつづける行動は,メラノプシンノックアウトマウスを用いた場合と同様であった.つまり,オプシナミドはマウス生体においてもメラノプシンの機能を阻害した.
成体のマウスを用いて瞳孔の収縮にあたえるオプシナミドの作用を検証した.自然変異により桿体および錐体のほぼすべてを失っているrdマウスを用いた.マウスを暗黒下で順応させたのち,オプシナミドを腹腔内投与し,20分後,30分後,40分後に青色光をそれぞれ1分間照射して瞳孔の大きさを測定した.その結果,対照の溶媒を投与したrdマウスと比べ,オプシナミドを投与したrdマウスの瞳孔の収縮は顕著に減少していた.投与から20分後にはオプシナミドは効果を示したが,40分後には対照のマウスとオプシナミドを投与したマウスはほぼ同じ程度の瞳孔収縮を示した.また,メラノプシンノックアウトマウスに対照の溶媒あるいはオプシナミドを投与した場合,青色光に対する瞳孔の収縮に差はみられなかった.以上の実験結果は,オプシナミドがメラノプシンに特異的な阻害薬であることを強く支持した.
この研究では,メラノプシンに特異的な阻害薬をはじめて同定し,オプシナミドと命名した.さらに,オプシナミドにより生体においてメラノプシンに由来する視覚以外の光応答(非視覚応答)を阻害できることを示した.つまり,偏頭痛の光照射による悪化などを緩和する薬剤の開発にむけた,最初の一歩を提示することができたと考えている.また,基礎研究にあたえる利点として,げっ歯類以外でのメラノプシンおよびメラノプシン発現網膜神経節細胞の役割の研究の促進を期待している.今後は,モデル生物以外においてメラノプシンの機能を解析していきたい.
略歴:2007年 東京大学大学院理学系研究科博士課程 修了,同年 米国Salk Institute for Biological StudiesにてResearch Associateを経て,2013年より同Senior Research Associate.
© 2013 羽鳥 恵 Licensed under CC 表示 2.1 日本
(米国Salk Institute for Biological Studies,Regulatory Biology Laboratory)
email:羽鳥 恵
DOI: 10.7875/first.author.2013.110
Small-molecule antagonists of melanopsin-mediated phototransduction.
Kenneth A. Jones, Megumi Hatori, Ludovic S. Mure, Jayne R. Bramley, Roman Artymyshyn, Sang-Phyo Hong, Mohammad Marzabadi, Huailing Zhong, Jeffrey Sprouse, Quansheng Zhu, Andrew T. E. Hartwick, Patricia J. Sollars, Gary E. Pickard, Satchidananda Panda
Nature Chemical Biology, 9, 630-635 (2013)
要 約
哺乳類の眼の網膜には桿体,錐体,そして,メラノプシン発現網膜神経節細胞という3種類の光受容細胞が存在する.桿体および錐体はおもに視覚を担う一方,Gタンパク質共役受容体であるメラノプシンを発現するごく一部の網膜神経節細胞は,概日時計の明暗周期への同調,瞳孔の収縮,偏頭痛の光による悪化など,視覚以外の光応答を担う.筆者らは,メラノプシンの機能を薬理学的に制御することにより,メラノプシン発現網膜神経節細胞の関与する生理現象を操作することができるのではないかと考えた.化合物スクリーニングからメラノプシンに特異的に作用する拮抗薬としてスルホンアミド系化合物を同定し,オプシナミドと命名した.オプシナミドは桿体あるいは錐体に由来する光応答には影響をあたえず,瞳孔の収縮や光回避行動などメラノプシンに依存する視覚以外の光応答のみを減弱させ,その効果は可逆的であった.
はじめに
生物は体内に時計をもち,約1日周期の生体リズム(概日リズム)を制御する体内の自己発振系を概日時計という.哺乳類のほぼ全身の組織および細胞に存在する概日時計は末梢時計とよばれ,食事による影響を強くうける.筆者らは,そのことを応用して,食事を摂取する時間帯の制限は概日時計の振幅を大きくし,食事の量を減らすことなく高脂肪食による肥満やそれに関連する病態をふせぐことを見い出した1)(新着論文レビュー でも掲載).一方,行動リズムを支配する概日時計は脳の視床下部の視交差上核に存在して中枢時計とよばれ,食事ではなく光の影響を強くうける2).
概日時計への光入力を担うのが眼の網膜である.網膜神経節細胞のうち数%の細胞にはメラノプシン(melanopsin)というGタンパク質共役受容体である光受容タンパク質が発現している3,4)(図1).メラノプシンの吸収極大波長は460~480 nm付近の青色光にあり,無脊椎動物の光受容体に類似したシグナル伝達系をもつことが示唆されている.メラノプシンの発現した網膜神経節細胞はメラノプシン発現網膜神経節細胞(melanopsin-expressing retinal ganglion cell:mRGC)とよばれ,桿体,錐体につぐ第3の光受容細胞として機能する.メラノプシン発現網膜神経節細胞はそれ自体,光受容能を保持することから光感受性網膜神経節細胞(intrinsically photosensitive RGC:ipRGC)ともよばれる.メラノプシン発現網膜神経節細胞のおもな投射先は視交差上核であり,概日時計の位相の制御を担う.さらに,膝状間小葉や視蓋前域オリーブ核などにも投射し5,6),瞳孔の反射や光による片頭痛の悪化など視覚以外の光応答(非視覚応答)を制御する.一方,メラノプシンノックアウトマウスでも非視覚応答は完全には失われていないことから7),桿体および錐体も非視覚応答に寄与することが判明していた.メラノプシン発現網膜神経節細胞を後天的に失う遺伝子改変マウスでは網膜から視交差上核への投射がほぼすべて消失し,この結果と一致して,概日時計の位相は明暗周期に同調されなくなり,さらに,瞳孔の反射や光による行動抑制など非視覚応答も完全に失われる8).つまり,メラノプシン発現網膜神経節細胞はそれ自体で光を感じると同時に桿体および錐体からの投射もうけ,網膜からの膨大な情報がメラノプシン発現網膜神経節細胞に集約され非視覚応答が制御されている.そのため,メラノプシン発現網膜神経節細胞の機能を制御することは非視覚応答の制御につながると考えられた.
1.メラノプシンに作用する拮抗薬のスクリーニングと同定
メラノプシンの機能を薬剤を用いて制御しようと考え,約80,000種類の低分子化合物についてメラノプシンに作用するかどうか検証した.メラノプシンは青色光に吸収極大をもち,光の照射によりイノシトールトリスリン酸経路が活性化され細胞内のCa2+濃度が上昇することが知られている3).哺乳類培養細胞にヒトのメラノプシンを安定的に発現させ,青色光を照射したのち細胞内のCa2+濃度を測定してメラノプシンの活性化レベルの変化を評価する系を利用した9).384ウェルプレートを用いたアッセイから,拮抗薬(アンタゴニスト)の候補として最終的に数種類のスルホンアミド系化合物を同定し,オプシナミド(opsinamide)と命名した.約70種類のGタンパク質共役受容体に対するカウンターアッセイから,オプシナミドはメラノプシンに特異的に作用すると考えられた.さらに,過剰発現系ではなくメラノプシン発現網膜神経節細胞それ自体に対しオプシナミドが阻害薬として作用するかどうか調べた.ラットの網膜から単離したメラノプシン発現網膜神経節細胞にオプシナミドを添加したところ,溶媒のみを添加した対照と比較して光応答は顕著に減弱した.
2.オプシナミドは桿体および錐体には作用しない
生体においてもオプシナミドは桿体あるいは錐体には影響をあたえず,メラノプシンに特異的に作用するのだろうか? 個体レベルでの実験を行うため,オプシナミドが腹腔内投与ののち体内にどの程度の時間にわたり存在するのか調べたところ,脳および網膜ともに,投与から30分後までは作用を示すのに十分な量が存在していたが,60分後には大幅に減少することがわかった.そこで,オプシナミドの投与から30分以内に網膜電位を測定し,桿体および錐体への影響を解析した.その結果,オプシナミドの投与は網膜電位に影響をあたえなかったことから,桿体および錐体には作用しないと考えられた(図2).また,オプシナミドの投与により,桿体に発現する光受容体であるロドプシンの吸収スペクトルにも変化はみられなかった.
3.オプシナミドは生体においてメラノプシン発現網膜神経節細胞に由来する反応を低下させる
非視覚応答に対しオプシナミドは影響をあたえるだろうか? 光回避行動と瞳孔の収縮の2種類の非視覚応答について測定した.
光回避行動の測定には生後7~9日齢のマウスを用いた.この日齢のマウスにおいて桿体および錐体は完全には発達しておらず,メラノプシン発現網膜神経節細胞が唯一の光受容細胞である.直径2~3 cm,長さ15 cm程度の透明なグラスチューブに生後7~9日齢のマウスを入れ,その動きをモニターした.マウスは暗条件下ではチューブの内部を動き回り,チューブの一方の端から青色光を照射すると光を避けて動きを止めた.それに対し,オプシナミドを投与した野生型マウスは青色光を照射したのちも動きを止めることなく,何もなかったかのように動きつづけた.光を避けずに動きつづける行動は,メラノプシンノックアウトマウスを用いた場合と同様であった.つまり,オプシナミドはマウス生体においてもメラノプシンの機能を阻害した.
成体のマウスを用いて瞳孔の収縮にあたえるオプシナミドの作用を検証した.自然変異により桿体および錐体のほぼすべてを失っているrdマウスを用いた.マウスを暗黒下で順応させたのち,オプシナミドを腹腔内投与し,20分後,30分後,40分後に青色光をそれぞれ1分間照射して瞳孔の大きさを測定した.その結果,対照の溶媒を投与したrdマウスと比べ,オプシナミドを投与したrdマウスの瞳孔の収縮は顕著に減少していた.投与から20分後にはオプシナミドは効果を示したが,40分後には対照のマウスとオプシナミドを投与したマウスはほぼ同じ程度の瞳孔収縮を示した.また,メラノプシンノックアウトマウスに対照の溶媒あるいはオプシナミドを投与した場合,青色光に対する瞳孔の収縮に差はみられなかった.以上の実験結果は,オプシナミドがメラノプシンに特異的な阻害薬であることを強く支持した.
おわりに
この研究では,メラノプシンに特異的な阻害薬をはじめて同定し,オプシナミドと命名した.さらに,オプシナミドにより生体においてメラノプシンに由来する視覚以外の光応答(非視覚応答)を阻害できることを示した.つまり,偏頭痛の光照射による悪化などを緩和する薬剤の開発にむけた,最初の一歩を提示することができたと考えている.また,基礎研究にあたえる利点として,げっ歯類以外でのメラノプシンおよびメラノプシン発現網膜神経節細胞の役割の研究の促進を期待している.今後は,モデル生物以外においてメラノプシンの機能を解析していきたい.
文 献
- Hatori, M., Vollmers, C., Zarrinpar, A. et al.: Time-restricted feeding without reducing caloric intake prevents metabolic diseases in mice fed a high-fat diet. Cell Metab., 15, 848-860 (2012)[PubMed] [新着論文レビュー]
- Mohawk, J. A., Green, C. B. & Takahashi, J. S.: Central and peripheral circadian clocks in mammals. Annu. Rev. Neurosci., 35, 445-462 (2012)[PubMed]
- Hatori, M. & Panda, M.: The emerging roles of melanopsin in behavioral adaptation to light. Trends Mol. Med., 16, 435-446 (2010)[PubMed]
- Schmidt, T. M., Chen, S. K. & Hattar, S.: Intrinsically photosensitive retinal ganglion cells: many subtypes, diverse functions. Trends Neurosci., 34, 572-580 (2011)[PubMed]
- Hattar, S., Kumar, M., Park, A. et al.: Central projections of melanopsin-expressing retinal ganglion cells in the mouse. J. Comp. Neurol., 497, 326-349 (2006)[PubMed]
- Brown, T. M., Gias, C., Hatori, M. et al.: Melanopsin contributions to irradiance coding in the thalamo-cortical visual system. PLoS Biol., 8, e1000558 (2010)[PubMed]
- Panda, S., Sato, T. K., Castrucci, A. M. et al.: Melanopsin (Opn4) requirement for normal light-induced circadian phase shifting. Science, 298, 2213-2216 (2002)[PubMed]
- Hatori, M., Le, H., Vollmers, C. et al.: Inducible ablation of melanopsin-expressing retinal ganglion cells reveals their central role in non-image forming visual responses. PLoS One, 3, e2451 (2008)[PubMed]
- Pulivarthy, S. R., Tanaka, N., Welsh, D. K. et al.: Reciprocity between phase shifts and amplitude changes in the mammalian circadian clock. Proc. Natl. Acad. Sci. USA, 104, 20356-20361 (2007)[PubMed]
著者プロフィール
略歴:2007年 東京大学大学院理学系研究科博士課程 修了,同年 米国Salk Institute for Biological StudiesにてResearch Associateを経て,2013年より同Senior Research Associate.
© 2013 羽鳥 恵 Licensed under CC 表示 2.1 日本