輸送受容体importinα2は転写因子の核への輸送を制御することによりES細胞の未分化性を維持する
安原徳子1・金子寛生2
(1大阪大学大学院生命機能研究科 細胞ネットワーク講座,2日本大学文理学部 物理生命システム科学科)
email:安原徳子
DOI: 10.7875/first.author.2013.102
Importin alpha subtypes determine differential transcription factor localization in embryonic stem cells maintenance.
Noriko Yasuhara, Ryosuke Yamagishi, Yoshiyuki Arai, Rashid Mehmood, Chihiro Kimoto, Toshiharu Fujita, Kenichi Touma, Azumi Kaneko, Yasunao Kamikawa, Tetsuji Moriyama, Toshio Yanagida, Hiroki Kaneko, Yoshihiro Yoneda
Developmental Cell, 26, 123-135 (2013)
importinαファミリータンパク質は真核生物の核にタンパク質を運び込む輸送受容体である.これまでに,importinαファミリータンパク質のひとつであるimportinα2は未分化なES細胞において高く発現していること,さらに,Oct3/4などの転写因子と結合しそれらの核への輸送にはたらいていることが知られていた.しかし,importinα2がどのようにES細胞の未分化性の維持にかかわるのかは明らかでなかった.筆者らは,ES細胞を用いた解析から得られた情報を手がかりに,コンピューターシミュレーションを用いた立体構造予測によりimportinα2に未知の基質認識部位を発見した.この新たに見い出された基質認識部位に細胞の分化を進行させるはたらきをもつOct6などの転写因子が結合すると,これらの転写因子は核へと輸送されなくなった.また,野生型のimportinα2を恒常的に発現させたES細胞は分化を誘導しても未分化性を維持するが,新たに見い出された基質認識部位にアミノ酸置換を導入した変異型importinα2では分化が起こるようになった.一方,ES細胞の未分化性の維持にはたらく転写因子であるOct3/4は,新たに見い出された基質認識部位ではなく,既知の基質認識部位に結合することにより効率よく核へと輸送された.つまり,importinα2は複数の基質認識部位をもち,転写因子の種類によりその基質認識部位を使い分けることにより核へと輸送するかどうかを決定し,ES細胞の未分化性を維持していると考えられた.
真核生物の核は核膜により仕切られており,分子の核の内外への移行は自由ではない.核膜には核膜孔とよばれる穴のような構造体が多く存在する.この核膜孔は,小さなイオンなどは拡散により自由に通過させる一方,大きな分子は単独では通過できない構造になっている.そのため,タンパク質など機能性分子の多くはエネルギーと輸送受容体を必要とする選択的な輸送により核の内外へと運ばれている.タンパク質を核へと輸送する受容体はいくつか存在する.そのうち,importinαファミリータンパク質は核へと輸送される積荷タンパク質のもつ塩基性アミノ酸残基に富む核局在化シグナル(nuclear localization signal:NLS)を認識して結合する.これに別の輸送受容体であるimportinβが結合して三者複合体が形成され,importinβと核膜孔構成タンパク質との相互作用により三者複合体は核へと輸送される1,2).核において,importinβは低分子量Gタンパク質Ranのはたらきにより解離し,また,Nup50により積荷タンパク質とimportinαファミリータンパク質とが解離し,核への輸送は完了する3).
importinαファミリータンパク質は哺乳類では5~6種類が存在し,それぞれが組織に特異的な発現パターンを示す.また,それぞれのファミリータンパク質は積荷タンパク質に対し基質特異性を示す.つまり,すべてのファミリータンパク質により輸送されるタンパク質もあれば,特定のファミリータンパク質によってのみ輸送されるタンパク質も存在する.importinαファミリータンパク質はES細胞(embryonic stem cell,胚性幹細胞)の分化に深くかかわっている4).未分化なES細胞ではimportinαファミリータンパク質のひとつであるimportinα2が高く発現し,ニューロンへの分化の過程においてその発現は低下する.ES細胞がニューロンへと分化するとimportinα1やimportinα4といったimportinα2以外のファミリータンパク質が高く発現する.この発現の変化はES細胞の分化において必要であり,とくに,importinα2の発現の低下を抑制すると分化は阻害される.また,importinαファミリータンパク質は分化にはたらく転写因子の核への運び分けをすることがわかっていた.ES細胞の未分化性の維持に必要な転写因子Oct3/4はすべてのimportinαファミリータンパク質により輸送されるのに対し,ニューロンへの分化にはたらく転写因子であるOct6およびBrn2はimportinα2では輸送されず,ほかのファミリータンパク質により輸送される.しかし,importinαファミリータンパク質がどのように転写因子を運び分けるのか,なぜimportinα2の発現がES細胞の未分化性の維持に必要なのかは不明であった.
importinαファミリータンパク質がどのように転写因子を核へと運び分けるかを明らかにするため,組換えタンパク質を用いてimportinαファミリータンパク質と転写因子との結合実験を行った.すると,importinα2はOct6およびBrn2を輸送しないにもかかわらず,これらと強く結合することがわかった.これまで,importinαファミリータンパク質は輸送しない積荷タンパク質とは結合しないと考えられていた.importinα2とOct6あるいはBrn2との結合は,むしろ核への輸送の阻害をひき起こすのではないかと推測し,ジギトニンの処理により細胞膜を透過性にした培養細胞を用いたin vitro輸送アッセイを行った.importinα1およびimportinβやRanなどとともにOct6あるいはBrn2を細胞にくわえると,Oct6あるいはBrn2は核へと輸送される.一方,importinα1の代わりにimportinα2を用いた場合には輸送されない.そして,importinα1とimportinα2を同時にくわえた場合にはOct6あるいはBrn2の輸送はみられなくなった.つまり,importinα2はimportinα1によるOct6およびBrn2の核への輸送を阻害することが見い出された.核へとタンパク質を運ぶ受容体として知られていたimportinα2に,輸送阻害というまったく逆の活性があることは驚くべきことであった.つぎに,importinα2による輸送阻害の分子機構について調べた.タンパク質の結合実験により,importinα2とOct6あるいはBrn2とが結合した場合でも,importinβを含めた三者複合体は形成されることがわかった.一方,1分子イメージング技術とin vitro輸送アッセイを用いた解析により,この三者複合体は核膜孔と相互作用しないことがわかった.
輸送阻害のひとつの原因として,importinα2とOct6あるいはBrn2との結合の状態が通常の結合とは異なる可能性が考えられた.Oct3/4,Oct6,Brn2は,塩基性アミノ酸残基に富む配列を1つ含むmonopartite型5) とよばれるタイプの核局在化シグナルを1つもっている6).この核局在化シグナルに変異を導入すると核への輸送能が失われたこと,および,importinαファミリータンパク質と結合しなくなったことから,これらの転写因子はmonopartite型の核局在化シグナルを介してimportinαファミリータンパク質と結合していることがわかった.一方,importinαファミリータンパク質には核局在化シグナルと結合する基質認識部位が2つあり,そのうち一方のメジャー核局在化シグナル部位とよばれる部位にmonopartite型の核局在化シグナルの結合することが知られている7).この既知の基質認識部位に強く結合するSV40T抗原の核局在化シグナルからなるペプチドを用いてタンパク質結合における競合実験をしたところ,importinα2とOct3/4との結合は阻害されたが,Oct6あるいはBrn2との結合は阻害されなかった.これにより,輸送阻害の起こる原因として,importinα2との結合力が強いため核においてOct6あるいはBrn2が解離しない可能性と,Oct6あるいはBrn2はimportinα2のもつ既知の基質認識部位を介すことなく結合している可能性が考えられた.
構造生物学にもとづいた解析により,Oct6あるいはBrn2のもつ核局在化シグナルがimportinα2のもつ既知の基質認識部位に結合した場合の構造を,Oct3/4の場合と比較した.さらに,ホモロジーモデリング法を用いて予測したimportinα1の立体構造を用いて,同様の比較を行った.しかし,いずれにおいても大きな違いを見い出すことはできなかった.また,さきに述べた1分子イメージング技術を用いた解析の結果からも,Oct6あるいはBrn2のもつ核局在化シグナル配列がimportinα2のもつ既知の基質認識部位に結合する可能性は低いと考えられた.そこで,importinα2には核局在化シグナルと結合する別の基質認識部位が存在すると考えた.そして,importinα2のC末端側の領域をimportinα1のC末端側の領域と置き換えたキメラタンパク質は,Oct6およびBrn2を核へと輸送できるようになり,輸送阻害の活性ももたないことをつきとめた.この結果より,importinα2のC末端側にOct6やBrn2の輸送を阻害する新たな基質認識部位があると推測された.
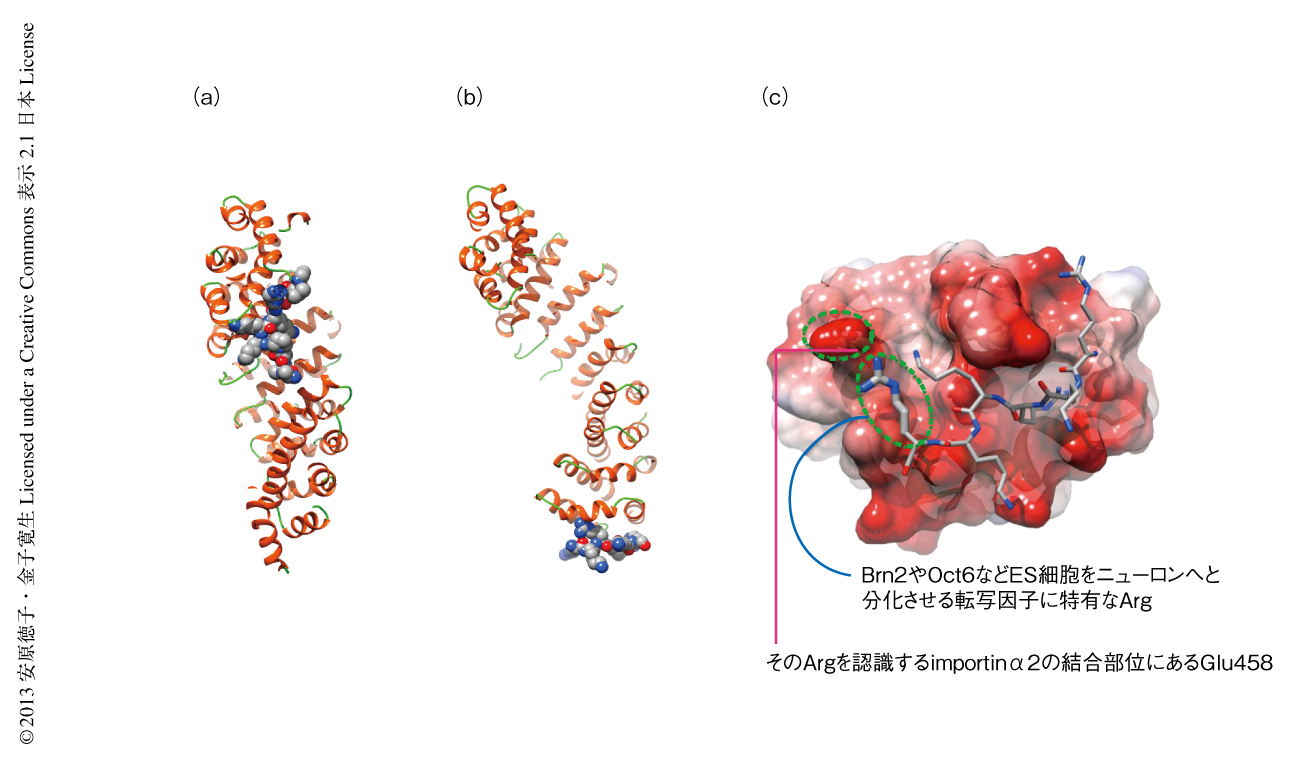
ドッキングシミュレーションや分子力学などの計算構造生物学的な手法を用い,importinα2のC末端側にOct6やBrn2のもつ核局在化シグナルと結合する基質認識部位があるかどうか解析した.すると,importinα2のもつNup50結合領域は3),Oct6およびBrn2のもつ核局在化シグナルと親和性が高く,Oct3/4のもつ核局在化シグナルとは親和性の低いことを見い出した.そして,importinα2とOct6あるいはBrn2との結合モデルにもとづくエネルギー解析の結果から,Oct6およびBrn2のもつ核局在化シグナルともっとも強く相互作用するimportinα2のC末端側の領域に存在するアミノ酸残基を特定した(図1).驚いたことに,importinα2についてもOct6あるいはBrn2についても,それぞれ1アミノ酸残基の違いにより特異性が生じていると推測された.
そこで,タンパク質や細胞を使用した実験系においてこのモデルを検証した.importinα2のもつ新たな基質認識部位において,Oct6およびBrn2のもつ核局在化シグナルとの相互作用に重要なアミノ酸残基であるGlu458は,importnα1ではAsn466になっていた.そこで,importinα2とimportinα1とのあいだでこれらのアミノ酸残基を入れ替えた1アミノ酸残基の変異体を作製し,Oct6およびBrn2の核への輸送について調べた.すると,importinα2の変異体はOct6を核へと輸送するようになり,阻害活性を失った.逆に,importinα1の変異体はOct6を輸送しなくなり,阻害活性を生じた.つまり,importinα2とimportinα1は1アミノ酸残基の変異だけでOct6およびBrn2に対する輸送能を逆転させたのである.また,Oct6のもつ核局在化シグナル配列Arg-Lys-Arg-Lys-Lys-Argを,Oct3/4のもつ1アミノ酸残基の欠失した核局在化シグナルArg-Lys-Arg-Lys-Argと置き換えた変異体を作製した.すると,このOct6の変異体はOct3/4と同様にimportinα2により核へと輸送されるようになった.これらの結果より,計算構造生物学的な手法により求めた結合モデルの正しいことが証明された.
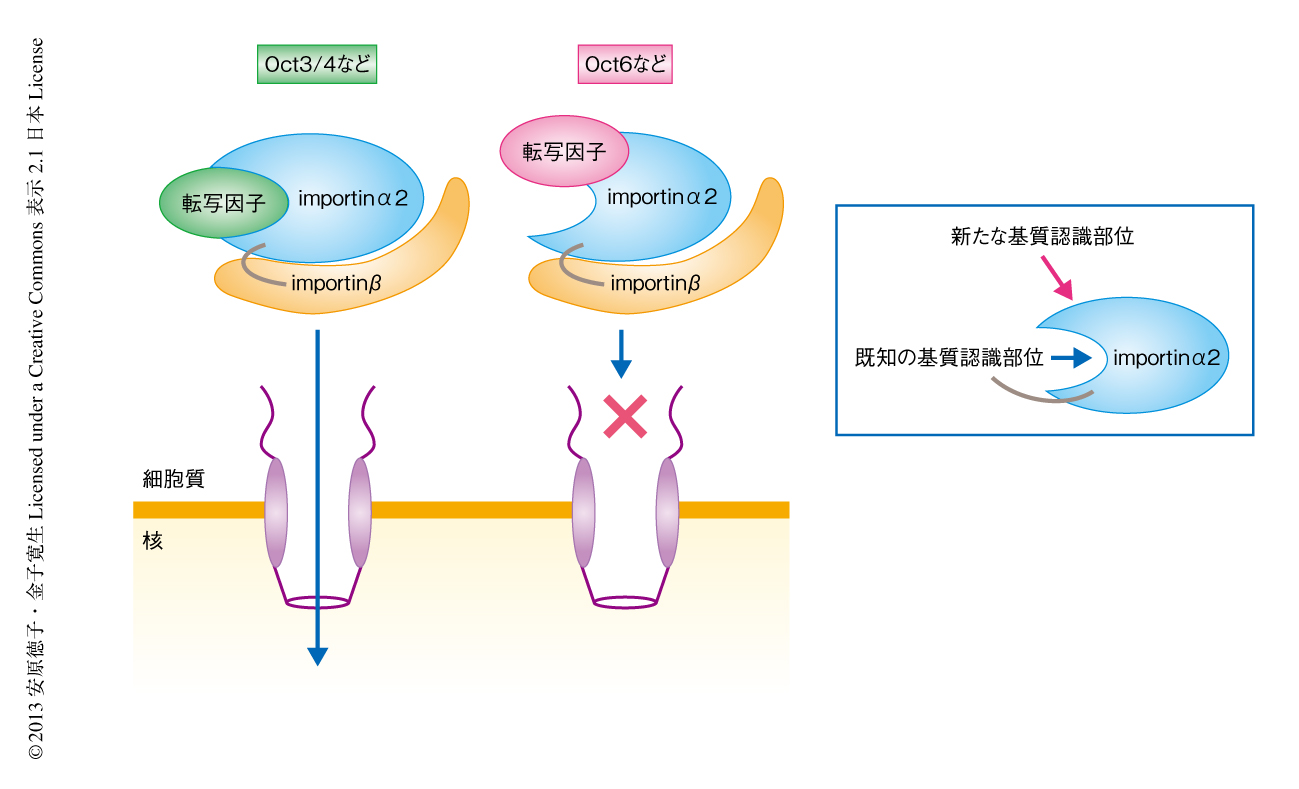
明らかになったimportinα2の機能は,ES細胞の運命決定にどのようにかかわるのだろうか.実は,ES細胞のニューロンへの分化にはたらくOct6は,その機能にもかかわらず未分化なES細胞においても高く発現し,細胞質に局在することがわかっていた4,8).そこで,このOct6の細胞質への局在化にimportinα2のかかわっている可能性が考えられた.人為的にimportinα2の発現を制御できるようにしたES細胞株を作製し,野生型のimportinα2および各種のimportinα2変異体の発現がES細胞の分化に影響をあたえるかどうかみたところ,野生型のimportinα2を恒常的に発現させたES細胞はニューロンへの分化を誘導しても分化せずに細胞死を起こした.このとき,対照となるES細胞では分化とともにみられるOct3/4の発現の低下は起こらなかったが,ニューロンへの分化のマーカーであるSOX1の発現の上昇はみられた.一方,新たに見い出された基質認識部位をimportinα1型にしたimportinα2変異体を発現させたES細胞では,対照となるES細胞と同様にニューロンへと分化させることができた.また,既知の基質認識部位をimportinα1型にしたimportinα2変異体を発現させたES細胞では,野生型のimportinα2を発現させたときと同じように細胞死を起こしたが,一部のES細胞は生存しニューロン以外の細胞へと分化した.この場合には,Oct3/4の発現の低下およびニューロンへの分化のマーカーであるSOX1の発現の上昇がみられた.これらの結果より,importinα2はOct3/4を核へと輸送するとともに,Oct6などの核への輸送を阻害してES細胞の未分化性の維持にはたらき,ES細胞の分化の開始に際してimportinα2の発現量が低下すると,Oct3/4の核への輸送効率は低下し,さらにOct6などが核へと輸送されるようになって,分化が進行すると考えられた(図2).
この研究により,輸送受容体importinα2は複数の基質認識部位をもち,ES細胞の未分化性を維持する転写因子の核への輸送を促進するだけでなく,細胞の分化を進行させる転写因子の核への輸送を阻害することにより細胞の分化を抑制するという,2つの制御を行うことによりES細胞の未分化性を維持していることが明らかになった.importinαファミリータンパク質は細胞の多様な分化にかかわると考えられ,発生および分化の研究分野における新たな展開が期待される.また,特定の転写因子の核への輸送を制御するというまったく新規な方法によりさまざまな幹細胞の分化を制御することなど,再生医療の分野への応用も考えられる.
略歴:2001年 大阪大学大学院医学系研究科にて博士号取得,大阪大学細胞工学センター 講師,大阪大学大学院医学系研究科 研究員,同 助教などを経て,同 生命機能研究科 特任研究員.
研究テーマ:真核生物における核への輸送と高次生命現象.
金子 寛生(Hiroki Kaneko)
日本大学文理学部 教授.
© 2013 安原徳子・金子寛生 Licensed under CC 表示 2.1 日本
(1大阪大学大学院生命機能研究科 細胞ネットワーク講座,2日本大学文理学部 物理生命システム科学科)
email:安原徳子
DOI: 10.7875/first.author.2013.102
Importin alpha subtypes determine differential transcription factor localization in embryonic stem cells maintenance.
Noriko Yasuhara, Ryosuke Yamagishi, Yoshiyuki Arai, Rashid Mehmood, Chihiro Kimoto, Toshiharu Fujita, Kenichi Touma, Azumi Kaneko, Yasunao Kamikawa, Tetsuji Moriyama, Toshio Yanagida, Hiroki Kaneko, Yoshihiro Yoneda
Developmental Cell, 26, 123-135 (2013)
要 約
importinαファミリータンパク質は真核生物の核にタンパク質を運び込む輸送受容体である.これまでに,importinαファミリータンパク質のひとつであるimportinα2は未分化なES細胞において高く発現していること,さらに,Oct3/4などの転写因子と結合しそれらの核への輸送にはたらいていることが知られていた.しかし,importinα2がどのようにES細胞の未分化性の維持にかかわるのかは明らかでなかった.筆者らは,ES細胞を用いた解析から得られた情報を手がかりに,コンピューターシミュレーションを用いた立体構造予測によりimportinα2に未知の基質認識部位を発見した.この新たに見い出された基質認識部位に細胞の分化を進行させるはたらきをもつOct6などの転写因子が結合すると,これらの転写因子は核へと輸送されなくなった.また,野生型のimportinα2を恒常的に発現させたES細胞は分化を誘導しても未分化性を維持するが,新たに見い出された基質認識部位にアミノ酸置換を導入した変異型importinα2では分化が起こるようになった.一方,ES細胞の未分化性の維持にはたらく転写因子であるOct3/4は,新たに見い出された基質認識部位ではなく,既知の基質認識部位に結合することにより効率よく核へと輸送された.つまり,importinα2は複数の基質認識部位をもち,転写因子の種類によりその基質認識部位を使い分けることにより核へと輸送するかどうかを決定し,ES細胞の未分化性を維持していると考えられた.
はじめに
真核生物の核は核膜により仕切られており,分子の核の内外への移行は自由ではない.核膜には核膜孔とよばれる穴のような構造体が多く存在する.この核膜孔は,小さなイオンなどは拡散により自由に通過させる一方,大きな分子は単独では通過できない構造になっている.そのため,タンパク質など機能性分子の多くはエネルギーと輸送受容体を必要とする選択的な輸送により核の内外へと運ばれている.タンパク質を核へと輸送する受容体はいくつか存在する.そのうち,importinαファミリータンパク質は核へと輸送される積荷タンパク質のもつ塩基性アミノ酸残基に富む核局在化シグナル(nuclear localization signal:NLS)を認識して結合する.これに別の輸送受容体であるimportinβが結合して三者複合体が形成され,importinβと核膜孔構成タンパク質との相互作用により三者複合体は核へと輸送される1,2).核において,importinβは低分子量Gタンパク質Ranのはたらきにより解離し,また,Nup50により積荷タンパク質とimportinαファミリータンパク質とが解離し,核への輸送は完了する3).
importinαファミリータンパク質は哺乳類では5~6種類が存在し,それぞれが組織に特異的な発現パターンを示す.また,それぞれのファミリータンパク質は積荷タンパク質に対し基質特異性を示す.つまり,すべてのファミリータンパク質により輸送されるタンパク質もあれば,特定のファミリータンパク質によってのみ輸送されるタンパク質も存在する.importinαファミリータンパク質はES細胞(embryonic stem cell,胚性幹細胞)の分化に深くかかわっている4).未分化なES細胞ではimportinαファミリータンパク質のひとつであるimportinα2が高く発現し,ニューロンへの分化の過程においてその発現は低下する.ES細胞がニューロンへと分化するとimportinα1やimportinα4といったimportinα2以外のファミリータンパク質が高く発現する.この発現の変化はES細胞の分化において必要であり,とくに,importinα2の発現の低下を抑制すると分化は阻害される.また,importinαファミリータンパク質は分化にはたらく転写因子の核への運び分けをすることがわかっていた.ES細胞の未分化性の維持に必要な転写因子Oct3/4はすべてのimportinαファミリータンパク質により輸送されるのに対し,ニューロンへの分化にはたらく転写因子であるOct6およびBrn2はimportinα2では輸送されず,ほかのファミリータンパク質により輸送される.しかし,importinαファミリータンパク質がどのように転写因子を運び分けるのか,なぜimportinα2の発現がES細胞の未分化性の維持に必要なのかは不明であった.
1.輸送受容体importinα2は転写因子Oct6の輸送を阻害する
importinαファミリータンパク質がどのように転写因子を核へと運び分けるかを明らかにするため,組換えタンパク質を用いてimportinαファミリータンパク質と転写因子との結合実験を行った.すると,importinα2はOct6およびBrn2を輸送しないにもかかわらず,これらと強く結合することがわかった.これまで,importinαファミリータンパク質は輸送しない積荷タンパク質とは結合しないと考えられていた.importinα2とOct6あるいはBrn2との結合は,むしろ核への輸送の阻害をひき起こすのではないかと推測し,ジギトニンの処理により細胞膜を透過性にした培養細胞を用いたin vitro輸送アッセイを行った.importinα1およびimportinβやRanなどとともにOct6あるいはBrn2を細胞にくわえると,Oct6あるいはBrn2は核へと輸送される.一方,importinα1の代わりにimportinα2を用いた場合には輸送されない.そして,importinα1とimportinα2を同時にくわえた場合にはOct6あるいはBrn2の輸送はみられなくなった.つまり,importinα2はimportinα1によるOct6およびBrn2の核への輸送を阻害することが見い出された.核へとタンパク質を運ぶ受容体として知られていたimportinα2に,輸送阻害というまったく逆の活性があることは驚くべきことであった.つぎに,importinα2による輸送阻害の分子機構について調べた.タンパク質の結合実験により,importinα2とOct6あるいはBrn2とが結合した場合でも,importinβを含めた三者複合体は形成されることがわかった.一方,1分子イメージング技術とin vitro輸送アッセイを用いた解析により,この三者複合体は核膜孔と相互作用しないことがわかった.
2.importinα2とOct6とは既知の基質認識部位を介さずに結合する
輸送阻害のひとつの原因として,importinα2とOct6あるいはBrn2との結合の状態が通常の結合とは異なる可能性が考えられた.Oct3/4,Oct6,Brn2は,塩基性アミノ酸残基に富む配列を1つ含むmonopartite型5) とよばれるタイプの核局在化シグナルを1つもっている6).この核局在化シグナルに変異を導入すると核への輸送能が失われたこと,および,importinαファミリータンパク質と結合しなくなったことから,これらの転写因子はmonopartite型の核局在化シグナルを介してimportinαファミリータンパク質と結合していることがわかった.一方,importinαファミリータンパク質には核局在化シグナルと結合する基質認識部位が2つあり,そのうち一方のメジャー核局在化シグナル部位とよばれる部位にmonopartite型の核局在化シグナルの結合することが知られている7).この既知の基質認識部位に強く結合するSV40T抗原の核局在化シグナルからなるペプチドを用いてタンパク質結合における競合実験をしたところ,importinα2とOct3/4との結合は阻害されたが,Oct6あるいはBrn2との結合は阻害されなかった.これにより,輸送阻害の起こる原因として,importinα2との結合力が強いため核においてOct6あるいはBrn2が解離しない可能性と,Oct6あるいはBrn2はimportinα2のもつ既知の基質認識部位を介すことなく結合している可能性が考えられた.
構造生物学にもとづいた解析により,Oct6あるいはBrn2のもつ核局在化シグナルがimportinα2のもつ既知の基質認識部位に結合した場合の構造を,Oct3/4の場合と比較した.さらに,ホモロジーモデリング法を用いて予測したimportinα1の立体構造を用いて,同様の比較を行った.しかし,いずれにおいても大きな違いを見い出すことはできなかった.また,さきに述べた1分子イメージング技術を用いた解析の結果からも,Oct6あるいはBrn2のもつ核局在化シグナル配列がimportinα2のもつ既知の基質認識部位に結合する可能性は低いと考えられた.そこで,importinα2には核局在化シグナルと結合する別の基質認識部位が存在すると考えた.そして,importinα2のC末端側の領域をimportinα1のC末端側の領域と置き換えたキメラタンパク質は,Oct6およびBrn2を核へと輸送できるようになり,輸送阻害の活性ももたないことをつきとめた.この結果より,importinα2のC末端側にOct6やBrn2の輸送を阻害する新たな基質認識部位があると推測された.
3.importinα2とOct6とは新たな結合様式をとる
ドッキングシミュレーションや分子力学などの計算構造生物学的な手法を用い,importinα2のC末端側にOct6やBrn2のもつ核局在化シグナルと結合する基質認識部位があるかどうか解析した.すると,importinα2のもつNup50結合領域は3),Oct6およびBrn2のもつ核局在化シグナルと親和性が高く,Oct3/4のもつ核局在化シグナルとは親和性の低いことを見い出した.そして,importinα2とOct6あるいはBrn2との結合モデルにもとづくエネルギー解析の結果から,Oct6およびBrn2のもつ核局在化シグナルともっとも強く相互作用するimportinα2のC末端側の領域に存在するアミノ酸残基を特定した(図1).驚いたことに,importinα2についてもOct6あるいはBrn2についても,それぞれ1アミノ酸残基の違いにより特異性が生じていると推測された.
そこで,タンパク質や細胞を使用した実験系においてこのモデルを検証した.importinα2のもつ新たな基質認識部位において,Oct6およびBrn2のもつ核局在化シグナルとの相互作用に重要なアミノ酸残基であるGlu458は,importnα1ではAsn466になっていた.そこで,importinα2とimportinα1とのあいだでこれらのアミノ酸残基を入れ替えた1アミノ酸残基の変異体を作製し,Oct6およびBrn2の核への輸送について調べた.すると,importinα2の変異体はOct6を核へと輸送するようになり,阻害活性を失った.逆に,importinα1の変異体はOct6を輸送しなくなり,阻害活性を生じた.つまり,importinα2とimportinα1は1アミノ酸残基の変異だけでOct6およびBrn2に対する輸送能を逆転させたのである.また,Oct6のもつ核局在化シグナル配列Arg-Lys-Arg-Lys-Lys-Argを,Oct3/4のもつ1アミノ酸残基の欠失した核局在化シグナルArg-Lys-Arg-Lys-Argと置き換えた変異体を作製した.すると,このOct6の変異体はOct3/4と同様にimportinα2により核へと輸送されるようになった.これらの結果より,計算構造生物学的な手法により求めた結合モデルの正しいことが証明された.
4.importinα2は転写因子を運び分けることによりES細胞の未分化性の維持にはたらく
明らかになったimportinα2の機能は,ES細胞の運命決定にどのようにかかわるのだろうか.実は,ES細胞のニューロンへの分化にはたらくOct6は,その機能にもかかわらず未分化なES細胞においても高く発現し,細胞質に局在することがわかっていた4,8).そこで,このOct6の細胞質への局在化にimportinα2のかかわっている可能性が考えられた.人為的にimportinα2の発現を制御できるようにしたES細胞株を作製し,野生型のimportinα2および各種のimportinα2変異体の発現がES細胞の分化に影響をあたえるかどうかみたところ,野生型のimportinα2を恒常的に発現させたES細胞はニューロンへの分化を誘導しても分化せずに細胞死を起こした.このとき,対照となるES細胞では分化とともにみられるOct3/4の発現の低下は起こらなかったが,ニューロンへの分化のマーカーであるSOX1の発現の上昇はみられた.一方,新たに見い出された基質認識部位をimportinα1型にしたimportinα2変異体を発現させたES細胞では,対照となるES細胞と同様にニューロンへと分化させることができた.また,既知の基質認識部位をimportinα1型にしたimportinα2変異体を発現させたES細胞では,野生型のimportinα2を発現させたときと同じように細胞死を起こしたが,一部のES細胞は生存しニューロン以外の細胞へと分化した.この場合には,Oct3/4の発現の低下およびニューロンへの分化のマーカーであるSOX1の発現の上昇がみられた.これらの結果より,importinα2はOct3/4を核へと輸送するとともに,Oct6などの核への輸送を阻害してES細胞の未分化性の維持にはたらき,ES細胞の分化の開始に際してimportinα2の発現量が低下すると,Oct3/4の核への輸送効率は低下し,さらにOct6などが核へと輸送されるようになって,分化が進行すると考えられた(図2).
おわりに
この研究により,輸送受容体importinα2は複数の基質認識部位をもち,ES細胞の未分化性を維持する転写因子の核への輸送を促進するだけでなく,細胞の分化を進行させる転写因子の核への輸送を阻害することにより細胞の分化を抑制するという,2つの制御を行うことによりES細胞の未分化性を維持していることが明らかになった.importinαファミリータンパク質は細胞の多様な分化にかかわると考えられ,発生および分化の研究分野における新たな展開が期待される.また,特定の転写因子の核への輸送を制御するというまったく新規な方法によりさまざまな幹細胞の分化を制御することなど,再生医療の分野への応用も考えられる.
文 献
- Gorlich, D. & Mattaj, I. W.: Nucleocytoplasmic transport. Science, 271, 1513-1518 (1996)[PubMed]
- Imamoto, N., Shimamoto, T., Takao, T. et al.: In vivo evidence for involvement of a 58 kDa component of nuclear pore-targeting complex in nuclear protein import. EMBO J., 14, 3617-3626 (1995)[PubMed]
- Matsuura, Y. & Stewart, M.: Nup50/Npap60 function in nuclear protein import complex disassembly and importin recycling. EMBO J., 24, 3681-3689 (2005)[PubMed]
- Yasuhara, N., Shibazaki, N., Tanaka, S. et al.: Triggering neural differentiation of ES cells by subtype switching of importinα. Nat. Cell Biol., 9, 72-79 (2007)[PubMed]
- Kalderon, D., Richardson, W. D., Markham, A. F. et al.: Sequence requirements for nuclear location of simian virus 40 large-T antigen. Nature, 311, 33-38 (1984)[PubMed]
- Sock, E., Enderich, J., Rosenfeld, M. G. et al.: Identification of the nuclear localization signal of the POU domain protein Tst-1/Oct6. J. Biol. Chem., 271, 17512-17518 (1996)[PubMed]
- Fontes, M. R., Teh, T. & Kobe, B.: Structural basis of recognition of monopartite and bipartite nuclear localization sequences by mammalian importinα. J. Mol. Biol., 297, 1183-1194 (2000)[PubMed]
- Suzuki, N., Rohdewohld, H., Neuman, T. et al.: Oct-6: a POU transcription factor expressed in embryonal stem cells and in the developing brain. EMBO J., 9, 3723-3732 (1990)[PubMed]
著者プロフィール
略歴:2001年 大阪大学大学院医学系研究科にて博士号取得,大阪大学細胞工学センター 講師,大阪大学大学院医学系研究科 研究員,同 助教などを経て,同 生命機能研究科 特任研究員.
研究テーマ:真核生物における核への輸送と高次生命現象.
金子 寛生(Hiroki Kaneko)
日本大学文理学部 教授.
© 2013 安原徳子・金子寛生 Licensed under CC 表示 2.1 日本