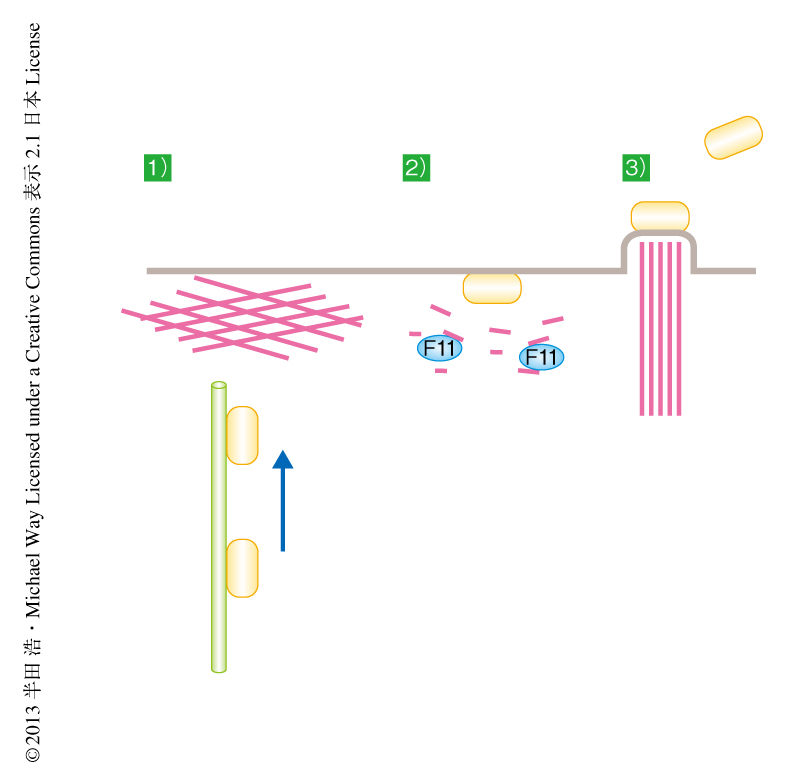
ワクシニアウイルスに由来するタンパク質F11はPDZ様ドメインを介しミオシン9Aに結合することによりRhoAシグナルを抑制する
半田 浩・Michael Way
(英国Cancer Research UK London Research Institute)
email:半田 浩
DOI: 10.7875/first.author.2013.099
Vaccinia virus F11 promotes viral spread by acting as a PDZ-containing scaffolding protein to bind Myosin-9A and inhibit RhoA signaling.
Yutaka Handa, Charlotte H. Durkin, Mark P. Dodding, Michael Way
Cell Host & Microbe, 14, 51-62 (2013)
ワクシニアウイルスに由来するタンパク質F11は宿主の細胞内においてRhoAに結合し,そのシグナルを抑制することによりウイルスの拡散を促進するが,その機構はいまだ不明であった.筆者らは,F11の中央の領域にはPDZ様ドメインが保存されており,このPDZ様ドメインがRhoAシグナルの抑制およびウイルスの拡散に重要であることを発見した.F11においてPDZ様ドメインはそのC末端側の領域にあるPDZ結合モチーフと結合することにより分子内結合を形成し,この分子内結合がこわれるとPDZ様ドメインを介しRhoAのGAPであるミオシン9Aに結合することによりRhoAシグナルを抑制した.RNAi法により内在性のミオシン9Aをノックダウンしたところ,ウイルスによるアクチンテイルの誘導は低下し,さらには,ウイルスの拡散は減少した.さらに,GAP活性をもたないミオシン9Aの変異体,もしくは,PDZ結合モチーフを欠損したミオシン9A変異体を発現させた細胞ではウイルスによるアクチンテイルの誘導は低下した.このような一連の結果から,ワクシニアウイルスに由来するタンパク質F11はPDZ様ドメインにてミオシン9AのPDZ結合モチーフに結合することにより,宿主細胞においてRhoAシグナルを抑制することが明らかになった.
ワクシニアウイルスは天然痘ウイルスと同じポックスウイルス科に属する,2本鎖DNAをもつDNAウイルスである.ワクシニアウイルスは宿主細胞において増殖したのち,その細胞膜と融合して細胞の外へと移行する.移行したのちはウイルスの直下においてアクチン重合の形成を促進してアクチンテイルを誘導し,その推進力を利用することにより宿主細胞の表面を移動し隣接の細胞へと拡散していく1).また,一部のウイルスは宿主細胞より放出され近接の細胞へと感染する.ウイルスが宿主細胞の細胞膜に到達するためには,細胞の表層に物理的な障害として存在するアクチンフィラメントを通過する必要がある.これまでに筆者らの研究室は,ワクシニアウイルスに由来するタンパク質F11にはC末端側の領域に低分子量Gタンパク質RhoAのエフェクタータンパク質であるROCKのもつRBD(Rho-binding domain)様モチーフが保存されていること,そして,このRBD様モチーフを介してRhoAに結合することを報告している2).くわえて,RhoAシグナルを抑制することによりアクチンフィラメントの形成を制御し,ウイルスの細胞膜への到達を促していることを明らかにしている3-5).さらに,F11によるRhoAシグナルの抑制は宿主細胞における細胞接着の変化を促し,細胞遊走を促進することにより隣接の細胞への感染の拡大に寄与している(図1).低分子量Gタンパク質のうちRasスーパーファミリーに属するRhoファミリータンパク質はアクチン骨格の再編成において中心的な役割を担う.低分子量Gタンパク質は活性型であるGTP結合型と不活性型のGDP結合型の2つの構造をとる.GDP結合型からGTP結合型への変換はグアニンヌクレオチド交換因子(GEF:guanine nucleotide exchange factor)より促進され,GTP結合型からGDP結合型への変換はGTPase活性化タンパク質(GAP:GTPase-activating protein)により行われる6).これまでに,F11がRhoAに結合してRhoAシグナルを抑制することによりウイルスによるアクチンテイルの誘導,宿主細胞からの放出,さらには,ウイルスの拡散が促進されることが明らかにされてきたが,その詳細な機構はいまだ不明であった.この研究では,F11がその中央の領域にPDZ様ドメインを保存しており,このPDZ様ドメインを介してRhoAのGAPであるミオシン9Aに結合することによりRhoAの制御を行っていることを明らかにした.
F11のもつ特異的なドメインを探索するため,ポックスウイルス科に属するウイルスのもつF11ファミリータンパク質について,そのアミノ酸配列を比較したところ,中央の領域に高い相同性が確認された.この領域をタンパク質立体構造予測サイトPhyreにより解析したところ,立体構造としてPDZドメインが示唆された.PDZドメインは細菌からヒトまで広範囲に保存されており,タンパク質どうしの結合に重要な役割を担う.しかしながら,ウイルスにおいてはPDZドメインを保存し感染に関与するタンパク質は報告されていなかった.PDZドメインは特徴的なモチーフであるGLGFモチーフおよびGDモチーフを保存している.PDZドメインはGLGFモチーフを介し,おもにC末端側の領域に存在するPDZ結合モチーフと特異的に結合する,一方で,GDモチーフはPDZドメインのフォールディングに関与すると推測されている7).さらに興味深いことには,F11はPDZ様ドメインだけでなく,C末端にPDZ結合モチーフも保存していた.
F11の中央の領域に存在するPDZ様ドメインがPDZ結合モチーフと結合するかどうかを検討するため,F11のPDZ結合モチーフを含むF11のC末端側のペプチドを用いてペプチドプルダウンアッセイを行った.その結果,F11のPDZ様ドメインはF11のPDZ結合モチーフと結合することが判明した.この結合がPDZ様ドメインに依存的かどうかを検討するため,GLGFモチーフのGly-PheおよびGDモチーフのGly-AspをAla-Alaに置換したF11変異体を作製し,F11のPDZ結合モチーフとの結合を確認した結果,これらの変異体は結合能を失っていた.さらに,PDZ結合モチーフを欠損させたF11のC末端側のペプチドはF11のPDZ様ドメインと結合しなかった.以上のことから,F11はPDZ様ドメインとPDZ結合モチーフを介し結合することが示された.F11はC末端側の領域に存在するRBD様モチーフを介しRhoAと結合するが,F11はPDZ様ドメインとPDZ結合モチーフとで分子内結合を形成することによりF11とRhoAとの結合を制御していることが予想された.この予想を検討するため,大腸菌においてPDZ結合モチーフを欠損させたF11変異体を発現させRhoAとの結合を確認した結果,野生型のF11と比較してRhoAと強く結合した.この結果から,F11はPDZ様ドメインとPDZ結合モチーフとの分子内結合によりRhoAとの結合を制御していることが示唆された.
F11のPDZ様ドメインがRhoAシグナルの抑制に関与しているのかどうかを検討するため,PDZ様ドメインにあるGLGFモチーフのGly-PheをAla-Alaに置換した変異体,あるいは,GDモチーフのGly-AspをAla-Alaに置換した変異体をもつウイルスを作製し,これらのウイルスの感染下におけるRhoAシグナルを測定した.その結果,RhoAシグナルは野生型のウイルスの感染では低下していたが,F11を欠損したウイルス,および,2種類のPDZ様ドメイン変異体を発現するウイルスの感染では変化は確認されなかった.ウイルスはF11によるRhoAシグナルの抑制を誘導することにより宿主細胞の表層に存在するアクチンフィラメントを制御し,これを通過することで宿主細胞の外への移行をはたしアクチンテイルを誘導する.そこで,PDZ様ドメイン変異体を発現するウイルスの感染下におけるアクチンテイルの数を測定した.野生型のウイルスの感染と比較して,F11を欠損したウイルス,および,2種類のPDZ様ドメイン変異体を発現するウイルスの感染ではアクチンテイルの数は1/3にまで減少していた.さらに,宿主細胞から放出されたウイルスも,F11を欠損したウイルス,および,2種類のPDZ様ドメイン変異体を発現するウイルスの感染では有意に減少していた.ウイルスの拡散を検討するプラークアッセイの結果,2種類のPDZ様ドメイン変異体を発現するウイルスの感染ではプラークサイズは野生型のウイルスの感染と比較して縮小しており,F11を欠損したウイルスの感染と同じであった.これらの結果より,PDZ様ドメインはF11の機能において重要であることが示された.
一部のタンパク質のもつPDZ結合モチーフは,細胞膜に局在するPDZドメインをもつタンパク質と結合することにより細胞膜への移行を促進する.F11のPDZ結合モチーフは分子内結合を形成するだけではなく,F11の細胞膜への移行も促進していると推測し,野生型のF11およびPDZ結合モチーフを欠損させたF11の細胞膜への局在を観察した.その結果,野生型のF11は細胞膜に局在していたが,PDZ結合モチーフを欠損させたF11は細胞膜への局在が低下していた.これらのことから,F11のPDZ結合モチーフは分子内結合によるF11とRhoAとの結合の制御だけでなく,F11の細胞膜への移行も促進していることが示された.
これまでの結果から,F11のPDZ様ドメインはRhoAシグナルの抑制に重要であることが示されているが,それでは,PDZ様ドメインはどのように関与しているのだろうか? 近年,Rhoファミリータンパク質のGEFもしくはGAPとしてはたらくドメインをもつタンパク質の多くがPDZ結合モチーフを保有するという非常に興味深い報告がなされた8).そこで,PDZ結合モチーフを保存しているRhoファミリータンパク質のGAPがF11に結合するかどうかを検討した.その結果,これまで約80のRho GAPが報告されているうち,18つがPDZ結合モチーフを保存していた.PDZ結合モチーフはおもに3つのクラスに分類されている.F11のPDZ様ドメインに結合するF11のPDZ結合モチーフはクラスIIに属していたことから,F11のPDZ様ドメインはクラスIIのPDZ結合モチーフに特異的に結合すると推測された.そこで,PDZ結合モチーフをもつ18つのRho GAPからクラスIIのPDZ結合モチーフを保有する7つに焦点をあて,F11のPDZ様ドメインとの結合について検討した.その結果,F11のPDZ様ドメインに結合するRho GAPとして,βキメリンおよびミオシン9Aが同定された.このうちβキメリンはRacに特異的なGAPであり,ミオシン9AはRhoAに特異的なGAPであったことから,ミオシン9Aに着目した.
ミオシン9Aがウイルスの感染下においてRhoAシグナルの抑制に関与しているのかどうかを検討するため,RNAi法によりミオシン9Aをノックダウンした.ミオシン9Aノックダウン細胞に野生型のウイルスあるいはF11を欠損したウイルスを感染させてRhoAシグナルを測定した結果,ミオシン9AのノックダウンによりRhoAシグナルの抑制は起こらなくなった.さらに,F11を欠損したウイルスの感染ではミオシン9AのノックダウンによりRhoAの活性に影響は認められなかったことから,ミオシン9AはF11に依存的なRhoAシグナルの抑制に深く関与していることが示唆された.アクチンテイルの数を測定した結果,ミオシン9Aのノックダウンにより野生型のウイルスに感染したときのアクチンテイルの数はF11を欠損したウイルスに感染したときのレベルにまで低下していた.ウイルスの放出についても同様に,ミオシン9Aのノックダウンによりウイルスの放出は減少した.さらに,ミオシン9A,RhoA GAP不活性型のミオシン9A,PDZ結合モチーフを欠損させたミオシン9Aにそれぞれ蛍光タンパク質GFPを融合させたタンパク質を,ミオシン9Aノックダウン細胞に発現させてアクチンテイルの誘導を観察した結果,ミオシン9Aの発現によりアクチンテイルは増加したが,RhoA GAP不活性型のミオシン9A,および,PDZ結合モチーフを欠損させたミオシン9Aの発現ではアクチンテイルは影響されなかった.これらの結果から,F11によるRhoAシグナルの抑制はミオシン9AのもつRhoA GAP活性に依存的であることが判明した.
ミオシン9Aがウイルスの拡散に関与するのかどうかを検討するため,ミオシン9Aノックダウン細胞を用いてプラークアッセイを行った.野生型のウイルスの感染においてはミオシン9Aのノックダウンによりプラークサイズの縮小が観察されたが,F11を欠損したウイルスの感染では影響は認められなかった.ウイルスの感染下においてF11がRhoAおよびミオシン9Aと複合体を形成しているのかどうかを検討するため,培養細胞にFLAGタグを融合させたF11を発現するウイルスを感染させて免疫沈降実験を行った.その結果,ウイルスの感染下でF11はRhoAおよびミオシン9Aと複合体を形成していることが明らかになった.以上の結果から,F11はRhoAおよびミオシン9Aと複合体を形成しRhoAシグナルを抑制することによりウイルスの感染に関与していることが明らかになった.
これまで,ワクシニアウイルスに由来するタンパク質F11の感染における役割は報告されていたが,その詳細な機構は不明であった.この研究では,1)F11はPDZ様ドメインおよびPDZ結合モチーフを保存していること,2)F11においてPDZ様ドメインはPDZ結合モチーフとの結合により分子内結合を形成しRhoAへの結合を制御していること,3)PDZ様ドメインはRhoAのGAPであるミオシン9Aと結合することによりRhoAシグナルを抑制していること,を明らかにした(図2).これまで,PDZ結合モチーフにより宿主細胞のもつPDZドメインを保有するタンパク質に結合し,感染を促進するタンパク質は数多く報告されている9).一方で,PDZドメインを介して感染に関与しているタンパク質はF11がはじめての報告となった.このことは,ウイルスは宿主細胞へ感染するための数多くの戦略をもち,きわめて巧妙に感染をひき起こしていることを示唆した.
略歴:2008年 東京大学大学院医学系研究博士後期課程 修了,同年 英国Cancer Research UK London Research InstituteにてResearch Fellowを経て,2013年より国立国際医療研究センター研究所 上級研究員.
研究テーマ:病原体の宿主細胞への感染の機構.
感心事:病原体と宿主免疫とのかかわり.
Michael Way
英国Cancer Research UK London Research InstituteにてGroup Leader.
研究室URL:http://www.london-research-institute.org.uk/research/michael-way
© 2013 半田 浩・Michael Way Licensed under CC 表示 2.1 日本
(英国Cancer Research UK London Research Institute)
email:半田 浩
DOI: 10.7875/first.author.2013.099
Vaccinia virus F11 promotes viral spread by acting as a PDZ-containing scaffolding protein to bind Myosin-9A and inhibit RhoA signaling.
Yutaka Handa, Charlotte H. Durkin, Mark P. Dodding, Michael Way
Cell Host & Microbe, 14, 51-62 (2013)
要 約
ワクシニアウイルスに由来するタンパク質F11は宿主の細胞内においてRhoAに結合し,そのシグナルを抑制することによりウイルスの拡散を促進するが,その機構はいまだ不明であった.筆者らは,F11の中央の領域にはPDZ様ドメインが保存されており,このPDZ様ドメインがRhoAシグナルの抑制およびウイルスの拡散に重要であることを発見した.F11においてPDZ様ドメインはそのC末端側の領域にあるPDZ結合モチーフと結合することにより分子内結合を形成し,この分子内結合がこわれるとPDZ様ドメインを介しRhoAのGAPであるミオシン9Aに結合することによりRhoAシグナルを抑制した.RNAi法により内在性のミオシン9Aをノックダウンしたところ,ウイルスによるアクチンテイルの誘導は低下し,さらには,ウイルスの拡散は減少した.さらに,GAP活性をもたないミオシン9Aの変異体,もしくは,PDZ結合モチーフを欠損したミオシン9A変異体を発現させた細胞ではウイルスによるアクチンテイルの誘導は低下した.このような一連の結果から,ワクシニアウイルスに由来するタンパク質F11はPDZ様ドメインにてミオシン9AのPDZ結合モチーフに結合することにより,宿主細胞においてRhoAシグナルを抑制することが明らかになった.
はじめに
ワクシニアウイルスは天然痘ウイルスと同じポックスウイルス科に属する,2本鎖DNAをもつDNAウイルスである.ワクシニアウイルスは宿主細胞において増殖したのち,その細胞膜と融合して細胞の外へと移行する.移行したのちはウイルスの直下においてアクチン重合の形成を促進してアクチンテイルを誘導し,その推進力を利用することにより宿主細胞の表面を移動し隣接の細胞へと拡散していく1).また,一部のウイルスは宿主細胞より放出され近接の細胞へと感染する.ウイルスが宿主細胞の細胞膜に到達するためには,細胞の表層に物理的な障害として存在するアクチンフィラメントを通過する必要がある.これまでに筆者らの研究室は,ワクシニアウイルスに由来するタンパク質F11にはC末端側の領域に低分子量Gタンパク質RhoAのエフェクタータンパク質であるROCKのもつRBD(Rho-binding domain)様モチーフが保存されていること,そして,このRBD様モチーフを介してRhoAに結合することを報告している2).くわえて,RhoAシグナルを抑制することによりアクチンフィラメントの形成を制御し,ウイルスの細胞膜への到達を促していることを明らかにしている3-5).さらに,F11によるRhoAシグナルの抑制は宿主細胞における細胞接着の変化を促し,細胞遊走を促進することにより隣接の細胞への感染の拡大に寄与している(図1).低分子量Gタンパク質のうちRasスーパーファミリーに属するRhoファミリータンパク質はアクチン骨格の再編成において中心的な役割を担う.低分子量Gタンパク質は活性型であるGTP結合型と不活性型のGDP結合型の2つの構造をとる.GDP結合型からGTP結合型への変換はグアニンヌクレオチド交換因子(GEF:guanine nucleotide exchange factor)より促進され,GTP結合型からGDP結合型への変換はGTPase活性化タンパク質(GAP:GTPase-activating protein)により行われる6).これまでに,F11がRhoAに結合してRhoAシグナルを抑制することによりウイルスによるアクチンテイルの誘導,宿主細胞からの放出,さらには,ウイルスの拡散が促進されることが明らかにされてきたが,その詳細な機構はいまだ不明であった.この研究では,F11がその中央の領域にPDZ様ドメインを保存しており,このPDZ様ドメインを介してRhoAのGAPであるミオシン9Aに結合することによりRhoAの制御を行っていることを明らかにした.
1.F11はPDZ様ドメインおよびPDZ結合モチーフを保存している
F11のもつ特異的なドメインを探索するため,ポックスウイルス科に属するウイルスのもつF11ファミリータンパク質について,そのアミノ酸配列を比較したところ,中央の領域に高い相同性が確認された.この領域をタンパク質立体構造予測サイトPhyreにより解析したところ,立体構造としてPDZドメインが示唆された.PDZドメインは細菌からヒトまで広範囲に保存されており,タンパク質どうしの結合に重要な役割を担う.しかしながら,ウイルスにおいてはPDZドメインを保存し感染に関与するタンパク質は報告されていなかった.PDZドメインは特徴的なモチーフであるGLGFモチーフおよびGDモチーフを保存している.PDZドメインはGLGFモチーフを介し,おもにC末端側の領域に存在するPDZ結合モチーフと特異的に結合する,一方で,GDモチーフはPDZドメインのフォールディングに関与すると推測されている7).さらに興味深いことには,F11はPDZ様ドメインだけでなく,C末端にPDZ結合モチーフも保存していた.
2.PDZ様ドメインはF11とRhoAとの結合に関与する
F11の中央の領域に存在するPDZ様ドメインがPDZ結合モチーフと結合するかどうかを検討するため,F11のPDZ結合モチーフを含むF11のC末端側のペプチドを用いてペプチドプルダウンアッセイを行った.その結果,F11のPDZ様ドメインはF11のPDZ結合モチーフと結合することが判明した.この結合がPDZ様ドメインに依存的かどうかを検討するため,GLGFモチーフのGly-PheおよびGDモチーフのGly-AspをAla-Alaに置換したF11変異体を作製し,F11のPDZ結合モチーフとの結合を確認した結果,これらの変異体は結合能を失っていた.さらに,PDZ結合モチーフを欠損させたF11のC末端側のペプチドはF11のPDZ様ドメインと結合しなかった.以上のことから,F11はPDZ様ドメインとPDZ結合モチーフを介し結合することが示された.F11はC末端側の領域に存在するRBD様モチーフを介しRhoAと結合するが,F11はPDZ様ドメインとPDZ結合モチーフとで分子内結合を形成することによりF11とRhoAとの結合を制御していることが予想された.この予想を検討するため,大腸菌においてPDZ結合モチーフを欠損させたF11変異体を発現させRhoAとの結合を確認した結果,野生型のF11と比較してRhoAと強く結合した.この結果から,F11はPDZ様ドメインとPDZ結合モチーフとの分子内結合によりRhoAとの結合を制御していることが示唆された.
3.F11のPDZ様ドメインはRhoAシグナルの抑制およびウイルスの拡散に重要である
F11のPDZ様ドメインがRhoAシグナルの抑制に関与しているのかどうかを検討するため,PDZ様ドメインにあるGLGFモチーフのGly-PheをAla-Alaに置換した変異体,あるいは,GDモチーフのGly-AspをAla-Alaに置換した変異体をもつウイルスを作製し,これらのウイルスの感染下におけるRhoAシグナルを測定した.その結果,RhoAシグナルは野生型のウイルスの感染では低下していたが,F11を欠損したウイルス,および,2種類のPDZ様ドメイン変異体を発現するウイルスの感染では変化は確認されなかった.ウイルスはF11によるRhoAシグナルの抑制を誘導することにより宿主細胞の表層に存在するアクチンフィラメントを制御し,これを通過することで宿主細胞の外への移行をはたしアクチンテイルを誘導する.そこで,PDZ様ドメイン変異体を発現するウイルスの感染下におけるアクチンテイルの数を測定した.野生型のウイルスの感染と比較して,F11を欠損したウイルス,および,2種類のPDZ様ドメイン変異体を発現するウイルスの感染ではアクチンテイルの数は1/3にまで減少していた.さらに,宿主細胞から放出されたウイルスも,F11を欠損したウイルス,および,2種類のPDZ様ドメイン変異体を発現するウイルスの感染では有意に減少していた.ウイルスの拡散を検討するプラークアッセイの結果,2種類のPDZ様ドメイン変異体を発現するウイルスの感染ではプラークサイズは野生型のウイルスの感染と比較して縮小しており,F11を欠損したウイルスの感染と同じであった.これらの結果より,PDZ様ドメインはF11の機能において重要であることが示された.
4.F11のPDZ結合モチーフはその細胞膜への移行を促進する
一部のタンパク質のもつPDZ結合モチーフは,細胞膜に局在するPDZドメインをもつタンパク質と結合することにより細胞膜への移行を促進する.F11のPDZ結合モチーフは分子内結合を形成するだけではなく,F11の細胞膜への移行も促進していると推測し,野生型のF11およびPDZ結合モチーフを欠損させたF11の細胞膜への局在を観察した.その結果,野生型のF11は細胞膜に局在していたが,PDZ結合モチーフを欠損させたF11は細胞膜への局在が低下していた.これらのことから,F11のPDZ結合モチーフは分子内結合によるF11とRhoAとの結合の制御だけでなく,F11の細胞膜への移行も促進していることが示された.
5.F11のPDZ様ドメインはRhoAのGAPであるミオシン9Aに結合する
これまでの結果から,F11のPDZ様ドメインはRhoAシグナルの抑制に重要であることが示されているが,それでは,PDZ様ドメインはどのように関与しているのだろうか? 近年,Rhoファミリータンパク質のGEFもしくはGAPとしてはたらくドメインをもつタンパク質の多くがPDZ結合モチーフを保有するという非常に興味深い報告がなされた8).そこで,PDZ結合モチーフを保存しているRhoファミリータンパク質のGAPがF11に結合するかどうかを検討した.その結果,これまで約80のRho GAPが報告されているうち,18つがPDZ結合モチーフを保存していた.PDZ結合モチーフはおもに3つのクラスに分類されている.F11のPDZ様ドメインに結合するF11のPDZ結合モチーフはクラスIIに属していたことから,F11のPDZ様ドメインはクラスIIのPDZ結合モチーフに特異的に結合すると推測された.そこで,PDZ結合モチーフをもつ18つのRho GAPからクラスIIのPDZ結合モチーフを保有する7つに焦点をあて,F11のPDZ様ドメインとの結合について検討した.その結果,F11のPDZ様ドメインに結合するRho GAPとして,βキメリンおよびミオシン9Aが同定された.このうちβキメリンはRacに特異的なGAPであり,ミオシン9AはRhoAに特異的なGAPであったことから,ミオシン9Aに着目した.
6.ミオシン9Aはアクチンテイルの誘導とウイルスの放出を促進する
ミオシン9Aがウイルスの感染下においてRhoAシグナルの抑制に関与しているのかどうかを検討するため,RNAi法によりミオシン9Aをノックダウンした.ミオシン9Aノックダウン細胞に野生型のウイルスあるいはF11を欠損したウイルスを感染させてRhoAシグナルを測定した結果,ミオシン9AのノックダウンによりRhoAシグナルの抑制は起こらなくなった.さらに,F11を欠損したウイルスの感染ではミオシン9AのノックダウンによりRhoAの活性に影響は認められなかったことから,ミオシン9AはF11に依存的なRhoAシグナルの抑制に深く関与していることが示唆された.アクチンテイルの数を測定した結果,ミオシン9Aのノックダウンにより野生型のウイルスに感染したときのアクチンテイルの数はF11を欠損したウイルスに感染したときのレベルにまで低下していた.ウイルスの放出についても同様に,ミオシン9Aのノックダウンによりウイルスの放出は減少した.さらに,ミオシン9A,RhoA GAP不活性型のミオシン9A,PDZ結合モチーフを欠損させたミオシン9Aにそれぞれ蛍光タンパク質GFPを融合させたタンパク質を,ミオシン9Aノックダウン細胞に発現させてアクチンテイルの誘導を観察した結果,ミオシン9Aの発現によりアクチンテイルは増加したが,RhoA GAP不活性型のミオシン9A,および,PDZ結合モチーフを欠損させたミオシン9Aの発現ではアクチンテイルは影響されなかった.これらの結果から,F11によるRhoAシグナルの抑制はミオシン9AのもつRhoA GAP活性に依存的であることが判明した.
7.F11はPDZのスカフォールドタンパク質としてはたらきウイルスの拡散を促進する
ミオシン9Aがウイルスの拡散に関与するのかどうかを検討するため,ミオシン9Aノックダウン細胞を用いてプラークアッセイを行った.野生型のウイルスの感染においてはミオシン9Aのノックダウンによりプラークサイズの縮小が観察されたが,F11を欠損したウイルスの感染では影響は認められなかった.ウイルスの感染下においてF11がRhoAおよびミオシン9Aと複合体を形成しているのかどうかを検討するため,培養細胞にFLAGタグを融合させたF11を発現するウイルスを感染させて免疫沈降実験を行った.その結果,ウイルスの感染下でF11はRhoAおよびミオシン9Aと複合体を形成していることが明らかになった.以上の結果から,F11はRhoAおよびミオシン9Aと複合体を形成しRhoAシグナルを抑制することによりウイルスの感染に関与していることが明らかになった.
おわりに
これまで,ワクシニアウイルスに由来するタンパク質F11の感染における役割は報告されていたが,その詳細な機構は不明であった.この研究では,1)F11はPDZ様ドメインおよびPDZ結合モチーフを保存していること,2)F11においてPDZ様ドメインはPDZ結合モチーフとの結合により分子内結合を形成しRhoAへの結合を制御していること,3)PDZ様ドメインはRhoAのGAPであるミオシン9Aと結合することによりRhoAシグナルを抑制していること,を明らかにした(図2).これまで,PDZ結合モチーフにより宿主細胞のもつPDZドメインを保有するタンパク質に結合し,感染を促進するタンパク質は数多く報告されている9).一方で,PDZドメインを介して感染に関与しているタンパク質はF11がはじめての報告となった.このことは,ウイルスは宿主細胞へ感染するための数多くの戦略をもち,きわめて巧妙に感染をひき起こしていることを示唆した.
文 献
- Roberts, K. L. & Smith, G. L.: Vaccinia virus morphogenesis and dissemination. Trends Microbiol., 16, 472-479 (2008)[PubMed]
- Valderrama, F., Cordeiro, J. V., Schleich, S. et al.: Vaccinia virus-induced cell motility requires F11L-mediated inhibition of RhoA signaling. Science, 311, 377-381 (2006)[PubMed]
- Arakawa, Y., Cordeiro, J. V. & Way, M.: F11L-mediated inhibition of RhoA-mDia signaling stimulates microtubule dynamics during vaccinia virus infection. Cell Host Microbe, 1, 213-226 (2007)[PubMed]
- Arakawa, Y., Cordeiro, J. V., Schleich, S. et al.: The release of vaccinia virus from infected cells requires RhoA-mDia modulation of cortical actin. Cell Host Microbe, 1, 227-240 (2007)[PubMed]
- Cordeiro, J. V., Guerra, S., Arakawa, Y. et al.: F11-mediated inhibition of RhoA signalling enhances the spread of vaccinia virus in vitro and in vivo in an intranasal mouse model of infection. PLoS One, 4, e8506 (2009)[PubMed]
- Ridley, A. J.: Rho proteins: linking signaling with membrane trafficking. Traffic, 2, 303-310 (2001)[PubMed]
- Nourry, C., Grant, S. G. & Borg, J. P.: PDZ domain proteins: plug and play! Sci. STKE, 2003, RE71 (2003)[PubMed]
- Garcia-Mata, R. & Burridge, K.: Catching a GEF by its tail. Trends Cell Biol., 17, 36-43 (2007)[PubMed]
- Javier, R. T. & Rice, A. P.: Emerging theme: cellular PDZ proteins as common targets of pathogenic viruses. J. Virol., 85, 11544-11556 (2011)[PubMed]
著者プロフィール
略歴:2008年 東京大学大学院医学系研究博士後期課程 修了,同年 英国Cancer Research UK London Research InstituteにてResearch Fellowを経て,2013年より国立国際医療研究センター研究所 上級研究員.
研究テーマ:病原体の宿主細胞への感染の機構.
感心事:病原体と宿主免疫とのかかわり.
Michael Way
英国Cancer Research UK London Research InstituteにてGroup Leader.
研究室URL:http://www.london-research-institute.org.uk/research/michael-way
© 2013 半田 浩・Michael Way Licensed under CC 表示 2.1 日本