シナプスの可塑性と記憶の形成とを結ぶショウジョウバエの摂食行動にかかわるコマンドニューロン
吉原 基二郎
(米国Massachusetts大学Medical School,Department of Neurobiology)
email:吉原基二郎
DOI: 10.7875/first.author.2013.091
A single pair of interneurons commands the Drosophila feeding motor program.
Thomas F. Flood, Shinya Iguchi, Michael Gorczyca, Benjamin White, Kei Ito, Motojiro Yoshihara
Nature, 499, 83-87 (2013)
筆者の研究室では,記憶の素過程を理解することを目的として,単純なシナプスのモデルであるショウジョウバエの神経筋接合部と,行動の変化として記憶に直接的に関係づけることのできるショウジョウバエの成虫の摂食行動をつかさどる神経回路のシナプスを,両者を比較しながら研究している.わが国のコンソーシアムにより確立されたショウジョウバエGal4挿入の保存系統であるNP系統を行動スクリーニングすることにより,活動すると摂食行動をひき起こすコマンドニューロンであるFdgニューロンを発見した.Fdgニューロンは摂食行動にかかわる神経回路の要に位置すると考えられるので,行動観察とライブイメージングや電気生理学的な解析を同時に行う目的のため新しく開発した実験系を用いることで,パブロフの条件反射をFdgニューロンに入力するシナプスの変化として研究できることを期待している.ショウジョウバエの神経筋接合部におけるシナプスの可塑性に関するこれまでの知見を作業仮説として,このFdgニューロンにおけるシナプスの可塑性を行動の変化とともに詳細に解析することにより,記憶の形成の分子機構にせまろうと考えている.
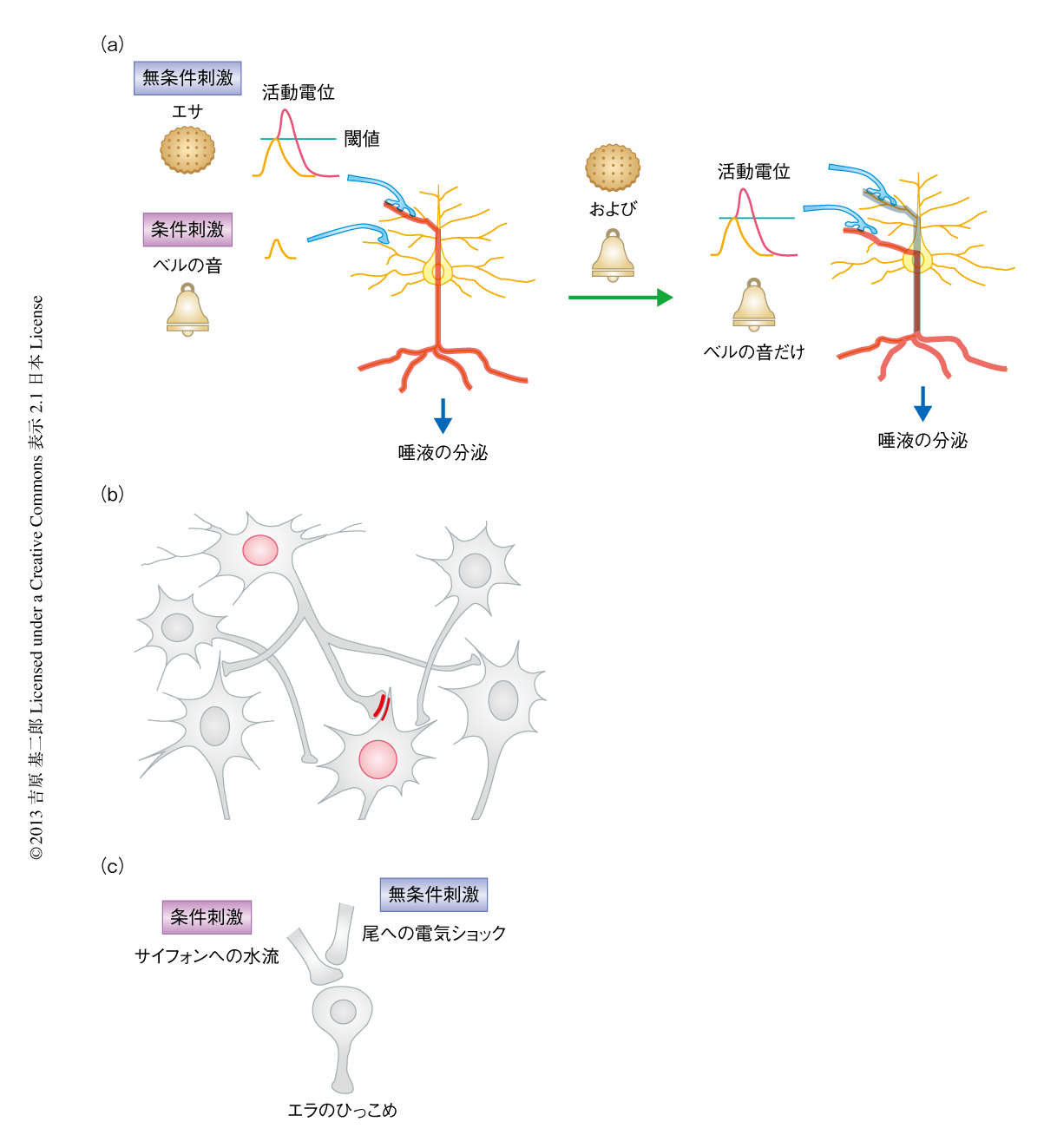
われわれの心に深く刻まれる記憶には,一生つづくものもあれば,とても興奮した記憶なのにしばらくすると忘れてしまったりと,記憶は不思議なものである.記憶はかつて,心理学のテーマとしてのみ研究されていた,とらえどころのない抽象概念であった.この記憶を実験生物学としてあつかったのが,一般にもよく知られているパブロフの条件反射である.パブロフははっきりした2つの刺激,ベルの音(条件刺激)とエサ(無条件刺激)を設定し,条件刺激につづけて無条件刺激をイヌにあたえることにより.本来は無条件刺激による反応であった唾液の分泌が,ベルの音(条件刺激)だけでもひき起こされた(図1a).ここでは,制御しやすい実験条件を設定したことも重要であったが,なにより,この条件刺激と無条件刺激との連合という単純な条件設定により,この連合学習の裏にひそむしくみとして神経回路の変化を明確に想像させたことが重要であった.しかし,変化する神経回路の実際はいまだ推測の域をでず,さらに,それがいかにして起こるかはまだよくわかっていない.筆者らの研究室は,記憶がどのようにしてつくられるのかという疑問に新しいアプローチを用いてとりくんでいる.
記憶は経験により強化されたシナプスを介してつながる一連のニューロンにより保持されていると,筆者を含め多くの神経科学者が推測していると思われる.このことは1940年代にはじめて定式化され,提唱者の名をとり“Hebb則”あるいは“Hebbのシナプス”として知られている1).前シナプス細胞が発火した直後に後シナプス細胞が発火すると,この前シナプスと後シナプスのタイミングがあったときにだけ,特異的にシナプスが強まるとされた(図1b).この考えによると,パブロフの条件反射がどのようにしてできるのか,非常に単純に説明できる(図1a).ベルの音のシグナル(条件刺激)を伝達するニューロンが,エサの刺激(無条件刺激)に反応して唾液を出すことを司令しているニューロンに対し,弱いシナプスを形成していたと仮定してみよう.パブロフの実験ではこの2つのニューロンが連続して発火するはずで,その結果,Hebb則により,そのあいだのシナプスが強くなることによりベルの音(条件刺激)だけで唾液が出るようになる,というように推測できる.
もちろん,実際のイヌの脳のなかはこんなに単純なはずはなく,無数のニューロンがこのシナプス可塑性をになっているはずであるから,さらに無関係な多くの細胞も入り乱れてからみあう脳においてこれを実際に調べることは容易ではない.そこでまず,単純なシナプスにおいてHebb則によるシナプス可塑性の底にひそむ機構を調べようと考えた.これに関しては,もちろん多くの研究者が海馬における長期増強などの実験において重要な知見を得ているのであるが,筆者らはまず,実験を単純化することによりシナプス可塑性の基礎的な過程をつかむため,詳細な定量により正確なシナプスの生理学的な解析の可能な2,3),ショウジョウバエの胚の神経筋接合部における可塑性の実験系を確立した.神経筋接合部における電気生理学的な解析と解剖学的な解析の結果から,前シナプスからの微小シナプス電位をつくる放出と,後シナプスから放出される逆行性シグナルとのあいだの相互な“ローカルフィードバック”により,1個のシナプスが特異的に強められた状態が維持されるのではないかという作業仮説をたてた4).これは神経筋接合部における実験結果から導き出された可能性であったが,Hebb則をよく説明するし,これまでの文献ともよくあうので,脳において記憶が維持され形成されるための機構であるのかもしれない.
筆者は,この可能性に大きな夢を感じたものの,実際に脳における記憶にかかわってはいない神経筋接合部をいくら研究したところで,記憶の本質にせまることはできない.そこで,神経筋接合部で得られた知見を脳において検証するため,つぎの段階に移ることにした.
さて,どうやって脳における記憶の形成をシナプスの可塑性に結びつければいいのか? 最初の実験的なアプローチは1980年代のアメフラシを使った研究で,実際のシナプスにおける分子機構にまでおよぶ大きな洞察をあたえた5).しかし,そのシナプス特異性は,無条件刺激をになうニューロンが条件刺激をになう前シナプスに直接に付着して修飾することによる,すなわち,解剖学的な特徴によりシナプスの特異性が決まっているので,Hebb則によるシナプスのモデルにはならない(図1c).それなら,自分たちで一から実験系をつくってみようか,と荒唐無稽なことを夢想した.このとき,頭にあったのが今回のキーワード,“コマンドニューロン”(司令ニューロン)であった.動物行動学のコンセプトである定型行動6),たとえば,攻撃行動や産卵行動などの決まった一連の行動パターンを起こす引き金にあたるニューロンがコマンドニューロンである.コマンドニューロンというコンセプトは,1960年代のザリガニの遊泳肢の運動をオンにしたりオフにしたりした実験に端を発している7).
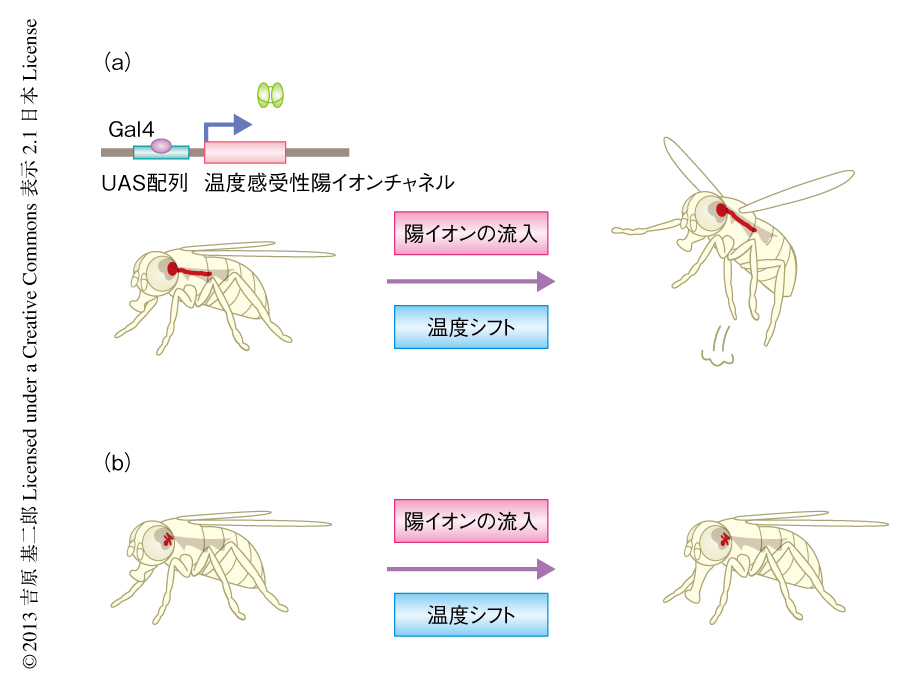
唾液の分泌を促すニューロンも,エサにより解発される摂食行動の一部をひき起こすコマンドニューロンであるということができる.だから,このようなコマンドニューロンをみつけることが,つぎの部屋に入るためにどうしても必要な鍵であるように思えた.筆者らが神経筋接合部の可塑性の研究を発表した4) のと同じ2005年,ちょうどいいタイミングでショウジョウバエの“リモートコントロール”技術が発表された8)(図2a).ここでは,陽イオンを細胞の外から内部にむけ透過することにより細胞を発火させるATP受容体チャネルを,出芽酵母の転写因子Gal4の標的配列であるUAS配列の下流につなぐことにより,Gal4を発現している細胞だけに特異的に発現させた.そして,光の照射によりケージドATPからATPを遊離させることによりATP受容体チャンネルを開口させ,その細胞だけをねらって発火させるのである.この実験は,細胞の活動を時間的および空間的に意のままにあやつる今日の光遺伝学(optogenetics)の時代の到来を意味し,まさに画期的なブレークスルーであった.その時点で,ショウジョウバエのコマンドニューロンといえるのは逃避行動を起こすニューロンだけであり,この実験ではこれを発火させてショウジョウバエに逃避行動を誘起した.だが,逃避行動は記憶の研究には使えそうもない.そこで,Gal4が挿入されたショウジョウバエを片っ端からチャネルを発現するショウジョウバエと掛け合わせてランダムなパターンの細胞を発火させ,たくさんの系統をスクリーニングすることにより新たなコマンドニューロンを探そう,というおおまかな方針がみえてきた.そこで利用したGal4挿入の保存系統が,1990年代にわが国のコンソーシアムにより構築された“NP系統”であった9).ちなみに,NPというのは“Nippon”を意味する.
しかし,最初の時点では細胞を発火させるための道具ももちあわせていなかった.まさにコマンドニューロンは“絵に描いた餅”そのものであった.その時点で使用可能であったATPチャネル8) に対しては1個体ごとにケージドATPを注射する必要があり,スクリーニングにはとても実用化することはできない.あとひとつだけ入手できたのは,哺乳類において光遺伝学の大流行をもたらした,青色光をうけて開口するチャネルロドプシン2であった.来る日も来る日もチャネルロドプシン2を使った実験を試みたが,透きとおったショウジョウバエの幼虫では非常にうまくいく一方,褐色の分厚いクチクラにおおわれている成虫では実験条件や装置をいくら変えてみてもうまくいかなかった.ショウジョウバエに青色光をあてて行動をみるための“blue light arena”と称した実験装置をいくつも製作してみたが,麻痺やジャンプなど期待する行動が弱く起こることはあったものの,行動を起こすのに強い光をあてるとショウジョウバエが熱くなってしまって狂ったように走り回る忌避行動が起こり,とても一般的なスクリーニングに応用できるレベルにはならなかった.
こうして途方に暮れているところに,有用な情報が得られた.ラットから遺伝子クローニングされた低温により開口するTRPM8チャネル10) をショウジョウバエに導入したところ細胞を活性化させるらしい,というのだ.このTRPM8チャネルを発現したショウジョウバエを試してみると,18度に温度を下げると細胞は発火をはじめたものの,すぐに脱感作して細胞は静かになってしまうので,行動スクリーニングに使用するのはむずかしかった.それでもあきらめきれず,正確に温度を制御できるチェンバーを自作して細かく条件設定し試した結果,14度まで下がると野生型のショウジョウバエもじっと動かなくなるのでこの温度まで下げるわけにはいかないが,その少しうえの15度から16度のあいだに保ったときのみ,発火による行動(たとえば,運動ニューロンの発火による麻痺)がずっとつづくことがわかった.温度の正確な微調整が必要であるものの,これでようやく行動スクリーニングが可能になった.
2008年の夏,時間をかけて条件設定しながら自作したチェンバーを含む実験装置を用いて,NP系統の約2000の系統のうちGal4の発現する細胞の比較的少ない835の系統のオスを,TRPM8チャネルを発現したメスに掛け合わせ,そのF1をあらかじめ15度に冷却しておいたチェンバーに入れその行動を観察した.その結果,予想したとおり,84系統の麻痺を示す系統だけでなく,24の系統は飛んだり跳ねたりと,それなりにおもしろい行動がでてきたが,記憶の実験に使えそうなものはなかった.
ところが幸運なことに,TRPM8チャネルによるスクリーニングが完了したちょうどそのころ,今度は,高温で開口するTrpA1チャネルがショウジョウバエから遺伝子クローニングされた11).その論文によると,TrpA1チャネルによる活性化のほうがTRPM8チャネルよりはるかに激しいようだった.そこで,TRPM8チャネルを発現するショウジョウバエと掛け合わせてなんらかの行動のみられたNP系統の系統にTrpA1チャネルを発現するショウジョウバエを掛け合わせると,そのうちひとつの系統NP883が温度を上げるとエサもないのに口吻をくり返し伸ばして壁をなめるという摂食行動にそっくりの行動を示すことをみつけた(図2b).“もし,この行動をひき起こすコマンドニューロンをつかまえることができたら,パブロフと同じ実験がニューロンのレベルでできる!”と興奮した.
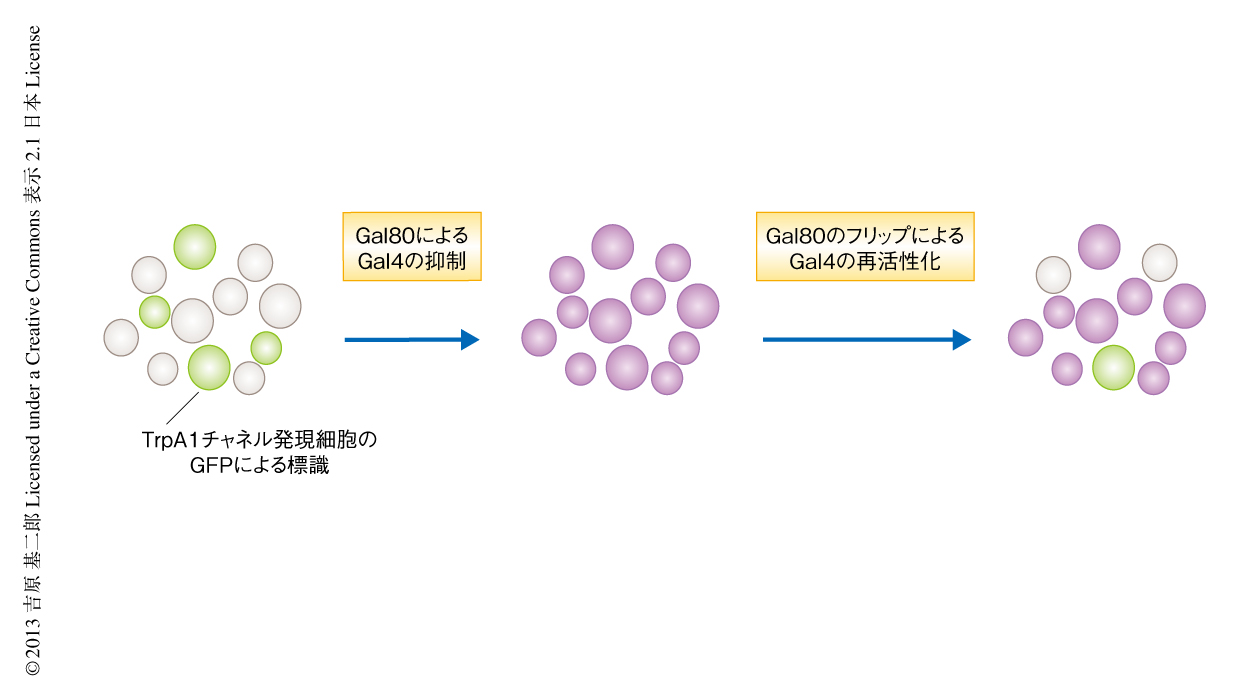
しかし,このNP883系統では100以上の中枢細胞がGal4を発現しており,それらがからみあうなかでは個々の細胞の同定すらむずかしい.このなかからコマンドニューロンをみつけださなければならなかった.では,とうやって細胞を絞り込むのか? Gal4のはたらきを抑制するGal80をランダムに削除してGal4を一部の細胞だけではたらくようにする“フリップGal80法”(図3)を使うことにした.このフリップGal80法によりTrpA1チャネルの発現をさまざまなパターンに限定したショウジョウバエを作製し,TrpA1チャネルを発現している細胞と個体の行動とを対応させることによりコマンドニューロンを探すことに決めた.Gal80のフリップののち摂食行動を示すショウジョウバエを選びだして解剖し,TrpA1チャネルと同時に発現させたGFPによりTrpA1チャネルの発現細胞をチェックしたところ,どのショウジョウバエを解剖しても,立派な枝を同じパターンで広く伸ばす特徴的なかたちのニューロンが指紋のようにうかびあがってきた.摂食行動を司令するニューロン,Fdgニューロンを発見した瞬間であった.もちろん,これだけではみかけの摂食行動と発現細胞とを対応づけただけで,これが本当に摂食行動の全体のコマンドニューロンだと断言はできない.
みたところは食べているようでも,本当に食べているのか調べる必要があった.そこで,ミオシン重鎖遺伝子のエンハンサー配列をGFPにつないだものを使いすべての筋細胞を標識して,エサを食道へと送るポンプを動かす筋細胞の動きを直接的に可視化する方法を確立した.その結果,ギャロップするようなポンプのリズミックな動きが正常な摂食行動において観察された.NP883系統においてTrpA1チャネルを発現させたショウジョウバエを高温におくと,正常な摂食のときと区別のつかないパターンでポンプが動きだすことが確認された.色素を飲ませることで摂食量を定量する方法も確立し,NP883系統においてTrpA1チャネルを発現させたショウジョウバエは,高温の刺激に応じて実際にポンプを動かして食物を飲み込んでいることが確認された.これらの実験により,外見の動きだけではなく,TrpA1チャネルの活性化により司令された行動においても実際に“食べている”ことがはっきりした.
人工的にFdgニューロンを活動させたときに摂食行動がみられたからといって,ショウジョウバエが自然にエサを食べているときにFdgニューロンがはたらいているという保証はなかった.これを示すには,実際に食べているときにFdgニューロンが活動していることを確認するのがいちばん直接的な証拠であった.しかしそれには,摂食行動と神経活動とを同時にモニターする必要があった.これが神経行動学のもっともむずかしいところで,カエルの摂餌行動がよく研究されているが,行動をさせたままで電気生理学的な記録をとることはむずかしい.この同時記録のために,ショウジョウバエの“顔”の側は乾いたまま,“頭”を生理食塩水において解剖して脳を露出させることのできる装置,“feeding circuit/fly brain live imaging and electrophysiology stage”(FLIES),をくふうして自作した12).この実験装置には汎用性があり,行動と神経の活動をGCaMPなどのCa2+指示タンパク質を使って同時記録できるし,電気生理学的にニューロンから記録することもできる.それとなによりも,長時間にわたりリアルタイムでシナプスのライブイメージングができるので,行動を観察しながらシナプスの動きを観察する記憶の実験に必須である.これが,この実験系づくりに膨大な時間を費やした真の目的であった.
この実験装置を使ったCa2+イメージング法による実験から,Fdgニューロンは口吻へのスクロースの刺激に反応して空腹のときのみに活動することがわかった.この結果は,Fdgニューロンが自然な摂食行動においてはたらいていること,また,Fdgニューロンは摂食行動をつかさどる神経回路において空腹あるいは満腹のシグナルの下流に位置することを示した.おそらく,Fdgニューロンが代謝のシグナルをうけて活動するかどうかの決定をくだしているのではないかと推測している.
フリップGal80法の結果からFdgニューロンの発火と摂食行動との相関は明らかであったものの,Fdgニューロンの発火だけにより摂食行動の全体がひき起こされるという決定的な証拠がどうしても必要であった.TrpA1チャネルの発現と行動との相関を調べるだけでは,因果関係,とくにFdgニューロンの活動のみで摂食行動がひき起こされるか,つまり,本当にコマンドニューロンであることを明確にすることはむずかしい.そのためにはやはり,Fdgニューロンをねらって刺激し,その効果をみる必要があったが,細胞を標的にして発火させる新しい実験系の開発が必要であった.Ca2+イメージング法の実験に使用したFLIESチェンバーを2光子顕微鏡のもと設置し,あらかじめTrpA1チャネルを発現させておいたNP883系統のFdgニューロンの細胞体をねらい赤外線を照射することにより,局所的に温度を上げてTrpA1チャネルを開口させる方法を確立した.短時間の赤外線の照射により,10μm以下の解像度で局所的にTrpA1チャネルを活性化することができた.この方法を用いてFdgニューロンに限局してTrpA1チャネルの活動を起こすことにより,口吻の伸展のみならず,ポンプの動きによる“飲み込み”もひき起こされることが明確に示された.この実験の結果から,Fdgニューロンがコマンドニューロンであることはほぼ確実になった.また,Fdgニューロンを抑制したり除去したりする実験により,Fdgニューロンは摂食行動をつかさどる神経回路の要に位置するニューロンであって,ほかのニューロンが代わりをすることはできないこともわかった.つまりは,たった1対のFdgニューロンがあらゆる情報を集約し,その結果として摂食行動を司令していた.
Fdgニューロンが情報の要にあるという知見は,当初の目的であったパブロフの条件反射の実験の図式を単純なものにしてくれた.もちろん,条件反射にともなうシナプスの変化がFdgニューロンに入力するシナプスにおいて起こっているという保証はないが,Fdgニューロンが要にあるニューロンであることを考えるとその可能性は大きい.条件刺激をになうニューロンをみつける作業は残っているが,いままで克服してきた困難を考えると,さほどの困難があるとも思えない.脳におけるシナプスの動きをライブイメージングする実験についてはすでに成功しているので,“Hebb則による記憶の形成をシナプスの変化としてリアルタイムで目撃する”という筆者の荒唐無稽な夢も,いまとなっては“絵に描いた餅”ではないように思えてきた.
縦横無尽に遺伝学的な操作をくわえたショウジョウバエの行動をモニターするという,古典的な生物学と最先端の生物学とを組み合わせた新しい実験系を開発していくことにより,当初,ねらったとおりの摂食行動をひき起こすコマンドニューロンがみつかった.これが,記憶の研究の突破口となることを期待している.いま,やっとステージがととのったところで,いよいよこれから本番がはじまる.
略歴:1992年 東京大学大学院理学系研究科 修了,同年 群馬大学医学部 助手,同年米国Beckman Research Institute of the City of Hopeポスドク,2000年 米国Massachusetts Institute of Technology客員研究員を経て,2006年より米国Massachusetts大学Medical School助教授.
研究テーマ:記憶のメカニズム.
関心事:昆虫の生活,和道流空手,J-POP.
© 2013 吉原 基二郎 Licensed under CC 表示 2.1 日本
(米国Massachusetts大学Medical School,Department of Neurobiology)
email:吉原基二郎
DOI: 10.7875/first.author.2013.091
A single pair of interneurons commands the Drosophila feeding motor program.
Thomas F. Flood, Shinya Iguchi, Michael Gorczyca, Benjamin White, Kei Ito, Motojiro Yoshihara
Nature, 499, 83-87 (2013)
要 約
筆者の研究室では,記憶の素過程を理解することを目的として,単純なシナプスのモデルであるショウジョウバエの神経筋接合部と,行動の変化として記憶に直接的に関係づけることのできるショウジョウバエの成虫の摂食行動をつかさどる神経回路のシナプスを,両者を比較しながら研究している.わが国のコンソーシアムにより確立されたショウジョウバエGal4挿入の保存系統であるNP系統を行動スクリーニングすることにより,活動すると摂食行動をひき起こすコマンドニューロンであるFdgニューロンを発見した.Fdgニューロンは摂食行動にかかわる神経回路の要に位置すると考えられるので,行動観察とライブイメージングや電気生理学的な解析を同時に行う目的のため新しく開発した実験系を用いることで,パブロフの条件反射をFdgニューロンに入力するシナプスの変化として研究できることを期待している.ショウジョウバエの神経筋接合部におけるシナプスの可塑性に関するこれまでの知見を作業仮説として,このFdgニューロンにおけるシナプスの可塑性を行動の変化とともに詳細に解析することにより,記憶の形成の分子機構にせまろうと考えている.
はじめに
われわれの心に深く刻まれる記憶には,一生つづくものもあれば,とても興奮した記憶なのにしばらくすると忘れてしまったりと,記憶は不思議なものである.記憶はかつて,心理学のテーマとしてのみ研究されていた,とらえどころのない抽象概念であった.この記憶を実験生物学としてあつかったのが,一般にもよく知られているパブロフの条件反射である.パブロフははっきりした2つの刺激,ベルの音(条件刺激)とエサ(無条件刺激)を設定し,条件刺激につづけて無条件刺激をイヌにあたえることにより.本来は無条件刺激による反応であった唾液の分泌が,ベルの音(条件刺激)だけでもひき起こされた(図1a).ここでは,制御しやすい実験条件を設定したことも重要であったが,なにより,この条件刺激と無条件刺激との連合という単純な条件設定により,この連合学習の裏にひそむしくみとして神経回路の変化を明確に想像させたことが重要であった.しかし,変化する神経回路の実際はいまだ推測の域をでず,さらに,それがいかにして起こるかはまだよくわかっていない.筆者らの研究室は,記憶がどのようにしてつくられるのかという疑問に新しいアプローチを用いてとりくんでいる.
1.シナプスの可塑性
記憶は経験により強化されたシナプスを介してつながる一連のニューロンにより保持されていると,筆者を含め多くの神経科学者が推測していると思われる.このことは1940年代にはじめて定式化され,提唱者の名をとり“Hebb則”あるいは“Hebbのシナプス”として知られている1).前シナプス細胞が発火した直後に後シナプス細胞が発火すると,この前シナプスと後シナプスのタイミングがあったときにだけ,特異的にシナプスが強まるとされた(図1b).この考えによると,パブロフの条件反射がどのようにしてできるのか,非常に単純に説明できる(図1a).ベルの音のシグナル(条件刺激)を伝達するニューロンが,エサの刺激(無条件刺激)に反応して唾液を出すことを司令しているニューロンに対し,弱いシナプスを形成していたと仮定してみよう.パブロフの実験ではこの2つのニューロンが連続して発火するはずで,その結果,Hebb則により,そのあいだのシナプスが強くなることによりベルの音(条件刺激)だけで唾液が出るようになる,というように推測できる.
もちろん,実際のイヌの脳のなかはこんなに単純なはずはなく,無数のニューロンがこのシナプス可塑性をになっているはずであるから,さらに無関係な多くの細胞も入り乱れてからみあう脳においてこれを実際に調べることは容易ではない.そこでまず,単純なシナプスにおいてHebb則によるシナプス可塑性の底にひそむ機構を調べようと考えた.これに関しては,もちろん多くの研究者が海馬における長期増強などの実験において重要な知見を得ているのであるが,筆者らはまず,実験を単純化することによりシナプス可塑性の基礎的な過程をつかむため,詳細な定量により正確なシナプスの生理学的な解析の可能な2,3),ショウジョウバエの胚の神経筋接合部における可塑性の実験系を確立した.神経筋接合部における電気生理学的な解析と解剖学的な解析の結果から,前シナプスからの微小シナプス電位をつくる放出と,後シナプスから放出される逆行性シグナルとのあいだの相互な“ローカルフィードバック”により,1個のシナプスが特異的に強められた状態が維持されるのではないかという作業仮説をたてた4).これは神経筋接合部における実験結果から導き出された可能性であったが,Hebb則をよく説明するし,これまでの文献ともよくあうので,脳において記憶が維持され形成されるための機構であるのかもしれない.
筆者は,この可能性に大きな夢を感じたものの,実際に脳における記憶にかかわってはいない神経筋接合部をいくら研究したところで,記憶の本質にせまることはできない.そこで,神経筋接合部で得られた知見を脳において検証するため,つぎの段階に移ることにした.
2.コマンドニューロン
さて,どうやって脳における記憶の形成をシナプスの可塑性に結びつければいいのか? 最初の実験的なアプローチは1980年代のアメフラシを使った研究で,実際のシナプスにおける分子機構にまでおよぶ大きな洞察をあたえた5).しかし,そのシナプス特異性は,無条件刺激をになうニューロンが条件刺激をになう前シナプスに直接に付着して修飾することによる,すなわち,解剖学的な特徴によりシナプスの特異性が決まっているので,Hebb則によるシナプスのモデルにはならない(図1c).それなら,自分たちで一から実験系をつくってみようか,と荒唐無稽なことを夢想した.このとき,頭にあったのが今回のキーワード,“コマンドニューロン”(司令ニューロン)であった.動物行動学のコンセプトである定型行動6),たとえば,攻撃行動や産卵行動などの決まった一連の行動パターンを起こす引き金にあたるニューロンがコマンドニューロンである.コマンドニューロンというコンセプトは,1960年代のザリガニの遊泳肢の運動をオンにしたりオフにしたりした実験に端を発している7).
唾液の分泌を促すニューロンも,エサにより解発される摂食行動の一部をひき起こすコマンドニューロンであるということができる.だから,このようなコマンドニューロンをみつけることが,つぎの部屋に入るためにどうしても必要な鍵であるように思えた.筆者らが神経筋接合部の可塑性の研究を発表した4) のと同じ2005年,ちょうどいいタイミングでショウジョウバエの“リモートコントロール”技術が発表された8)(図2a).ここでは,陽イオンを細胞の外から内部にむけ透過することにより細胞を発火させるATP受容体チャネルを,出芽酵母の転写因子Gal4の標的配列であるUAS配列の下流につなぐことにより,Gal4を発現している細胞だけに特異的に発現させた.そして,光の照射によりケージドATPからATPを遊離させることによりATP受容体チャンネルを開口させ,その細胞だけをねらって発火させるのである.この実験は,細胞の活動を時間的および空間的に意のままにあやつる今日の光遺伝学(optogenetics)の時代の到来を意味し,まさに画期的なブレークスルーであった.その時点で,ショウジョウバエのコマンドニューロンといえるのは逃避行動を起こすニューロンだけであり,この実験ではこれを発火させてショウジョウバエに逃避行動を誘起した.だが,逃避行動は記憶の研究には使えそうもない.そこで,Gal4が挿入されたショウジョウバエを片っ端からチャネルを発現するショウジョウバエと掛け合わせてランダムなパターンの細胞を発火させ,たくさんの系統をスクリーニングすることにより新たなコマンドニューロンを探そう,というおおまかな方針がみえてきた.そこで利用したGal4挿入の保存系統が,1990年代にわが国のコンソーシアムにより構築された“NP系統”であった9).ちなみに,NPというのは“Nippon”を意味する.
3.“絵に描いた餅”コマンドニューロンをもとめて
しかし,最初の時点では細胞を発火させるための道具ももちあわせていなかった.まさにコマンドニューロンは“絵に描いた餅”そのものであった.その時点で使用可能であったATPチャネル8) に対しては1個体ごとにケージドATPを注射する必要があり,スクリーニングにはとても実用化することはできない.あとひとつだけ入手できたのは,哺乳類において光遺伝学の大流行をもたらした,青色光をうけて開口するチャネルロドプシン2であった.来る日も来る日もチャネルロドプシン2を使った実験を試みたが,透きとおったショウジョウバエの幼虫では非常にうまくいく一方,褐色の分厚いクチクラにおおわれている成虫では実験条件や装置をいくら変えてみてもうまくいかなかった.ショウジョウバエに青色光をあてて行動をみるための“blue light arena”と称した実験装置をいくつも製作してみたが,麻痺やジャンプなど期待する行動が弱く起こることはあったものの,行動を起こすのに強い光をあてるとショウジョウバエが熱くなってしまって狂ったように走り回る忌避行動が起こり,とても一般的なスクリーニングに応用できるレベルにはならなかった.
こうして途方に暮れているところに,有用な情報が得られた.ラットから遺伝子クローニングされた低温により開口するTRPM8チャネル10) をショウジョウバエに導入したところ細胞を活性化させるらしい,というのだ.このTRPM8チャネルを発現したショウジョウバエを試してみると,18度に温度を下げると細胞は発火をはじめたものの,すぐに脱感作して細胞は静かになってしまうので,行動スクリーニングに使用するのはむずかしかった.それでもあきらめきれず,正確に温度を制御できるチェンバーを自作して細かく条件設定し試した結果,14度まで下がると野生型のショウジョウバエもじっと動かなくなるのでこの温度まで下げるわけにはいかないが,その少しうえの15度から16度のあいだに保ったときのみ,発火による行動(たとえば,運動ニューロンの発火による麻痺)がずっとつづくことがわかった.温度の正確な微調整が必要であるものの,これでようやく行動スクリーニングが可能になった.
2008年の夏,時間をかけて条件設定しながら自作したチェンバーを含む実験装置を用いて,NP系統の約2000の系統のうちGal4の発現する細胞の比較的少ない835の系統のオスを,TRPM8チャネルを発現したメスに掛け合わせ,そのF1をあらかじめ15度に冷却しておいたチェンバーに入れその行動を観察した.その結果,予想したとおり,84系統の麻痺を示す系統だけでなく,24の系統は飛んだり跳ねたりと,それなりにおもしろい行動がでてきたが,記憶の実験に使えそうなものはなかった.
ところが幸運なことに,TRPM8チャネルによるスクリーニングが完了したちょうどそのころ,今度は,高温で開口するTrpA1チャネルがショウジョウバエから遺伝子クローニングされた11).その論文によると,TrpA1チャネルによる活性化のほうがTRPM8チャネルよりはるかに激しいようだった.そこで,TRPM8チャネルを発現するショウジョウバエと掛け合わせてなんらかの行動のみられたNP系統の系統にTrpA1チャネルを発現するショウジョウバエを掛け合わせると,そのうちひとつの系統NP883が温度を上げるとエサもないのに口吻をくり返し伸ばして壁をなめるという摂食行動にそっくりの行動を示すことをみつけた(図2b).“もし,この行動をひき起こすコマンドニューロンをつかまえることができたら,パブロフと同じ実験がニューロンのレベルでできる!”と興奮した.
しかし,このNP883系統では100以上の中枢細胞がGal4を発現しており,それらがからみあうなかでは個々の細胞の同定すらむずかしい.このなかからコマンドニューロンをみつけださなければならなかった.では,とうやって細胞を絞り込むのか? Gal4のはたらきを抑制するGal80をランダムに削除してGal4を一部の細胞だけではたらくようにする“フリップGal80法”(図3)を使うことにした.このフリップGal80法によりTrpA1チャネルの発現をさまざまなパターンに限定したショウジョウバエを作製し,TrpA1チャネルを発現している細胞と個体の行動とを対応させることによりコマンドニューロンを探すことに決めた.Gal80のフリップののち摂食行動を示すショウジョウバエを選びだして解剖し,TrpA1チャネルと同時に発現させたGFPによりTrpA1チャネルの発現細胞をチェックしたところ,どのショウジョウバエを解剖しても,立派な枝を同じパターンで広く伸ばす特徴的なかたちのニューロンが指紋のようにうかびあがってきた.摂食行動を司令するニューロン,Fdgニューロンを発見した瞬間であった.もちろん,これだけではみかけの摂食行動と発現細胞とを対応づけただけで,これが本当に摂食行動の全体のコマンドニューロンだと断言はできない.
4.これは本当に摂食行動なのか?
みたところは食べているようでも,本当に食べているのか調べる必要があった.そこで,ミオシン重鎖遺伝子のエンハンサー配列をGFPにつないだものを使いすべての筋細胞を標識して,エサを食道へと送るポンプを動かす筋細胞の動きを直接的に可視化する方法を確立した.その結果,ギャロップするようなポンプのリズミックな動きが正常な摂食行動において観察された.NP883系統においてTrpA1チャネルを発現させたショウジョウバエを高温におくと,正常な摂食のときと区別のつかないパターンでポンプが動きだすことが確認された.色素を飲ませることで摂食量を定量する方法も確立し,NP883系統においてTrpA1チャネルを発現させたショウジョウバエは,高温の刺激に応じて実際にポンプを動かして食物を飲み込んでいることが確認された.これらの実験により,外見の動きだけではなく,TrpA1チャネルの活性化により司令された行動においても実際に“食べている”ことがはっきりした.
5.Fdgニューロンは自然な摂食のときに本当にはたらいているのか?
人工的にFdgニューロンを活動させたときに摂食行動がみられたからといって,ショウジョウバエが自然にエサを食べているときにFdgニューロンがはたらいているという保証はなかった.これを示すには,実際に食べているときにFdgニューロンが活動していることを確認するのがいちばん直接的な証拠であった.しかしそれには,摂食行動と神経活動とを同時にモニターする必要があった.これが神経行動学のもっともむずかしいところで,カエルの摂餌行動がよく研究されているが,行動をさせたままで電気生理学的な記録をとることはむずかしい.この同時記録のために,ショウジョウバエの“顔”の側は乾いたまま,“頭”を生理食塩水において解剖して脳を露出させることのできる装置,“feeding circuit/fly brain live imaging and electrophysiology stage”(FLIES),をくふうして自作した12).この実験装置には汎用性があり,行動と神経の活動をGCaMPなどのCa2+指示タンパク質を使って同時記録できるし,電気生理学的にニューロンから記録することもできる.それとなによりも,長時間にわたりリアルタイムでシナプスのライブイメージングができるので,行動を観察しながらシナプスの動きを観察する記憶の実験に必須である.これが,この実験系づくりに膨大な時間を費やした真の目的であった.
この実験装置を使ったCa2+イメージング法による実験から,Fdgニューロンは口吻へのスクロースの刺激に反応して空腹のときのみに活動することがわかった.この結果は,Fdgニューロンが自然な摂食行動においてはたらいていること,また,Fdgニューロンは摂食行動をつかさどる神経回路において空腹あるいは満腹のシグナルの下流に位置することを示した.おそらく,Fdgニューロンが代謝のシグナルをうけて活動するかどうかの決定をくだしているのではないかと推測している.
6.Fdgニューロンは本当にそれだけで摂食を司令できるのか?
フリップGal80法の結果からFdgニューロンの発火と摂食行動との相関は明らかであったものの,Fdgニューロンの発火だけにより摂食行動の全体がひき起こされるという決定的な証拠がどうしても必要であった.TrpA1チャネルの発現と行動との相関を調べるだけでは,因果関係,とくにFdgニューロンの活動のみで摂食行動がひき起こされるか,つまり,本当にコマンドニューロンであることを明確にすることはむずかしい.そのためにはやはり,Fdgニューロンをねらって刺激し,その効果をみる必要があったが,細胞を標的にして発火させる新しい実験系の開発が必要であった.Ca2+イメージング法の実験に使用したFLIESチェンバーを2光子顕微鏡のもと設置し,あらかじめTrpA1チャネルを発現させておいたNP883系統のFdgニューロンの細胞体をねらい赤外線を照射することにより,局所的に温度を上げてTrpA1チャネルを開口させる方法を確立した.短時間の赤外線の照射により,10μm以下の解像度で局所的にTrpA1チャネルを活性化することができた.この方法を用いてFdgニューロンに限局してTrpA1チャネルの活動を起こすことにより,口吻の伸展のみならず,ポンプの動きによる“飲み込み”もひき起こされることが明確に示された.この実験の結果から,Fdgニューロンがコマンドニューロンであることはほぼ確実になった.また,Fdgニューロンを抑制したり除去したりする実験により,Fdgニューロンは摂食行動をつかさどる神経回路の要に位置するニューロンであって,ほかのニューロンが代わりをすることはできないこともわかった.つまりは,たった1対のFdgニューロンがあらゆる情報を集約し,その結果として摂食行動を司令していた.
7.イヌの代わりにショウジョウバエを使ったパブロフの条件反射の実験
Fdgニューロンが情報の要にあるという知見は,当初の目的であったパブロフの条件反射の実験の図式を単純なものにしてくれた.もちろん,条件反射にともなうシナプスの変化がFdgニューロンに入力するシナプスにおいて起こっているという保証はないが,Fdgニューロンが要にあるニューロンであることを考えるとその可能性は大きい.条件刺激をになうニューロンをみつける作業は残っているが,いままで克服してきた困難を考えると,さほどの困難があるとも思えない.脳におけるシナプスの動きをライブイメージングする実験についてはすでに成功しているので,“Hebb則による記憶の形成をシナプスの変化としてリアルタイムで目撃する”という筆者の荒唐無稽な夢も,いまとなっては“絵に描いた餅”ではないように思えてきた.
おわりに
縦横無尽に遺伝学的な操作をくわえたショウジョウバエの行動をモニターするという,古典的な生物学と最先端の生物学とを組み合わせた新しい実験系を開発していくことにより,当初,ねらったとおりの摂食行動をひき起こすコマンドニューロンがみつかった.これが,記憶の研究の突破口となることを期待している.いま,やっとステージがととのったところで,いよいよこれから本番がはじまる.
文 献
- Hebb, D. O.: The Organization of Behavior. Wiley, New York (1949)
- Yoshihara, M. & Littleton, J. T.: Synaptotagmin I functions as a calcium sensor to synchronize neurotransmitter release. Neuron, 36, 897-908 (2002)[PubMed]
- Yoshihara, M., Guan, Z. & Littleton, J. T.: Differential regulation of synchronous versus asynchronous neurotransmitter release by the C2 domains of synaptotagmin 1. Proc. Natl. Acad. Sci. USA, 107, 14869-14874 (2010)[PubMed]
- Yoshihara, M., Adolfsen, B., Galle, K. T. et al.: Retrograde signaling by Syt 4 induces presynaptic release and synapse-specific growth. Science, 310, 858-863 (2005)[PubMed]
- Kandel, E. R.: The molecular biology of memory storage: a dialogue between genes and synapses. Science, 294, 1030-1038 (2001)[PubMed]
- Tinbergen, N.: The Study of Instinct. Clarendon Press, Oxford (1989)
- Wiersma, C. A. & Ikeda, K.: Interneurons commanding swimmeret movements in the crayfish, Procambarus clarki (Girard). Comp. Biochem. Physiol., 12, 509-525 (1964)[PubMed]
- Lima, S. Q. & Miesenbock, G.: Remote control of behavior through genetically targeted photostimulation of neurons. Cell, 121, 141-152 (2005)[PubMed]
- Yoshihara, M. & Ito, K.: Improved Gal4 screening kit for large-scale generation of enhancer-trap strains. Drosoph. Inf. Serv., 83, 199-202 (2000)
- Peabody, N. C., Pohl, J. B., Diao, F. et al.: Characterization of the decision network for wing expansion in Drosophila using targeted expression of the TRPM8 channel. J. Neurosci., 29, 3343-3353 (2009)[PubMed]
- Hamada, F. N., Rosenzweig, M., Kang, K. et al.: An internal thermal sensor controlling temperature preference in Drosophila. Nature, 454, 217-220 (2008)[PubMed]
- Yoshihara, M.: Simultaneous recording of calcium signals from identified neurons and feeding behavior of Drosophila melanogaster. J. Vis. Exp., 62, 3625 (2012)[PubMed]
著者プロフィール
略歴:1992年 東京大学大学院理学系研究科 修了,同年 群馬大学医学部 助手,同年米国Beckman Research Institute of the City of Hopeポスドク,2000年 米国Massachusetts Institute of Technology客員研究員を経て,2006年より米国Massachusetts大学Medical School助教授.
研究テーマ:記憶のメカニズム.
関心事:昆虫の生活,和道流空手,J-POP.
© 2013 吉原 基二郎 Licensed under CC 表示 2.1 日本