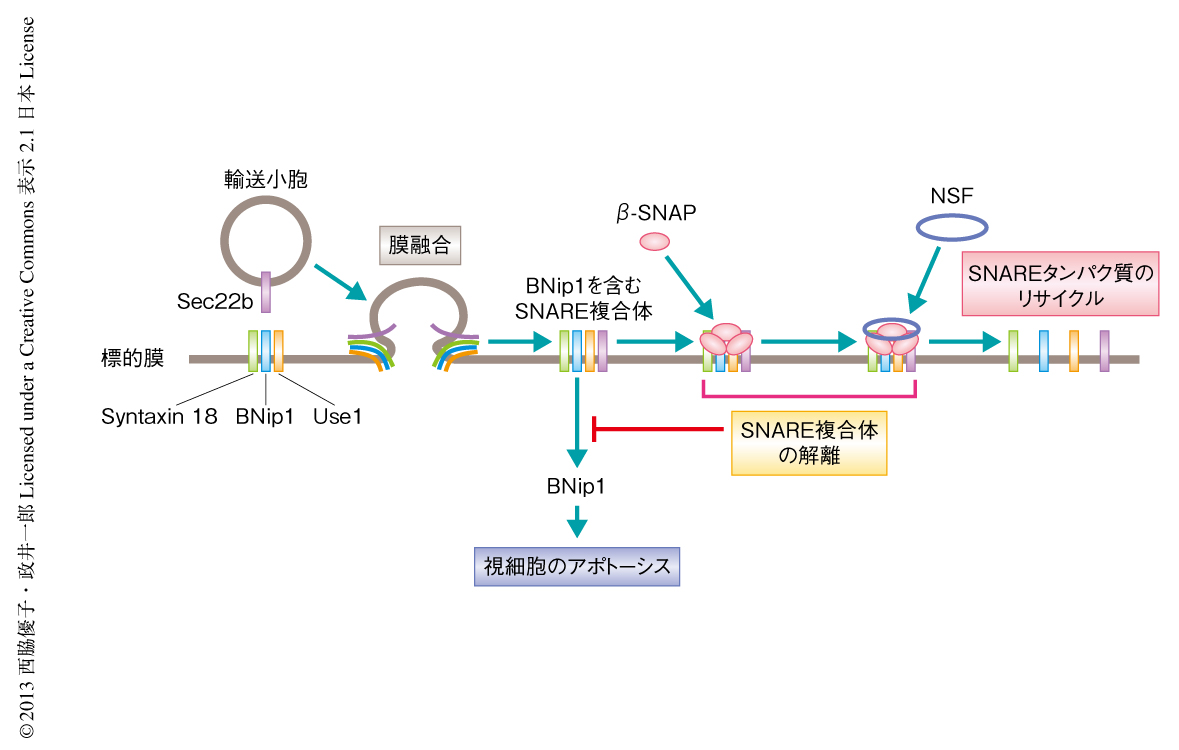
BH3ドメインをもつSNAREタンパク質BNip1は輸送小胞の融合の異常に反応し視細胞のアポトーシスをひき起こす
西脇優子・政井一郎
(沖縄科学技術大学院大学 神経発生ユニット)
email:政井一郎
DOI: 10.7875/first.author.2013.086
The BH3-only SNARE BNip1 mediates photoreceptor apoptosis in response to vesicular fusion defects.
Yuko Nishiwaki, Asuka Yoshizawa, Yutaka Kojima, Eri Oguri, Shohei Nakamura, Shohei Suzuki, Junichi Yuasa-Kawada, Mariko Kinoshita-Kawada, Toshiaki Mochizuki, Ichiro Masai
Developmental Cell, 25, 374-387 (2013)
細胞における小胞輸送は視細胞の機能および維持において重要な役割を担う.しかしながら,小胞輸送の異常により起こる視細胞の変性の分子機構についてはいまだ不明である.筆者らは,ゼブラフィッシュにおいてβ-SNAPの突然変異体では視細胞がアポトーシスを起こすことを発見した.β-SNAPは輸送小胞の融合の際に形成されるcis-SNARE複合体を解離させることによりSNAREタンパク質のリサイクルにはたらく.さらに,β-SNAP突然変異体にて起こる視細胞の変性は,BH3ドメインをもつSNAREタンパク質であるBNip1に依存していることも発見された.BNip1はゴルジ体から小胞体への逆行輸送を制御するSyntaxin18 SNARE複合体の構成タンパク質である.輸送小胞の融合において生じるSyntaxin18-cis-SNARE複合体が解離しないとBNip1に依存してアポトーシスが誘導される.この結果から,Syntaxin18-cis-SNARE複合体は輸送小胞の融合を監視する警報として機能し,BNip1は膜融合の異常に反応してアポトーシスをひき起こすことが明らかになった.
現在,ヒトでは視細胞の変性にかかわる遺伝子が200以上も同定されている1).視細胞を維持するうえでのタンパク質輸送の重要性は,光受容膜への輸送が異常になるロドプシンの突然変異や2),結合繊毛を介したタンパク質輸送の制御タンパク質の突然変異3) の研究から示唆されてきた.しかし,タンパク質輸送と視細胞の変性とを関連づけるしくみは不明であった.
細胞におけるタンパク質輸送は細胞の膜器官を経由した分泌系により制御され,供給膜から小胞が出芽し,標的膜へと輸送され,融合する過程から構成される4).ここでは,NSF(N-ethylmaleimide-sensitive factor),SNAP(soluble NSF attachment protein),SNARE(SNAP receptor)の3つの制御タンパク質が膜融合の過程を制御する.SNAREタンパク質は輸送小胞においてはたらくv-SNARE(vesicle-membrane SNARE)と,標的膜においてはたらくt-SNARE(target-membrane SNARE)とに分類される.3種類のt-SNAREが受容側のSNARE複合体を形成し,1種類のv-SNAREと相互作用することにより,小胞膜と標的膜との融合は開始する.受容側のSNARE複合体とv-SNAREは膜融合によりcis-SNARE複合体を形成する.SNAPはNSFと協調してcis-SNARE複合体を解離することにより,SNAREタンパク質のリサイクルを促進する.
BNip1はアデノウイルスE1Bの19 kDaタンパク質と相互作用するタンパク質として同定され5),BH3ドメインをもちアポトーシスを誘導する活性をもつ6).また,BNip1はゴルジ体から小胞体への逆行輸送を担うSyntaxin18 SNARE複合体のt-SNAREのひとつとして機能している6).Syntaxin18 SNARE複合体は,Syntaxin18,BNip1,Use1の3つのt-SNAREと,v-SNAREであるSec22bから構成される.ヒトの培養細胞を用いた研究において,α-SNAPの強制発現によりBNip1のアポトーシス誘導活性が抑制されたという報告がある6).しかしながら,SNAPによるBNip1のアポトーシス誘導活性の抑制機構は不明であった.
筆者らは,視細胞の変性の分子機構を明らかにする目的で,ゼブラフィッシュを用いて大規模な突然変異体のスクリーニングを行い,視細胞が特異的に変性するcorona(coa)突然変異体を同定した.coa遺伝子をクローニングした結果,β-SNAP(β-soluble N-ethylmaleimide-sensitive factor attachment protein)をコードすることが明らかになった.β-SNAPの機能が低下すると輸送小胞の融合は完了できず,SNAREタンパク質のリサイクルはとどこおり,最終的に,輸送小胞を介したタンパク質輸送は停止することが予想された.実際に,coa突然変異体においてはロドプシンなどの光受容タンパク質は検出できず,ゴルジ体や光受容膜から構成される外節が著しく縮退したことから,タンパク質輸送と視細胞の変性との関係を調べるモデルになると考えられた.つぎに,アポトーシスの分子機構について研究を行った.coa突然変異体においては,視細胞の変性はアポトーシスを抑制するBcl2の強制発現やアポトーシスを誘導するBaxの阻害により抑制された.この結果から,β-SNAPの機能の低下にともないBaxを介したアポトーシスの起こることが,視細胞の変性の原因であることが明らかになった.
ミトコンドリアを介したアポトーシスはBaxとBcl2とのバランスにより制御されており7),その上流タンパク質として多くのBH3-onlyタンパク質の関与が報告されている.coa突然変異体では視細胞においてBaxを介したアポトーシスが起こることから,それに関与するBH3-onlyタンパク質を探索した.ヒトの培養細胞を用いた研究において,α-SNAPの強制発現はBNip1のアポトーシス誘導活性を抑制することが報告されている6).ヒトのα-SNAPとゼブラフィッシュのβ-SNAPはアミノ酸配列レベルでの相同性が高いことから,coa突然変異体における視細胞のアポトーシスはBNip1に依存するかどうかを検討した.coa突然変異体においてBNip1を阻害すると視細胞のアポトーシスが抑制されたことから,β-SNAPの機能の低下はBNip1を介しアポトーシスを誘導することが明らかになった.
β-SNAPは輸送小胞の融合ののち形成されるcis-SNARE複合体を解離させる.coa突然変異体ではβ-SNAPの機能が低下するので,すべてのcis-SNARE複合体が蓄積すると思われた.ひとつの可能性として,BNip1は単独では低いアポトーシス誘導活性しかもたないが,Syntaxin18-cis-SNARE複合体の状態ではアポトーシス誘導活性の亢進することが考えられた.この可能性を検討するため,coa突然変異体における視細胞のアポトーシスがSyntaxin18-cis-SNARE複合体と相関するかどうか調べた.ここでは,coa突然変異体においてBNip1以外のSyntaxin18 SNARE複合体の構成タンパク質,すなわち,Syntaxin18,Use1,Sec22bの機能阻害を行うことによりSyntaxin18-cis-SNARE複合体の形成を阻害した.その結果,coa突然変異体における視細胞のアポトーシスは抑制された.また,初期胚においてBNip1を単独で発現させてもアポトーシスは誘導されないが,ほかのSyntaxin18 SNARE複合体の構成タンパク質と共発現させるとアポトーシスが誘導された.これらの結果は,β-SNAPの機能の低下によりSyntaxin18-cis-SNARE複合体が蓄積し,その結果,BNip1に依存性のアポトーシスが誘導されることを示唆した.
この研究では,ゼブラフィッシュの視細胞において,β-SNAPの機能の低下によりSyntaxin18-cis-SNARE複合体が蓄積し,その結果,BNip1に依存性のアポトーシスが誘導されることが明らかになった(図1).正常なβ-SNAPはSyntaxin18-cis-SNARE複合体を解離することによりBNip1のアポトーシス誘導活性を抑制していることが示唆された.以上から,Syntaxin18-cis-SNARE複合体は小胞輸送の融合をモニターする警報として機能し,BNip1は輸送小胞の融合の異常を感知してアポトーシスを誘導すると考えられた.この発見は,小胞輸送の異常とアポトーシスとを結びつける新たなしくみを示した.
タンパク質の輸送は,供給膜からの輸送小胞の出芽,標的膜への輸送と融合のステップを介し制御される.もし,輸送小胞の出芽や輸送に異常が起こった場合,輸送小胞の融合そのものが開始されないので,Syntaxin18-cis-SNARE複合体も形成されず,BNip1を介したアポトーシスも活性化されないと考えられた.Syntaxin18-cis-SNARE複合体が蓄積するのは,輸送小胞の融合によるcis-SNARE複合体の形成がSNAPによる解離をうわまわった場合である.そのような場合はどのような状況において生じるのだろうか.coa突然変異体では視細胞のアポトーシスは受精ののち2~3日目に観察される.この時期は視細胞の外節がもっとも成長する時期と一致しており,多くの光受容タンパク質が小胞体で合成され,ゴルジ体を経由して外節へと輸送されることから,小胞輸送が非常に活発であると考えられる.もし,小胞輸送が細胞において過度に活性化されるとSNAPが大量に消費され,小胞体へ供給されるSNAPの量が減少することが考えられる.ひとつの可能性として,Syntaxin18-cis-SNARE複合体は視細胞の分化の過程において小胞輸送系が過度に活性化するのを監視しているのかもしれない.一般に,小胞輸送系が停止すると小胞体からのタンパク質の輸送が停止し,小胞体ストレス反応の起こる可能性がある.Syntaxin18-cis-SNARE複合体は小胞体ストレス反応と協調して,小胞輸送の活性の上限と下限を決めている可能性もある.
ヒトではタンパク質の輸送異常をともなう視細胞の変性疾患が報告されている.これらの網膜変性疾患のなかにはSNAPやNSFの機能の低下と関連するものが存在する可能性もある.そのようなケースではBNip1に依存するアポトーシスの関与が今後の研究課題となり,BNip1を阻害する薬剤の開発も網膜変性疾患の治療に貢献することが期待される.
略歴:1998年 大阪大学大学院理学研究科博士課程 修了,同年 日本宇宙フォーラム 研究員,理化学研究所脳科学総合研究センター 研究員,2002年 理化学研究所 政井独立主幹研究ユニット 研究員を経て,2006年より沖縄科学技術基盤整備機構(現 沖縄科学技術大学院大学)研究員.
研究テーマ:視細胞の発生と変性の機構.
抱負:光を受容するために特化した機能と美しい構造をもつ視細胞について,運命決定のしくみや細胞変性の分子機構を明らかにしていくことにより,網膜変性疾患の病態の理解にも貢献していきたい.
政井 一郎(Ichiro Masai)
沖縄科学技術大学院大学 准教授.
研究室URL:https://groups.oist.jp/ja/dnu
© 2013 西脇優子・政井一郎 Licensed under CC 表示 2.1 日本
(沖縄科学技術大学院大学 神経発生ユニット)
email:政井一郎
DOI: 10.7875/first.author.2013.086
The BH3-only SNARE BNip1 mediates photoreceptor apoptosis in response to vesicular fusion defects.
Yuko Nishiwaki, Asuka Yoshizawa, Yutaka Kojima, Eri Oguri, Shohei Nakamura, Shohei Suzuki, Junichi Yuasa-Kawada, Mariko Kinoshita-Kawada, Toshiaki Mochizuki, Ichiro Masai
Developmental Cell, 25, 374-387 (2013)
要 約
細胞における小胞輸送は視細胞の機能および維持において重要な役割を担う.しかしながら,小胞輸送の異常により起こる視細胞の変性の分子機構についてはいまだ不明である.筆者らは,ゼブラフィッシュにおいてβ-SNAPの突然変異体では視細胞がアポトーシスを起こすことを発見した.β-SNAPは輸送小胞の融合の際に形成されるcis-SNARE複合体を解離させることによりSNAREタンパク質のリサイクルにはたらく.さらに,β-SNAP突然変異体にて起こる視細胞の変性は,BH3ドメインをもつSNAREタンパク質であるBNip1に依存していることも発見された.BNip1はゴルジ体から小胞体への逆行輸送を制御するSyntaxin18 SNARE複合体の構成タンパク質である.輸送小胞の融合において生じるSyntaxin18-cis-SNARE複合体が解離しないとBNip1に依存してアポトーシスが誘導される.この結果から,Syntaxin18-cis-SNARE複合体は輸送小胞の融合を監視する警報として機能し,BNip1は膜融合の異常に反応してアポトーシスをひき起こすことが明らかになった.
はじめに
現在,ヒトでは視細胞の変性にかかわる遺伝子が200以上も同定されている1).視細胞を維持するうえでのタンパク質輸送の重要性は,光受容膜への輸送が異常になるロドプシンの突然変異や2),結合繊毛を介したタンパク質輸送の制御タンパク質の突然変異3) の研究から示唆されてきた.しかし,タンパク質輸送と視細胞の変性とを関連づけるしくみは不明であった.
細胞におけるタンパク質輸送は細胞の膜器官を経由した分泌系により制御され,供給膜から小胞が出芽し,標的膜へと輸送され,融合する過程から構成される4).ここでは,NSF(N-ethylmaleimide-sensitive factor),SNAP(soluble NSF attachment protein),SNARE(SNAP receptor)の3つの制御タンパク質が膜融合の過程を制御する.SNAREタンパク質は輸送小胞においてはたらくv-SNARE(vesicle-membrane SNARE)と,標的膜においてはたらくt-SNARE(target-membrane SNARE)とに分類される.3種類のt-SNAREが受容側のSNARE複合体を形成し,1種類のv-SNAREと相互作用することにより,小胞膜と標的膜との融合は開始する.受容側のSNARE複合体とv-SNAREは膜融合によりcis-SNARE複合体を形成する.SNAPはNSFと協調してcis-SNARE複合体を解離することにより,SNAREタンパク質のリサイクルを促進する.
BNip1はアデノウイルスE1Bの19 kDaタンパク質と相互作用するタンパク質として同定され5),BH3ドメインをもちアポトーシスを誘導する活性をもつ6).また,BNip1はゴルジ体から小胞体への逆行輸送を担うSyntaxin18 SNARE複合体のt-SNAREのひとつとして機能している6).Syntaxin18 SNARE複合体は,Syntaxin18,BNip1,Use1の3つのt-SNAREと,v-SNAREであるSec22bから構成される.ヒトの培養細胞を用いた研究において,α-SNAPの強制発現によりBNip1のアポトーシス誘導活性が抑制されたという報告がある6).しかしながら,SNAPによるBNip1のアポトーシス誘導活性の抑制機構は不明であった.
1.ゼブラフィッシュのβ-SNAPの突然変異体では視細胞がアポトーシスを起こす
筆者らは,視細胞の変性の分子機構を明らかにする目的で,ゼブラフィッシュを用いて大規模な突然変異体のスクリーニングを行い,視細胞が特異的に変性するcorona(coa)突然変異体を同定した.coa遺伝子をクローニングした結果,β-SNAP(β-soluble N-ethylmaleimide-sensitive factor attachment protein)をコードすることが明らかになった.β-SNAPの機能が低下すると輸送小胞の融合は完了できず,SNAREタンパク質のリサイクルはとどこおり,最終的に,輸送小胞を介したタンパク質輸送は停止することが予想された.実際に,coa突然変異体においてはロドプシンなどの光受容タンパク質は検出できず,ゴルジ体や光受容膜から構成される外節が著しく縮退したことから,タンパク質輸送と視細胞の変性との関係を調べるモデルになると考えられた.つぎに,アポトーシスの分子機構について研究を行った.coa突然変異体においては,視細胞の変性はアポトーシスを抑制するBcl2の強制発現やアポトーシスを誘導するBaxの阻害により抑制された.この結果から,β-SNAPの機能の低下にともないBaxを介したアポトーシスの起こることが,視細胞の変性の原因であることが明らかになった.
2.β-SNAPの突然変異体における視細胞のアポトーシスはBNip1に依存する
ミトコンドリアを介したアポトーシスはBaxとBcl2とのバランスにより制御されており7),その上流タンパク質として多くのBH3-onlyタンパク質の関与が報告されている.coa突然変異体では視細胞においてBaxを介したアポトーシスが起こることから,それに関与するBH3-onlyタンパク質を探索した.ヒトの培養細胞を用いた研究において,α-SNAPの強制発現はBNip1のアポトーシス誘導活性を抑制することが報告されている6).ヒトのα-SNAPとゼブラフィッシュのβ-SNAPはアミノ酸配列レベルでの相同性が高いことから,coa突然変異体における視細胞のアポトーシスはBNip1に依存するかどうかを検討した.coa突然変異体においてBNip1を阻害すると視細胞のアポトーシスが抑制されたことから,β-SNAPの機能の低下はBNip1を介しアポトーシスを誘導することが明らかになった.
3.Syntaxin18-cis-SNARE複合体の解離の不全はBNip1に依存したアポトーシスをひき起こす
β-SNAPは輸送小胞の融合ののち形成されるcis-SNARE複合体を解離させる.coa突然変異体ではβ-SNAPの機能が低下するので,すべてのcis-SNARE複合体が蓄積すると思われた.ひとつの可能性として,BNip1は単独では低いアポトーシス誘導活性しかもたないが,Syntaxin18-cis-SNARE複合体の状態ではアポトーシス誘導活性の亢進することが考えられた.この可能性を検討するため,coa突然変異体における視細胞のアポトーシスがSyntaxin18-cis-SNARE複合体と相関するかどうか調べた.ここでは,coa突然変異体においてBNip1以外のSyntaxin18 SNARE複合体の構成タンパク質,すなわち,Syntaxin18,Use1,Sec22bの機能阻害を行うことによりSyntaxin18-cis-SNARE複合体の形成を阻害した.その結果,coa突然変異体における視細胞のアポトーシスは抑制された.また,初期胚においてBNip1を単独で発現させてもアポトーシスは誘導されないが,ほかのSyntaxin18 SNARE複合体の構成タンパク質と共発現させるとアポトーシスが誘導された.これらの結果は,β-SNAPの機能の低下によりSyntaxin18-cis-SNARE複合体が蓄積し,その結果,BNip1に依存性のアポトーシスが誘導されることを示唆した.
4.Syntaxin18-cis-SNARE複合体は輸送小胞の融合の異常を感知する警報として機能する
この研究では,ゼブラフィッシュの視細胞において,β-SNAPの機能の低下によりSyntaxin18-cis-SNARE複合体が蓄積し,その結果,BNip1に依存性のアポトーシスが誘導されることが明らかになった(図1).正常なβ-SNAPはSyntaxin18-cis-SNARE複合体を解離することによりBNip1のアポトーシス誘導活性を抑制していることが示唆された.以上から,Syntaxin18-cis-SNARE複合体は小胞輸送の融合をモニターする警報として機能し,BNip1は輸送小胞の融合の異常を感知してアポトーシスを誘導すると考えられた.この発見は,小胞輸送の異常とアポトーシスとを結びつける新たなしくみを示した.
タンパク質の輸送は,供給膜からの輸送小胞の出芽,標的膜への輸送と融合のステップを介し制御される.もし,輸送小胞の出芽や輸送に異常が起こった場合,輸送小胞の融合そのものが開始されないので,Syntaxin18-cis-SNARE複合体も形成されず,BNip1を介したアポトーシスも活性化されないと考えられた.Syntaxin18-cis-SNARE複合体が蓄積するのは,輸送小胞の融合によるcis-SNARE複合体の形成がSNAPによる解離をうわまわった場合である.そのような場合はどのような状況において生じるのだろうか.coa突然変異体では視細胞のアポトーシスは受精ののち2~3日目に観察される.この時期は視細胞の外節がもっとも成長する時期と一致しており,多くの光受容タンパク質が小胞体で合成され,ゴルジ体を経由して外節へと輸送されることから,小胞輸送が非常に活発であると考えられる.もし,小胞輸送が細胞において過度に活性化されるとSNAPが大量に消費され,小胞体へ供給されるSNAPの量が減少することが考えられる.ひとつの可能性として,Syntaxin18-cis-SNARE複合体は視細胞の分化の過程において小胞輸送系が過度に活性化するのを監視しているのかもしれない.一般に,小胞輸送系が停止すると小胞体からのタンパク質の輸送が停止し,小胞体ストレス反応の起こる可能性がある.Syntaxin18-cis-SNARE複合体は小胞体ストレス反応と協調して,小胞輸送の活性の上限と下限を決めている可能性もある.
おわりに
ヒトではタンパク質の輸送異常をともなう視細胞の変性疾患が報告されている.これらの網膜変性疾患のなかにはSNAPやNSFの機能の低下と関連するものが存在する可能性もある.そのようなケースではBNip1に依存するアポトーシスの関与が今後の研究課題となり,BNip1を阻害する薬剤の開発も網膜変性疾患の治療に貢献することが期待される.
文 献
- Kennan, A., Aherne, A. & Humphries, P.: Light in retinitis pigmentosa. Trends Genet., 21, 103-110 (2005)[PubMed]
- Mendes, H. F., van der Spuy, J., Chapple, J. P. et al.: Mechanisms of cell death in rhodopsin retinitis pigmentosa: implications for therapy. Trends Mol. Med., 11, 177-185 (2005)[PubMed]
- Eley, L., Yates, L. M. & Goodship, J. A.: Cilia and disease. Curr. Opin. Genet. Dev., 15, 308-314 (2005)[PubMed]
- Bonifacino, J. S. & Glick, B. S.: The mechanisms of vesicle budding and fusion. Cell, 116, 153-166 (2004)[PubMed]
- Boyd, J. M., Malstrom, S., Subramanian, T. et al.: Adenovirus E1B 19 kDa and Bcl-2 proteins interact with a common set of cellular proteins. Cell, 79, 341-351 (1994)[PubMed]
- Nakajima, K., Hirose, H., Taniguchi, M. et al.: Involvement of BNIP1 in apoptosis and endoplasmic reticulum membrane fusion. EMBO J., 23, 3216-3226 (2004)[PubMed]
- Tait, S. W. & Green, D. R.: Mitochondria and cell death: outer membrane permeabilization and beyond. Nat. Rev. Mol. Cell Biol., 11, 621-632 (2010)[PubMed]
著者プロフィール
略歴:1998年 大阪大学大学院理学研究科博士課程 修了,同年 日本宇宙フォーラム 研究員,理化学研究所脳科学総合研究センター 研究員,2002年 理化学研究所 政井独立主幹研究ユニット 研究員を経て,2006年より沖縄科学技術基盤整備機構(現 沖縄科学技術大学院大学)研究員.
研究テーマ:視細胞の発生と変性の機構.
抱負:光を受容するために特化した機能と美しい構造をもつ視細胞について,運命決定のしくみや細胞変性の分子機構を明らかにしていくことにより,網膜変性疾患の病態の理解にも貢献していきたい.
政井 一郎(Ichiro Masai)
沖縄科学技術大学院大学 准教授.
研究室URL:https://groups.oist.jp/ja/dnu
© 2013 西脇優子・政井一郎 Licensed under CC 表示 2.1 日本