H+/Ca2+交換輸送体における対向輸送の分子基盤
西澤知宏・石谷隆一郎・濡木 理
(東京大学大学院理学系研究科 生物化学専攻)
email:西澤知宏,濡木 理
DOI: 10.7875/first.author.2013.079
Structural basis for the counter-transport mechanism of a H+/Ca2+ exchanger.
Tomohiro Nishizawa, Satomi Kita, Andrés D. Maturana, Noritaka Furuya, Kunio Hirata, Go Kasuya, Satoshi Ogasawara, Naoshi Dohmae, Takahiro Iwamoto, Ryuichiro Ishitani, Osamu Nureki
Science, 341, 168-172 (2013)
CaCAファミリータンパク質はNa+やH+の濃度勾配を利用してCa2+の輸送を行うことにより,細胞内におけるCa2+濃度の制御にかかわる.今回,筆者らは,CaCAファミリータンパク質のうち古細菌に由来するH+/Ca2+交換輸送体の結晶構造を2.3Åの分解能で明らかにした.この結晶構造において,イオンとの結合部位は細胞の内側に開いており,H+が結合した状態を示していた.過去に報告された細胞の外側に開いた状態のCaCAファミリータンパク質の構造との比較から,2本の膜貫通ヘリックスが配向を変えることにより,イオン結合部位が細胞の内側あるいは外側に開いた状態を相互に遷移することが明らかになった.さらに,変異体を用いた実験から,結晶構造においてH+が結合していると考えられた2つの保存されたグルタミン酸残基はCa2+との結合にもかかわっており,これらの結合は相互に排他的であることが示された.結晶格子に含まれた2種類の異なる構造と,過去に報告されたCa2+の結合した状態のCaCAファミリータンパク質の構造との比較から,H+あるいはCa2+の結合に依存して細胞の内側あるいは外側に開いた状態のあいだの遷移がひき起こされるという輸送モデルを提唱した.
細胞内のCa2+はセカンドメッセンジャーとして重要な役割をもち,多くの制御タンパク質が細胞内Ca2+濃度の制御にかかわっている.イオンポンプやイオンチャネルなどにくわえ,Na+やH+とCa2+との交換反応を行うCaCA(cation/Ca2+ antiporter,カチオン/Ca2+交換輸送体)ファミリータンパク質はカウンターイオンであるNa+やH+などの濃度勾配を利用してCa2+の排出を行う1,2).CaCAファミリータンパク質の構造情報がはじめて明らかになったのは2012年のことで,古細菌Methanococcus jannaschiiに由来するNa+/Ca2+交換輸送体は5つの膜貫通ヘリックスの2回くり返し単位による分子内偽2回対称性をもつことが明らかになった3)(PDB ID:3V5U).さらに,CaCAファミリーのサブファミリーのあいだで高度に保存されているαリピートとよばれるアミノ酸配列は基質イオンであるCa2+およびNa+が結合するポケットを形成しており,このNa+/Ca2+交換輸送体はイオン結合ポケットが細胞の外側に開いた構造を示していた3).分子内偽2回対称性をもとにイオン結合ポケットが細胞の内側に開いた構造も予測されたが,実際の構造変化をひとつの結晶構造から類推することには限界があるため,CaCAファミリータンパク質においてCa2+およびカウンターイオンがそれぞれどのように輸送されるのかという分子機構については未解明の部分が多く,さらなる構造情報が必要とされていた.
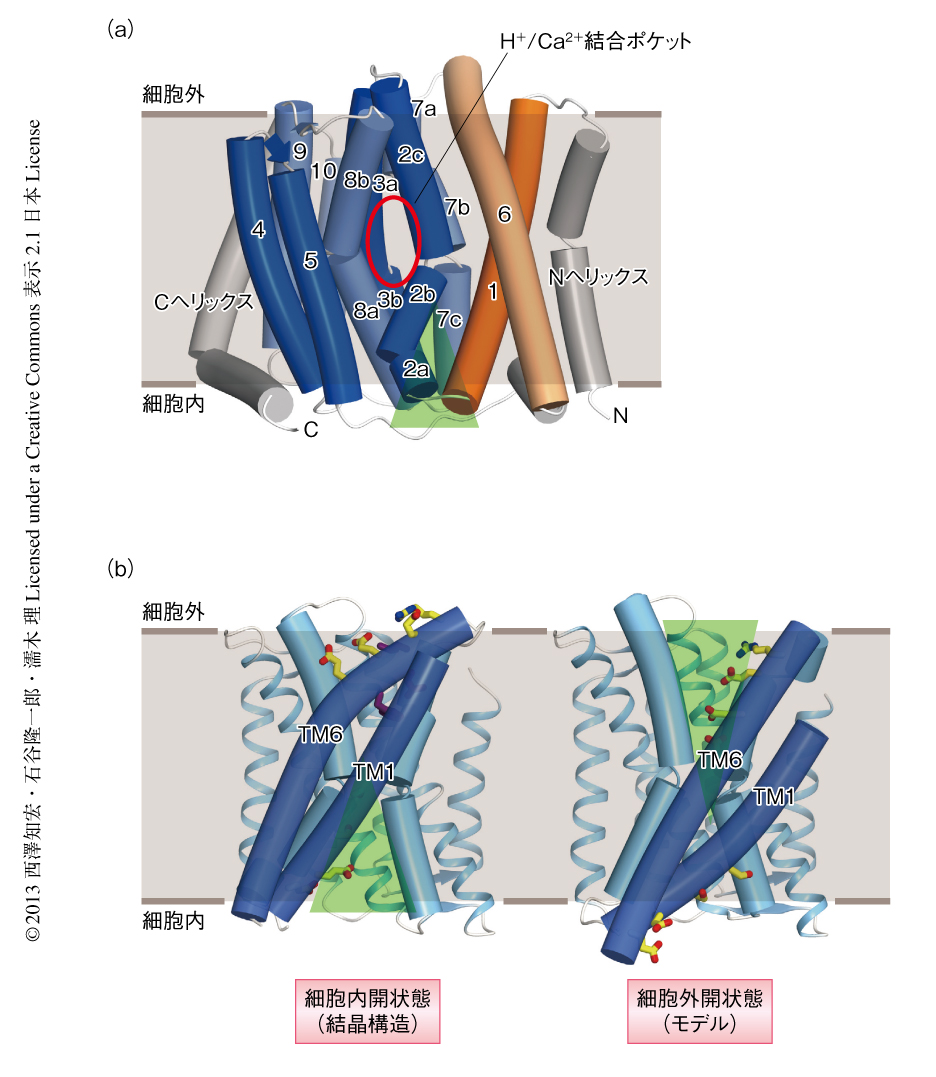
筆者らは,CaCAファミリー遺伝子のスクリーニングにより,古細菌Archaeoglobus fulgidusに由来するH+/Ca2+交換輸送体を構造解析のターゲットの候補として見い出し,さらに,このタンパク質がH+/Ca2+交換輸送活性をもつことを大腸菌およびリポソーム再構成による実験により確認した.精製したH+/Ca2+交換輸送体は,モノオレインの脂質相に膜タンパク質を再構成した状態で結晶化を行う脂質キュービック相法とよばれる方法を用い,2.3Åの分解能で構造を決定した(PDB ID:4KPP).明らかになったH+/Ca2+交換輸送体の構造は,12本の膜貫通ヘリックスをもち,中心となる10回膜貫通領域はコアドメイン(膜貫通ヘリックス2~膜貫通ヘリックス5,および,膜貫通ヘリックス7~膜貫通ヘリックス10)と,コアドメインに対しゆるやかにパッキングされた2本のヘリックスバンドル(膜貫通ヘリックス1,および,膜貫通ヘリックス6)からなり,過去に報告されたNa+/Ca2+交換輸送体の構造と類似性を示した(図1a).サブファミリーごとに保存されたαリピートを含む4本の膜貫通ヘリックス(膜貫通ヘリックス2,膜貫通ヘリックス3,膜貫通ヘリックス7,膜貫通ヘリックス8)はそれぞれ中央で屈曲し,タンパク質の中央に基質イオンが結合すると思われる空間を形成していた(H+/Ca2+結合ポケット).配列の保存性などから,コアドメインの構造はCaCAファミリータンパク質において共通であると考えられた.しかし,イオン結合ポケットが細胞の外側に開いていたNa+/Ca2+交換輸送体と比較すると,H+/Ca2+交換輸送体ではヘリックスバンドルの配向は著しく異なっており,イオン結合ポケットは細胞の内側に開いた状態になっていた(図1b).
膜貫通ヘリックス1および膜貫通ヘリックス6はともに両親媒性であり,膜貫通ヘリックス1の細胞質の側(内側)に存在する親水性アミノ酸残基のクラスターはコアドメインに面し,H+/Ca2+結合ポケットから細胞質へとつながる孔を親水的な環境に保っていた.ここには複数の水分子が観察されたことから,細胞内の側における基質イオンの透過経路であると考えられた.一方,膜貫通ヘリックス6の細胞外の側に存在する親水性アミノ酸残基のクラスターは細胞の外側の溶媒をむいており,H+/Ca2+結合ポケットは細胞の外側から疎水性アミノ酸残基によりシールされていた.Na+/Ca2+交換輸送体では膜貫通ヘリックス6のもつ親水性アミノ酸残基のクラスターが細胞外の側のイオン輸送経路を形成していたことから,膜貫通ヘリックス1とおよび膜貫通ヘリックス6は滑るように構造変化を生じ,同時に,これら膜貫通ヘリックスのもつ親水性クラスターが向きを変えることにより,細胞内の側および細胞外の側に相互にイオン輸送経路を形成し,H+/Ca2+結合ポケットに結合した基質イオンの輸送を行うと考えられた(図1b).今回,このヘリックスバンドルをゲーティングバンドルと名づけた.
ゲーティングバンドルの滑るような動きにより細胞の内外に交互にイオン透過経路を形成する輸送機構はNa+/Ca2+交換輸送体の構造から予測されていたモデルに近いが,ゲーティングバンドルの親水性アミノ酸残基クラスターの存在とその配向の変化については,今回の報告によりはじめて明らかになった.このような親水性のアミノ酸残基クラスターは哺乳類のもつCaCAファミリータンパク質であるNCXやNCKXなどにも存在しており,この分子機構はCaCAファミリータンパク質に共通すると予想された.
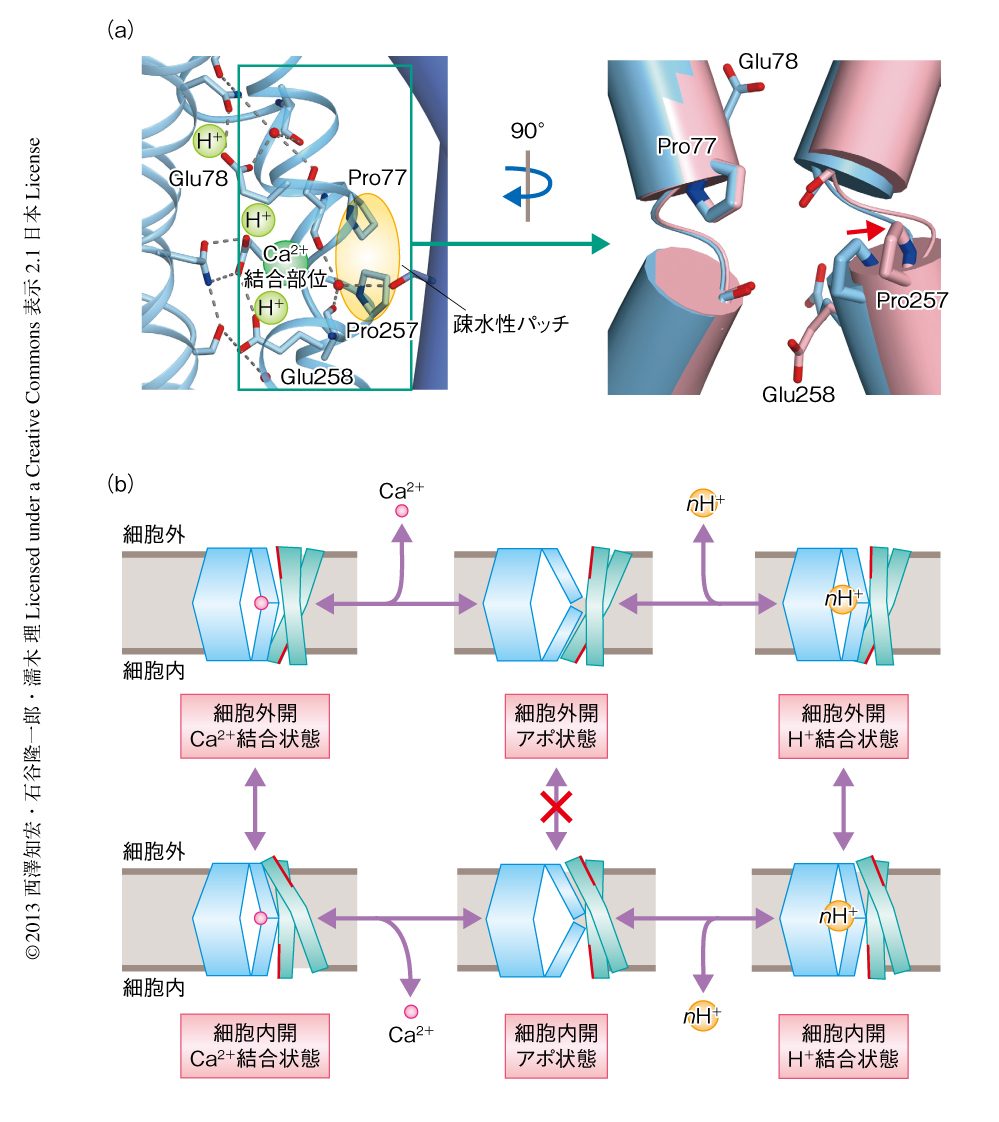
H+/Ca2+結合ポケットを形成する膜貫通ヘリックスのうち膜貫通ヘリックス2と膜貫通ヘリックス7にはサブファミリーのあいだで保存されているαリピートが含まれており,CaCAファミリータンパク質に共通する特徴的なモチーフである連続したPro-GluのProにより中央で大きく折れ曲がっていた.Na+/Ca2+交換輸送体の結晶構造においてもこのような特徴は観察されており,さらに,このモチーフのGluはCa2+との結合にかかわっていた.H+/Ca2+交換輸送体のリポソームにおけるCa2+取り込み実験において,この2つのGlu(Glu78およびGlu258)をAlaに変えた変異体は完全に活性を失ったことから,H+/Ca2+交換輸送体においてもこれらのGluがCa2+の配位にかかわっていることが示唆された.しかし,結晶構造ではこの2つのGluの側鎖はH+/Ca2+結合ポケットにおいて水素結合ネットワークを形成しており,Ca2+の結合部位と推定される位置から離れていた(図2a).結晶化の条件がpH 6.0~6.5と弱酸性であったことにくわえて,観察された水素結合のパターンから,Glu78およびGlu258を含む3つのGluの側鎖はH+が結合した状態にある可能性が高く,Glu78とGlu258にはH+あるいはCa2+のどちらかしか結合できないことが予想された.実際に,H+/Ca2+交換輸送体の結晶構造ではH+/Ca2+結合ポケットは細胞の内側の溶媒に完全に露出していたにもかかわらず,結晶化の条件にCa2+をくわえてもH+/Ca2+結合ポケットにCa2+に相当する電子密度は観測されなかった.これらのことから,H+/Ca2+交換輸送体におけるH+あるいはCa2+との結合は相互に排他的であり,今回の結晶構造はH+と結合した状態を示すことが示唆された.
今回の結晶構造の非対称単位にはMol AとMol Bの2種類が存在しており,わずかではあるがその構造に違いがみられた.Mol Aではこれまでに述べたようにCa2+との結合にかかわるGlu78およびGlu258がともにH+との結合状態であったのに対し,Mol BではGlu258が脱プロトン化されMol Aとは異なった配向になっていた(図2a).その結果,H+が結合した状態(Mol A)において膜貫通ヘリックス3と膜貫通ヘリックス7とのあいだの安定化に寄与していた水素結合ネットワークは,Glu258が脱プロトン化した状態(Mol B)では失われており膜貫通ヘリックス7はゲーティングバンドルの方向にむかって突き出るように移動していた.膜貫通ヘリックス2および膜貫通ヘリックス7の中央に存在する保存されたProは疎水性パッチを形成しており,これはゲーティングバンドルの滑るような動きのために必要であると考えられていた.しかし,Glu258が脱プロトン化した状態では膜貫通ヘリックス7の構造変化にともないこの疎水性パッチは分断されていた(図2a).さらに,Mol AとMol Bとでゲーティングバンドルの位置を比較すると,疎水性パッチの形成されているMol Aでは細胞の外へ開いた状態へと少し移動していた(図2a).これらの構造の違いは,H+/Ca2+結合ポケットにH+が結合すると,内部における水素結合が周囲の膜貫通ヘリックス,とくに膜貫通ヘリックス7を安定化することにより疎水性パッチが形成され,その結果,ゲーティングバンドルにおける構造変化が可能となることを示唆した.
Na+/Ca2+交換輸送体の構造においては,膜貫通ヘリックス2および膜貫通ヘリックス7の折れ曲がりの部分に位置する主鎖のカルボニルに由来する酸素原子とαリピートの保存されたGluがCa2+の配位子となっていたが,これらはすべてH+/Ca2+交換輸送体においても保存されていたことから,同様の配位様式によるCa2+の結合が予想された.したがって,Ca2+の結合によってもやはり膜貫通ヘリックス2および膜貫通ヘリックス7は中央の折れ曲がった部分が互いに近接することになり,同様の疎水性パッチが形成されると考えられた.これらの結果から,H+/Ca2+交換輸送体において相互に排他的に結合するCa2+あるいはH+に依存して疎水性パッチが形成され,ゲーティングバンドルによる細胞内開状態と細胞外開状態とのあいだの遷移が可能になるという輸送モデルを提唱した(図2b).このモデルにおいて,なにも結合していない状態,いわゆるアポ状態では膜貫通ヘリックス2および膜貫通ヘリックス7はH+あるいはCa2+との結合にかかわるGluの負電荷などにより反発しあい,疎水性パッチが分断されることにより状態の遷移が抑えられる.このようなしくみは,細胞からのイオンの漏洩をふせぎイオン交換輸送体として機能するため必須であり,CaCAファミリータンパク質において共通であると予想されるが,CaCAファミリータンパク質におけるさらなる構造研究および機能研究が待たれるところである.
H+/Ca2+交換輸送体の結晶構造が解けてから,さて,イオン輸送モデルを考えようというところで,筆者らはかなり悩んだ.過去に報告されたNa+/Ca2+交換輸送体の構造では基質イオンである3つのNa+と1つのCa2+がすべて結合した状態であったからである.この論文では,これらの結合部位を形成するアミノ酸残基の側鎖はとくに配置を変えることはなく,イオン輸送サイクルにおいて同じ配向を保ったままであると考察されていた.その結果,これまでの2次輸送体とは大きく異なる輸送モデルが提唱されており,納得できない部分も多かった.一方,筆者らの報告したH+/Ca2+交換輸送体の結晶構造では,対向輸送される基質イオンの片方であるH+しか結合しておらず,Ca2+の結合とは排他的であった.この2つのCaCAファミリータンパク質におけるCa2+とカウンターイオンの結合の違いは真っ向から対立しているように思えた.H+/Ca2+交換輸送体の結晶構造に含まれた2つの構造の微妙な違いから,H+/Ca2+結合ポケットを形成する膜貫通ヘリックスのうち膜貫通ヘリックス7(と,分子内対称性により関連づけられた膜貫通ヘリックス2)はフレキシブルでありイオン輸送サイクルの過程で動きうるという考えにたどりついてはじめて,イオン輸送サイクル全体の構造変化に対する知見が得られた.やはり,1枚のスナップショットだけでタンパク質全体の構造変化を理解することはむずかしい.
筆者らは,はじめこの内容の論文をNature誌に投稿したのだが,“最近,非常に関連性の高い構造の論文を受理した直後なので”という理由でリジェクトされてしまった.タンパク質立体構造データベースPDBにおいて未発表のカテゴリーの登録を確認したところ,出芽酵母に由来するH+/Ca2+交換輸送体の構造が登録されていた(PDB ID:4KIC).急いでScience誌に再投稿し,エディターに事情を説明して可能なかぎり早くレフェリーに回してもらった.改稿の要求に応えるための実験など怒涛の1カ月ののち受理が決まり,Nature誌の論文4) に遅れること4日でオンライン出版に至った.じつは筆者らは,海外の学会においてこのH+/Ca2+交換輸送体を,CaCAファミリータンパク質においてはじめてのイオン結合ポケットが細胞の内側に開いた状態の構造として発表していた.なんと,その会場に今回のコンペティターも参加しており,直接にディスカッションする機会もあった.そのときには,まさか彼らがコンペティターであるなどとは露にも思わず,Nature誌に投稿した際にはレフェリーに推薦したくらいである.のちに出版された彼らの論文をみると,“first structure, to our knowledge, within the CAX family” という表現があり,“おいおい待て待て,世間的にはそうかもしれないが,知っていたじゃないか”という気分にもなるが,投稿が遅れたこちらのせいもあるのでしかたない.あらためて,膜タンパク質の構造研究は熾烈な争いにあることを実感したしだいではあるが,投稿のまえに連絡をとり互いの構造をある程度までみせあって議論できたのなら内容を変えたかった部分もいくつかあり,残念でもある.
略歴:東京大学理学系研究科 特任助教.
研究テーマ:膜タンパク質,とくに,イオン輸送体の結晶構造解析.
抱負:他人の机の上をガチャガチャのおもちゃで占領すること.
石谷 隆一郎(Ryuichiro Ishitani)
東京大学大学院理学系研究科 准教授.
濡木 理(Osamu Nureki)
東京大学大学院理学系研究科 教授.
研究室URL:http://www.nurekilab.net/
© 2013 西澤知宏・石谷隆一郎・濡木 理 Licensed under CC 表示 2.1 日本
(東京大学大学院理学系研究科 生物化学専攻)
email:西澤知宏,濡木 理
DOI: 10.7875/first.author.2013.079
Structural basis for the counter-transport mechanism of a H+/Ca2+ exchanger.
Tomohiro Nishizawa, Satomi Kita, Andrés D. Maturana, Noritaka Furuya, Kunio Hirata, Go Kasuya, Satoshi Ogasawara, Naoshi Dohmae, Takahiro Iwamoto, Ryuichiro Ishitani, Osamu Nureki
Science, 341, 168-172 (2013)
要 約
CaCAファミリータンパク質はNa+やH+の濃度勾配を利用してCa2+の輸送を行うことにより,細胞内におけるCa2+濃度の制御にかかわる.今回,筆者らは,CaCAファミリータンパク質のうち古細菌に由来するH+/Ca2+交換輸送体の結晶構造を2.3Åの分解能で明らかにした.この結晶構造において,イオンとの結合部位は細胞の内側に開いており,H+が結合した状態を示していた.過去に報告された細胞の外側に開いた状態のCaCAファミリータンパク質の構造との比較から,2本の膜貫通ヘリックスが配向を変えることにより,イオン結合部位が細胞の内側あるいは外側に開いた状態を相互に遷移することが明らかになった.さらに,変異体を用いた実験から,結晶構造においてH+が結合していると考えられた2つの保存されたグルタミン酸残基はCa2+との結合にもかかわっており,これらの結合は相互に排他的であることが示された.結晶格子に含まれた2種類の異なる構造と,過去に報告されたCa2+の結合した状態のCaCAファミリータンパク質の構造との比較から,H+あるいはCa2+の結合に依存して細胞の内側あるいは外側に開いた状態のあいだの遷移がひき起こされるという輸送モデルを提唱した.
はじめに
細胞内のCa2+はセカンドメッセンジャーとして重要な役割をもち,多くの制御タンパク質が細胞内Ca2+濃度の制御にかかわっている.イオンポンプやイオンチャネルなどにくわえ,Na+やH+とCa2+との交換反応を行うCaCA(cation/Ca2+ antiporter,カチオン/Ca2+交換輸送体)ファミリータンパク質はカウンターイオンであるNa+やH+などの濃度勾配を利用してCa2+の排出を行う1,2).CaCAファミリータンパク質の構造情報がはじめて明らかになったのは2012年のことで,古細菌Methanococcus jannaschiiに由来するNa+/Ca2+交換輸送体は5つの膜貫通ヘリックスの2回くり返し単位による分子内偽2回対称性をもつことが明らかになった3)(PDB ID:3V5U).さらに,CaCAファミリーのサブファミリーのあいだで高度に保存されているαリピートとよばれるアミノ酸配列は基質イオンであるCa2+およびNa+が結合するポケットを形成しており,このNa+/Ca2+交換輸送体はイオン結合ポケットが細胞の外側に開いた構造を示していた3).分子内偽2回対称性をもとにイオン結合ポケットが細胞の内側に開いた構造も予測されたが,実際の構造変化をひとつの結晶構造から類推することには限界があるため,CaCAファミリータンパク質においてCa2+およびカウンターイオンがそれぞれどのように輸送されるのかという分子機構については未解明の部分が多く,さらなる構造情報が必要とされていた.
1.H+/Ca2+交換輸送体の結晶構造
筆者らは,CaCAファミリー遺伝子のスクリーニングにより,古細菌Archaeoglobus fulgidusに由来するH+/Ca2+交換輸送体を構造解析のターゲットの候補として見い出し,さらに,このタンパク質がH+/Ca2+交換輸送活性をもつことを大腸菌およびリポソーム再構成による実験により確認した.精製したH+/Ca2+交換輸送体は,モノオレインの脂質相に膜タンパク質を再構成した状態で結晶化を行う脂質キュービック相法とよばれる方法を用い,2.3Åの分解能で構造を決定した(PDB ID:4KPP).明らかになったH+/Ca2+交換輸送体の構造は,12本の膜貫通ヘリックスをもち,中心となる10回膜貫通領域はコアドメイン(膜貫通ヘリックス2~膜貫通ヘリックス5,および,膜貫通ヘリックス7~膜貫通ヘリックス10)と,コアドメインに対しゆるやかにパッキングされた2本のヘリックスバンドル(膜貫通ヘリックス1,および,膜貫通ヘリックス6)からなり,過去に報告されたNa+/Ca2+交換輸送体の構造と類似性を示した(図1a).サブファミリーごとに保存されたαリピートを含む4本の膜貫通ヘリックス(膜貫通ヘリックス2,膜貫通ヘリックス3,膜貫通ヘリックス7,膜貫通ヘリックス8)はそれぞれ中央で屈曲し,タンパク質の中央に基質イオンが結合すると思われる空間を形成していた(H+/Ca2+結合ポケット).配列の保存性などから,コアドメインの構造はCaCAファミリータンパク質において共通であると考えられた.しかし,イオン結合ポケットが細胞の外側に開いていたNa+/Ca2+交換輸送体と比較すると,H+/Ca2+交換輸送体ではヘリックスバンドルの配向は著しく異なっており,イオン結合ポケットは細胞の内側に開いた状態になっていた(図1b).
膜貫通ヘリックス1および膜貫通ヘリックス6はともに両親媒性であり,膜貫通ヘリックス1の細胞質の側(内側)に存在する親水性アミノ酸残基のクラスターはコアドメインに面し,H+/Ca2+結合ポケットから細胞質へとつながる孔を親水的な環境に保っていた.ここには複数の水分子が観察されたことから,細胞内の側における基質イオンの透過経路であると考えられた.一方,膜貫通ヘリックス6の細胞外の側に存在する親水性アミノ酸残基のクラスターは細胞の外側の溶媒をむいており,H+/Ca2+結合ポケットは細胞の外側から疎水性アミノ酸残基によりシールされていた.Na+/Ca2+交換輸送体では膜貫通ヘリックス6のもつ親水性アミノ酸残基のクラスターが細胞外の側のイオン輸送経路を形成していたことから,膜貫通ヘリックス1とおよび膜貫通ヘリックス6は滑るように構造変化を生じ,同時に,これら膜貫通ヘリックスのもつ親水性クラスターが向きを変えることにより,細胞内の側および細胞外の側に相互にイオン輸送経路を形成し,H+/Ca2+結合ポケットに結合した基質イオンの輸送を行うと考えられた(図1b).今回,このヘリックスバンドルをゲーティングバンドルと名づけた.
ゲーティングバンドルの滑るような動きにより細胞の内外に交互にイオン透過経路を形成する輸送機構はNa+/Ca2+交換輸送体の構造から予測されていたモデルに近いが,ゲーティングバンドルの親水性アミノ酸残基クラスターの存在とその配向の変化については,今回の報告によりはじめて明らかになった.このような親水性のアミノ酸残基クラスターは哺乳類のもつCaCAファミリータンパク質であるNCXやNCKXなどにも存在しており,この分子機構はCaCAファミリータンパク質に共通すると予想された.
2.H+/Ca2+結合ポケット
H+/Ca2+結合ポケットを形成する膜貫通ヘリックスのうち膜貫通ヘリックス2と膜貫通ヘリックス7にはサブファミリーのあいだで保存されているαリピートが含まれており,CaCAファミリータンパク質に共通する特徴的なモチーフである連続したPro-GluのProにより中央で大きく折れ曲がっていた.Na+/Ca2+交換輸送体の結晶構造においてもこのような特徴は観察されており,さらに,このモチーフのGluはCa2+との結合にかかわっていた.H+/Ca2+交換輸送体のリポソームにおけるCa2+取り込み実験において,この2つのGlu(Glu78およびGlu258)をAlaに変えた変異体は完全に活性を失ったことから,H+/Ca2+交換輸送体においてもこれらのGluがCa2+の配位にかかわっていることが示唆された.しかし,結晶構造ではこの2つのGluの側鎖はH+/Ca2+結合ポケットにおいて水素結合ネットワークを形成しており,Ca2+の結合部位と推定される位置から離れていた(図2a).結晶化の条件がpH 6.0~6.5と弱酸性であったことにくわえて,観察された水素結合のパターンから,Glu78およびGlu258を含む3つのGluの側鎖はH+が結合した状態にある可能性が高く,Glu78とGlu258にはH+あるいはCa2+のどちらかしか結合できないことが予想された.実際に,H+/Ca2+交換輸送体の結晶構造ではH+/Ca2+結合ポケットは細胞の内側の溶媒に完全に露出していたにもかかわらず,結晶化の条件にCa2+をくわえてもH+/Ca2+結合ポケットにCa2+に相当する電子密度は観測されなかった.これらのことから,H+/Ca2+交換輸送体におけるH+あるいはCa2+との結合は相互に排他的であり,今回の結晶構造はH+と結合した状態を示すことが示唆された.
3.Glu258におけるH+の結合による構造変化
今回の結晶構造の非対称単位にはMol AとMol Bの2種類が存在しており,わずかではあるがその構造に違いがみられた.Mol Aではこれまでに述べたようにCa2+との結合にかかわるGlu78およびGlu258がともにH+との結合状態であったのに対し,Mol BではGlu258が脱プロトン化されMol Aとは異なった配向になっていた(図2a).その結果,H+が結合した状態(Mol A)において膜貫通ヘリックス3と膜貫通ヘリックス7とのあいだの安定化に寄与していた水素結合ネットワークは,Glu258が脱プロトン化した状態(Mol B)では失われており膜貫通ヘリックス7はゲーティングバンドルの方向にむかって突き出るように移動していた.膜貫通ヘリックス2および膜貫通ヘリックス7の中央に存在する保存されたProは疎水性パッチを形成しており,これはゲーティングバンドルの滑るような動きのために必要であると考えられていた.しかし,Glu258が脱プロトン化した状態では膜貫通ヘリックス7の構造変化にともないこの疎水性パッチは分断されていた(図2a).さらに,Mol AとMol Bとでゲーティングバンドルの位置を比較すると,疎水性パッチの形成されているMol Aでは細胞の外へ開いた状態へと少し移動していた(図2a).これらの構造の違いは,H+/Ca2+結合ポケットにH+が結合すると,内部における水素結合が周囲の膜貫通ヘリックス,とくに膜貫通ヘリックス7を安定化することにより疎水性パッチが形成され,その結果,ゲーティングバンドルにおける構造変化が可能となることを示唆した.
4.H+/Ca2+交換サイクルにおける構造変化
Na+/Ca2+交換輸送体の構造においては,膜貫通ヘリックス2および膜貫通ヘリックス7の折れ曲がりの部分に位置する主鎖のカルボニルに由来する酸素原子とαリピートの保存されたGluがCa2+の配位子となっていたが,これらはすべてH+/Ca2+交換輸送体においても保存されていたことから,同様の配位様式によるCa2+の結合が予想された.したがって,Ca2+の結合によってもやはり膜貫通ヘリックス2および膜貫通ヘリックス7は中央の折れ曲がった部分が互いに近接することになり,同様の疎水性パッチが形成されると考えられた.これらの結果から,H+/Ca2+交換輸送体において相互に排他的に結合するCa2+あるいはH+に依存して疎水性パッチが形成され,ゲーティングバンドルによる細胞内開状態と細胞外開状態とのあいだの遷移が可能になるという輸送モデルを提唱した(図2b).このモデルにおいて,なにも結合していない状態,いわゆるアポ状態では膜貫通ヘリックス2および膜貫通ヘリックス7はH+あるいはCa2+との結合にかかわるGluの負電荷などにより反発しあい,疎水性パッチが分断されることにより状態の遷移が抑えられる.このようなしくみは,細胞からのイオンの漏洩をふせぎイオン交換輸送体として機能するため必須であり,CaCAファミリータンパク質において共通であると予想されるが,CaCAファミリータンパク質におけるさらなる構造研究および機能研究が待たれるところである.
おわりに
H+/Ca2+交換輸送体の結晶構造が解けてから,さて,イオン輸送モデルを考えようというところで,筆者らはかなり悩んだ.過去に報告されたNa+/Ca2+交換輸送体の構造では基質イオンである3つのNa+と1つのCa2+がすべて結合した状態であったからである.この論文では,これらの結合部位を形成するアミノ酸残基の側鎖はとくに配置を変えることはなく,イオン輸送サイクルにおいて同じ配向を保ったままであると考察されていた.その結果,これまでの2次輸送体とは大きく異なる輸送モデルが提唱されており,納得できない部分も多かった.一方,筆者らの報告したH+/Ca2+交換輸送体の結晶構造では,対向輸送される基質イオンの片方であるH+しか結合しておらず,Ca2+の結合とは排他的であった.この2つのCaCAファミリータンパク質におけるCa2+とカウンターイオンの結合の違いは真っ向から対立しているように思えた.H+/Ca2+交換輸送体の結晶構造に含まれた2つの構造の微妙な違いから,H+/Ca2+結合ポケットを形成する膜貫通ヘリックスのうち膜貫通ヘリックス7(と,分子内対称性により関連づけられた膜貫通ヘリックス2)はフレキシブルでありイオン輸送サイクルの過程で動きうるという考えにたどりついてはじめて,イオン輸送サイクル全体の構造変化に対する知見が得られた.やはり,1枚のスナップショットだけでタンパク質全体の構造変化を理解することはむずかしい.
筆者らは,はじめこの内容の論文をNature誌に投稿したのだが,“最近,非常に関連性の高い構造の論文を受理した直後なので”という理由でリジェクトされてしまった.タンパク質立体構造データベースPDBにおいて未発表のカテゴリーの登録を確認したところ,出芽酵母に由来するH+/Ca2+交換輸送体の構造が登録されていた(PDB ID:4KIC).急いでScience誌に再投稿し,エディターに事情を説明して可能なかぎり早くレフェリーに回してもらった.改稿の要求に応えるための実験など怒涛の1カ月ののち受理が決まり,Nature誌の論文4) に遅れること4日でオンライン出版に至った.じつは筆者らは,海外の学会においてこのH+/Ca2+交換輸送体を,CaCAファミリータンパク質においてはじめてのイオン結合ポケットが細胞の内側に開いた状態の構造として発表していた.なんと,その会場に今回のコンペティターも参加しており,直接にディスカッションする機会もあった.そのときには,まさか彼らがコンペティターであるなどとは露にも思わず,Nature誌に投稿した際にはレフェリーに推薦したくらいである.のちに出版された彼らの論文をみると,“first structure, to our knowledge, within the CAX family” という表現があり,“おいおい待て待て,世間的にはそうかもしれないが,知っていたじゃないか”という気分にもなるが,投稿が遅れたこちらのせいもあるのでしかたない.あらためて,膜タンパク質の構造研究は熾烈な争いにあることを実感したしだいではあるが,投稿のまえに連絡をとり互いの構造をある程度までみせあって議論できたのなら内容を変えたかった部分もいくつかあり,残念でもある.
文 献
- Lytton, J.: Na+/Ca2+ exchangers: three mammalian gene families control Ca2+ transport. Biochem. J., 406, 365-382 (2007)[PubMed]
- Cai, X., Lytton, J.: The cation/Ca2+ exchanger superfamily: phylogenetic analysis and structural implications. Mol. Biol. Evol., 21, 1692-1703 (2004)[PubMed]
- Liao, J., Li, H., Zeng, W. et al.: Structural insight into the ion-exchange mechanism of the sodium/calcium exchanger. Science, 335, 686-690 (2012)[PubMed]
- Waight, A. B., Pedersen, B. P., Schlessinger, A. et al.: Structural basis for alternating access of a eukaryotic calcium/proton exchanger. Nature, 499, 107-110 (2013)[PubMed]
著者プロフィール
略歴:東京大学理学系研究科 特任助教.
研究テーマ:膜タンパク質,とくに,イオン輸送体の結晶構造解析.
抱負:他人の机の上をガチャガチャのおもちゃで占領すること.
石谷 隆一郎(Ryuichiro Ishitani)
東京大学大学院理学系研究科 准教授.
濡木 理(Osamu Nureki)
東京大学大学院理学系研究科 教授.
研究室URL:http://www.nurekilab.net/
© 2013 西澤知宏・石谷隆一郎・濡木 理 Licensed under CC 表示 2.1 日本