ユビキチンリガーゼMITOLはMfn2を活性化してミトコンドリアと小胞体との接着を制御する
杉浦 歩・長島 駿・柳 茂
(東京薬科大学生命科学部 生命医科学科分子生化学研究室)
email:柳 茂
DOI: 10.7875/first.author.2013.078
MITOL regulates endoplasmic reticulum-mitochondria contacts via Mitofusin2.
Ayumu Sugiura, Shun Nagashima, Takeshi Tokuyama, Taku Amo, Yohei Matsuki, Satoshi Ishido, Yoshihisa Kudo, Heidi M. McBride, Toshifumi Fukuda, Nobuko Matsushita, Ryoko Inatome, Shigeru Yanagi
Molecular Cell, 51, 20-34 (2013)
エネルギーを産生するミトコンドリアは,タンパク質合成の場である小胞体と近接することにより,Ca2+の受け渡しや脂質代謝を効率よく行っている.ミトコンドリアの融合にかかわるタンパク質Mfn2は,ミトコンドリアと小胞体の両方に局在して互いに結合することによりミトコンドリアと小胞体との接着を仲介することが知られていたが,その制御機構は不明であった.筆者らは,ミトコンドリアに局在するユビキチンリガーゼMITOLがMfn2を活性化することにより,ミトコンドリアと小胞体との接着を促進することを明らかにした.MITOLの機能を抑制するとMfn2は不活性化しミトコンドリアと小胞体との接着に異常が生じ,小胞体からミトコンドリアへのシグナル伝達が正常にはたらかなくなることを示した.この研究が,Mfn2の変異により発症するCharcot-Marie-Tooth病をはじめ,さまざまな神経変性疾患の機序の解明への新たな糸口となることが期待される.
ミトコンドリアは生体においてエネルギーのほとんどをつくりだす細胞の発電所である.ミトコンドリアの形態は融合と分裂とのバランスにより制御されており,そのバランスがくずれるとミトコンドリアの機能は低下し,神経疾患などさまざまな疾患をひき起こすことが知られている.近年のイメージング解析技術の進歩により,ミトコンドリアの動的な移動や小胞体などほかのオルガネラとの会合および解離が見い出され,その生理的な重要性が注目されるようになってきた.
筆者らは,以前の研究において,ミトコンドリア外膜を4回貫通するユビキチンリガーゼMITOLを同定し,このMITOLがミトコンドリアの分裂にかかわるタンパク質Drp1の分解を促進することによりミトコンドリアの形態を制御することなどを報告した1-4).しかしながら,MITOLの役割にはいまだ不明な点が多く,実際に,MITOLの機能を抑制するとミトコンドリアの動きは止まり,小胞体との相互作用も阻害されることが観察されていた.その分子機構を解明するためMITOLの結合タンパク質を検索したところ,ミトコンドリア外膜に存在しミトコンドリアの融合にかかわるタンパク質Mitofusin2(Mfn2)が同定された.このMfn2は小胞体膜にも局在し,ミトコンドリア外膜に存在するMfn2と結合することによりミトコンドリアと小胞体とをつなぎとめている5,6).ミトコンドリアと小胞体とは可逆的に会合および解離をくり返しており,なかでも,ミトコンドリアと小胞体との接着部位は脂質の生合成や小胞体とミトコンドリアとのあいだのCa2+の受け渡しなどに重要な役割をはたしていることが知られている.今回,筆者らは,MITOLによるMfn2の活性制御機構とミトコンドリアと小胞体との接着部位の形成への影響について解析した.
MITOLがミトコンドリアと小胞体との接着部位にも局在していることがわかったことから,MITOLとMfn2との結合について解析したところ,MITOLは小胞体に局在するMfn2とではなく,ミトコンドリアに局在するMfn2と結合してこれをユビキチン化することがわかった.MITOLとMfn2との結合部位を詳細に調べた結果,MITOLのもつ基質認識ドメインであるC末端側の領域が,Mfn2のもつコイルドコイルドメインであるHR1ドメインを特異的に認識して結合していることがわかった.MITOLは小胞体ではなくミトコンドリアに局在するMfn2を特異的にポリユビキチン化するが,このとき,Lys48結合型ポリユビキチン鎖の形成によるプロテアソーム経路を介したMfn2の分解は誘導せず,Lys63結合型ポリユビキチン鎖を形成しミトコンドリアと小胞体との接着部位へのMfn2の局在に必要であることが示された.さらに,MITOLはMfn2のもつGTP結合能を上昇させ,Mfn2のGTPase活性に依存的な多量体化を誘導することが明らかになった.
RNAi法によりMITOLの発現を安定的にノックダウンしたHeLa細胞において,小胞体とミトコンドリアとの接着部位は有意に減少することが確かめられた.また,ヒスタミンによる刺激ののちミトコンドリアにおけるCa2+濃度の変化を観察したところ,MITOLノックダウン細胞では対照となる細胞に比べCa2+濃度の上昇が著しく抑制されることを見い出した.ミトコンドリアのCa2+取り込みに対する感受性は鈍いため,ミトコンドリアがCa2+を効率よく取り込むためには小胞体とミトコンドリアとで接着部位を形成することにより小胞体に近接する必要がある.したがって,MITOLノックダウン細胞ではMfn2が多量体化しないためミトコンドリアと小胞体との接着部位の形成不全が生じ,ミトコンドリアは小胞体からCa2+を効率よく取り込めなかったと考えられた.
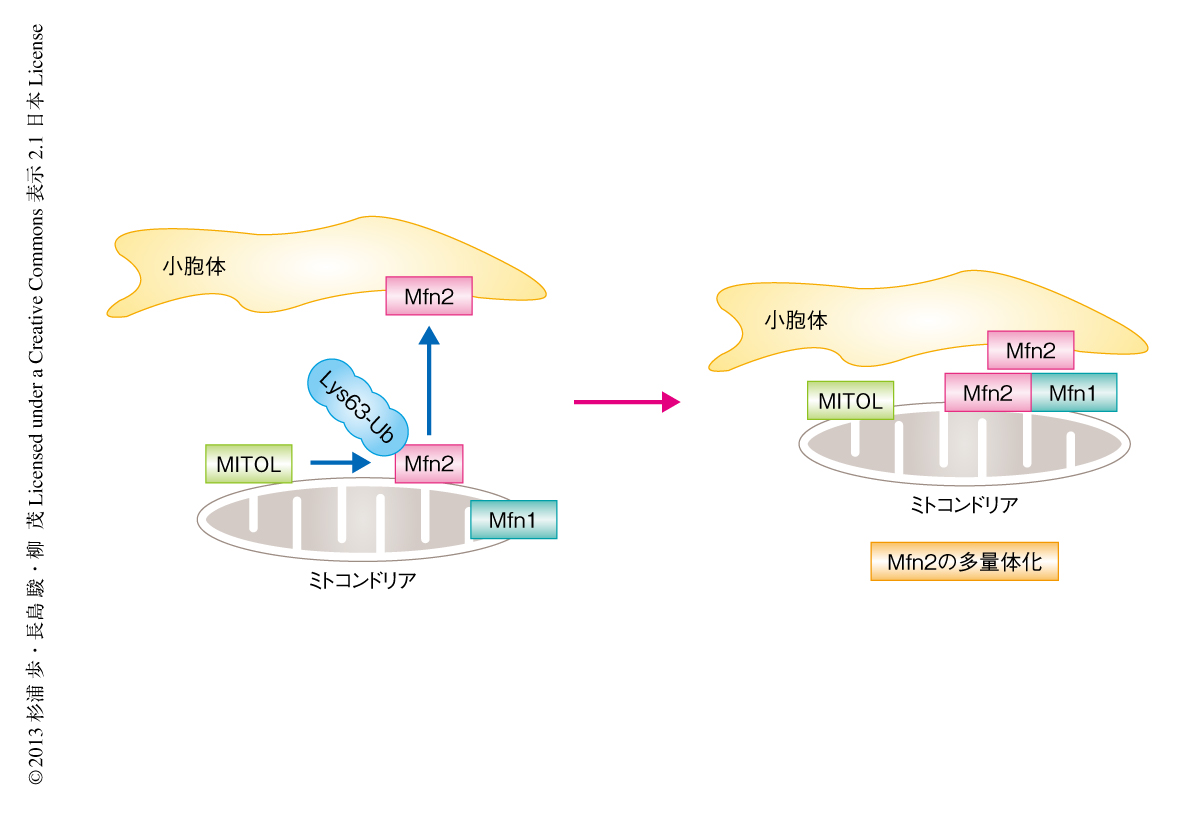
以上の結果から,MITOLによるMfn2の活性化を介した小胞体とミトコンドリアとの接着の制御という新たなモデルを提唱した(図1).MITOLはミトコンドリアに局在するMfn2と結合し,Mfn2のLys192を特異的にポリユビキチン化する.ポリユビキチン化されたMfn2はGTP結合能が上昇することにより活性化され,小胞体に局在するMfn2と結合しMfn2が多量体化することによりミトコンドリアと小胞体とが接着する.
Mfn2は,その遺伝子変異が神経難病であるCharcot-Marie-Tooth病の原因のひとつとなることから,機能制御機構の解明が期待されていた.この研究により,Mfn2の活性化の機構が明らかになり,Charcot-Marie-Tooth病の病態の解明と治療法の開発につながることが期待できる.さらに,ミトコンドリアと小胞体との接着部位は脂質の生合成やCa2+の受け渡しなど細胞機能において重要な役割をはたしており,この機能の破綻はアルツハイマー病をはじめさまざまな神経変性疾患に密接に関与していることがこれまで多く報告されている.この研究により,ミトコンドリアと小胞体との接着の機構の一端が解明されたことより,関連する多くの疾患の病態の理解と治療法の開発につながることが期待される.
略歴:2012年 東京薬科大学大学院生命科学研究科 修了,同年よりカナダMcGill大学ポスドク.
研究テーマ:ミトコンドリアから生じる小胞の放出の機構.
抱負:ミトコンドリアについて少しでも多くのことを知ることができたらと思っています.
長島 駿(Shun Nagashima)
略歴:2012年 東京薬科大学大学院生命科学研究科 修了,同年より東京薬科大学生命科学部 助教.
研究テーマ:神経発生におけるミトコンドリアの動態.
抱負:研究をとおして神経疾患の治療法の確立に貢献したい.
柳 茂(Shigeru Yanagi)
東京薬科大学生命科学部 教授.
研究室URL:http://logos.ls.toyaku.ac.jp/Life-Science/lmb-8/
© 2013 杉浦 歩・長島 駿・柳 茂 Licensed under CC 表示 2.1 日本
(東京薬科大学生命科学部 生命医科学科分子生化学研究室)
email:柳 茂
DOI: 10.7875/first.author.2013.078
MITOL regulates endoplasmic reticulum-mitochondria contacts via Mitofusin2.
Ayumu Sugiura, Shun Nagashima, Takeshi Tokuyama, Taku Amo, Yohei Matsuki, Satoshi Ishido, Yoshihisa Kudo, Heidi M. McBride, Toshifumi Fukuda, Nobuko Matsushita, Ryoko Inatome, Shigeru Yanagi
Molecular Cell, 51, 20-34 (2013)
要 約
エネルギーを産生するミトコンドリアは,タンパク質合成の場である小胞体と近接することにより,Ca2+の受け渡しや脂質代謝を効率よく行っている.ミトコンドリアの融合にかかわるタンパク質Mfn2は,ミトコンドリアと小胞体の両方に局在して互いに結合することによりミトコンドリアと小胞体との接着を仲介することが知られていたが,その制御機構は不明であった.筆者らは,ミトコンドリアに局在するユビキチンリガーゼMITOLがMfn2を活性化することにより,ミトコンドリアと小胞体との接着を促進することを明らかにした.MITOLの機能を抑制するとMfn2は不活性化しミトコンドリアと小胞体との接着に異常が生じ,小胞体からミトコンドリアへのシグナル伝達が正常にはたらかなくなることを示した.この研究が,Mfn2の変異により発症するCharcot-Marie-Tooth病をはじめ,さまざまな神経変性疾患の機序の解明への新たな糸口となることが期待される.
はじめに
ミトコンドリアは生体においてエネルギーのほとんどをつくりだす細胞の発電所である.ミトコンドリアの形態は融合と分裂とのバランスにより制御されており,そのバランスがくずれるとミトコンドリアの機能は低下し,神経疾患などさまざまな疾患をひき起こすことが知られている.近年のイメージング解析技術の進歩により,ミトコンドリアの動的な移動や小胞体などほかのオルガネラとの会合および解離が見い出され,その生理的な重要性が注目されるようになってきた.
筆者らは,以前の研究において,ミトコンドリア外膜を4回貫通するユビキチンリガーゼMITOLを同定し,このMITOLがミトコンドリアの分裂にかかわるタンパク質Drp1の分解を促進することによりミトコンドリアの形態を制御することなどを報告した1-4).しかしながら,MITOLの役割にはいまだ不明な点が多く,実際に,MITOLの機能を抑制するとミトコンドリアの動きは止まり,小胞体との相互作用も阻害されることが観察されていた.その分子機構を解明するためMITOLの結合タンパク質を検索したところ,ミトコンドリア外膜に存在しミトコンドリアの融合にかかわるタンパク質Mitofusin2(Mfn2)が同定された.このMfn2は小胞体膜にも局在し,ミトコンドリア外膜に存在するMfn2と結合することによりミトコンドリアと小胞体とをつなぎとめている5,6).ミトコンドリアと小胞体とは可逆的に会合および解離をくり返しており,なかでも,ミトコンドリアと小胞体との接着部位は脂質の生合成や小胞体とミトコンドリアとのあいだのCa2+の受け渡しなどに重要な役割をはたしていることが知られている.今回,筆者らは,MITOLによるMfn2の活性制御機構とミトコンドリアと小胞体との接着部位の形成への影響について解析した.
1.MITOLによるMfn2のユビキチン化と活性化
MITOLがミトコンドリアと小胞体との接着部位にも局在していることがわかったことから,MITOLとMfn2との結合について解析したところ,MITOLは小胞体に局在するMfn2とではなく,ミトコンドリアに局在するMfn2と結合してこれをユビキチン化することがわかった.MITOLとMfn2との結合部位を詳細に調べた結果,MITOLのもつ基質認識ドメインであるC末端側の領域が,Mfn2のもつコイルドコイルドメインであるHR1ドメインを特異的に認識して結合していることがわかった.MITOLは小胞体ではなくミトコンドリアに局在するMfn2を特異的にポリユビキチン化するが,このとき,Lys48結合型ポリユビキチン鎖の形成によるプロテアソーム経路を介したMfn2の分解は誘導せず,Lys63結合型ポリユビキチン鎖を形成しミトコンドリアと小胞体との接着部位へのMfn2の局在に必要であることが示された.さらに,MITOLはMfn2のもつGTP結合能を上昇させ,Mfn2のGTPase活性に依存的な多量体化を誘導することが明らかになった.
2.MITOLの機能抑制によるミトコンドリアと小胞体とのあいだの接着の抑制
RNAi法によりMITOLの発現を安定的にノックダウンしたHeLa細胞において,小胞体とミトコンドリアとの接着部位は有意に減少することが確かめられた.また,ヒスタミンによる刺激ののちミトコンドリアにおけるCa2+濃度の変化を観察したところ,MITOLノックダウン細胞では対照となる細胞に比べCa2+濃度の上昇が著しく抑制されることを見い出した.ミトコンドリアのCa2+取り込みに対する感受性は鈍いため,ミトコンドリアがCa2+を効率よく取り込むためには小胞体とミトコンドリアとで接着部位を形成することにより小胞体に近接する必要がある.したがって,MITOLノックダウン細胞ではMfn2が多量体化しないためミトコンドリアと小胞体との接着部位の形成不全が生じ,ミトコンドリアは小胞体からCa2+を効率よく取り込めなかったと考えられた.
3.MITOLによるMfn2の制御機構のモデル
以上の結果から,MITOLによるMfn2の活性化を介した小胞体とミトコンドリアとの接着の制御という新たなモデルを提唱した(図1).MITOLはミトコンドリアに局在するMfn2と結合し,Mfn2のLys192を特異的にポリユビキチン化する.ポリユビキチン化されたMfn2はGTP結合能が上昇することにより活性化され,小胞体に局在するMfn2と結合しMfn2が多量体化することによりミトコンドリアと小胞体とが接着する.
おわりに
Mfn2は,その遺伝子変異が神経難病であるCharcot-Marie-Tooth病の原因のひとつとなることから,機能制御機構の解明が期待されていた.この研究により,Mfn2の活性化の機構が明らかになり,Charcot-Marie-Tooth病の病態の解明と治療法の開発につながることが期待できる.さらに,ミトコンドリアと小胞体との接着部位は脂質の生合成やCa2+の受け渡しなど細胞機能において重要な役割をはたしており,この機能の破綻はアルツハイマー病をはじめさまざまな神経変性疾患に密接に関与していることがこれまで多く報告されている.この研究により,ミトコンドリアと小胞体との接着の機構の一端が解明されたことより,関連する多くの疾患の病態の理解と治療法の開発につながることが期待される.
文 献
- Yonashiro, R., Ishido, S., Kyo, S. et al.: A novel mitochondrial ubiquitin ligase plays a critical role in mitochondrial dynamics. EMBO J., 25, 3618-3626 (2006)[PubMed]
- Yonashiro, R., Sugiura, A., Miyachi, M. et al.: Mitochondrial ubiquitin ligase MITOL ubiquitinates mutant SOD1 and attenuates mutant SOD1-induced ROS generation. Mol. Biol. Cell, 20, 4254-4530 (2009)[PubMed]
- Sugiura, A., Yonashiro, R., Fukuda, T. et al.: A mitochondrial ubiquitin ligase MITOL controls cell toxicity of polyglutamine-expanded protein. Mitochondrion, 11, 139-146 (2011)[PubMed]
- Yonashiro, R., Kimijima, Y., Shimura, T. et al.: Mitochondrial ubiquitin ligase MITOL blocks S-nitrosylated MAP1B-light chain 1-mediated mitochondrial dysfunction and neuronal cell death. Proc. Natl. Acad. Sci. USA, 109, 2382-2387 (2012)[PubMed]
- Merkwirth, C. & Langer, T.: Mitofusin 2 builds a bridge between ER and mitochondria. Cell, 135, 1165-1167 (2008)[PubMed]
- de Brito, O. M. & Scorrano, L.: Mitofusin 2 tethers endoplasmic reticulum to mitochondria. Nature, 456, 605-610 (2008)[PubMed]
著者プロフィール
略歴:2012年 東京薬科大学大学院生命科学研究科 修了,同年よりカナダMcGill大学ポスドク.
研究テーマ:ミトコンドリアから生じる小胞の放出の機構.
抱負:ミトコンドリアについて少しでも多くのことを知ることができたらと思っています.
長島 駿(Shun Nagashima)
略歴:2012年 東京薬科大学大学院生命科学研究科 修了,同年より東京薬科大学生命科学部 助教.
研究テーマ:神経発生におけるミトコンドリアの動態.
抱負:研究をとおして神経疾患の治療法の確立に貢献したい.
柳 茂(Shigeru Yanagi)
東京薬科大学生命科学部 教授.
研究室URL:http://logos.ls.toyaku.ac.jp/Life-Science/lmb-8/
© 2013 杉浦 歩・長島 駿・柳 茂 Licensed under CC 表示 2.1 日本