Regnase-1はMalt1により切断されT細胞の活性化を制御する
植畑拓也・審良静男
(大阪大学免疫学フロンティア研究センター 自然免疫学研究室)
email:植畑拓也,審良静男
DOI: 10.7875/first.author.2013.076
Malt1-induced cleavage of Regnase-1 in CD4+ helper T cells regulates immune activation.
Takuya Uehata, Hidenori Iwasaki, Alexis Vandenbon, Kazufumi Matsushita, Eduardo Hernandez-Cuellar, Kanako Kuniyoshi, Takashi Satoh, Takashi Mino, Yutaka Suzuki, Daron M. Standley, Tohru Tsujimura, Hiromi Rakugi, Yoshitaka Isaka, Osamu Takeuchi, Shizuo Akira
Cell, 153, 1036-1049 (2013)
Regnase-1はインターロイキン6やインターロイキン12 p40などをコードするmRNAを不安定化するヌクレアーゼである.Regnase-1ノックアウトマウスにはT細胞の活性化や形質細胞の蓄積,高グロブリン血症などを特徴とする激しい炎症が認められるが,その病態の発症機構は明らかではない.筆者らは,Regnase-1ノックアウトマウスにおける病態はT細胞によりひき起こされることを示した.さらに,T細胞においてRegnase-1は多くの遺伝子の発現を制御していたが,転写因子c-RelはNF-κBファミリーのなかでRegnase-1の標的となる唯一のメンバーであり,Regnase-1ノックアウトマウスの病態に部分的に関与していることがわかった.注目すべきことに,T細胞においてRegnase-1は恒常的に発現しており,刺激に依存して111番目のアルギニン残基においてプロテアーゼであるMalt1により切断されることを見い出した.さらに,このようなMalt1によるRegnase-1の切断を介しmRNAの安定性が制御されていることが示された.以上より,T細胞においてRegnase-1の発現量を変化させることは,T細胞の活性化を制御するうえで重要であることが示された.
免疫において機能する細胞において,転写後制御は転写制御とともに重要な遺伝子発現の制御機構である1).とくに,mRNAの安定性の制御は転写後制御の主要な分子機構のひとつであり,炎症を迅速に誘導あるいは収束させるため必要なステップである2).
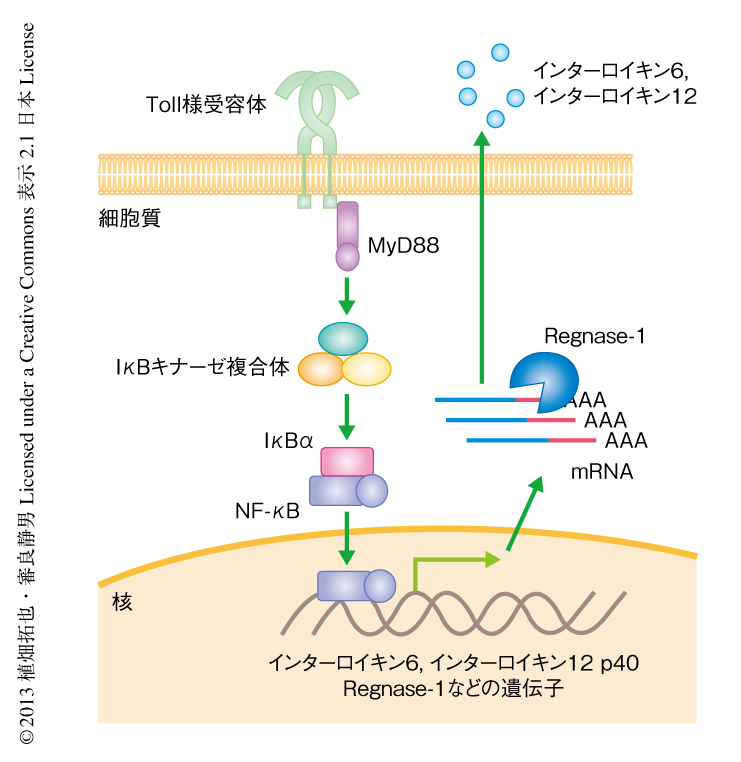
以前に,筆者らは,マクロファージにおいてリポ多糖の刺激により早期に誘導される遺伝子産物のなかからCCCH型のジンクフィンガードメインをもつZc3h12aを同定した3).さらに,このZc3h12aはジンクフィンガードメインのN末端側にPIN様ドメインをもつヌクレアーゼであることを明らかにしてRegnase-1と命名した.Regnase-1はToll様受容体への刺激により誘導されるインターロイキン6やインターロイキン12p40をコードするmRNAを不安定化し,それらの転写後制御に関与していると考えられている(図1).Regnase-1のノックアウトマウスは12週齢までにほとんどが死にいたる.さらに,著明な脾腫やリンパ節の腫大を認め,リンパ球の異常な活性化を呈しており,血中には自己抗体も観察されることから自己免疫疾患に類似した疾患を発症していると思われるが,その病態の分子機構は十分には解明されていない.
これまでに筆者らは,マクロファージにおいてRegnase-1の標的となるRNAとして,インターロイキン6やインターロイキン12 p40といった炎症性サイトカインをコードするmRNAを同定している.このことから,Regnase-1ノックアウトマウスにおいては,これらのサイトカインの異常な産生が病態に関与している可能性が考えられた.そこで,Regnase-1とこれらサイトカインとのダブルノックアウトマウスを作製したところ,インターロイキン6とのダブルノックアウトマウスおよびインターロイキン12 p40とのダブルノックアウトマウスには,依然としてエフェクターT細胞あるいはメモリーT細胞,あるいは,形質細胞の蓄積が認められた.このことから,インターロイキン6やインターロイキン12 p40といったサイトカインはRegnase-1ノックアウトマウスにおける病態において重要ではないと考えられた.
そこで,どの細胞が病態において重要であるかを検討するため,T細胞に特異的なRegnase-1のノックアウトマウスを作製した.このノックアウトマウスは17週齢までにほとんどが死にいたり,著明な脾腫やリンパ節の腫大が認められた.さらに,T細胞はほとんどエフェクターT細胞あるいはメモリーT細胞に分化しており,形質細胞の蓄積や抗核抗体などもRegnase-1ノックアウトマウスと同様に観察された.野生型マウスあるいはT細胞特異的Regnase-1ノックアウトマウスに由来するCD4陽性T細胞を,部分的にγ線を照射した野生型マウスに移入したところ,Regnase-1を欠損したT細胞を移入したマウスでは脾臓は腫大し,T細胞およびB細胞はT細胞特異的Regnase-1ノックアウトマウスと同様に活性化することがわかった.これらの結果より,Regnase-1はT細胞において自己免疫疾患の発症を抑制するために重要な役割をはたしていることが示された.
T細胞特異的Regnase-1ノックアウトマウスにおいては生後まもなくT細胞の活性化が認められ,その大部分がエフェクターT細胞あるいはメモリーT細胞となりナイーブT細胞はほとんど認められなかった.Regnase-1を欠損したT細胞の活性化に抗原の刺激が関与しているかどうかを検討するため,オボアルブミンを特異的に認識するT細胞受容体をもつT細胞特異的Regnase-1ノックアウトマウスを作製した.注目すべきことに,このノックアウトマウスではオボアルブミンを特異的に認識するCD4陽性T細胞のうち70~80%がナイーブT細胞であった.さらに,野生型マウスあるいはオボアルブミンを特異的に認識するT細胞受容体をもつT細胞特異的Regnase-1ノックアウトマウスから得られたCD4陽性のナイーブT細胞をin vitroにおいて刺激すると,Regnase-1を欠損したナイーブT細胞は野生型のナイーブT細胞と比較して著明な増殖応答を示し,インターフェロンγ,インターロイキン4,インターロイキン17といったサイトカインを多く産生した.in vivoにおける免疫応答を検討するため,さきと同様に得たCD4陽性のナイーブT細胞を野生型マウスへと移入しオボアルブミンにより免疫したところ,Regnase-1を欠損したナイーブT細胞は野生型のナイーブT細胞と比較して3~6倍も増殖した.さらに,オボアルブミンに対する2次応答について検討するため,免疫ののち5日目の時点でT細胞を移入したマウスから脾臓の細胞を回収し,オボアルブミンの部分ペプチドにより刺激したところ,Regnase-1を欠損したナイーブT細胞を移入したマウスの脾臓の細胞では,野生型のナイーブT細胞を移入したマウスと比較して,増殖応答やインターフェロンγの産生が亢進していた.以上の結果から,Regnase-1を欠損したCD4陽性T細胞の活性化には抗原の刺激が重要であることが示唆された.
これまでのT細胞の活性化には,どのようなタンパク質がかかわっているのだろうか.野生型マウスあるいはT細胞特異的Regnase-1ノックアウトマウスに由来するCD4陽性T細胞において,遺伝子の発現を網羅的に検討した.その結果,Regnase-1を欠損したT細胞では野生型のT細胞と比較して,非常に数多くの遺伝子において高い発現の差が認められたが,これらのうちT細胞の活性化と関連の深いものとしては,OX40,TNFR2,ICOS,CD40Lやインターロイキン2受容体αといった表面抗原をコードする遺伝子や,インターロイキン2やインターロイキン6といったサイトカインをコードする遺伝子があった.さらに,NF-κBファミリーの転写因子としては,RelAではなくc-Relをコードする遺伝子が高く発現していることがわかった.
これまでに,Regnase-1は3’側非翻訳領域を介してmRNAを分解することが知られている4).そこで,ルシフェラーゼの遺伝子の下流にmRNAの3’側非翻訳領域を挿入した発現ベクターを作製し,ルシフェラーゼアッセイによりRegnase-1による影響を検討した.その結果,表面抗原ではOX40,TNFR2,ICOS,CD44などのmRNAが,また,サイトカインではインターロイキン2やインターロイキン1βなどのmRNAが,Regnase-1により分解されることがわかった.さらに,転写因子ではc-RelのmRNAがRegnase-1により強く影響をうける一方,そのほかのNF-κBファミリーのメンバーにはRegnase-1による影響は認められなかった.
そこで,Regnase-1を欠損したCD4陽性T細胞において高発現である遺伝子のなかにはRegnase-1による直接的な制御をうけていないものもあったことから,Regnase-1により発現の制御される転写因子がT細胞の活性化をさらに増幅させていると仮定した.c-RelはT細胞の活性化にとり重要な転写因子であり,自己免疫疾患との関連も指摘されている5,6).c-RelがRegnase-1ノックアウトマウスにおいてどのように病態に関与しているのかを検討するため,c-RelとRegnase-1とのダブルノックアウトマウスを作製した.その結果,Regnase-1単独のノックアウトマウスと比較して,このダブルノックアウトマウスではナイーブT細胞からエフェクターT細胞あるいはメモリーT細胞への分化が減少し,形質細胞の蓄積もまた改善していた.したがって,c-RelはRegnase-1ノックアウトマウスの病態を部分的に説明しうるタンパク質であることが示唆された.
これまでの結果から,Regnase-1はT細胞の活性化を抑制する重要なタンパク質であることが示されたが,Regnase-1はT細胞においてどのように制御されているのだろうか.これまでに筆者らは,マクロファージにおいてRegnase-1はToll様受容体への刺激に依存してIκBキナーゼ複合体によりリン酸化をうけ,プロテアソームにおいて分解されることを示している7).一方,T細胞においても,T細胞受容体への刺激によりIκBキナーゼ複合体が活性化されることが知られている8).そこで,野生型マウスから得られたCD4陽性T細胞を抗CD3/CD28抗体やPMA/Ionomycinなどにより刺激しRegnase-1の変化を確認したところ,Regnase-1は刺激よりまえに恒常的に発現しており,刺激ののちその発現量は減少することがわかった.さらに,この減少はプロテアソーム阻害剤により抑制されなかったことから,Regnase-1はマクロファージとは異なる分子機構により分解されていることが示唆された.
刺激ののちのRegnase-1の分解を注意深く観察したところ,刺激ののちRegnase-1の切断断片と考えられるバンドの出現が認められた.そこで,これまでにT細胞受容体の下流においてパラカスパーゼ活性の存在が指摘されているMalt1に注目した9,10).Malt1を欠損したCD4陽性T細胞に対し,さきと同様に刺激したところ,興味深いことに,Regnase-1の分解はまったく起こらなかった.また,Malt1のパラカスパーゼ活性を特異的に阻害する阻害剤を用いて野生型のCD4陽性T細胞を刺激したところ,Regnase-1の分解は部分的に阻害された.つづいて,Regnase-1の切断部位の同定を試みた.Malt1はアルギニン残基に特異的なプロテアーゼであり,切断断片のサイズから予想されたアルギニン残基をアラニン残基に1塩基置換したRegnase-1の変異体を作製してMalt1により切断されるかどうか検討したところ,111番目のアルギニン残基が切断部位であることが判明した.実際に,Arg111をAlaに置換した変異Regnase-1をT細胞に発現させPMA/Ionomycinにより刺激すると,野生型のRegnase-1は分解されたがこの変異Regnase-1は分解をうけなかった.これらの結果より,Regnase-1はT細胞受容体への刺激に依存してMalt1のもつパラカスパーゼ活性を介し,111番目のアルギニン残基において切断されることがわかった.
このような現象により,Malt1がmRNAの安定性の制御に関与しているかどうかを検討した.野生型のCD4陽性T細胞をMalt1の阻害剤により処理しPMA/Ionomycinにて刺激したのち,転写を阻害するアクチノマイシンDを添加してそののちのRNAの量を評価した.その結果,Malt1阻害剤により処理したT細胞では野生型のT細胞と比較して,c-RelのmRNAなどRegnase-1の標的の分解が速いことが示された.この結果から,Malt1はRegnase-1の切断を介してmRNAの安定性を制御していることが示唆された(図2).
この研究において,Regnase-1はT細胞の活性化を抑制する重要なタンパク質であることが示された.T細胞におけるRegnase-1の欠損により自己免疫疾患が自然発症するが,外来の抗原であるオボアルブミンを特異的に認識するT細胞は大部分がナイーブT細胞であったことから,T細胞特異的Regnase-1ノックアウトマウスにおいてT細胞は内在性の抗原を認識して活性化している可能性が考えられた.このことは,自己応答性のT細胞が自己抗原を認識して発症する自己免疫疾患の病態を考えるうえでたいへんに興味深い.さらに,これまでMalt1は転写因子NF-κBの活性化において重要と考えられていたが,Regnase-1の分解を介してmRNAの安定性を制御することにより転写後制御にも関与していることが明らかになった.T細胞におけるRegnase-1の発現量の変化はT細胞の活性化に大きく影響をあたえたことから,新規のアジュバンドの開発などにも貢献することが考えられる.
略歴:2013年 大阪大学大学院医学系研究科博士課程 修了.
研究テーマ:免疫において機能する細胞の転写後制御を介した活性化の分子機構.
抱負:自己免疫疾患の治療法の開発に貢献したい.
審良 静男(Shizuo Akira)
大阪大学免疫学フロンティア研究センター 教授.
研究室URL:http://hostdefense.ifrec.osaka-u.ac.jp/ja/index.html
© 2013 植畑拓也・審良静男 Licensed under CC 表示 2.1 日本
(大阪大学免疫学フロンティア研究センター 自然免疫学研究室)
email:植畑拓也,審良静男
DOI: 10.7875/first.author.2013.076
Malt1-induced cleavage of Regnase-1 in CD4+ helper T cells regulates immune activation.
Takuya Uehata, Hidenori Iwasaki, Alexis Vandenbon, Kazufumi Matsushita, Eduardo Hernandez-Cuellar, Kanako Kuniyoshi, Takashi Satoh, Takashi Mino, Yutaka Suzuki, Daron M. Standley, Tohru Tsujimura, Hiromi Rakugi, Yoshitaka Isaka, Osamu Takeuchi, Shizuo Akira
Cell, 153, 1036-1049 (2013)
要 約
Regnase-1はインターロイキン6やインターロイキン12 p40などをコードするmRNAを不安定化するヌクレアーゼである.Regnase-1ノックアウトマウスにはT細胞の活性化や形質細胞の蓄積,高グロブリン血症などを特徴とする激しい炎症が認められるが,その病態の発症機構は明らかではない.筆者らは,Regnase-1ノックアウトマウスにおける病態はT細胞によりひき起こされることを示した.さらに,T細胞においてRegnase-1は多くの遺伝子の発現を制御していたが,転写因子c-RelはNF-κBファミリーのなかでRegnase-1の標的となる唯一のメンバーであり,Regnase-1ノックアウトマウスの病態に部分的に関与していることがわかった.注目すべきことに,T細胞においてRegnase-1は恒常的に発現しており,刺激に依存して111番目のアルギニン残基においてプロテアーゼであるMalt1により切断されることを見い出した.さらに,このようなMalt1によるRegnase-1の切断を介しmRNAの安定性が制御されていることが示された.以上より,T細胞においてRegnase-1の発現量を変化させることは,T細胞の活性化を制御するうえで重要であることが示された.
はじめに
免疫において機能する細胞において,転写後制御は転写制御とともに重要な遺伝子発現の制御機構である1).とくに,mRNAの安定性の制御は転写後制御の主要な分子機構のひとつであり,炎症を迅速に誘導あるいは収束させるため必要なステップである2).
以前に,筆者らは,マクロファージにおいてリポ多糖の刺激により早期に誘導される遺伝子産物のなかからCCCH型のジンクフィンガードメインをもつZc3h12aを同定した3).さらに,このZc3h12aはジンクフィンガードメインのN末端側にPIN様ドメインをもつヌクレアーゼであることを明らかにしてRegnase-1と命名した.Regnase-1はToll様受容体への刺激により誘導されるインターロイキン6やインターロイキン12p40をコードするmRNAを不安定化し,それらの転写後制御に関与していると考えられている(図1).Regnase-1のノックアウトマウスは12週齢までにほとんどが死にいたる.さらに,著明な脾腫やリンパ節の腫大を認め,リンパ球の異常な活性化を呈しており,血中には自己抗体も観察されることから自己免疫疾患に類似した疾患を発症していると思われるが,その病態の分子機構は十分には解明されていない.
1.T細胞におけるRegnase-1の欠損は自己免疫疾患をひき起こす
これまでに筆者らは,マクロファージにおいてRegnase-1の標的となるRNAとして,インターロイキン6やインターロイキン12 p40といった炎症性サイトカインをコードするmRNAを同定している.このことから,Regnase-1ノックアウトマウスにおいては,これらのサイトカインの異常な産生が病態に関与している可能性が考えられた.そこで,Regnase-1とこれらサイトカインとのダブルノックアウトマウスを作製したところ,インターロイキン6とのダブルノックアウトマウスおよびインターロイキン12 p40とのダブルノックアウトマウスには,依然としてエフェクターT細胞あるいはメモリーT細胞,あるいは,形質細胞の蓄積が認められた.このことから,インターロイキン6やインターロイキン12 p40といったサイトカインはRegnase-1ノックアウトマウスにおける病態において重要ではないと考えられた.
そこで,どの細胞が病態において重要であるかを検討するため,T細胞に特異的なRegnase-1のノックアウトマウスを作製した.このノックアウトマウスは17週齢までにほとんどが死にいたり,著明な脾腫やリンパ節の腫大が認められた.さらに,T細胞はほとんどエフェクターT細胞あるいはメモリーT細胞に分化しており,形質細胞の蓄積や抗核抗体などもRegnase-1ノックアウトマウスと同様に観察された.野生型マウスあるいはT細胞特異的Regnase-1ノックアウトマウスに由来するCD4陽性T細胞を,部分的にγ線を照射した野生型マウスに移入したところ,Regnase-1を欠損したT細胞を移入したマウスでは脾臓は腫大し,T細胞およびB細胞はT細胞特異的Regnase-1ノックアウトマウスと同様に活性化することがわかった.これらの結果より,Regnase-1はT細胞において自己免疫疾患の発症を抑制するために重要な役割をはたしていることが示された.
2.Regnase-1を欠損したT細胞の活性化には抗原の刺激が必要である
T細胞特異的Regnase-1ノックアウトマウスにおいては生後まもなくT細胞の活性化が認められ,その大部分がエフェクターT細胞あるいはメモリーT細胞となりナイーブT細胞はほとんど認められなかった.Regnase-1を欠損したT細胞の活性化に抗原の刺激が関与しているかどうかを検討するため,オボアルブミンを特異的に認識するT細胞受容体をもつT細胞特異的Regnase-1ノックアウトマウスを作製した.注目すべきことに,このノックアウトマウスではオボアルブミンを特異的に認識するCD4陽性T細胞のうち70~80%がナイーブT細胞であった.さらに,野生型マウスあるいはオボアルブミンを特異的に認識するT細胞受容体をもつT細胞特異的Regnase-1ノックアウトマウスから得られたCD4陽性のナイーブT細胞をin vitroにおいて刺激すると,Regnase-1を欠損したナイーブT細胞は野生型のナイーブT細胞と比較して著明な増殖応答を示し,インターフェロンγ,インターロイキン4,インターロイキン17といったサイトカインを多く産生した.in vivoにおける免疫応答を検討するため,さきと同様に得たCD4陽性のナイーブT細胞を野生型マウスへと移入しオボアルブミンにより免疫したところ,Regnase-1を欠損したナイーブT細胞は野生型のナイーブT細胞と比較して3~6倍も増殖した.さらに,オボアルブミンに対する2次応答について検討するため,免疫ののち5日目の時点でT細胞を移入したマウスから脾臓の細胞を回収し,オボアルブミンの部分ペプチドにより刺激したところ,Regnase-1を欠損したナイーブT細胞を移入したマウスの脾臓の細胞では,野生型のナイーブT細胞を移入したマウスと比較して,増殖応答やインターフェロンγの産生が亢進していた.以上の結果から,Regnase-1を欠損したCD4陽性T細胞の活性化には抗原の刺激が重要であることが示唆された.
3.転写因子c-RelはRegnase-1の標的として自己免疫疾患の病態に関与する
これまでのT細胞の活性化には,どのようなタンパク質がかかわっているのだろうか.野生型マウスあるいはT細胞特異的Regnase-1ノックアウトマウスに由来するCD4陽性T細胞において,遺伝子の発現を網羅的に検討した.その結果,Regnase-1を欠損したT細胞では野生型のT細胞と比較して,非常に数多くの遺伝子において高い発現の差が認められたが,これらのうちT細胞の活性化と関連の深いものとしては,OX40,TNFR2,ICOS,CD40Lやインターロイキン2受容体αといった表面抗原をコードする遺伝子や,インターロイキン2やインターロイキン6といったサイトカインをコードする遺伝子があった.さらに,NF-κBファミリーの転写因子としては,RelAではなくc-Relをコードする遺伝子が高く発現していることがわかった.
これまでに,Regnase-1は3’側非翻訳領域を介してmRNAを分解することが知られている4).そこで,ルシフェラーゼの遺伝子の下流にmRNAの3’側非翻訳領域を挿入した発現ベクターを作製し,ルシフェラーゼアッセイによりRegnase-1による影響を検討した.その結果,表面抗原ではOX40,TNFR2,ICOS,CD44などのmRNAが,また,サイトカインではインターロイキン2やインターロイキン1βなどのmRNAが,Regnase-1により分解されることがわかった.さらに,転写因子ではc-RelのmRNAがRegnase-1により強く影響をうける一方,そのほかのNF-κBファミリーのメンバーにはRegnase-1による影響は認められなかった.
そこで,Regnase-1を欠損したCD4陽性T細胞において高発現である遺伝子のなかにはRegnase-1による直接的な制御をうけていないものもあったことから,Regnase-1により発現の制御される転写因子がT細胞の活性化をさらに増幅させていると仮定した.c-RelはT細胞の活性化にとり重要な転写因子であり,自己免疫疾患との関連も指摘されている5,6).c-RelがRegnase-1ノックアウトマウスにおいてどのように病態に関与しているのかを検討するため,c-RelとRegnase-1とのダブルノックアウトマウスを作製した.その結果,Regnase-1単独のノックアウトマウスと比較して,このダブルノックアウトマウスではナイーブT細胞からエフェクターT細胞あるいはメモリーT細胞への分化が減少し,形質細胞の蓄積もまた改善していた.したがって,c-RelはRegnase-1ノックアウトマウスの病態を部分的に説明しうるタンパク質であることが示唆された.
4.T細胞においてMalt1はRegnase-1を切断することによりmRNAの安定性を制御する
これまでの結果から,Regnase-1はT細胞の活性化を抑制する重要なタンパク質であることが示されたが,Regnase-1はT細胞においてどのように制御されているのだろうか.これまでに筆者らは,マクロファージにおいてRegnase-1はToll様受容体への刺激に依存してIκBキナーゼ複合体によりリン酸化をうけ,プロテアソームにおいて分解されることを示している7).一方,T細胞においても,T細胞受容体への刺激によりIκBキナーゼ複合体が活性化されることが知られている8).そこで,野生型マウスから得られたCD4陽性T細胞を抗CD3/CD28抗体やPMA/Ionomycinなどにより刺激しRegnase-1の変化を確認したところ,Regnase-1は刺激よりまえに恒常的に発現しており,刺激ののちその発現量は減少することがわかった.さらに,この減少はプロテアソーム阻害剤により抑制されなかったことから,Regnase-1はマクロファージとは異なる分子機構により分解されていることが示唆された.
刺激ののちのRegnase-1の分解を注意深く観察したところ,刺激ののちRegnase-1の切断断片と考えられるバンドの出現が認められた.そこで,これまでにT細胞受容体の下流においてパラカスパーゼ活性の存在が指摘されているMalt1に注目した9,10).Malt1を欠損したCD4陽性T細胞に対し,さきと同様に刺激したところ,興味深いことに,Regnase-1の分解はまったく起こらなかった.また,Malt1のパラカスパーゼ活性を特異的に阻害する阻害剤を用いて野生型のCD4陽性T細胞を刺激したところ,Regnase-1の分解は部分的に阻害された.つづいて,Regnase-1の切断部位の同定を試みた.Malt1はアルギニン残基に特異的なプロテアーゼであり,切断断片のサイズから予想されたアルギニン残基をアラニン残基に1塩基置換したRegnase-1の変異体を作製してMalt1により切断されるかどうか検討したところ,111番目のアルギニン残基が切断部位であることが判明した.実際に,Arg111をAlaに置換した変異Regnase-1をT細胞に発現させPMA/Ionomycinにより刺激すると,野生型のRegnase-1は分解されたがこの変異Regnase-1は分解をうけなかった.これらの結果より,Regnase-1はT細胞受容体への刺激に依存してMalt1のもつパラカスパーゼ活性を介し,111番目のアルギニン残基において切断されることがわかった.
このような現象により,Malt1がmRNAの安定性の制御に関与しているかどうかを検討した.野生型のCD4陽性T細胞をMalt1の阻害剤により処理しPMA/Ionomycinにて刺激したのち,転写を阻害するアクチノマイシンDを添加してそののちのRNAの量を評価した.その結果,Malt1阻害剤により処理したT細胞では野生型のT細胞と比較して,c-RelのmRNAなどRegnase-1の標的の分解が速いことが示された.この結果から,Malt1はRegnase-1の切断を介してmRNAの安定性を制御していることが示唆された(図2).
おわりに
この研究において,Regnase-1はT細胞の活性化を抑制する重要なタンパク質であることが示された.T細胞におけるRegnase-1の欠損により自己免疫疾患が自然発症するが,外来の抗原であるオボアルブミンを特異的に認識するT細胞は大部分がナイーブT細胞であったことから,T細胞特異的Regnase-1ノックアウトマウスにおいてT細胞は内在性の抗原を認識して活性化している可能性が考えられた.このことは,自己応答性のT細胞が自己抗原を認識して発症する自己免疫疾患の病態を考えるうえでたいへんに興味深い.さらに,これまでMalt1は転写因子NF-κBの活性化において重要と考えられていたが,Regnase-1の分解を介してmRNAの安定性を制御することにより転写後制御にも関与していることが明らかになった.T細胞におけるRegnase-1の発現量の変化はT細胞の活性化に大きく影響をあたえたことから,新規のアジュバンドの開発などにも貢献することが考えられる.
文 献
- Anderson, P.: Post-transcriptional regulons coordinate the initiation and resolution of inflammation. Nat. Rev. Immunol., 10, 24-35 (2010)[PubMed]
- Hao, S. & Baltimore, D.: The stability of mRNA influences the temporal order of the induction of genes encoding inflammatory molecules. Nat. Immunol., 10, 281-288 (2009)[PubMed]
- Matsushita, K., Takeuchi, O., Standley, D. M.: et al.: Zc3h12a is an RNase essential for controlling immune responses by regulating mRNA decay. Nature, 458, 1185-1190 (2009)[PubMed]
- Uehata, T. & Akira, S.: mRNA degradation by the endoribonuclease Regnase-1/ZC3H12a/MCPIP-1. Biochim. Biophys. Acta, 1829, 708-713 (2013)[PubMed]
- Hilliard, B. A., Mason, N., Xu, L. et al.: Critical roles of c-Rel in autoimmune inflammation and helper T cell differentiation. J. Clin. Invest., 110, 843-850 (2002)[PubMed]
- Visekruna, A., Volkov, A. & Steinhoff, U.: A key role for NF-κB transcription factor c-Rel in T-lymphocyte-differentiation and effector functions. Clin. Dev. Immunol., 2012, 239368 (2012)[PubMed]
- Iwasaki, H., Takeuchi, O., Teraguchi, S. et al.: The IκB kinase complex regulates the stability of cytokine-encoding mRNA induced by TLR-IL-1R by controlling degradation of regnase-1. Nat. Immunol., 12, 1167-1175 (2011)[PubMed] [新着論文レビュー]
- Vallabhapurapu, S. & Karin, M.: Regulation and function of NF-κB transcription factors in the immune system. Annu. Rev. Immunol., 27, 693-733 (2009)[PubMed]
- Thome, M.: Multifunctional roles for MALT1 in T-cell activation. Nat. Rev. Immunol., 8, 495-500 (2008)[PubMed]
- McAllister-Lucas, L. M. & Lucas, P. C.: Finally, MALT1 is a protease! Nat. Immunol., 9, 231-233 (2008)[PubMed]
著者プロフィール
略歴:2013年 大阪大学大学院医学系研究科博士課程 修了.
研究テーマ:免疫において機能する細胞の転写後制御を介した活性化の分子機構.
抱負:自己免疫疾患の治療法の開発に貢献したい.
審良 静男(Shizuo Akira)
大阪大学免疫学フロンティア研究センター 教授.
研究室URL:http://hostdefense.ifrec.osaka-u.ac.jp/ja/index.html
© 2013 植畑拓也・審良静男 Licensed under CC 表示 2.1 日本