クロマチン制御タンパク質Pygopus2によるWntシグナル伝達経路とNotchシグナル伝達経路とのクロストークの制御を介した乳腺幹細胞の分化の抑制
渡邉和秀・Xing Dai
(米国California大学Irvine校School of Medicine,Department of Biological Chemistry)
email:渡邉和秀
DOI: 10.7875/first.author.2013.072
Chromatin effector Pygo2 mediates Wnt-Notch crosstalk to suppress luminal/alveolar potential of mammary stem and basal cells.
Bingnan Gu, Kazuhide Watanabe, Peng Sun, Magid Fallahi, Xing Dai
Cell Stem Cell, 13, 48-61 (2013)
乳腺幹細胞の分化におけるエピジェネティックな制御に関しては未解明の部分が多々ある.筆者らは,Wntシグナル伝達系における核内活性化タンパク質であると同時に,ヒストンメチル化の認識および制御にもかかわるPygopus2が,乳腺幹細胞および乳腺基底上皮細胞の管上皮細胞への分化を抑制することを明らかにした.組織特異的なPygopus2ノックアウトマウスの乳腺幹細胞および乳腺基底上皮細胞は,Notchシグナル伝達系の活性化など管上皮細胞により近い遺伝子の発現様式を示し,乳腺幹細胞の機能の指標である移植ののちの乳腺の再形成能の低下がみられた.一方,Wntシグナル伝達系の活性化はPygopus2に依存的なNotchシグナル伝達系の抑制により,乳腺幹細胞および乳腺基底上皮細胞の管上皮細胞への分化を抑制した.Pygopus2は乳腺幹細胞および乳腺基底上皮細胞においてNotch3の発現を直接的に制御し,Notch3遺伝子座へのβカテニンの結合,および,活性型および抑制型のヒストンメチル化修飾を同時にもつクロマチン構造を保つのに必要とされた.このように,Pygopus2はクロマチンの修飾制御をとおしてWntシグナル伝達経路とNotchシグナル伝達経路とを連結し,乳腺幹細胞および乳腺基底上皮細胞の管上皮細胞への分化を制限していると考えられた.
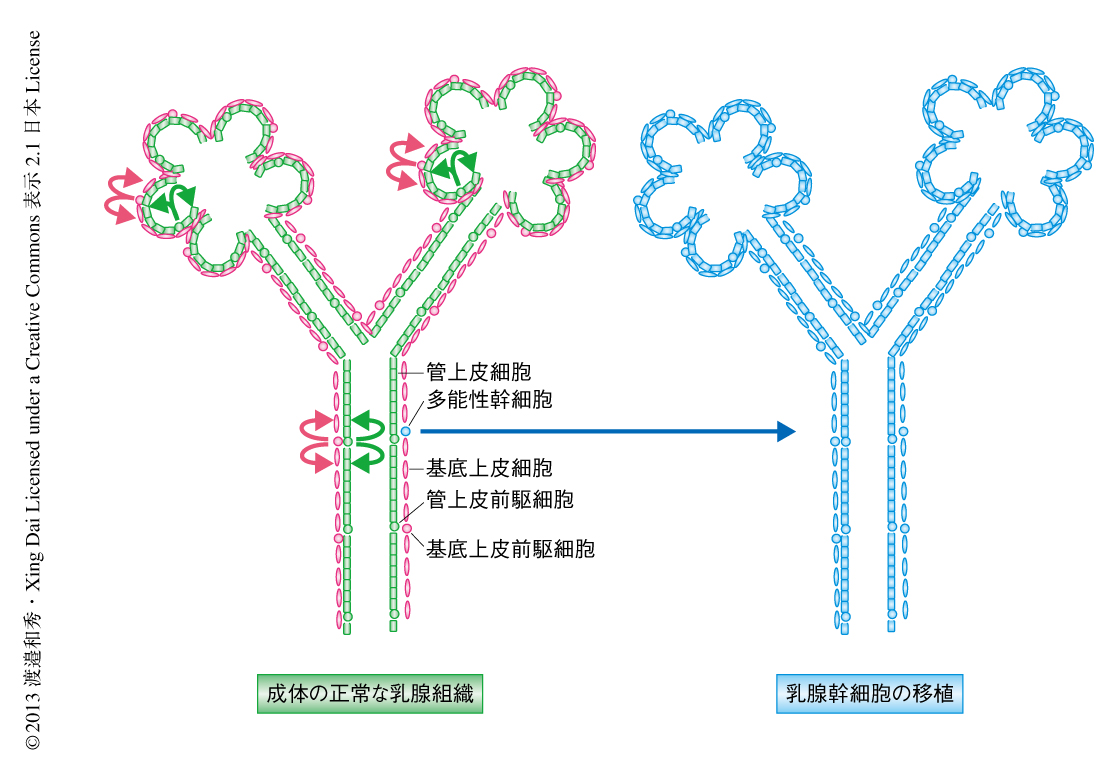
成体組織における幹細胞の分化の制御機構の解明は,再生医療の発展の基礎となるとともに,細胞の多様性を示すがんの形成を理解するうえでも重要である.マウスの乳腺は生後,とくに思春期および妊娠期において,ダイナミックな形態変化を示す特異な上皮組織であり,成体における組織幹細胞の研究に最適なモデルのひとつである.乳腺上皮は基底上皮細胞系および管上皮細胞系の2つの分化系列よりなり,多分化能をもつ幹細胞は基底上皮細胞系の一部として存在すると考えられている1).実際,蛍光セルソーター(FACS)を用いた表面マーカーによる分離により,基底上皮細胞系のなかに単一の細胞から基底上皮細胞および管上皮細胞へと分化し機能的な乳腺組織を形成することのできる多能性幹細胞(双能性幹細胞)がより多く含まれるとの報告がある2,3).これまで,多能性幹細胞が乳腺組織の維持を担うモデルが提唱されてきたが1),近年の遺伝的な細胞系譜追跡の手法を用いた解析では,このような多分化能は生後直後までの発生の過程を除く成体の乳腺組織では検出されず,基底上皮細胞系および管上皮細胞系それぞれにコミットした前駆細胞により乳腺組織が維持されていることが判明した4).すなわち,移植などの特殊な条件においては幹細胞の多分化能が顕著にみられるのに対し,生理的な条件ではその多分化能は抑制され,その結果,乳腺組織は単一の分化能しか示さない基底上皮細胞系および管上皮細胞系それぞれの前駆細胞のみで維持されていると考えられる(図1).細胞分化にはエピジェネティックな制御が深くかかわっているが,この幹細胞および前駆細胞の分化能がどのような分子機構により制御されているのかはほとんど解明されていない.
Pygopusファミリーは,元来,Wntシグナル伝達系における核内活性化タンパク質として同定されたが,のちに,筆者らの研究室などにより,ヒストンのメチル化修飾部位に特異的に結合し,また,ヒストンメチル化酵素と結合してヒストンのメチル化を促す,いわば,クロマチン修飾の“読み込み”および“書き込み”を同時に行うタンパク質であることが明らかになった5,6).Pygopus2(Pygo2)は哺乳動物において機能的により重要なメンバーであり,その全身性のノックアウトマウスは胎生致死である7).以前に,筆者らの研究室は,Pygo2の皮膚および乳腺に特異的なノックアウトマウスを用いた研究により,Pygo2がクロマチンの修飾制御をとおして乳腺幹細胞および乳腺前駆細胞の維持に重要な役割をはたしていることをつきとめた6).しかし,Pygo2が乳腺幹細胞の維持と分化の制御においてどのような分子機構によりかかわっているのか,その詳細は不明であった.Wntシグナル伝達系が乳腺幹細胞の自己増殖に重要であることは知られており8),また,Notchシグナル伝達系が乳腺幹細胞の自己増殖を制限し,管上皮細胞への分化を促す機能をもつことも報告されている9).今回,筆者らは,Pygo2がクロマチンの修飾制御によるWntシグナル伝達経路とNotchシグナル伝達経路とのクロストークの制御を介して,乳腺幹細胞および乳腺基底上皮細胞の管上皮細胞への分化に対し抑制的にはたらいていることを明らかにした.
まず,皮膚および乳腺に特異的なPygo2ノックアウトマウスの乳腺組織における,幹細胞および基底上皮細胞と管上皮細胞との比率に着目した.細胞表面マーカーを用いたFACS解析および免疫染色による組織学的な解析により,皮膚および乳腺に特異的なPygo2ノックアウトマウスの乳腺では,野生型マウスの乳腺に比べ,幹細胞および基底上皮細胞と管上皮細胞との比が,管上皮細胞の側に有意なかたよりを示すことが明らかになった.より機能的な見解を得るため,FACSにより分離した幹細胞および基底上皮細胞と管上皮細胞のマトリゲル3次元培養を行った.このアッセイでは,幹細胞および基底上皮細胞に由来する分枝したコロニー,および,管上皮細胞に由来する内腔をもつコロニーを,形態学的に容易に分類することできる.皮膚および乳腺に特異的なPygo2ノックアウトマウスの乳腺に由来する幹細胞および基底上皮細胞は,野生型マウスに比べ,より多くの管上皮細胞系のコロニーを形成することが示された.さらに,FACSにより分離した幹細胞および基底上皮細胞について,マイクロアレイを用いた遺伝子発現解析により,皮膚および乳腺に特異的なPygo2ノックアウトマウスの乳腺に由来する幹細胞および基底上皮細胞は,野生型マウスに比べ,管上皮細胞により近い遺伝子発現パターンを示すことが判明した.また,皮膚および乳腺に特異的なPygo2ノックアウトマウスの乳腺に由来する幹細胞および基底上皮細胞は,乳腺幹細胞の機能の指標である移植ののちの乳腺の再形成能が低下していた.以上のことから,Pygo2は乳腺幹細胞および乳腺基底上皮細胞の管上皮細胞への分化を抑制していると考えられた.
マイクロアレイ解析において発現変化のみられた遺伝子のうち,Notchシグナル伝達系に関連する遺伝子に注目した.さきに述べたように,Notchシグナル伝達系は管上皮細胞への分化の誘導に重要であることが知られている9).FACSにより分離した幹細胞および基底上皮細胞と管上皮細胞を定量的RT-PCR法により解析したところ,皮膚および乳腺に特異的なPygo2ノックアウトマウスの乳腺に由来する幹細胞および基底上皮細胞において,Notch1~Notch4の4つのNotch,および,Notchの標的となる遺伝子の発現が上昇していた.さらに,FACS解析により,細胞膜におけるNotch3の発現が有意に変化していることも判明した.Notchシグナル伝達系の機能的な関与について調べるため,γセクレターゼの阻害剤であるDAPT,および,Cbf1のノックダウンにより,Notchシグナル伝達系の活性化の抑制を試みた.FACSにより分離した幹細胞および基底上皮細胞におけるNotchシグナル伝達系の抑制は,マトリゲル3次元培養においてPygo2の欠損による管上皮細胞系のコロニーの形成を抑制し,また,移植実験において乳腺の分枝の形成を促進した.これらより,Pygo2の欠損による乳腺幹細胞および乳腺基底上皮細胞の管上皮細胞への分化は,Notchシグナル伝達系の活性化を必要とすると考えられた.
Wntシグナル伝達系の関与を調べるため,GSK3の阻害剤であるBIOによるWntシグナル伝達系の活性化を試みた.BIOにより処理した幹細胞および基底上皮細胞では,マトリゲル3次元培養においてPygo2の欠損による管上皮細胞系のコロニーの形成が抑制され,それにともなう成熟した管上皮細胞のマーカーの誘導も抑制された.Wntシグナル伝達系の活性化は,対照となる幹細胞および基底上皮細胞においてNotchの発現を抑制したが,Pygo2を欠損した幹細胞および基底上皮細胞ではその抑制は検出されず,Wntシグナル伝達系はPygo2に依存的にNotchシグナル伝達系の活性化を抑制することが明らかになった.さらに,クロマチン免疫沈降法により,Wntシグナル伝達系において核における転写活性制御を担うβカテニンとPygo2はNotch3遺伝子座の発現制御領域に結合するが,このβカテニンの結合はPygo2に依存的であることが証明された.さらに興味深いことに,Pygo2の発現は幹細胞および基底上皮細胞において,Notch3遺伝子座が活性型および抑制型のヒストンメチル化修飾を同時にもつ,いわゆる2価の(bivalentな)クロマチン状態を保つのに必要であることが判明した.
今回の筆者らの研究は,Pygo2が乳腺幹細胞および乳腺基底上皮細胞の運命決定機構において,エピジェネティックな制御の門番的な役割をはたしていることを解明した.とくに,Wntシグナル伝達系によるPygo2に依存的なヒストンメチル化修飾の制御を介したNotchシグナル伝達系の活性の制御機構(図2)は,乳腺上皮細胞の2つの細胞系列の分化および維持に重要なWntシグナル伝達経路とNotchシグナル伝達経路とのクロストークにおける分子機構として重要であった.細胞の運命決定機構の異常は多くのがんにおいて検出されており,がんの発生および進展の機序を理解するうえで重要である.事実,筆者らは,Pygo2の欠損がMMTV-Wnt1マウス乳がんモデルにおける腫瘍幹細胞の分化能を抑制し,腫瘍の発生を低下させることを報告している10).今後,新たながん治療法の解明が期待される.
略歴:2005年 東北大学大学院医学研究科にて博士号取得,同年 米国NIH National Cancer Institute研究員,2009年 米国California大学Irvine校School of Medicine研究員を経て,2010年より同Project scientist.
研究テーマ:発生の過程およびがんにおける上皮組織細胞の運命決定機構の分子機序.
関心事:研究,ロッククライミング.
Xing Dai
米国California大学Irvine校School of MedicineにてProfessor.
研究室URL:http://mfallahi.biochem.uci.edu/
© 2013 渡邉和秀・Xing Dai Licensed under CC 表示 2.1 日本
(米国California大学Irvine校School of Medicine,Department of Biological Chemistry)
email:渡邉和秀
DOI: 10.7875/first.author.2013.072
Chromatin effector Pygo2 mediates Wnt-Notch crosstalk to suppress luminal/alveolar potential of mammary stem and basal cells.
Bingnan Gu, Kazuhide Watanabe, Peng Sun, Magid Fallahi, Xing Dai
Cell Stem Cell, 13, 48-61 (2013)
要 約
乳腺幹細胞の分化におけるエピジェネティックな制御に関しては未解明の部分が多々ある.筆者らは,Wntシグナル伝達系における核内活性化タンパク質であると同時に,ヒストンメチル化の認識および制御にもかかわるPygopus2が,乳腺幹細胞および乳腺基底上皮細胞の管上皮細胞への分化を抑制することを明らかにした.組織特異的なPygopus2ノックアウトマウスの乳腺幹細胞および乳腺基底上皮細胞は,Notchシグナル伝達系の活性化など管上皮細胞により近い遺伝子の発現様式を示し,乳腺幹細胞の機能の指標である移植ののちの乳腺の再形成能の低下がみられた.一方,Wntシグナル伝達系の活性化はPygopus2に依存的なNotchシグナル伝達系の抑制により,乳腺幹細胞および乳腺基底上皮細胞の管上皮細胞への分化を抑制した.Pygopus2は乳腺幹細胞および乳腺基底上皮細胞においてNotch3の発現を直接的に制御し,Notch3遺伝子座へのβカテニンの結合,および,活性型および抑制型のヒストンメチル化修飾を同時にもつクロマチン構造を保つのに必要とされた.このように,Pygopus2はクロマチンの修飾制御をとおしてWntシグナル伝達経路とNotchシグナル伝達経路とを連結し,乳腺幹細胞および乳腺基底上皮細胞の管上皮細胞への分化を制限していると考えられた.
はじめに
成体組織における幹細胞の分化の制御機構の解明は,再生医療の発展の基礎となるとともに,細胞の多様性を示すがんの形成を理解するうえでも重要である.マウスの乳腺は生後,とくに思春期および妊娠期において,ダイナミックな形態変化を示す特異な上皮組織であり,成体における組織幹細胞の研究に最適なモデルのひとつである.乳腺上皮は基底上皮細胞系および管上皮細胞系の2つの分化系列よりなり,多分化能をもつ幹細胞は基底上皮細胞系の一部として存在すると考えられている1).実際,蛍光セルソーター(FACS)を用いた表面マーカーによる分離により,基底上皮細胞系のなかに単一の細胞から基底上皮細胞および管上皮細胞へと分化し機能的な乳腺組織を形成することのできる多能性幹細胞(双能性幹細胞)がより多く含まれるとの報告がある2,3).これまで,多能性幹細胞が乳腺組織の維持を担うモデルが提唱されてきたが1),近年の遺伝的な細胞系譜追跡の手法を用いた解析では,このような多分化能は生後直後までの発生の過程を除く成体の乳腺組織では検出されず,基底上皮細胞系および管上皮細胞系それぞれにコミットした前駆細胞により乳腺組織が維持されていることが判明した4).すなわち,移植などの特殊な条件においては幹細胞の多分化能が顕著にみられるのに対し,生理的な条件ではその多分化能は抑制され,その結果,乳腺組織は単一の分化能しか示さない基底上皮細胞系および管上皮細胞系それぞれの前駆細胞のみで維持されていると考えられる(図1).細胞分化にはエピジェネティックな制御が深くかかわっているが,この幹細胞および前駆細胞の分化能がどのような分子機構により制御されているのかはほとんど解明されていない.
Pygopusファミリーは,元来,Wntシグナル伝達系における核内活性化タンパク質として同定されたが,のちに,筆者らの研究室などにより,ヒストンのメチル化修飾部位に特異的に結合し,また,ヒストンメチル化酵素と結合してヒストンのメチル化を促す,いわば,クロマチン修飾の“読み込み”および“書き込み”を同時に行うタンパク質であることが明らかになった5,6).Pygopus2(Pygo2)は哺乳動物において機能的により重要なメンバーであり,その全身性のノックアウトマウスは胎生致死である7).以前に,筆者らの研究室は,Pygo2の皮膚および乳腺に特異的なノックアウトマウスを用いた研究により,Pygo2がクロマチンの修飾制御をとおして乳腺幹細胞および乳腺前駆細胞の維持に重要な役割をはたしていることをつきとめた6).しかし,Pygo2が乳腺幹細胞の維持と分化の制御においてどのような分子機構によりかかわっているのか,その詳細は不明であった.Wntシグナル伝達系が乳腺幹細胞の自己増殖に重要であることは知られており8),また,Notchシグナル伝達系が乳腺幹細胞の自己増殖を制限し,管上皮細胞への分化を促す機能をもつことも報告されている9).今回,筆者らは,Pygo2がクロマチンの修飾制御によるWntシグナル伝達経路とNotchシグナル伝達経路とのクロストークの制御を介して,乳腺幹細胞および乳腺基底上皮細胞の管上皮細胞への分化に対し抑制的にはたらいていることを明らかにした.
1.Pygopus2の欠損により乳腺幹細胞および乳腺基底上皮細胞の管上皮細胞への分化は促進される
まず,皮膚および乳腺に特異的なPygo2ノックアウトマウスの乳腺組織における,幹細胞および基底上皮細胞と管上皮細胞との比率に着目した.細胞表面マーカーを用いたFACS解析および免疫染色による組織学的な解析により,皮膚および乳腺に特異的なPygo2ノックアウトマウスの乳腺では,野生型マウスの乳腺に比べ,幹細胞および基底上皮細胞と管上皮細胞との比が,管上皮細胞の側に有意なかたよりを示すことが明らかになった.より機能的な見解を得るため,FACSにより分離した幹細胞および基底上皮細胞と管上皮細胞のマトリゲル3次元培養を行った.このアッセイでは,幹細胞および基底上皮細胞に由来する分枝したコロニー,および,管上皮細胞に由来する内腔をもつコロニーを,形態学的に容易に分類することできる.皮膚および乳腺に特異的なPygo2ノックアウトマウスの乳腺に由来する幹細胞および基底上皮細胞は,野生型マウスに比べ,より多くの管上皮細胞系のコロニーを形成することが示された.さらに,FACSにより分離した幹細胞および基底上皮細胞について,マイクロアレイを用いた遺伝子発現解析により,皮膚および乳腺に特異的なPygo2ノックアウトマウスの乳腺に由来する幹細胞および基底上皮細胞は,野生型マウスに比べ,管上皮細胞により近い遺伝子発現パターンを示すことが判明した.また,皮膚および乳腺に特異的なPygo2ノックアウトマウスの乳腺に由来する幹細胞および基底上皮細胞は,乳腺幹細胞の機能の指標である移植ののちの乳腺の再形成能が低下していた.以上のことから,Pygo2は乳腺幹細胞および乳腺基底上皮細胞の管上皮細胞への分化を抑制していると考えられた.
2.Pygopus2の欠損による乳腺幹細胞および乳腺基底上皮細胞の管上皮細胞への分化はNotchシグナル伝達系の活性化を必要とする
マイクロアレイ解析において発現変化のみられた遺伝子のうち,Notchシグナル伝達系に関連する遺伝子に注目した.さきに述べたように,Notchシグナル伝達系は管上皮細胞への分化の誘導に重要であることが知られている9).FACSにより分離した幹細胞および基底上皮細胞と管上皮細胞を定量的RT-PCR法により解析したところ,皮膚および乳腺に特異的なPygo2ノックアウトマウスの乳腺に由来する幹細胞および基底上皮細胞において,Notch1~Notch4の4つのNotch,および,Notchの標的となる遺伝子の発現が上昇していた.さらに,FACS解析により,細胞膜におけるNotch3の発現が有意に変化していることも判明した.Notchシグナル伝達系の機能的な関与について調べるため,γセクレターゼの阻害剤であるDAPT,および,Cbf1のノックダウンにより,Notchシグナル伝達系の活性化の抑制を試みた.FACSにより分離した幹細胞および基底上皮細胞におけるNotchシグナル伝達系の抑制は,マトリゲル3次元培養においてPygo2の欠損による管上皮細胞系のコロニーの形成を抑制し,また,移植実験において乳腺の分枝の形成を促進した.これらより,Pygo2の欠損による乳腺幹細胞および乳腺基底上皮細胞の管上皮細胞への分化は,Notchシグナル伝達系の活性化を必要とすると考えられた.
3.Pygopus2はWntシグナル伝達系を制御して乳腺幹細胞および乳腺基底上皮細胞の管上皮細胞への分化およびNotchシグナル伝達系の活性化を抑制する
Wntシグナル伝達系の関与を調べるため,GSK3の阻害剤であるBIOによるWntシグナル伝達系の活性化を試みた.BIOにより処理した幹細胞および基底上皮細胞では,マトリゲル3次元培養においてPygo2の欠損による管上皮細胞系のコロニーの形成が抑制され,それにともなう成熟した管上皮細胞のマーカーの誘導も抑制された.Wntシグナル伝達系の活性化は,対照となる幹細胞および基底上皮細胞においてNotchの発現を抑制したが,Pygo2を欠損した幹細胞および基底上皮細胞ではその抑制は検出されず,Wntシグナル伝達系はPygo2に依存的にNotchシグナル伝達系の活性化を抑制することが明らかになった.さらに,クロマチン免疫沈降法により,Wntシグナル伝達系において核における転写活性制御を担うβカテニンとPygo2はNotch3遺伝子座の発現制御領域に結合するが,このβカテニンの結合はPygo2に依存的であることが証明された.さらに興味深いことに,Pygo2の発現は幹細胞および基底上皮細胞において,Notch3遺伝子座が活性型および抑制型のヒストンメチル化修飾を同時にもつ,いわゆる2価の(bivalentな)クロマチン状態を保つのに必要であることが判明した.
おわりに
今回の筆者らの研究は,Pygo2が乳腺幹細胞および乳腺基底上皮細胞の運命決定機構において,エピジェネティックな制御の門番的な役割をはたしていることを解明した.とくに,Wntシグナル伝達系によるPygo2に依存的なヒストンメチル化修飾の制御を介したNotchシグナル伝達系の活性の制御機構(図2)は,乳腺上皮細胞の2つの細胞系列の分化および維持に重要なWntシグナル伝達経路とNotchシグナル伝達経路とのクロストークにおける分子機構として重要であった.細胞の運命決定機構の異常は多くのがんにおいて検出されており,がんの発生および進展の機序を理解するうえで重要である.事実,筆者らは,Pygo2の欠損がMMTV-Wnt1マウス乳がんモデルにおける腫瘍幹細胞の分化能を抑制し,腫瘍の発生を低下させることを報告している10).今後,新たながん治療法の解明が期待される.
文 献
- Visvader, J. E.: Keeping abreast of the mammary epithelial hierarchy and breast tumorigenesis. Genes Dev., 23, 2563-2577 (2009)[PubMed]
- Shackleton, M., Vaillant, F., Simpson, K. J. et al.: Generation of a functional mammary gland from a single stem cell. Nature, 439, 84-88 (2006)[PubMed]
- Stingl, J., Eirew, P., Ricketson, I. et al.: Purification and unique properties of mammary epithelial stem cells. Nature, 439, 993-997 (2006)[PubMed]
- Van Keymeulen, A., Rocha, A. S., Ousset, M. et al.: Distinct stem cells contribute to mammary gland development and maintenance. Nature, 479, 189-193 (2011)[PubMed]
- Fiedler, M., Sanchez-Barrena, M. J., Nekrasov, M. et al.: Decoding of methylated histone H3 tail by the Pygo-BCL9 Wnt signaling complex. Mol. Cell, 30, 507-518 (2008)[PubMed]
- Gu, B., Sun, P., Yuan, Y. et al.: Pygo2 expands mammary progenitor cells by facilitating histone H3 K4 methylation. J. Cell Biol., 185, 811-826 (2009)[PubMed]
- Jessen, S., Gu, B. & Dai, X.: Pygopus and the Wnt signaling pathway: a diverse set of connections. Bioessays, 30, 448-456 (2008)[PubMed]
- Zeng, Y. A. & Nusse, R.: Wnt proteins are self-renewal factors for mammary stem cells and promote their long-term expansion in culture. Cell Stem Cell, 6, 568-577 (2010)[PubMed]
- Bouras, T., Pal, B., Vaillant, F. et al.: Notch signaling regulates mammary stem cell function and luminal cell-fate commitment. Cell Stem Cell, 3, 429-441 (2008)[PubMed]
- Watanabe, K., Fallahi, M. & Dai, X.: Chromatin effector Pygo2 regulates mammary tumor initiation and heterogeneity in MMTV-Wnt1 mice. Oncogene, 33, 632-642 (2014)[PubMed]
著者プロフィール
略歴:2005年 東北大学大学院医学研究科にて博士号取得,同年 米国NIH National Cancer Institute研究員,2009年 米国California大学Irvine校School of Medicine研究員を経て,2010年より同Project scientist.
研究テーマ:発生の過程およびがんにおける上皮組織細胞の運命決定機構の分子機序.
関心事:研究,ロッククライミング.
Xing Dai
米国California大学Irvine校School of MedicineにてProfessor.
研究室URL:http://mfallahi.biochem.uci.edu/
© 2013 渡邉和秀・Xing Dai Licensed under CC 表示 2.1 日本