赤痢菌はエフェクタータンパク質OspC3によりカスパーゼ4の活性を阻害することで炎症性細胞死による排除を回避し上皮細胞への定着を促す
小林泰良・笹川千尋
(東京大学医科学研究所 感染症国際研究センター細菌学分野)
email:小林泰良,笹川千尋
DOI: 10.7875/first.author.2013.071
The Shigella OspC3 effector inhibits caspase-4, antagonizes inflammatory cell death, and promotes epithelial infection.
Taira Kobayashi, Michinaga Ogawa, Takahito Sanada, Hitomi Mimuro, Minsoo Kim, Hiroshi Ashida, Reiko Akakura, Mitsutaka Yoshida, Magdalena Kawalec, Jean-Marc Reichhart, Tsunehiro Mizushima, Chihiro Sasakawa
Cell Host & Microbe, 13, 570-583 (2013)
病原体の感染やがんなどにより個体全体へと障害が及ぶとき,多細胞生物の細胞はカスパーゼとよばれる一群のプロテアーゼにより制御されたプログラム細胞死を選択するが,その分子機構に関してはいまだ不明な点が多い.筆者らは,赤痢菌をはじめサルモネラ菌や腸管病原性大腸菌が上皮細胞に感染すると,宿主細胞に生体防御反応としてカスパーゼ4に依存的な細胞死が誘導されることを発見した.また,興味深いことに,赤痢菌はカスパーゼ4を特異的に阻害するエフェクタータンパク質OspC3を分泌し,カスパーゼ4の成熟化の抑制および成熟型カスパーゼ4の活性ポケットへの拮抗作用によりその活性を阻害することを明らかにした.また,ospC3遺伝子を欠損した赤痢菌を上皮細胞へ感染させるとカスパーゼ4に依存的な炎症性細胞死が惹起され,感染した細胞が排除されることを細胞および動物個体のレベルにおいて明らかにした.この研究は,腸管の粘膜における病原細菌の排除の機構,および,病原細菌のもつ宿主の防御機構を回避する戦術の一端を明らかにし,細菌感染の解明や治療薬の開発に寄与するものである.
赤痢菌(Shigella flexneri)は細菌性赤痢の起因細菌であり,経口的にヒトに取り込まれたのち腸管上皮細胞へと侵入し,細胞内運動および増殖により感染を成立させる.その過程がとどこおりなく遂行されるためには,病原性プラスミドにコードされた病原タンパク質である“エフェクター”が重要な役割を担う1).エフェクタータンパク質はグラム陰性の病原細菌に特有のIII型分泌機構に依存して分泌され,宿主細胞のタンパク質の機能を制御または阻害することにより,細菌の細胞への侵入や細胞内運動などの感染現象を積極的に誘導する.これらのエフェクタータンパク質による細菌の感染戦略のひとつに,上皮細胞における感染の足場の確保という概念があり,細胞死の抑制もこの概念のもとその存在が報告されているが,現在まで,それに関与するエフェクタータンパク質の報告はない2,3).このような状況をかんがみて,赤痢菌における細胞死抑制エフェクタータンパク質を同定し,その作用機序を明らかにすることを研究の目的とした.
一方,感染における病原体の排除に関与する細胞死は,ネクローシス,アポトーシス,パイロプトーシスという3つの型に分類することができる4).アポトーシスおよびパイロプトーシス(pyroptosis)はシステインプロテアーゼであるカスパーゼファミリータンパク質により制御されるプログラム細胞死であり,多細胞生物における計画的な自殺である5).なかでも,パイロプトーシスは炎症性サイトカインの活性化をともなう炎症性の細胞死で,おもに炎症性カスパーゼのひとつであるカスパーゼ1に依存した現象として血球系細胞において研究が進められている6).この研究では,エフェクタータンパク質OspC3がカスパーゼファミリーのなかでも炎症性カスパーゼのひとつであるカスパーゼ4を特異的に阻害することを明らかにするとともに,カスパーゼ4に依存的な細胞死の特徴の一端を明らかにした.
細胞死を抑制する赤痢菌のエフェクタータンパク質を探索するため,病原プラスミドに存在するエフェクター遺伝子をそれぞれ欠損した赤痢菌変異株を作製し,上皮細胞に感染させたのち,細胞から漏出したハウスキーピング酵素ラクトースデヒドロゲナーゼを定量するLDHアッセイにその細胞上清を供して細胞傷害性を調べた.その結果,ospC3欠損変異株に感染した細胞では,感染ののち2~4時間という短時間で,野生株およびほかの変異株と比較して著しく細胞が傷害されることを見い出した.この細胞傷害は腸管に由来する細胞株や初代培養腸管上皮細胞といったヒトの上皮組織に由来する細胞への感染においても広く観察され,実際に,赤痢菌の感染部位である腸管上皮において惹起することが考えられた.そこで,感染細胞の形態的な特徴を観察したところ,ospC3欠損変異株の感染においてはネクローシスで観察されるような細胞膜が破綻した細胞が観察された.以上の結果,OspC3は赤痢菌の感染に依存的に生じる細胞死を抑制するエフェクタータンパク質であることが示唆された.
エフェクタータンパク質OspC3の機能を解析するうえで,まず,ospC3欠損変異株が感染した上皮細胞において生じる細胞死の特徴を解析した.その結果,ospC3欠損変異株の感染細胞では核の断片化(TUNEL陽性),および,膜の破綻(PI陽性)の生じる細胞の割合が顕著に上昇し,炎症性サイトカインであるインターロイキン18の活性化および細胞外への分泌がみられた.一方で,感染細胞の傷害性はカスパーゼファミリーのうち炎症性カスパーゼであるカスパーゼ1,カスパーゼ4,カスパーゼ5の活性を特異的に阻害する阻害剤を用いることにより抑制された.さらに,透過型電子顕微鏡を用いてospC3欠損変異株に感染した細胞を観察したところ,膜の破綻と核の委縮が同時に進行する感染像がみられた.以上の結果,ospC3欠損変異株が感染した上皮細胞ではパイロプトーシス様の特徴をもつ細胞死が誘導されることが明らかになった.
細胞死を抑制するエフェクタータンパク質OspC3の機能が赤痢菌の感染を促進する役割を担うことを検証するため,野生株およびospC3欠損変異株が感染した細胞における生菌の数を比較した.その結果,ospC3欠損変異株に感染した細胞では野生株に比べ生菌数が減少したが,カスパーゼ阻害剤の添加により野生株の感染と同じ程度まで生菌数は回復した.そこで,ospC3欠損変異株の感染においては細胞死により感染の足場を失っていると仮定し,モルモットを用いた動物感染モデル実験において腸管組織に感染した赤痢菌の数を定量した.その結果,ospC3欠損変異株の感染した組織では野生株に比べ細胞内に定着した生菌の数が減少した.ospC3欠損変異株が感染したモルモットは肛門から出血が生じるとともに,腸管の粘膜固有層が破壊され,浮腫や血球の浸潤が認められた.また,組織の切片をTUNELアッセイにより観察した結果,核の断片化が生じていたことから,細胞死による組織の破壊が考えられた.以上の結果,OspC3は赤痢菌が感染した細胞において生じる細胞死を抑制することにより,細菌が増殖する足場を維持し感染の拡大に寄与するエフェクタータンパク質であることが示唆された.
エフェクタータンパク質OspC3による細胞死の抑制の標的を同定するため,OspC3が結合する宿主のタンパク質を探索した.文献を参考に,パイロプトーシスへの関与が報告されるタンパク質,または,カスパーゼ1からカスパーゼ10までのヒトのカスパーゼファミリーのOspC3に対する結合を確認した結果,炎症性カスパーゼのひとつであるカスパーゼ4がOspC3と特異的に結合することが示唆された.カスパーゼ4はその全長がCARD,p19,p10に限定分解されたのち,p19およびp10からなる四量体が成熟型カスパーゼ4となりシステインプロテアーゼとして機能する7).赤痢菌に感染した細胞では感染から1時間以内に全長のカスパーゼ4が消失したことから,限定分解が生じていることが考えられた.そこで,赤痢菌の感染による細胞ストレスによりカスパーゼ4の活性化が生じ,その結果としてパイロプトーシスが惹起されると仮定し,カスパーゼ4をノックダウンした上皮細胞に赤痢菌を感染させた結果,ospC3欠損変異株を感染した細胞において惹起されるはずのパイロプトーシスが抑制された.一方,パイロプトーシスとの関与が多く報告されているカスパーゼ1をノックダウンした細胞ではパイロプトーシスの惹起に影響はみられなかったことから,この研究において明らかにされた細胞死は,カスパーゼ4に依存した新しい分子機構による細胞死であることが示唆された.
野生型の赤痢菌に感染した細胞でもカスパーゼ4の限定分解が観察されたことから,OspC3は成熟型カスパーゼ4に直接的に作用することが考えられた.そこで,精製した成熟型カスパーゼ4に精製したOspC3を添加し,蛍光プローブを用いてカスパーゼ4の活性を測定した結果,OspC3の存在下においてカスパーゼ4の活性は阻害された.また,カスパーゼ4のp19およびp10を細胞に強制的に発現させて細胞死を誘導する系を構築し,この系にOspC3を同時に発現させたところ,細胞死はOspC3依存的に抑制された.以上の結果,OspC3は成熟型カスパーゼ4を直接的に阻害することが示唆された.おのおのの精製タンパク質を用いて結合実験を行ったところ,OspC3はカスパーゼ4のp19と特異的に結合しp19とp10とのあいだの結合を阻害することを見い出した.したがって,エフェクタータンパク質OspC3はカスパーゼ4への特異的な結合を利用し,成熟型カスパーゼ4の形成を阻害することが示唆された.
カスパーゼ阻害タンパク質としてのOspC3の分子的な機能を解析するため,カスパーゼ4への結合および抑制に作用する機能的なドメインを同定した.カスパーゼ4への結合に寄与する領域を特定するため,部分的に欠失させたOspC3の変異体を作製しカスパーゼ4との結合を確認した結果,C末端側の約30アミノ酸残基からなる領域が結合に重要な役割をはたしていることがわかった.この領域は2つのαヘリックスから構成されるアンキリンリピートというドメインに分類され,機能的な領域である可能性が高いと推測された8).そこで,この領域とアミノ酸配列の相同性の高いタンパク質を検索した結果,ほかの細胞内感染性の細菌や天然痘ウイルスのもつ,いずれも機能未知のタンパク質に相同性の高いアンキリンリピート配列がみつかり,それらにはすべてLeu,Ala,Leuの3つのアミノ酸残基が保存されていることが明らかになった.
一方,in silicoによるOspC3のモチーフ解析および立体構造予測から,カスパーゼ4の基質と同様のモチーフをもつLeu-Ser-Thr-Asp-Asn配列がカスパーゼ4の活性ポケットに侵入することが予測された.実際に,ペプチドLeu-Ser-Thr-Aspを合成しospC3欠損変異株に感染した細胞に添加してその細胞死を検討した結果,パイロプトーシスが抑制されたことからも,OspC3がLeu-Ser-Thr-Asp-Asn配列によりカスパーゼ4の活性ポケットにふたをしていることが予測された.
以上の機能ドメイン予測をもとに,さきのカスパーゼ4に依存的な細胞死誘導系に,Leu,Ala,Leuの3つのアミノ酸残基あるいはLeu-Ser-Thr-Asp-Asn配列を,それぞれ,Ala,Gly,Alaの3つのアミノ酸残基あるいはAla-Ala-Ala-Ala-Ala配列に変異させたOspC3を発現させ細胞死を測定した.その結果,一方の領域の変異体では約50%,2つの領域の同時変異体では約100%の細胞死が抑制された.したがって,エフェクタータンパク質OspC3は2つの機能的なドメインによりカスパーゼ4の活性を特異的に阻害していることが示唆された.
赤痢菌ospC3欠損変異株を感染した細胞において惹起されるカスパーゼ4に依存的なパイロプトーシスが,ほかの病原細菌に感染した細胞でも同様に惹起されるかどうか検証した.腸管病原性細菌であるサルモネラ菌および腸管病原性大腸菌が感染した上皮細胞を赤痢菌と同様に観察した結果,パイロプトーシスが惹起されていた.さらに,カスパーゼ4あるいはカスパーゼ1をノックダウンした細胞を用いて細胞死を定量した結果,カスパーゼ4に依存的かつカスパーゼ1に非依存的に細胞死の惹起されることが示唆された.以上の結果から,カスパーゼ4に依存したパイロプトーシスは,宿主細胞における普遍的な病原体の排除機構であることが示唆された.
この研究では,赤痢菌のエフェクタータンパク質OspC3の研究をとおし,宿主細胞が粘膜感染性の病原細菌を排除するための防御反応として,カスパーゼ4を介したパイロプトーシスを惹起することを明らかにした(図1).現在まで,カスパーゼ4の関与するパイロプトーシス,および,上皮細胞におけるパイロプトーシスの詳細な研究は行われていない.この研究で得られた結果は,いまだ機能の明らかになっていない上皮細胞における感染防御機構の解明に寄与すると考えられた.さらに,この研究では,カスパーゼを阻害する細菌に由来する病原タンパク質をはじめて同定し,カスパーゼに対する直接的な阻害機構についても新しい知見を得ることができた.ウイルスにおいてはすでにカスパーゼを阻害するタンパク質の報告がなされているが,おのおののカスパーゼファミリーに対する特異性は低く広域な阻害スペクトルをもつ9).一方で,OspC3は特異的な結合により阻害性の規定される,カスパーゼ4を特異的に阻害する新しいタイプの阻害タンパク質であった.
カスパーゼ4はマウスにおけるオーソログであるカスパーゼ11の研究から,敗血症に関与することが注目されはじめている10).この研究により得られたカスパーゼ4に対する知見,および,OspC3やospC3欠損変異株といった材料は,カスパーゼ4の関与する細菌感染症のみならず,敗血症などカスパーゼ4に関与する未解明な疾患の分子機構を解明する手がかりになるとともに,その治療薬を開発する足がかりともなることが期待される.
略歴:2013年 東京大学大学院新領域創成科学研究科 単位取得退学,同年より東京大学医科学研究所 学術支援専門職員.
研究テーマ:カスパーゼに依存的な細胞死を回避する赤痢菌の機能解析.
関心事:細菌や細胞などの分子装置の医学的および工学的な応用.
笹川 千尋(Chihiro Sasakawa)
千葉大学真菌医学研究センター センター長.
© 2013 小林泰良・笹川千尋 Licensed under CC 表示 2.1 日本
(東京大学医科学研究所 感染症国際研究センター細菌学分野)
email:小林泰良,笹川千尋
DOI: 10.7875/first.author.2013.071
The Shigella OspC3 effector inhibits caspase-4, antagonizes inflammatory cell death, and promotes epithelial infection.
Taira Kobayashi, Michinaga Ogawa, Takahito Sanada, Hitomi Mimuro, Minsoo Kim, Hiroshi Ashida, Reiko Akakura, Mitsutaka Yoshida, Magdalena Kawalec, Jean-Marc Reichhart, Tsunehiro Mizushima, Chihiro Sasakawa
Cell Host & Microbe, 13, 570-583 (2013)
要 約
病原体の感染やがんなどにより個体全体へと障害が及ぶとき,多細胞生物の細胞はカスパーゼとよばれる一群のプロテアーゼにより制御されたプログラム細胞死を選択するが,その分子機構に関してはいまだ不明な点が多い.筆者らは,赤痢菌をはじめサルモネラ菌や腸管病原性大腸菌が上皮細胞に感染すると,宿主細胞に生体防御反応としてカスパーゼ4に依存的な細胞死が誘導されることを発見した.また,興味深いことに,赤痢菌はカスパーゼ4を特異的に阻害するエフェクタータンパク質OspC3を分泌し,カスパーゼ4の成熟化の抑制および成熟型カスパーゼ4の活性ポケットへの拮抗作用によりその活性を阻害することを明らかにした.また,ospC3遺伝子を欠損した赤痢菌を上皮細胞へ感染させるとカスパーゼ4に依存的な炎症性細胞死が惹起され,感染した細胞が排除されることを細胞および動物個体のレベルにおいて明らかにした.この研究は,腸管の粘膜における病原細菌の排除の機構,および,病原細菌のもつ宿主の防御機構を回避する戦術の一端を明らかにし,細菌感染の解明や治療薬の開発に寄与するものである.
はじめに
赤痢菌(Shigella flexneri)は細菌性赤痢の起因細菌であり,経口的にヒトに取り込まれたのち腸管上皮細胞へと侵入し,細胞内運動および増殖により感染を成立させる.その過程がとどこおりなく遂行されるためには,病原性プラスミドにコードされた病原タンパク質である“エフェクター”が重要な役割を担う1).エフェクタータンパク質はグラム陰性の病原細菌に特有のIII型分泌機構に依存して分泌され,宿主細胞のタンパク質の機能を制御または阻害することにより,細菌の細胞への侵入や細胞内運動などの感染現象を積極的に誘導する.これらのエフェクタータンパク質による細菌の感染戦略のひとつに,上皮細胞における感染の足場の確保という概念があり,細胞死の抑制もこの概念のもとその存在が報告されているが,現在まで,それに関与するエフェクタータンパク質の報告はない2,3).このような状況をかんがみて,赤痢菌における細胞死抑制エフェクタータンパク質を同定し,その作用機序を明らかにすることを研究の目的とした.
一方,感染における病原体の排除に関与する細胞死は,ネクローシス,アポトーシス,パイロプトーシスという3つの型に分類することができる4).アポトーシスおよびパイロプトーシス(pyroptosis)はシステインプロテアーゼであるカスパーゼファミリータンパク質により制御されるプログラム細胞死であり,多細胞生物における計画的な自殺である5).なかでも,パイロプトーシスは炎症性サイトカインの活性化をともなう炎症性の細胞死で,おもに炎症性カスパーゼのひとつであるカスパーゼ1に依存した現象として血球系細胞において研究が進められている6).この研究では,エフェクタータンパク質OspC3がカスパーゼファミリーのなかでも炎症性カスパーゼのひとつであるカスパーゼ4を特異的に阻害することを明らかにするとともに,カスパーゼ4に依存的な細胞死の特徴の一端を明らかにした.
1.エフェクタータンパク質OspC3は赤痢菌の感染において生じる宿主の細胞死を抑制する
細胞死を抑制する赤痢菌のエフェクタータンパク質を探索するため,病原プラスミドに存在するエフェクター遺伝子をそれぞれ欠損した赤痢菌変異株を作製し,上皮細胞に感染させたのち,細胞から漏出したハウスキーピング酵素ラクトースデヒドロゲナーゼを定量するLDHアッセイにその細胞上清を供して細胞傷害性を調べた.その結果,ospC3欠損変異株に感染した細胞では,感染ののち2~4時間という短時間で,野生株およびほかの変異株と比較して著しく細胞が傷害されることを見い出した.この細胞傷害は腸管に由来する細胞株や初代培養腸管上皮細胞といったヒトの上皮組織に由来する細胞への感染においても広く観察され,実際に,赤痢菌の感染部位である腸管上皮において惹起することが考えられた.そこで,感染細胞の形態的な特徴を観察したところ,ospC3欠損変異株の感染においてはネクローシスで観察されるような細胞膜が破綻した細胞が観察された.以上の結果,OspC3は赤痢菌の感染に依存的に生じる細胞死を抑制するエフェクタータンパク質であることが示唆された.
2.ospC3欠損変異株を感染した細胞ではパイロプトーシス型の細胞死が惹起される
エフェクタータンパク質OspC3の機能を解析するうえで,まず,ospC3欠損変異株が感染した上皮細胞において生じる細胞死の特徴を解析した.その結果,ospC3欠損変異株の感染細胞では核の断片化(TUNEL陽性),および,膜の破綻(PI陽性)の生じる細胞の割合が顕著に上昇し,炎症性サイトカインであるインターロイキン18の活性化および細胞外への分泌がみられた.一方で,感染細胞の傷害性はカスパーゼファミリーのうち炎症性カスパーゼであるカスパーゼ1,カスパーゼ4,カスパーゼ5の活性を特異的に阻害する阻害剤を用いることにより抑制された.さらに,透過型電子顕微鏡を用いてospC3欠損変異株に感染した細胞を観察したところ,膜の破綻と核の委縮が同時に進行する感染像がみられた.以上の結果,ospC3欠損変異株が感染した上皮細胞ではパイロプトーシス様の特徴をもつ細胞死が誘導されることが明らかになった.
3.ospC3欠損変異株の感染では細胞死により細菌の増殖が抑制される
細胞死を抑制するエフェクタータンパク質OspC3の機能が赤痢菌の感染を促進する役割を担うことを検証するため,野生株およびospC3欠損変異株が感染した細胞における生菌の数を比較した.その結果,ospC3欠損変異株に感染した細胞では野生株に比べ生菌数が減少したが,カスパーゼ阻害剤の添加により野生株の感染と同じ程度まで生菌数は回復した.そこで,ospC3欠損変異株の感染においては細胞死により感染の足場を失っていると仮定し,モルモットを用いた動物感染モデル実験において腸管組織に感染した赤痢菌の数を定量した.その結果,ospC3欠損変異株の感染した組織では野生株に比べ細胞内に定着した生菌の数が減少した.ospC3欠損変異株が感染したモルモットは肛門から出血が生じるとともに,腸管の粘膜固有層が破壊され,浮腫や血球の浸潤が認められた.また,組織の切片をTUNELアッセイにより観察した結果,核の断片化が生じていたことから,細胞死による組織の破壊が考えられた.以上の結果,OspC3は赤痢菌が感染した細胞において生じる細胞死を抑制することにより,細菌が増殖する足場を維持し感染の拡大に寄与するエフェクタータンパク質であることが示唆された.
4.ospC3欠損変異株の感染細胞ではカスパーゼ4に依存的なパイロプトーシスが惹起される
エフェクタータンパク質OspC3による細胞死の抑制の標的を同定するため,OspC3が結合する宿主のタンパク質を探索した.文献を参考に,パイロプトーシスへの関与が報告されるタンパク質,または,カスパーゼ1からカスパーゼ10までのヒトのカスパーゼファミリーのOspC3に対する結合を確認した結果,炎症性カスパーゼのひとつであるカスパーゼ4がOspC3と特異的に結合することが示唆された.カスパーゼ4はその全長がCARD,p19,p10に限定分解されたのち,p19およびp10からなる四量体が成熟型カスパーゼ4となりシステインプロテアーゼとして機能する7).赤痢菌に感染した細胞では感染から1時間以内に全長のカスパーゼ4が消失したことから,限定分解が生じていることが考えられた.そこで,赤痢菌の感染による細胞ストレスによりカスパーゼ4の活性化が生じ,その結果としてパイロプトーシスが惹起されると仮定し,カスパーゼ4をノックダウンした上皮細胞に赤痢菌を感染させた結果,ospC3欠損変異株を感染した細胞において惹起されるはずのパイロプトーシスが抑制された.一方,パイロプトーシスとの関与が多く報告されているカスパーゼ1をノックダウンした細胞ではパイロプトーシスの惹起に影響はみられなかったことから,この研究において明らかにされた細胞死は,カスパーゼ4に依存した新しい分子機構による細胞死であることが示唆された.
5.OspC3は成熟型カスパーゼ4に直接に作用することでその活性を阻害する
野生型の赤痢菌に感染した細胞でもカスパーゼ4の限定分解が観察されたことから,OspC3は成熟型カスパーゼ4に直接的に作用することが考えられた.そこで,精製した成熟型カスパーゼ4に精製したOspC3を添加し,蛍光プローブを用いてカスパーゼ4の活性を測定した結果,OspC3の存在下においてカスパーゼ4の活性は阻害された.また,カスパーゼ4のp19およびp10を細胞に強制的に発現させて細胞死を誘導する系を構築し,この系にOspC3を同時に発現させたところ,細胞死はOspC3依存的に抑制された.以上の結果,OspC3は成熟型カスパーゼ4を直接的に阻害することが示唆された.おのおのの精製タンパク質を用いて結合実験を行ったところ,OspC3はカスパーゼ4のp19と特異的に結合しp19とp10とのあいだの結合を阻害することを見い出した.したがって,エフェクタータンパク質OspC3はカスパーゼ4への特異的な結合を利用し,成熟型カスパーゼ4の形成を阻害することが示唆された.
6.OspC3はC末端側がカスパーゼ4と結合するとともに別の配列により活性ポケットにふたをしている
カスパーゼ阻害タンパク質としてのOspC3の分子的な機能を解析するため,カスパーゼ4への結合および抑制に作用する機能的なドメインを同定した.カスパーゼ4への結合に寄与する領域を特定するため,部分的に欠失させたOspC3の変異体を作製しカスパーゼ4との結合を確認した結果,C末端側の約30アミノ酸残基からなる領域が結合に重要な役割をはたしていることがわかった.この領域は2つのαヘリックスから構成されるアンキリンリピートというドメインに分類され,機能的な領域である可能性が高いと推測された8).そこで,この領域とアミノ酸配列の相同性の高いタンパク質を検索した結果,ほかの細胞内感染性の細菌や天然痘ウイルスのもつ,いずれも機能未知のタンパク質に相同性の高いアンキリンリピート配列がみつかり,それらにはすべてLeu,Ala,Leuの3つのアミノ酸残基が保存されていることが明らかになった.
一方,in silicoによるOspC3のモチーフ解析および立体構造予測から,カスパーゼ4の基質と同様のモチーフをもつLeu-Ser-Thr-Asp-Asn配列がカスパーゼ4の活性ポケットに侵入することが予測された.実際に,ペプチドLeu-Ser-Thr-Aspを合成しospC3欠損変異株に感染した細胞に添加してその細胞死を検討した結果,パイロプトーシスが抑制されたことからも,OspC3がLeu-Ser-Thr-Asp-Asn配列によりカスパーゼ4の活性ポケットにふたをしていることが予測された.
以上の機能ドメイン予測をもとに,さきのカスパーゼ4に依存的な細胞死誘導系に,Leu,Ala,Leuの3つのアミノ酸残基あるいはLeu-Ser-Thr-Asp-Asn配列を,それぞれ,Ala,Gly,Alaの3つのアミノ酸残基あるいはAla-Ala-Ala-Ala-Ala配列に変異させたOspC3を発現させ細胞死を測定した.その結果,一方の領域の変異体では約50%,2つの領域の同時変異体では約100%の細胞死が抑制された.したがって,エフェクタータンパク質OspC3は2つの機能的なドメインによりカスパーゼ4の活性を特異的に阻害していることが示唆された.
7.カスパーゼ4に依存的なパイロプトーシスはサルモネラ菌および腸管病原性大腸菌を感染した細胞においても惹起される
赤痢菌ospC3欠損変異株を感染した細胞において惹起されるカスパーゼ4に依存的なパイロプトーシスが,ほかの病原細菌に感染した細胞でも同様に惹起されるかどうか検証した.腸管病原性細菌であるサルモネラ菌および腸管病原性大腸菌が感染した上皮細胞を赤痢菌と同様に観察した結果,パイロプトーシスが惹起されていた.さらに,カスパーゼ4あるいはカスパーゼ1をノックダウンした細胞を用いて細胞死を定量した結果,カスパーゼ4に依存的かつカスパーゼ1に非依存的に細胞死の惹起されることが示唆された.以上の結果から,カスパーゼ4に依存したパイロプトーシスは,宿主細胞における普遍的な病原体の排除機構であることが示唆された.
おわりに
この研究では,赤痢菌のエフェクタータンパク質OspC3の研究をとおし,宿主細胞が粘膜感染性の病原細菌を排除するための防御反応として,カスパーゼ4を介したパイロプトーシスを惹起することを明らかにした(図1).現在まで,カスパーゼ4の関与するパイロプトーシス,および,上皮細胞におけるパイロプトーシスの詳細な研究は行われていない.この研究で得られた結果は,いまだ機能の明らかになっていない上皮細胞における感染防御機構の解明に寄与すると考えられた.さらに,この研究では,カスパーゼを阻害する細菌に由来する病原タンパク質をはじめて同定し,カスパーゼに対する直接的な阻害機構についても新しい知見を得ることができた.ウイルスにおいてはすでにカスパーゼを阻害するタンパク質の報告がなされているが,おのおののカスパーゼファミリーに対する特異性は低く広域な阻害スペクトルをもつ9).一方で,OspC3は特異的な結合により阻害性の規定される,カスパーゼ4を特異的に阻害する新しいタイプの阻害タンパク質であった.
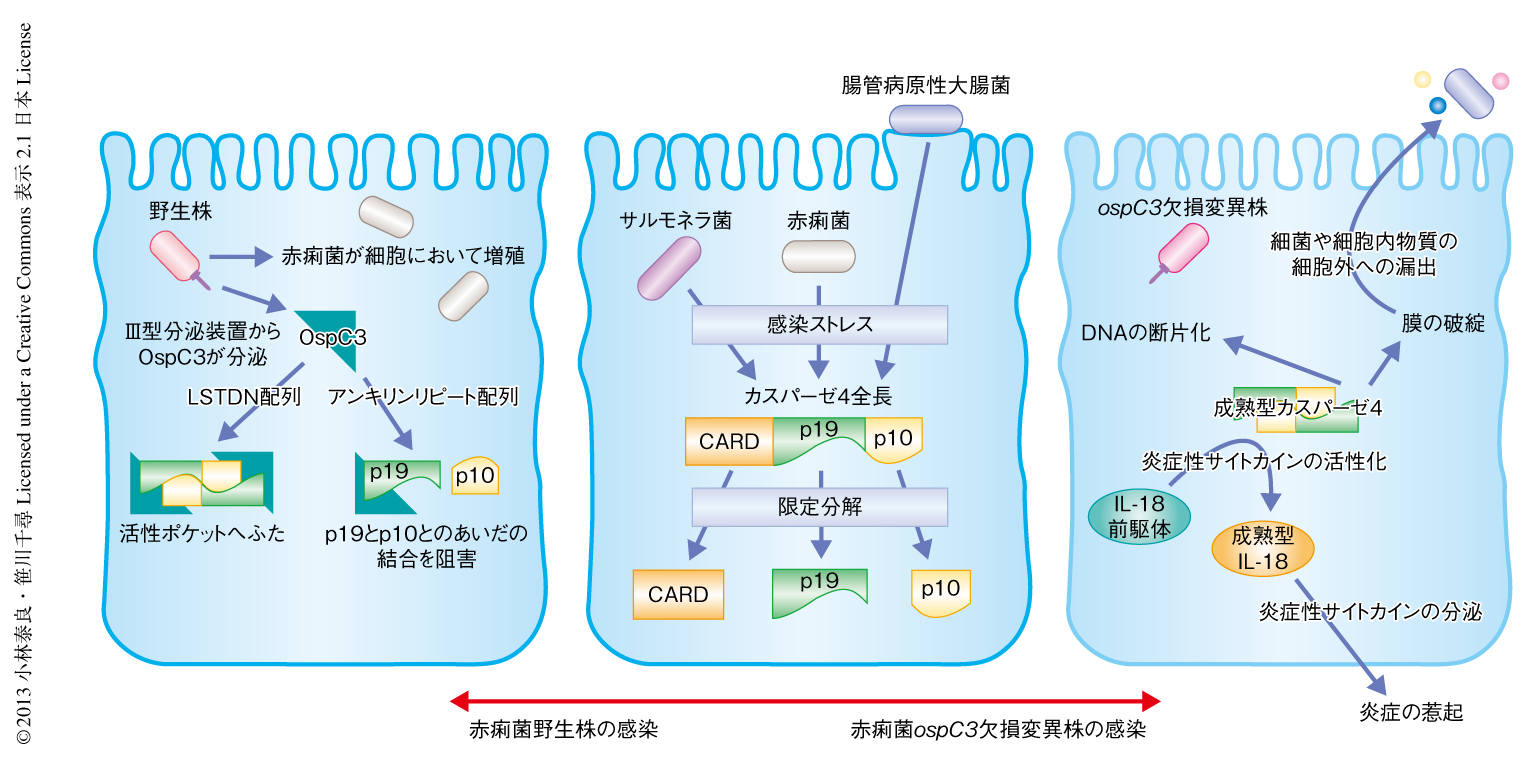
図1 カスパーゼ4に依存的な感染排除機構とOspC3の役割
赤痢菌やサルモネラ菌,腸管病原性大腸菌の感染した上皮細胞では,感染のストレスにより全長のカスパーゼ4が限定分解される(中央).赤痢菌ospC3欠損変異株やサルモネラ菌,腸管病原性大腸菌を感染した細胞ではカスパーゼ4が成熟型となって活性化し,そのプロテアーゼ活性によりインターロイキン18(IL-18)などの炎症性サイトカインを活性化するとともに,DNAの断片化や膜の破綻を惹起する.このような一連のパイロプトーシスにより,細菌や細胞内物質が細胞外へと漏出されて感染は抑制される(右).野生型の赤痢菌に感染した細胞では赤痢菌がIII型分泌機構からOspC3を分泌する.OspC3はアンキリンリピート配列によりカスパーゼ4のp19に結合して成熟型カスパーゼ4の形成を阻害するとともに,Leu-Ser-Thr-Asp-Asn(LSTDN)配列がカスパーゼ4の活性ポケットに基質の侵入を防ぐふたをすることにより,カスパーゼ4を特異的に阻害する.このようなOspC3の機能により赤痢菌は宿主の細胞死を抑制し,細胞において増殖する環境を確保している(左).
[Download]
赤痢菌やサルモネラ菌,腸管病原性大腸菌の感染した上皮細胞では,感染のストレスにより全長のカスパーゼ4が限定分解される(中央).赤痢菌ospC3欠損変異株やサルモネラ菌,腸管病原性大腸菌を感染した細胞ではカスパーゼ4が成熟型となって活性化し,そのプロテアーゼ活性によりインターロイキン18(IL-18)などの炎症性サイトカインを活性化するとともに,DNAの断片化や膜の破綻を惹起する.このような一連のパイロプトーシスにより,細菌や細胞内物質が細胞外へと漏出されて感染は抑制される(右).野生型の赤痢菌に感染した細胞では赤痢菌がIII型分泌機構からOspC3を分泌する.OspC3はアンキリンリピート配列によりカスパーゼ4のp19に結合して成熟型カスパーゼ4の形成を阻害するとともに,Leu-Ser-Thr-Asp-Asn(LSTDN)配列がカスパーゼ4の活性ポケットに基質の侵入を防ぐふたをすることにより,カスパーゼ4を特異的に阻害する.このようなOspC3の機能により赤痢菌は宿主の細胞死を抑制し,細胞において増殖する環境を確保している(左).
[Download]
カスパーゼ4はマウスにおけるオーソログであるカスパーゼ11の研究から,敗血症に関与することが注目されはじめている10).この研究により得られたカスパーゼ4に対する知見,および,OspC3やospC3欠損変異株といった材料は,カスパーゼ4の関与する細菌感染症のみならず,敗血症などカスパーゼ4に関与する未解明な疾患の分子機構を解明する手がかりになるとともに,その治療薬を開発する足がかりともなることが期待される.
文 献
- Ashida, H., Ogawa, M., Mimuro, H. et al.: Shigella are versatile mucosal pathogens that circumvent the host innate immune system. Curr. Opin. Immunol., 23, 448-455 (2011)[PubMed]
- Ashida, H., Mimuro, H., Ogawa, M. et al.: Cell death and infection: a double-edged sword for host and pathogen survival. J. Cell Biol., 195, 931-942 (2011)[PubMed]
- Kim, M., Ashida, H., Ogawa, M. et al.: Bacterial interactions with the host epithelium. Cell Host Microbe, 8, 20-35 (2010)[PubMed]
- Labbe, K. & Saleh, M.: Cell death in the host response to infection. Cell Death Differ., 15, 1339-1349 (2008)[PubMed]
- Elmore, S.: Apoptosis: a review of programmed cell death. Toxicol. Pathol., 35, 495-516 (2007)[PubMed]
- Bergsbaken, T., Fink, S. L. & Cookson, B. T.: Pyroptosis: host cell death and inflammation. Nat. Rev. Microbiol., 7, 99-109 (2009)[PubMed]
- Karki, P., Dahal, G. R. & Park, I. S.: Both dimerization and interdomain processing are essential for caspase-4 activation. Biochem. Biophys. Res. Commun., 356, 1056-1061 (2007)[PubMed]
- Al-Khodor, S., Price, C. T., Kalia, A. et al.: Functional diversity of ankyrin repeats in microbial proteins. Trends Microbiol., 18, 132-139 (2010)[PubMed]
- Callus, B. A. & Vaux, D. L.: Caspase inhibitors: viral, cellular and chemical. Cell Death Differ., 14, 73-78 (2007)[PubMed]
- Kayagaki, N., Warming, S., Lamkanfi, M. et al.: Non-canonical inflammasome activation targets caspase-11. Nature, 479, 117-121 (2011)[PubMed]
著者プロフィール
略歴:2013年 東京大学大学院新領域創成科学研究科 単位取得退学,同年より東京大学医科学研究所 学術支援専門職員.
研究テーマ:カスパーゼに依存的な細胞死を回避する赤痢菌の機能解析.
関心事:細菌や細胞などの分子装置の医学的および工学的な応用.
笹川 千尋(Chihiro Sasakawa)
千葉大学真菌医学研究センター センター長.
© 2013 小林泰良・笹川千尋 Licensed under CC 表示 2.1 日本