マイクロRNAであるmiR-235は栄養の状態と芽細胞の休眠とを連動させる
春日秀文・福山征光
(東京大学大学院薬学系研究科 生理化学教室)
email:福山征光
DOI: 10.7875/first.author.2013.067
The microRNA miR-235 couples blast-cell quiescence to the nutritional state.
Hidefumi Kasuga, Masamitsu Fukuyama, Aya Kitazawa, Kenji Kontani, Toshiaki Katada
Nature, 497, 503-506 (2013)
幹細胞など未分化な細胞は発生段階に応じて,または,栄養の状態や損傷など外的な環境に応答して,増殖および分化と休眠とが可逆的に制御されているが,その詳細な分子機構には依然として不明な点が多く残されている.線虫Caenorhabditis elegansの孵化直後の1齢幼虫の幹細胞および芽細胞は,低栄養条件においては増殖や分化を停止した休眠状態で維持されており,高栄養条件に移すと一斉に休眠から離脱して発生を開始する.今回,筆者らは,低栄養条件における芽細胞の休眠状態の維持に必須な遺伝子の探索を行い,その結果,マイクロRNAであるmiR-235を見い出した.miR-235の発現量は芽細胞の休眠状態が維持されている低栄養条件においては相対的に高く,摂食に応答して芽細胞が休眠から離脱するのにともないインスリン/インスリン様成長因子シグナル経路を介し減少した.マイクロRNAは標的遺伝子のmRNAの3’側非翻訳領域にある相補配列を認識してその発現を抑制する.そこで,miR-235の標的遺伝子の探索を行い,核内受容体をコードするnhr-91/GCNF遺伝子を見い出した.この研究により,低栄養条件におけるマイクロRNAを介したインスリン/インスリン様成長因子シグナル経路に依存的な芽細胞の休眠の制御機構の一端が明らかになった.miR-235は進化的に保存されたmiR-92ファミリーに属し,今後,ほかの生物においてもmiR-92とインスリン/インスリン様成長因子シグナル経路と幹細胞あるいは芽細胞の休眠との関連性が見い出される可能性がある.
幹細胞や芽細胞などの未分化な細胞は,栄養状態や発生の段階,組織の損傷といったさまざまな生理的な状態の変化に応じて,自己複製や分化,休眠などの頻度やタイミングを適切に制御することにより,健常な個体の成長や組織の恒常性の維持を担う1).これらの制御の破綻は幹細胞プールの枯渇やがん幹細胞の発生といった病態と密接に関連することが予想されるため,マウスやショウジョウバエなどを用いて,生理的な状態の変化に応答した幹細胞の挙動の制御機構の解明が試みられてきた.
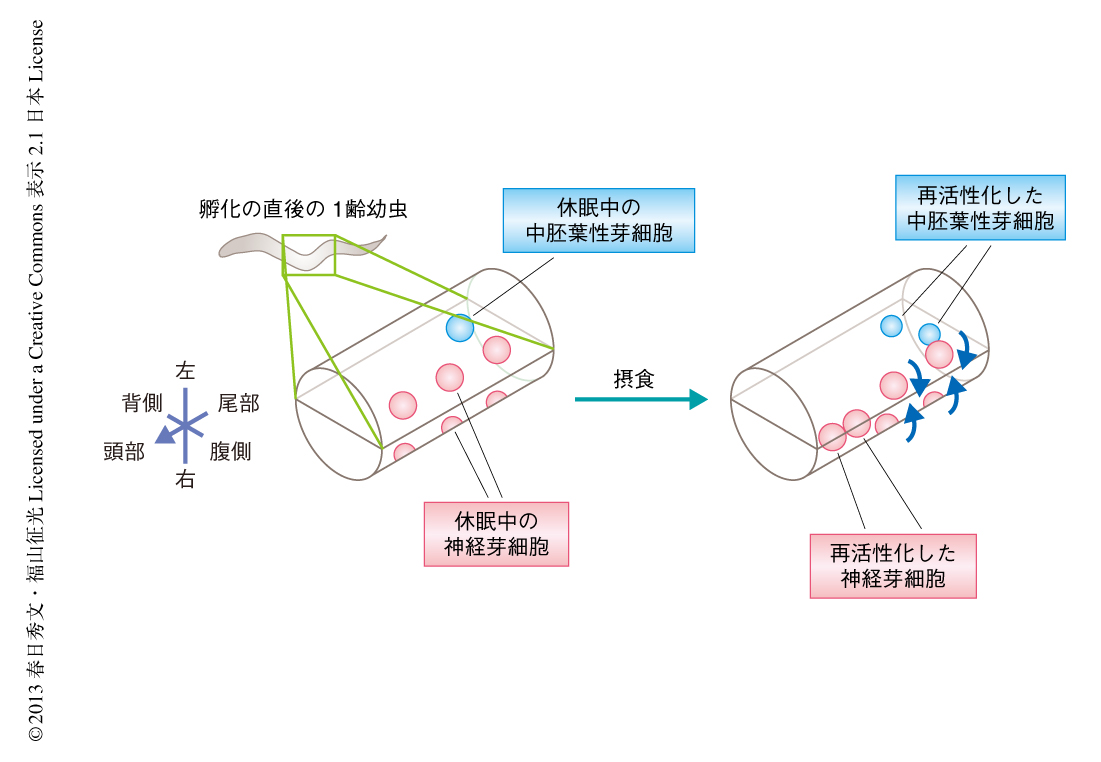
これまで,筆者らは,線虫Caenorhabditis elegansにおける体細胞性組織の前駆細胞である芽細胞や生殖幹細胞を用いて,生体において栄養状態の変化に応じた未分化な細胞の挙動を制御する機構の解明を試みてきた2,3).孵化の直後の幼虫の神経芽細胞や中胚葉性芽細胞などの体細胞性の芽細胞や生殖幹細胞は,餌である大腸菌を含まない低栄養条件においては,細胞移動や分裂,分化を停止したいわゆる休眠状態で維持(L1休眠とよばれる)されているが,大腸菌を添加した高栄養条件へと移し摂食を開始させると,休眠状態から離脱して分裂や分化を開始(再活性化)する2,4,5)(図1).これらの幹細胞および芽細胞は微分干渉顕微鏡により生きたまま容易に同定および観察することができ,かつ,これらの休眠と再活性化は培地を変えるだけで個体のあいだで同調的に誘導することができる.
これまでに,このような線虫の幹細胞および芽細胞の栄養応答においてインスリン/インスリン様成長因子シグナル経路の関与することが報告されてきた2,5-7).インスリン受容体遺伝子のオルソログであるdaf-2/InR遺伝子の機能減弱型変異体では,餌をあたえても後胚発生の進行しないことは,かなり以前から知られていた5-7).一方,インスリン/インスリン様成長因子シグナル経路に対し拮抗的に機能するPten(phosphatase and tensin homologue deleted on chromosome 10)およびFoxOの欠失変異体では,貧栄養条件においても後胚発生が開始する.幹細胞および芽細胞に着目した解析により,生殖幹細胞および体細胞性芽細胞の休眠がPtenの下流において,それぞれ,FoxOに非依存的2),あるいは,FoxOに依存的に5),制御されていることが報告されている.これらのことから,インスリン/インスリン様成長因子シグナル経路は幹細胞および芽細胞の再活性化を促進していることが示唆される.
興味深いことに,PtenノックアウトマウスおよびFoxOノックアウトマウスは造血幹細胞や原始卵胞細胞の休眠状態からの離脱といった,線虫の相同遺伝子の変異体と類似した表現型を示すことが報告されている8-11).このことから,線虫の芽細胞と哺乳動物の幹細胞では,それぞれ類似した機構により休眠と再活性化が制御されている可能性が示唆される.以上のように,線虫における幹細胞および芽細胞は,1)微分干渉顕微鏡により容易に観察および同定できる,2)栄養条件に応じて休眠と再活性化をほぼ完全に誘導できる,3)哺乳動物における幹細胞の制御と類似した機構で制御されている,といった観点から,幹細胞などの未分化な細胞の挙動を制御する分子機構の解明のための有用な実験モデルになりうると期待された.
そこで,筆者らは,すでに作出された線虫変異体のなかから,daf-18/Pten変異体やdaf-16/FoxO変異体と同様な表現型を示す変異体を探索することにより,インスリン/インスリン様成長因子シグナル経路の下流において低栄養条件における幹細胞および芽細胞の休眠状態を維持する新規の因子の同定を試みた.
マイクロRNA(miRNA)は約22塩基の非コード小分子RNAであり,シード配列とよばれる5’末端から2~8塩基目の7塩基を介して標的遺伝子mRNAの3’側非翻訳領域にある相補配列を認識し,その翻訳を抑制するもしくはその分解を促進することにより標的遺伝子の発現を抑制する12).筆者らが,線虫の幹細胞および芽細胞の栄養応答にかかわる新規の因子を探索しはじめた数年前,マウスの胚性幹細胞の自己増殖と分化の運命決定において複数のmiRNAが重要なはたらきを担うことが報告された13-16).このことから,幹細胞および芽細胞の栄養応答にもmiRNAが重要なはたらきをもつのではないかという仮説をたてた.また,線虫においては網羅的なmiRNAの欠失変異体の作出が進められており17),それらの多くは入手が可能であった.そこで,105のmiRNAを欠失した計85の変異体に関して,低栄養条件においても幹細胞あるいは芽細胞が休眠から離脱するものをスクリーニングした.その結果,唯一,mir-235欠失変異体において,daf-18/Pten変異体やdaf-16/FoxO変異体と同様に,低栄養条件における神経芽細胞や中胚葉性芽細胞の再活性化が観察された.発生を開始した幼虫はおのおのの幼虫期への移行の際に脱皮するが,mir-235欠失変異体は低栄養条件にもかかわらず脱皮し2齢幼虫へと成長した.さらに,mir-235欠失変異体にmir-235遺伝子を含むゲノム断片を導入するとこの表現型はほぼ完全にレスキューされた一方で,標的遺伝子の認識に重要なシード配列の2塩基を本来とは異なる塩基に置換したmir-235遺伝子を含むゲノム断片の導入ではこのレスキューはまったく起こらなかったことから,mir-235遺伝子によりコードされるマイクロRNAであるmiR-235が,低栄養条件における神経芽細胞と中胚葉性芽細胞の休眠維持および脱皮の抑制に必須であることが示された.
miR-235の発現部位を明らかにするため,mir-235遺伝子のプロモーター領域の下流にGFPを融合させた発現ベクターを構築しその発現部位を観察した.GFPは胚発生の後期から成虫にいたるまで表皮において発現が観察された.つぎに,低栄養条件において誘導されたL1休眠でのGFPの発現部位を観察したところ,表皮にくわえ,神経芽細胞および頭部のグリア細胞であるAmphidソケット細胞でも発現が認められた.しかしながら,中胚葉性芽細胞におけるGFPの発現は認められなかったことから,miR-235は細胞非自律的に中胚葉性芽細胞の休眠を維持している可能性が示唆された.
この発現部位をふまえ,miR-235がどの組織において芽細胞の休眠を制御しているのか明らかにするため,miR-235の組織特異的な発現によるmir-235変異体の表現型のレスキューを試みた.神経芽細胞と表皮に特異的な遺伝子プロモーターや,グリア細胞を含む分化したニューロンにおいて特異的な遺伝子プロモーターを用いてmiR-235を発現させると,神経芽細胞および中胚葉性芽細胞の両方において表現型は抑制された.しかしながら,mir-235遺伝子のプロモーター活性が認められなかった腸においてmiR-235を特異的に発現させても,これらの表現型のレスキューは認められなかった.さらに,Amphidソケット細胞,一部の感覚ニューロンと腸でのみ特異的に発現するztf-16遺伝子のプロモーター,あるいは,Qシステムを用いて,表皮において特異的にmiR-235を発現させたときにもmir-235変異体における芽細胞の休眠という表現型がレスキューされたことから,表皮やグリアにおいてmiR-235が細胞非自律的に神経芽細胞や中胚葉性芽細胞の休眠を制御することが示唆された(図2).
低栄養条件と高栄養条件のそれぞれにおけるmiR-235の発現の変動をノーザンブロット法により解析した.miR-235の発現は低栄養条件において,少なくとも1週間にわたり比較的高い発現レベルで維持された.これに対して,大腸菌を摂食させるとその8時間後にmiR-235の発現は急激に低下した.そこで,この栄養に応答したmiR-235の発現抑制におけるインスリン/インスリン様成長因子シグナル経路の寄与を明らかにするため,さきに述べたdaf-2/InR遺伝子の機能減弱型変異体におけるmiR-235の発現の変動を検討したところ,大腸菌の摂食に応答した発現の低下はみられなかった.さらに,低栄養条件においても,野生型と比較してdaf-2/InR変異体においては,daf-16/FoxO遺伝子の活性に依存してmiR-235の発現量は上昇していた.以上から,miR-235は栄養に応答してインスリン/インスリン様成長因子シグナル経路により発現が抑制されていることが明らかになった.
miRNAは標的遺伝子mRNAの3’側非翻訳領域にある相同配列を認識してその発現を抑制する12).そこで,複数のアルゴリズムにより重複して予測された標的の候補遺伝子のなかで,低栄養条件において野生型と比較してmir-235変異体での発現が上昇している遺伝子を探索したところ,哺乳類の核内受容体GCNFのオルソログをコードするnhr-91/GCNF遺伝子を見い出した.さらに,nhr-91遺伝子は摂食にともない発現が誘導されるが,mir-235変異体においては野生型よりも顕著に発現が誘導された.これらのことから,miR-235はnhr-91遺伝子の発現を抑制している可能性が示唆された.nhr-91遺伝子がmiR-235の直接の標的遺伝子であるかどうかを検討するため,nhr-91遺伝子の3’側非翻訳領域を用いたGFPレポーター実験を行った.GFP遺伝子をnhr-91遺伝子の3’側非翻訳領域の制御下においてmir-235遺伝子と共発現させると,GFPの発現しない形質転換体が多くみられる一方で,その3’側非翻訳領域における2か所のmiR-235による認識配列(シード配列)の2残基を異なる塩基に置換するとGFPを発現する形質転換体が有意に増加したことから,miR-235はnhr-91遺伝子mRNAの3’側非翻訳領域にある認識配列を介して直接にその発現を制御していることが示唆された.さらに,mir-235変異体の低栄養条件における神経芽細胞の細胞移動はnhr-91遺伝子の欠失により有意に抑制された.以上から,miR-235により核内受容体をコードするnhr-91遺伝子の発現抑制が低栄養時条件における芽細胞の休眠の維持にかかわることが明らかになった.
この研究をつうじ,筆者らは,miRNAであるmiR-235が核内受容体をコードするnhr-91/GCNF遺伝子の発現の抑制を介し低栄養条件における芽細胞の休眠状態を維持すること,また,その発現は栄養によりインスリン/インスリン様成長因子シグナル経路を介して抑制されることを明らかにした.今後の課題として,インスリン/インスリン様成長因子シグナル経路によるmiR-235の発現制御機構や,miR-235による低栄養条件における芽細胞の休眠の維持機構の詳細の解明があげられる.
miR-235は進化的に保存されたmiR-92ファミリーに属し,miR-92はmiR-17~92クラスターファミリーの一部として発現する18).miR-17~92クラスターファミリーは各種の造血器悪性腫瘍および肺がん腫などの固形腫瘍において高発現している染色体領域13q31-q32に遺伝子が存在することが報告され,がん遺伝子産物としてふるまうmiRNAであることからoncomiR-1ともよばれる19,20).しかしながら,哺乳動物のmiR-92そのものの生理機能はいまだ詳細には解析されておらず,今後,miR-17~92クラスターファミリーによるがん形成機構の解明にむけ,miR-92がmiR-235でみられたような幹細胞および芽細胞の栄養応答や休眠あるいは分化の抑制などのような生理機能をもつのか検討が待たれる.
線虫の生育の過程において,幹細胞および芽細胞の再活性化のほかにも,複数の発生イベントのタイミングを制御するlin-4遺伝子や周期的な脱皮に関与する遺伝子の発現が摂食により誘導されることが知られている.ここではふれなかったが,mir-235遺伝子は低栄養条件におけるそれら遺伝子の発現抑制にも必須であることも,この論文では報告した.以上を考えると,線虫の低栄養条件における発育の停止は健常な生育を保証するための能動的なプロセスであり,飢餓の際に機能するmiR-235はいわば複数の発生現象を制御する“栄養チェックポイント”の分子実体だととらえることができる.多くの発生生物学の研究は細胞運命の決定や形態形成など発生イベントの進行を促進する分子基盤をおもに扱っている.一方,個体や組織,細胞のレベルでの発生イベントが停止した休眠は,多くの生物種において観察される現象ではあるものの,その制御機構には不明な点が多い.以上のことを考えると,休眠の研究を切り口とすることにより,個体の発生をささえる分子基盤の包括的な理解の深まることが期待できる.
略歴:2013年 東京大学大学院薬学系研究科博士課程 修了,同年より大鵬薬品工業つくば研究センター 研究員.
研究テーマ:がんの分子標的薬の研究開発.
抱負:より効果的な抗がん剤の創出をつうじて,よりよい社会づくりに貢献したい.
福山 征光(Masamitsu Fukuyama)
東京大学大学院薬学系研究科 助教.
© 2013 春日秀文・福山征光 Licensed under CC 表示 2.1 日本
(東京大学大学院薬学系研究科 生理化学教室)
email:福山征光
DOI: 10.7875/first.author.2013.067
The microRNA miR-235 couples blast-cell quiescence to the nutritional state.
Hidefumi Kasuga, Masamitsu Fukuyama, Aya Kitazawa, Kenji Kontani, Toshiaki Katada
Nature, 497, 503-506 (2013)
要 約
幹細胞など未分化な細胞は発生段階に応じて,または,栄養の状態や損傷など外的な環境に応答して,増殖および分化と休眠とが可逆的に制御されているが,その詳細な分子機構には依然として不明な点が多く残されている.線虫Caenorhabditis elegansの孵化直後の1齢幼虫の幹細胞および芽細胞は,低栄養条件においては増殖や分化を停止した休眠状態で維持されており,高栄養条件に移すと一斉に休眠から離脱して発生を開始する.今回,筆者らは,低栄養条件における芽細胞の休眠状態の維持に必須な遺伝子の探索を行い,その結果,マイクロRNAであるmiR-235を見い出した.miR-235の発現量は芽細胞の休眠状態が維持されている低栄養条件においては相対的に高く,摂食に応答して芽細胞が休眠から離脱するのにともないインスリン/インスリン様成長因子シグナル経路を介し減少した.マイクロRNAは標的遺伝子のmRNAの3’側非翻訳領域にある相補配列を認識してその発現を抑制する.そこで,miR-235の標的遺伝子の探索を行い,核内受容体をコードするnhr-91/GCNF遺伝子を見い出した.この研究により,低栄養条件におけるマイクロRNAを介したインスリン/インスリン様成長因子シグナル経路に依存的な芽細胞の休眠の制御機構の一端が明らかになった.miR-235は進化的に保存されたmiR-92ファミリーに属し,今後,ほかの生物においてもmiR-92とインスリン/インスリン様成長因子シグナル経路と幹細胞あるいは芽細胞の休眠との関連性が見い出される可能性がある.
はじめに
幹細胞や芽細胞などの未分化な細胞は,栄養状態や発生の段階,組織の損傷といったさまざまな生理的な状態の変化に応じて,自己複製や分化,休眠などの頻度やタイミングを適切に制御することにより,健常な個体の成長や組織の恒常性の維持を担う1).これらの制御の破綻は幹細胞プールの枯渇やがん幹細胞の発生といった病態と密接に関連することが予想されるため,マウスやショウジョウバエなどを用いて,生理的な状態の変化に応答した幹細胞の挙動の制御機構の解明が試みられてきた.
これまで,筆者らは,線虫Caenorhabditis elegansにおける体細胞性組織の前駆細胞である芽細胞や生殖幹細胞を用いて,生体において栄養状態の変化に応じた未分化な細胞の挙動を制御する機構の解明を試みてきた2,3).孵化の直後の幼虫の神経芽細胞や中胚葉性芽細胞などの体細胞性の芽細胞や生殖幹細胞は,餌である大腸菌を含まない低栄養条件においては,細胞移動や分裂,分化を停止したいわゆる休眠状態で維持(L1休眠とよばれる)されているが,大腸菌を添加した高栄養条件へと移し摂食を開始させると,休眠状態から離脱して分裂や分化を開始(再活性化)する2,4,5)(図1).これらの幹細胞および芽細胞は微分干渉顕微鏡により生きたまま容易に同定および観察することができ,かつ,これらの休眠と再活性化は培地を変えるだけで個体のあいだで同調的に誘導することができる.
これまでに,このような線虫の幹細胞および芽細胞の栄養応答においてインスリン/インスリン様成長因子シグナル経路の関与することが報告されてきた2,5-7).インスリン受容体遺伝子のオルソログであるdaf-2/InR遺伝子の機能減弱型変異体では,餌をあたえても後胚発生の進行しないことは,かなり以前から知られていた5-7).一方,インスリン/インスリン様成長因子シグナル経路に対し拮抗的に機能するPten(phosphatase and tensin homologue deleted on chromosome 10)およびFoxOの欠失変異体では,貧栄養条件においても後胚発生が開始する.幹細胞および芽細胞に着目した解析により,生殖幹細胞および体細胞性芽細胞の休眠がPtenの下流において,それぞれ,FoxOに非依存的2),あるいは,FoxOに依存的に5),制御されていることが報告されている.これらのことから,インスリン/インスリン様成長因子シグナル経路は幹細胞および芽細胞の再活性化を促進していることが示唆される.
興味深いことに,PtenノックアウトマウスおよびFoxOノックアウトマウスは造血幹細胞や原始卵胞細胞の休眠状態からの離脱といった,線虫の相同遺伝子の変異体と類似した表現型を示すことが報告されている8-11).このことから,線虫の芽細胞と哺乳動物の幹細胞では,それぞれ類似した機構により休眠と再活性化が制御されている可能性が示唆される.以上のように,線虫における幹細胞および芽細胞は,1)微分干渉顕微鏡により容易に観察および同定できる,2)栄養条件に応じて休眠と再活性化をほぼ完全に誘導できる,3)哺乳動物における幹細胞の制御と類似した機構で制御されている,といった観点から,幹細胞などの未分化な細胞の挙動を制御する分子機構の解明のための有用な実験モデルになりうると期待された.
そこで,筆者らは,すでに作出された線虫変異体のなかから,daf-18/Pten変異体やdaf-16/FoxO変異体と同様な表現型を示す変異体を探索することにより,インスリン/インスリン様成長因子シグナル経路の下流において低栄養条件における幹細胞および芽細胞の休眠状態を維持する新規の因子の同定を試みた.
1.インスリン/インスリン様成長因子シグナル経路を介した栄養応答性の芽細胞の制御にかかわる因子の探索
マイクロRNA(miRNA)は約22塩基の非コード小分子RNAであり,シード配列とよばれる5’末端から2~8塩基目の7塩基を介して標的遺伝子mRNAの3’側非翻訳領域にある相補配列を認識し,その翻訳を抑制するもしくはその分解を促進することにより標的遺伝子の発現を抑制する12).筆者らが,線虫の幹細胞および芽細胞の栄養応答にかかわる新規の因子を探索しはじめた数年前,マウスの胚性幹細胞の自己増殖と分化の運命決定において複数のmiRNAが重要なはたらきを担うことが報告された13-16).このことから,幹細胞および芽細胞の栄養応答にもmiRNAが重要なはたらきをもつのではないかという仮説をたてた.また,線虫においては網羅的なmiRNAの欠失変異体の作出が進められており17),それらの多くは入手が可能であった.そこで,105のmiRNAを欠失した計85の変異体に関して,低栄養条件においても幹細胞あるいは芽細胞が休眠から離脱するものをスクリーニングした.その結果,唯一,mir-235欠失変異体において,daf-18/Pten変異体やdaf-16/FoxO変異体と同様に,低栄養条件における神経芽細胞や中胚葉性芽細胞の再活性化が観察された.発生を開始した幼虫はおのおのの幼虫期への移行の際に脱皮するが,mir-235欠失変異体は低栄養条件にもかかわらず脱皮し2齢幼虫へと成長した.さらに,mir-235欠失変異体にmir-235遺伝子を含むゲノム断片を導入するとこの表現型はほぼ完全にレスキューされた一方で,標的遺伝子の認識に重要なシード配列の2塩基を本来とは異なる塩基に置換したmir-235遺伝子を含むゲノム断片の導入ではこのレスキューはまったく起こらなかったことから,mir-235遺伝子によりコードされるマイクロRNAであるmiR-235が,低栄養条件における神経芽細胞と中胚葉性芽細胞の休眠維持および脱皮の抑制に必須であることが示された.
2.miR-235は表皮とグリア細胞において機能する
miR-235の発現部位を明らかにするため,mir-235遺伝子のプロモーター領域の下流にGFPを融合させた発現ベクターを構築しその発現部位を観察した.GFPは胚発生の後期から成虫にいたるまで表皮において発現が観察された.つぎに,低栄養条件において誘導されたL1休眠でのGFPの発現部位を観察したところ,表皮にくわえ,神経芽細胞および頭部のグリア細胞であるAmphidソケット細胞でも発現が認められた.しかしながら,中胚葉性芽細胞におけるGFPの発現は認められなかったことから,miR-235は細胞非自律的に中胚葉性芽細胞の休眠を維持している可能性が示唆された.
この発現部位をふまえ,miR-235がどの組織において芽細胞の休眠を制御しているのか明らかにするため,miR-235の組織特異的な発現によるmir-235変異体の表現型のレスキューを試みた.神経芽細胞と表皮に特異的な遺伝子プロモーターや,グリア細胞を含む分化したニューロンにおいて特異的な遺伝子プロモーターを用いてmiR-235を発現させると,神経芽細胞および中胚葉性芽細胞の両方において表現型は抑制された.しかしながら,mir-235遺伝子のプロモーター活性が認められなかった腸においてmiR-235を特異的に発現させても,これらの表現型のレスキューは認められなかった.さらに,Amphidソケット細胞,一部の感覚ニューロンと腸でのみ特異的に発現するztf-16遺伝子のプロモーター,あるいは,Qシステムを用いて,表皮において特異的にmiR-235を発現させたときにもmir-235変異体における芽細胞の休眠という表現型がレスキューされたことから,表皮やグリアにおいてmiR-235が細胞非自律的に神経芽細胞や中胚葉性芽細胞の休眠を制御することが示唆された(図2).
3.miR-235の発現は摂食に応答しインスリン/インスリン様成長因子シグナル経路により抑制される
低栄養条件と高栄養条件のそれぞれにおけるmiR-235の発現の変動をノーザンブロット法により解析した.miR-235の発現は低栄養条件において,少なくとも1週間にわたり比較的高い発現レベルで維持された.これに対して,大腸菌を摂食させるとその8時間後にmiR-235の発現は急激に低下した.そこで,この栄養に応答したmiR-235の発現抑制におけるインスリン/インスリン様成長因子シグナル経路の寄与を明らかにするため,さきに述べたdaf-2/InR遺伝子の機能減弱型変異体におけるmiR-235の発現の変動を検討したところ,大腸菌の摂食に応答した発現の低下はみられなかった.さらに,低栄養条件においても,野生型と比較してdaf-2/InR変異体においては,daf-16/FoxO遺伝子の活性に依存してmiR-235の発現量は上昇していた.以上から,miR-235は栄養に応答してインスリン/インスリン様成長因子シグナル経路により発現が抑制されていることが明らかになった.
4.miR-235は核内受容体をコードする遺伝子の発現抑制を介して低栄養における芽細胞の休眠を維持する
miRNAは標的遺伝子mRNAの3’側非翻訳領域にある相同配列を認識してその発現を抑制する12).そこで,複数のアルゴリズムにより重複して予測された標的の候補遺伝子のなかで,低栄養条件において野生型と比較してmir-235変異体での発現が上昇している遺伝子を探索したところ,哺乳類の核内受容体GCNFのオルソログをコードするnhr-91/GCNF遺伝子を見い出した.さらに,nhr-91遺伝子は摂食にともない発現が誘導されるが,mir-235変異体においては野生型よりも顕著に発現が誘導された.これらのことから,miR-235はnhr-91遺伝子の発現を抑制している可能性が示唆された.nhr-91遺伝子がmiR-235の直接の標的遺伝子であるかどうかを検討するため,nhr-91遺伝子の3’側非翻訳領域を用いたGFPレポーター実験を行った.GFP遺伝子をnhr-91遺伝子の3’側非翻訳領域の制御下においてmir-235遺伝子と共発現させると,GFPの発現しない形質転換体が多くみられる一方で,その3’側非翻訳領域における2か所のmiR-235による認識配列(シード配列)の2残基を異なる塩基に置換するとGFPを発現する形質転換体が有意に増加したことから,miR-235はnhr-91遺伝子mRNAの3’側非翻訳領域にある認識配列を介して直接にその発現を制御していることが示唆された.さらに,mir-235変異体の低栄養条件における神経芽細胞の細胞移動はnhr-91遺伝子の欠失により有意に抑制された.以上から,miR-235により核内受容体をコードするnhr-91遺伝子の発現抑制が低栄養時条件における芽細胞の休眠の維持にかかわることが明らかになった.
おわりに
この研究をつうじ,筆者らは,miRNAであるmiR-235が核内受容体をコードするnhr-91/GCNF遺伝子の発現の抑制を介し低栄養条件における芽細胞の休眠状態を維持すること,また,その発現は栄養によりインスリン/インスリン様成長因子シグナル経路を介して抑制されることを明らかにした.今後の課題として,インスリン/インスリン様成長因子シグナル経路によるmiR-235の発現制御機構や,miR-235による低栄養条件における芽細胞の休眠の維持機構の詳細の解明があげられる.
miR-235は進化的に保存されたmiR-92ファミリーに属し,miR-92はmiR-17~92クラスターファミリーの一部として発現する18).miR-17~92クラスターファミリーは各種の造血器悪性腫瘍および肺がん腫などの固形腫瘍において高発現している染色体領域13q31-q32に遺伝子が存在することが報告され,がん遺伝子産物としてふるまうmiRNAであることからoncomiR-1ともよばれる19,20).しかしながら,哺乳動物のmiR-92そのものの生理機能はいまだ詳細には解析されておらず,今後,miR-17~92クラスターファミリーによるがん形成機構の解明にむけ,miR-92がmiR-235でみられたような幹細胞および芽細胞の栄養応答や休眠あるいは分化の抑制などのような生理機能をもつのか検討が待たれる.
線虫の生育の過程において,幹細胞および芽細胞の再活性化のほかにも,複数の発生イベントのタイミングを制御するlin-4遺伝子や周期的な脱皮に関与する遺伝子の発現が摂食により誘導されることが知られている.ここではふれなかったが,mir-235遺伝子は低栄養条件におけるそれら遺伝子の発現抑制にも必須であることも,この論文では報告した.以上を考えると,線虫の低栄養条件における発育の停止は健常な生育を保証するための能動的なプロセスであり,飢餓の際に機能するmiR-235はいわば複数の発生現象を制御する“栄養チェックポイント”の分子実体だととらえることができる.多くの発生生物学の研究は細胞運命の決定や形態形成など発生イベントの進行を促進する分子基盤をおもに扱っている.一方,個体や組織,細胞のレベルでの発生イベントが停止した休眠は,多くの生物種において観察される現象ではあるものの,その制御機構には不明な点が多い.以上のことを考えると,休眠の研究を切り口とすることにより,個体の発生をささえる分子基盤の包括的な理解の深まることが期待できる.
文 献
- Nakada, D., Levi, B. & Morrison, S.: Integrating physiological regulation with stem cell and tissue homeostasis. Neuron, 70, 703-718 (2011)[PubMed]
- Fukuyama, M., Rougvie, A. & Rothman, J.: C. elegans DAF-18/PTEN mediates nutrient-dependent arrest of cell cycle and growth in the germline. Curr. Biol., 16, 773-779 (2006)[PubMed]
- Fukuyama, M., Sakuma, K., Park, R. et al.: C. elegans AMPKs promote survival and arrest germline development during nutrient stress. Biol. Open, 1, 929-936 (2012)[PubMed]
- Johnson, T. E., Mitchell, D. H. & Kline, S.: Arresting development arrests aging in the nematode Caenorhabditis elegans. Mech. Ageing Dev., 28, 23-40 (1984)[PubMed]
- Baugh, L. & Sternberg, P.: DAF-16/FOXO regulates transcription of cki-1/Cip/Kip and repression of lin-4 during C. elegans L1 arrest. Curr. Biol., 16, 780-785 (2006)[PubMed]
- Vowels, J. J. & Thomas, J. H.: Genetic analysis of chemosensory control of dauer formation in Caenorhabditis elegans. Genetics, 130, 105-123 (1992)[PubMed]
- Gems, D., Sutton, A. J., Sundermeyer, M. L. et al.: Two pleiotropic classes of daf-2 mutation affect larval arrest, adult behavior, reproduction and longevity in Caenorhabditis elegans. Genetics, 150, 129-155 (1998)[PubMed]
- Castrillon, D. H., Miao, L., Kollipara, R. et al.: Suppression of ovarian follicle activation in mice by the transcription factor Foxo3a. Science, 301, 215-218 (2003)[PubMed]
- Yilmaz, O., Valdez, R., Theisen, B. et al.: Pten dependence distinguishes haematopoietic stem cells from leukaemia-initiating cells. Nature, 441, 475-482 (2006)[PubMed]
- Tothova, Z. & Gilliland, D. G.: FoxO transcription factors and stem cell homeostasis: insights from the hematopoietic system. Cell Stem Cell, 16, 140-152 (2007)[PubMed]
- Reddy, P., Liu, L. & Adhikari, D.: Oocyte-specific deletion of Pten causes premature activation of the primordial follicle pool. Science, 319, 611-613 (2008)[PubMed]
- Bartel, D.: MicroRNAs: target recognition and regulatory functions. Cell, 136, 215-233 (2009)[PubMed]
- Kanellopoulou, C., Muljo, S. A., Kung, A. L. et al.: Dicer-deficient mouse embryonic stem cells are defective in differentiation and centromeric silencing. Genes Dev., 19, 489-501 (2005)[PubMed]
- Murchison, E. P., Partridge, J. F., Tam, O. H. et al.: Characterization of Dicer-deficient murine embryonic stem cells. Proc. Natl. Acad. Sci. USA, 102, 12135-12140 (2005)[PubMed]
- Wang, Y., Medvid, R., Melton, C. et al.: DGCR8 is essential for microRNA biogenesis and silencing of embryonic stem cell self-renewal. Nat. Genet., 39, 380-385 (2007)[PubMed]
- Melton, C., Judson, R. L. & Blelloch, R.: Opposing microRNA families regulate self-renewal in mouse embryonic stem cells. Nature, 463, 621-626 (2010)[PubMed]
- Miska, E., Alvarez-Saavedra, E., Abbott, A. et al.: Most Caenorhabditis elegans microRNAs are individually not essential for development or viability. PLoS Genet., 3, e215 (2007)[PubMed]
- Olive, V., Jiang, I. & He, L.: mir-17-92, a cluster of miRNAs in the midst of the cancer network. Int. J. Biochem. Cell Biol., 42, 1348-1354 (2010)[PubMed]
- Ota, A., Tagawa, H., Karnan, S. et al.: Identification and characterization of a novel gene, C13orf25, as a target for 13q31-q32 amplification in malignant lymphoma. Cancer Res., 64, 3087-3095 (2004)[PubMed]
- He, L., Thomson, J., Hemann, M. et al.: A microRNA polycistron as a potential human oncogene. Nature, 435, 828-833 (2005)[PubMed]
著者プロフィール
略歴:2013年 東京大学大学院薬学系研究科博士課程 修了,同年より大鵬薬品工業つくば研究センター 研究員.
研究テーマ:がんの分子標的薬の研究開発.
抱負:より効果的な抗がん剤の創出をつうじて,よりよい社会づくりに貢献したい.
福山 征光(Masamitsu Fukuyama)
東京大学大学院薬学系研究科 助教.
© 2013 春日秀文・福山征光 Licensed under CC 表示 2.1 日本