中枢神経においてランビエ絞輪を形成する3つの機序
薄 敬一郎・Matthew N. Rasband
(米国Baylor College of Medicine,Department of Neuroscience)
email:薄 敬一郎
DOI: 10.7875/first.author.2013.068
Three mechanisms assemble central nervous system nodes of Ranvier.
Keiichiro Susuki, Kae-Jiun Chang, Daniel R. Zollinger, Yanhong Liu, Yasuhiro Ogawa, Yael Eshed-Eisenbach, María T. Dours-Zimmermann, Juan A. Oses-Prieto, Alma L. Burlingame, Constanze I. Seidenbecher, Dieter R. Zimmermann, Toshitaka Oohashi, Elior Peles, Matthew N. Rasband
Neuron, 78, 469-482 (2013)
有髄神経における活動電位のすみやかな伝導には,ランビエ絞輪における電位依存性Na+チャネルの集積が不可欠である.しかし,ランビエ絞輪の形成機序は,とくに中枢神経においてはいまだ十分に解明されていない.この研究では,中枢神経におけるランビエ絞輪の形成には,つぎの3つの異なる機序がはたらいていることを示した.1)細胞外マトリックスタンパク質複合体により軸索膜において細胞接着分子が集積される.2)傍絞輪部における軸索とグリア細胞との結合が軸索膜におけるタンパク質の拡散を制限する.3)軸索のもつ細胞骨格がNa+チャネルを含むタンパク質複合体をさらに安定化させる.おのおのの機序1つだけを破壊した変異マウスではランビエ絞輪はほぼ正常に形成された.しかし,2つの機序を同時に破壊すると,どの組合せの場合も顕著な神経症状によりマウスは早期に死亡し,中枢神経においてはランビエ絞輪の著明な減少が認められた.これらの結果により,細胞外マトリックスタンパク質との結合,傍絞輪部による拡散の制限,軸索の細胞骨格による安定化,の3つの異なる機序が相互に関連してはたらくことにより,中枢神経においてランビエ絞輪が形成されることが示された.
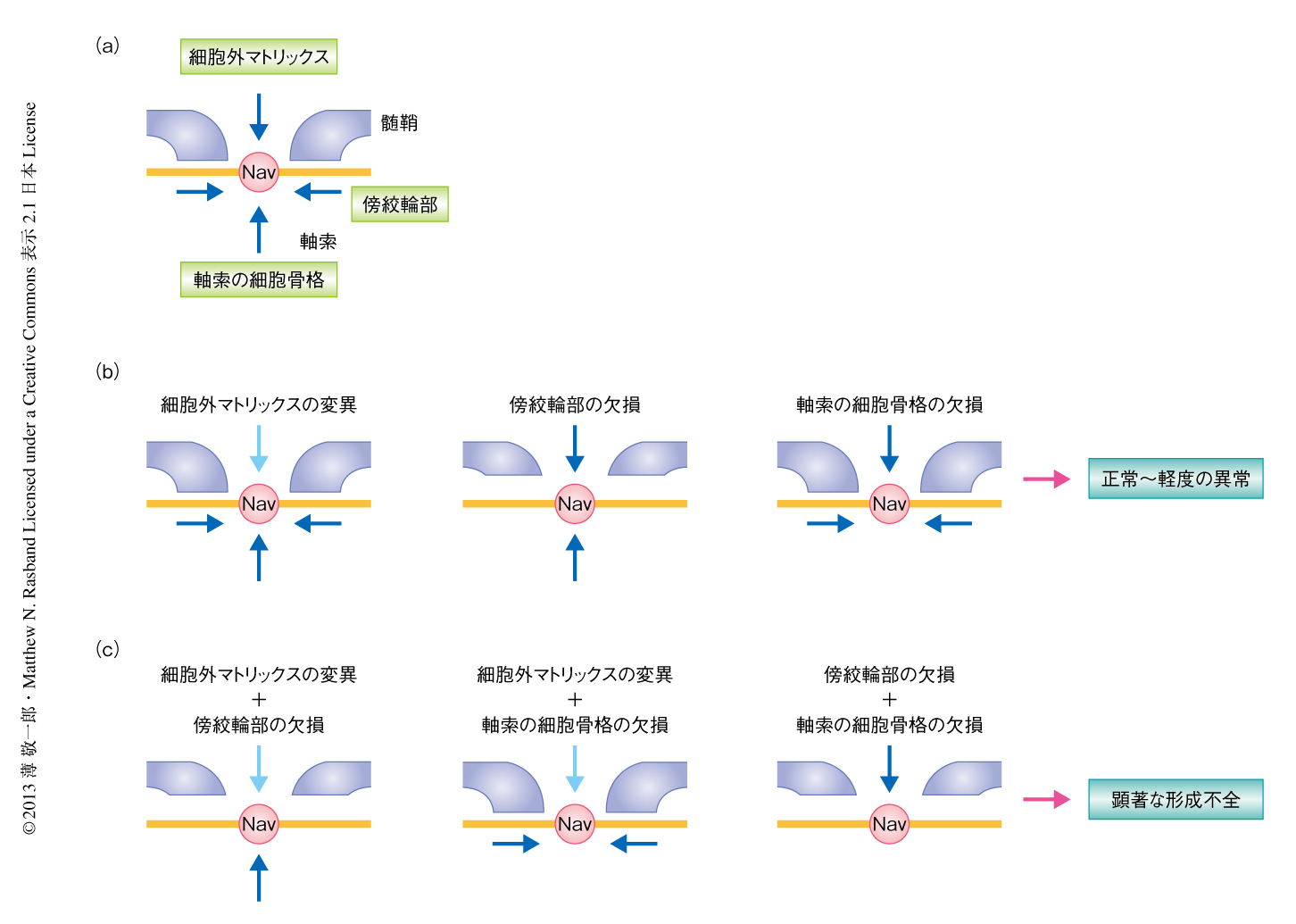
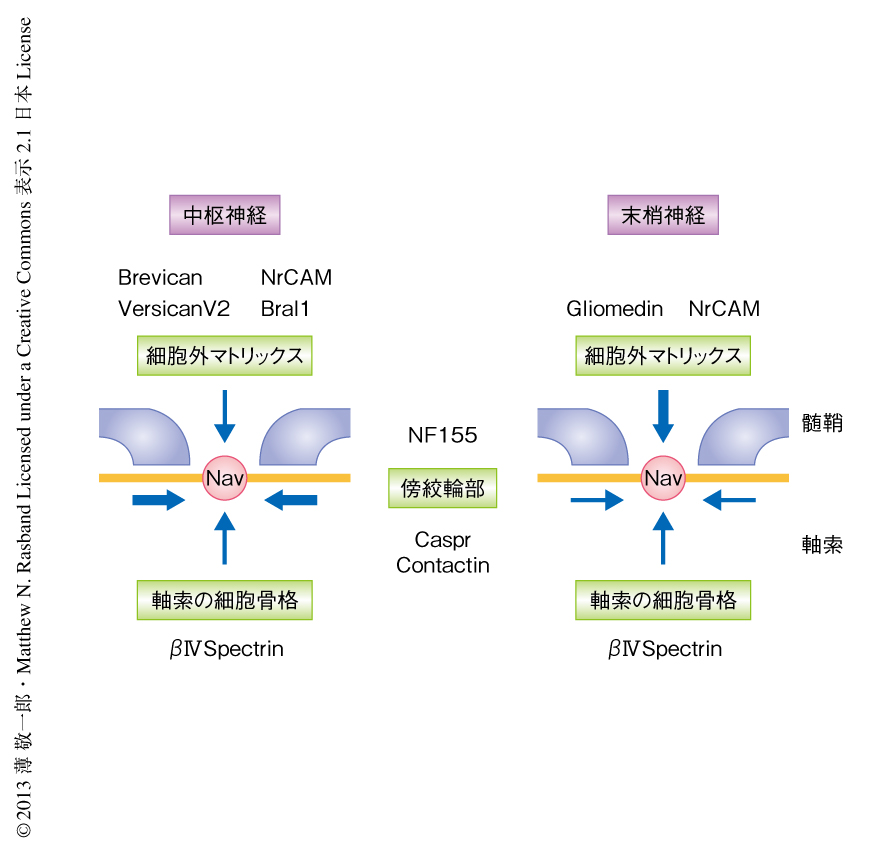
有髄神経線維には隣接する髄鞘のあいだにランビエ絞輪とよばれる長さ約1μmの小さな構造が存在する.ランビエ絞輪にはイオンチャネルや細胞接着分子,細胞骨格タンパク質などさまざまなタンパク質が集積してタンパク質複合体を形成している1).なかでも重要なのが,活動電位の発生に寄与する電位依存性Na+チャネルである.髄鞘による絶縁とランビエ絞輪へのNa+チャネルの集積により,跳躍伝導とよばれる神経活動電位のすみやかな伝導が可能になっている.ランビエ絞輪は軸索と髄鞘を形成するグリア細胞(中枢神経ではオリゴデンドロサイト,末梢神経ではシュワン細胞)との相互作用により形成される.末梢神経ではシュワン細胞に由来する細胞外マトリックスタンパク質GliomedinおよびNrCAMが軸索膜に存在する細胞接着分子NF186(Neurofascin186)と結合し,これを形成の途中の髄鞘の先端部に集積させる2).髄鞘の先端部では軸索と髄鞘とのあいだに結合が形成され(傍絞輪部ジャンクション),NF186の拡散を防いでいる.NF186およびNa+チャネルは細胞骨格タンパク質であるAnkyrin Gと結合している.これらのタンパク質複合体はAnkyrin Gが細胞骨格タンパク質であるβIV spectrinを介しアクチンと結合することによりさらに安定化されている.このように,ランビエ絞輪の形成には,細胞外マトリックスタンパク質との結合,傍絞輪部による拡散の制限,軸索の細胞骨格による安定化,の3つの異なる機序がはたらいていることが想定されていた3)(図1a).しかしながら,これら3つの機序のうち1つを破壊した変異マウスの報告が複数あるが,いずれもランビエ絞輪は正常に形成あるいはごく軽度の異常にとどまっていた(図1b).また,有髄神経の構造や構成タンパク質がやや異なることから中枢神経と末梢神経とは機序が異なるものと推定され,その詳細は不明であった.そこで,この研究では,とくに中枢神経においてランビエ絞輪へのNa+チャネルの集積の機序を解明することを目的とした.
ランビエ絞輪におけるタンパク質複合体の形成の初期においてNF186はきわめて重要なタンパク質である.NF186が中枢神経においてどのような機序によりランビエ絞輪に集積するかを解析するため,種々のドメインを欠損した変異NF186を作製し,子宮内電気穿孔法によりマウスの大脳皮質のニューロンに導入した.生後28日目に脳梁を解析したところ,野生型NF186および細胞内ドメインを欠損した変異NF186はともにランビエ絞輪への局在を示した.一方,細胞外ドメインを欠損した変異NF186はランビエ絞輪のほかにも局在したものの,ランビエ絞輪においてとくに高い集積を示した.また,細胞外ドメインおよびAnkyrin G結合ドメインを欠損した変異NF186はランビエ絞輪への集積を示さなかった.したがって,細胞外のタンパク質との相互作用および細胞内のタンパク質との相互作用のいずれも,中枢神経においてNF186をランビエ絞輪に集積させるのに十分であることが明らかになった.
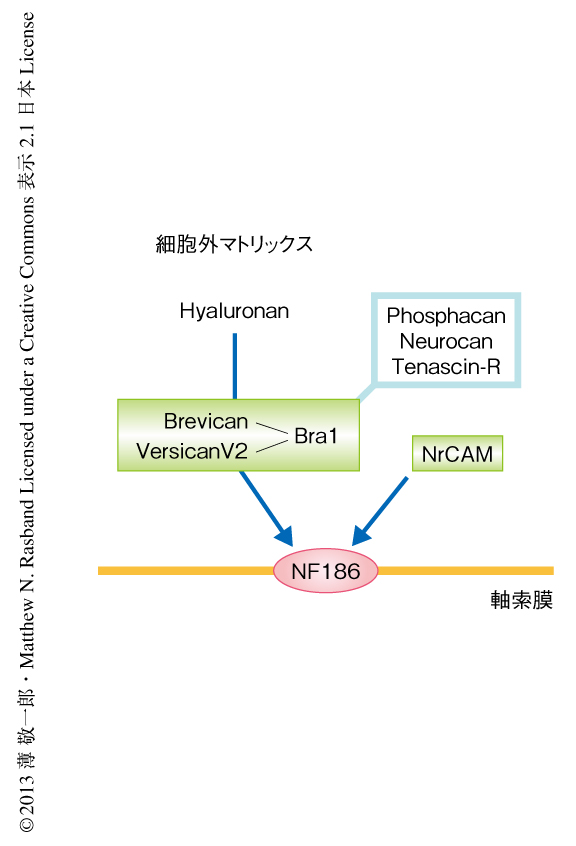
オリゴデンドロサイトに由来する可溶性のタンパク質がランビエ絞輪におけるタンパク質複合体の形成を促すことが知られていたが4),その詳細な分子機構は明らかではなかった.そこで,とくにNF186との相互作用に着目し,中枢神経においてランビエ絞輪の細胞外マトリックスに局在するタンパク質を解析した.プロテオグリカンであるBrevicanおよびVersican V2,さらに,リンクタンパク質であるBral1は,中枢神経においてランビエ絞輪の細胞外マトリックスに豊富に存在することが知られている.これらにくわえ,細胞接着分子であるNrCAMも細胞外へと分泌され中枢神経においてランビエ絞輪の細胞外マトリックスに集積することを見い出した.そのほか,Phosphacan,Tenascin-R,Neurocanのランビエ絞輪への局在が知られているが,それらの集積はBrevicanノックアウトマウスおよびVersican V2ノックアウトマウスでは消失することから,ランビエ絞輪の形成に中心的な役割をはたしているとは考えにくい.Brevican,Versican V2,Bral1,NrCAMをCOS7細胞の培養液にくわえたところ,細胞膜に発現させたNF186と結合した.また,プルダウンアッセイにおいても,Brevican,Versican V2,Bral1はNF186と直接に結合することが確認された.さらに,ラットの後根神経節神経細胞の培養液にBrevicanあるいはNrCAMをくわえると,軸索に発現したNF186と結合しクラスターを形成した.また,Bral1はBrevicanおよびVersican V2,さらに,ヒアルロン酸とも結合することにより,これらの細胞外マトリックスタンパク質複合体を安定化させていることが示された.以上より,中枢神経においてランビエ絞輪の形成にはたらく細胞外マトリックスタンパク質は,Brevican,Versican V2,Bral1からなるタンパク質複合体,ならびに,NrCAMであることが明らかになった(図2).
ラットの視神経におけるランビエ絞輪の発達の過程を免疫組織染色により詳細に調べたところ,傍絞輪部の軸索膜に存在するタンパク質であるCasprの集積が最初に観察された.NF186の集積はCasprの染色に隣接して認められた.軸索の細胞骨格タンパク質であるβIV spectrinの染色はNF186と時期および局在ともほぼ一致していた.しかし,細胞外マトリックスタンパク質であるBrevican,Versican V2,Bral1の集積はNF186よりかなり遅れて出現した.これらの所見は,中枢神経におけるランビエ絞輪の発達の過程では,傍絞輪部が主体の機序であることを示唆した.一方,末梢神経におけるランビエ絞輪の発達の過程では,最初に細胞外マトリックスタンパク質であるGliomedinが出現しNF186の集積を形成することから5),細胞外マトリックスが主体の機序であることが推察される.
以前の研究やさきの実験結果から,細胞外マトリックス,傍絞輪部,軸索の細胞骨格がランビエ絞輪の形成にかかわっていることが示唆された.しかし,おのおのの変異マウスではランビエ絞輪は正常ないしごく軽微の変化にとどまっており,それぞれの役割に関しては議論の余地があった.これらの結果からは,それぞれの機序は独立してランビエ絞輪の形成にはたらくものの,通常の発達の過程では互いに補完しあい,1つの機序が欠けた場合は残る2つの機序により代償されるという可能性が考えられた.この仮説を証明するため,3つのうち2つの機序が同時に破壊された変異マウスを作製しその影響を調べた.
細胞外マトリックスタンパク質のノックアウトマウスとしてBrevicanノックアウトマウス6),Versicanノックアウトマウス7),Bral1ノックアウトマウス8),Brevican Versicanダブルノックアウトマウスと,傍絞輪部ジャンクションを欠損するCasprノックアウトマウス9) とを交配し,軸索の細胞骨格のみが正常にはたらいている状態の変異マウスを作製した(図1c).これらの変異マウスでは細胞外マトリックスタンパク質複合体は完全には消失していないものの,生後2週以降に失調などの神経症状や体重の減少などを示し,早いケースでは生後3週前後で死亡した.生後18日目において視神経を解析したところ,これらの変異マウスでは単一のノックアウトマウスまたは野生型マウスに比べ,ランビエ絞輪の数が有意に減少していた.髄鞘や軸索の形成に異常はみられなかった.なお,Brevican,Versican V2,Bral1は末梢神経においてランビエ絞輪には集積していないため,これらの変異マウスの末梢神経では単一のノックアウトマウスと比べ明らかな差はみられなかった.これらの結果から,細胞外マトリックスと傍絞輪部とが共同して中枢神経におけるランビエ絞輪の形成にはたらくこと,残った軸索の細胞骨格と細胞外マトリックスタンパク質によりランビエ絞輪が形成されるものの十分ではないことが示された.
細胞外マトリックスタンパク質のノックアウトマウスとしてBrevicanノックアウトマウスあるいはVersicanノックアウトマウスと,軸索の細胞骨格タンパク質であるβIV spectrinに変異をもつqv3J変異マウス10) とを交配し,傍絞輪部ジャンクションのみが正常にはたらいている状態の変異マウスを作製した(図1c).これらの変異マウスは,細胞外マトリックスと傍絞輪部とを同時に破壊した変異マウスより比較的軽度ではあるものの,生後2週以降に失調などの神経症状や体重の減少などを示し,その多くは生後4週までに死亡した.生後18日目の視神経においては,Versicanノックアウトqv3J変異マウスでは軽度であったが,Brevicanノックアウトqv3J変異マウスでは単一の変異マウスまたは野生型マウスに比べランビエ絞輪の数が有意に減少していた.髄鞘や軸索の形成に大きな異常はみられず,末梢神経についても単一の変異マウスと比べてとくに大きな差はみられなかった.これらの結果から,細胞外マトリックスと軸索の細胞骨格とが共同して中枢神経におけるランビエ絞輪の形成にはたらくこと,残った傍絞輪部と細胞外マトリックスタンパク質によりランビエ絞輪が形成されるものの十分ではないことが示された.
傍絞輪部ジャンクションを欠損するCasprノックアウトマウスと,軸索の細胞骨格に変異をもつqv3J変異マウスとを交配し,細胞外マトリックスのみが正常にはたらいている状態の変異マウスを作製した(図1c).この変異マウスでは傍絞輪部ジャンクションと軸索におけるβIV spectrinとが完全に消失していることを免疫組織染色により確認した.この変異マウスは生後2週以降に顕著な神経症状や体重の減少をともなう全身状態の悪化を示し,その多くは生後18日前後に死亡した.生後18日目の視神経および脊髄においてランビエ絞輪におけるNa+チャネルの数は顕著に減少していた.残ったNa+チャネルも長さが一定でないなど明らかな形態の異常を認め,その多くはBrevicanやVersicanの集積をともなっていた.視神経における活動電位の伝導速度は有意に遅延していた.髄鞘や軸索の形成に大きな異常はみられなかった.これらの結果から,傍絞輪部と軸索の細胞骨格とが共同して中枢神経におけるランビエ絞輪の形成にはたらくこと,細胞外マトリックスタンパク質にはランビエ絞輪を形成する作用はあるものの十分ではないことが示された.
中枢神経と末梢神経とで傍絞輪部と軸索の細胞骨格における構成タンパク質は共通している(図3).したがって,Casprノックアウトqv3J変異マウスの末梢神経においても細胞外マトリックスタンパク質のみがランビエ絞輪の形成にはたらいている状況にある.しかしながら,この変異マウスの坐骨神経においてランビエ絞輪はほぼ正常に形成されており,Casprノックアウトマウスと比べ差はみられなかった.また,末梢神経における活動電位の伝導速度もCasprノックアウトマウスと比べ有意な差はなかった.したがって,末梢神経において細胞外マトリックスタンパク質は単独でもランビエ絞輪をほぼ正常に形成しうることがわかった.
この研究では,中枢神経におけるランビエ絞輪の細胞外マトリックスの構成タンパク質(図2),さらに,3つの機序が相互に関連しながらランビエ絞輪においてNa+チャネルを集積すること(図3)を明らかにした.第1の機序として,細胞外マトリックスに局在するタンパク質(中枢神経ではBrevican,Versican V2,Bral1,NrCAM,末梢神経ではGliomedin,NrCAM)が軸索膜に存在するNF186と結合し,そのランビエ絞輪への集積を促す2,4,5).末梢神経におけるランビエ絞輪の形成ではこの機序が主体としてはたらいている.第2に,傍絞輪部において軸索のタンパク質CasprおよびContactinが髄鞘のNF155と結合することにより軸索とグリア細胞とのあいだに傍絞輪部ジャンクションが形成され,ランビエ絞輪の軸索膜に局在するタンパク質の拡散を制限するバリアとしてはたらく2,11).中枢神経におけるランビエ絞輪の形成ではこの機序が主体としてはたらいている.第3に,軸索の細胞骨格のAnkyrinGおよびβIV spectrinを介したアクチンへの結合により,ランビエ絞輪においてタンパク質複合体がさらに安定化される.有髄神経の跳躍伝導に不可欠なランビエ絞輪におけるNa+チャネルの集積をより確実に形成するため,これら3つの相互に補完しうる機序が存在するものと考えられた.
略歴:2001年 横浜市立大学大学院医学研究科にて博士号取得,2005年 米国Connecticut大学 研究員,2007年 米国Baylor College of Medicine研究員を経て,2008年より同Assistant Professor.
研究テーマ:有髄神経の形成,維持,傷害,再生の機序.
抱負:基礎科学と病態生理との橋わたしから,神経疾患の治療へと結びつけたい.
Matthew N. Rasband
米国Baylor College of MedicineにてProfessor.
研究室URL:http://neuro.bcm.edu/rasbandlab/
© 2013 薄 敬一郎・Matthew N. Rasband Licensed under CC 表示 2.1 日本
(米国Baylor College of Medicine,Department of Neuroscience)
email:薄 敬一郎
DOI: 10.7875/first.author.2013.068
Three mechanisms assemble central nervous system nodes of Ranvier.
Keiichiro Susuki, Kae-Jiun Chang, Daniel R. Zollinger, Yanhong Liu, Yasuhiro Ogawa, Yael Eshed-Eisenbach, María T. Dours-Zimmermann, Juan A. Oses-Prieto, Alma L. Burlingame, Constanze I. Seidenbecher, Dieter R. Zimmermann, Toshitaka Oohashi, Elior Peles, Matthew N. Rasband
Neuron, 78, 469-482 (2013)
要 約
有髄神経における活動電位のすみやかな伝導には,ランビエ絞輪における電位依存性Na+チャネルの集積が不可欠である.しかし,ランビエ絞輪の形成機序は,とくに中枢神経においてはいまだ十分に解明されていない.この研究では,中枢神経におけるランビエ絞輪の形成には,つぎの3つの異なる機序がはたらいていることを示した.1)細胞外マトリックスタンパク質複合体により軸索膜において細胞接着分子が集積される.2)傍絞輪部における軸索とグリア細胞との結合が軸索膜におけるタンパク質の拡散を制限する.3)軸索のもつ細胞骨格がNa+チャネルを含むタンパク質複合体をさらに安定化させる.おのおのの機序1つだけを破壊した変異マウスではランビエ絞輪はほぼ正常に形成された.しかし,2つの機序を同時に破壊すると,どの組合せの場合も顕著な神経症状によりマウスは早期に死亡し,中枢神経においてはランビエ絞輪の著明な減少が認められた.これらの結果により,細胞外マトリックスタンパク質との結合,傍絞輪部による拡散の制限,軸索の細胞骨格による安定化,の3つの異なる機序が相互に関連してはたらくことにより,中枢神経においてランビエ絞輪が形成されることが示された.
はじめに
有髄神経線維には隣接する髄鞘のあいだにランビエ絞輪とよばれる長さ約1μmの小さな構造が存在する.ランビエ絞輪にはイオンチャネルや細胞接着分子,細胞骨格タンパク質などさまざまなタンパク質が集積してタンパク質複合体を形成している1).なかでも重要なのが,活動電位の発生に寄与する電位依存性Na+チャネルである.髄鞘による絶縁とランビエ絞輪へのNa+チャネルの集積により,跳躍伝導とよばれる神経活動電位のすみやかな伝導が可能になっている.ランビエ絞輪は軸索と髄鞘を形成するグリア細胞(中枢神経ではオリゴデンドロサイト,末梢神経ではシュワン細胞)との相互作用により形成される.末梢神経ではシュワン細胞に由来する細胞外マトリックスタンパク質GliomedinおよびNrCAMが軸索膜に存在する細胞接着分子NF186(Neurofascin186)と結合し,これを形成の途中の髄鞘の先端部に集積させる2).髄鞘の先端部では軸索と髄鞘とのあいだに結合が形成され(傍絞輪部ジャンクション),NF186の拡散を防いでいる.NF186およびNa+チャネルは細胞骨格タンパク質であるAnkyrin Gと結合している.これらのタンパク質複合体はAnkyrin Gが細胞骨格タンパク質であるβIV spectrinを介しアクチンと結合することによりさらに安定化されている.このように,ランビエ絞輪の形成には,細胞外マトリックスタンパク質との結合,傍絞輪部による拡散の制限,軸索の細胞骨格による安定化,の3つの異なる機序がはたらいていることが想定されていた3)(図1a).しかしながら,これら3つの機序のうち1つを破壊した変異マウスの報告が複数あるが,いずれもランビエ絞輪は正常に形成あるいはごく軽度の異常にとどまっていた(図1b).また,有髄神経の構造や構成タンパク質がやや異なることから中枢神経と末梢神経とは機序が異なるものと推定され,その詳細は不明であった.そこで,この研究では,とくに中枢神経においてランビエ絞輪へのNa+チャネルの集積の機序を解明することを目的とした.
1.NF186は中枢神経において細胞外あるいは細胞内との関連によりランビエ絞輪に集積する
ランビエ絞輪におけるタンパク質複合体の形成の初期においてNF186はきわめて重要なタンパク質である.NF186が中枢神経においてどのような機序によりランビエ絞輪に集積するかを解析するため,種々のドメインを欠損した変異NF186を作製し,子宮内電気穿孔法によりマウスの大脳皮質のニューロンに導入した.生後28日目に脳梁を解析したところ,野生型NF186および細胞内ドメインを欠損した変異NF186はともにランビエ絞輪への局在を示した.一方,細胞外ドメインを欠損した変異NF186はランビエ絞輪のほかにも局在したものの,ランビエ絞輪においてとくに高い集積を示した.また,細胞外ドメインおよびAnkyrin G結合ドメインを欠損した変異NF186はランビエ絞輪への集積を示さなかった.したがって,細胞外のタンパク質との相互作用および細胞内のタンパク質との相互作用のいずれも,中枢神経においてNF186をランビエ絞輪に集積させるのに十分であることが明らかになった.
2.中枢神経の細胞外マトリックスタンパク質は軸索膜のNF186に直接に結合しその集積を促す
オリゴデンドロサイトに由来する可溶性のタンパク質がランビエ絞輪におけるタンパク質複合体の形成を促すことが知られていたが4),その詳細な分子機構は明らかではなかった.そこで,とくにNF186との相互作用に着目し,中枢神経においてランビエ絞輪の細胞外マトリックスに局在するタンパク質を解析した.プロテオグリカンであるBrevicanおよびVersican V2,さらに,リンクタンパク質であるBral1は,中枢神経においてランビエ絞輪の細胞外マトリックスに豊富に存在することが知られている.これらにくわえ,細胞接着分子であるNrCAMも細胞外へと分泌され中枢神経においてランビエ絞輪の細胞外マトリックスに集積することを見い出した.そのほか,Phosphacan,Tenascin-R,Neurocanのランビエ絞輪への局在が知られているが,それらの集積はBrevicanノックアウトマウスおよびVersican V2ノックアウトマウスでは消失することから,ランビエ絞輪の形成に中心的な役割をはたしているとは考えにくい.Brevican,Versican V2,Bral1,NrCAMをCOS7細胞の培養液にくわえたところ,細胞膜に発現させたNF186と結合した.また,プルダウンアッセイにおいても,Brevican,Versican V2,Bral1はNF186と直接に結合することが確認された.さらに,ラットの後根神経節神経細胞の培養液にBrevicanあるいはNrCAMをくわえると,軸索に発現したNF186と結合しクラスターを形成した.また,Bral1はBrevicanおよびVersican V2,さらに,ヒアルロン酸とも結合することにより,これらの細胞外マトリックスタンパク質複合体を安定化させていることが示された.以上より,中枢神経においてランビエ絞輪の形成にはたらく細胞外マトリックスタンパク質は,Brevican,Versican V2,Bral1からなるタンパク質複合体,ならびに,NrCAMであることが明らかになった(図2).
3.中枢神経におけるランビエ絞輪の発達の過程では傍絞輪部の形成が先行する
ラットの視神経におけるランビエ絞輪の発達の過程を免疫組織染色により詳細に調べたところ,傍絞輪部の軸索膜に存在するタンパク質であるCasprの集積が最初に観察された.NF186の集積はCasprの染色に隣接して認められた.軸索の細胞骨格タンパク質であるβIV spectrinの染色はNF186と時期および局在ともほぼ一致していた.しかし,細胞外マトリックスタンパク質であるBrevican,Versican V2,Bral1の集積はNF186よりかなり遅れて出現した.これらの所見は,中枢神経におけるランビエ絞輪の発達の過程では,傍絞輪部が主体の機序であることを示唆した.一方,末梢神経におけるランビエ絞輪の発達の過程では,最初に細胞外マトリックスタンパク質であるGliomedinが出現しNF186の集積を形成することから5),細胞外マトリックスが主体の機序であることが推察される.
4.細胞外マトリックスと傍絞輪部との同時破壊により中枢神経においてランビエ絞輪が減少する
以前の研究やさきの実験結果から,細胞外マトリックス,傍絞輪部,軸索の細胞骨格がランビエ絞輪の形成にかかわっていることが示唆された.しかし,おのおのの変異マウスではランビエ絞輪は正常ないしごく軽微の変化にとどまっており,それぞれの役割に関しては議論の余地があった.これらの結果からは,それぞれの機序は独立してランビエ絞輪の形成にはたらくものの,通常の発達の過程では互いに補完しあい,1つの機序が欠けた場合は残る2つの機序により代償されるという可能性が考えられた.この仮説を証明するため,3つのうち2つの機序が同時に破壊された変異マウスを作製しその影響を調べた.
細胞外マトリックスタンパク質のノックアウトマウスとしてBrevicanノックアウトマウス6),Versicanノックアウトマウス7),Bral1ノックアウトマウス8),Brevican Versicanダブルノックアウトマウスと,傍絞輪部ジャンクションを欠損するCasprノックアウトマウス9) とを交配し,軸索の細胞骨格のみが正常にはたらいている状態の変異マウスを作製した(図1c).これらの変異マウスでは細胞外マトリックスタンパク質複合体は完全には消失していないものの,生後2週以降に失調などの神経症状や体重の減少などを示し,早いケースでは生後3週前後で死亡した.生後18日目において視神経を解析したところ,これらの変異マウスでは単一のノックアウトマウスまたは野生型マウスに比べ,ランビエ絞輪の数が有意に減少していた.髄鞘や軸索の形成に異常はみられなかった.なお,Brevican,Versican V2,Bral1は末梢神経においてランビエ絞輪には集積していないため,これらの変異マウスの末梢神経では単一のノックアウトマウスと比べ明らかな差はみられなかった.これらの結果から,細胞外マトリックスと傍絞輪部とが共同して中枢神経におけるランビエ絞輪の形成にはたらくこと,残った軸索の細胞骨格と細胞外マトリックスタンパク質によりランビエ絞輪が形成されるものの十分ではないことが示された.
5.細胞外マトリックスと軸索の細胞骨格との同時破壊により中枢神経においてランビエ絞輪が減少する
細胞外マトリックスタンパク質のノックアウトマウスとしてBrevicanノックアウトマウスあるいはVersicanノックアウトマウスと,軸索の細胞骨格タンパク質であるβIV spectrinに変異をもつqv3J変異マウス10) とを交配し,傍絞輪部ジャンクションのみが正常にはたらいている状態の変異マウスを作製した(図1c).これらの変異マウスは,細胞外マトリックスと傍絞輪部とを同時に破壊した変異マウスより比較的軽度ではあるものの,生後2週以降に失調などの神経症状や体重の減少などを示し,その多くは生後4週までに死亡した.生後18日目の視神経においては,Versicanノックアウトqv3J変異マウスでは軽度であったが,Brevicanノックアウトqv3J変異マウスでは単一の変異マウスまたは野生型マウスに比べランビエ絞輪の数が有意に減少していた.髄鞘や軸索の形成に大きな異常はみられず,末梢神経についても単一の変異マウスと比べてとくに大きな差はみられなかった.これらの結果から,細胞外マトリックスと軸索の細胞骨格とが共同して中枢神経におけるランビエ絞輪の形成にはたらくこと,残った傍絞輪部と細胞外マトリックスタンパク質によりランビエ絞輪が形成されるものの十分ではないことが示された.
6.傍絞輪部と軸索の細胞骨格との同時破壊により中枢神経においてランビエ絞輪が減少する
傍絞輪部ジャンクションを欠損するCasprノックアウトマウスと,軸索の細胞骨格に変異をもつqv3J変異マウスとを交配し,細胞外マトリックスのみが正常にはたらいている状態の変異マウスを作製した(図1c).この変異マウスでは傍絞輪部ジャンクションと軸索におけるβIV spectrinとが完全に消失していることを免疫組織染色により確認した.この変異マウスは生後2週以降に顕著な神経症状や体重の減少をともなう全身状態の悪化を示し,その多くは生後18日前後に死亡した.生後18日目の視神経および脊髄においてランビエ絞輪におけるNa+チャネルの数は顕著に減少していた.残ったNa+チャネルも長さが一定でないなど明らかな形態の異常を認め,その多くはBrevicanやVersicanの集積をともなっていた.視神経における活動電位の伝導速度は有意に遅延していた.髄鞘や軸索の形成に大きな異常はみられなかった.これらの結果から,傍絞輪部と軸索の細胞骨格とが共同して中枢神経におけるランビエ絞輪の形成にはたらくこと,細胞外マトリックスタンパク質にはランビエ絞輪を形成する作用はあるものの十分ではないことが示された.
中枢神経と末梢神経とで傍絞輪部と軸索の細胞骨格における構成タンパク質は共通している(図3).したがって,Casprノックアウトqv3J変異マウスの末梢神経においても細胞外マトリックスタンパク質のみがランビエ絞輪の形成にはたらいている状況にある.しかしながら,この変異マウスの坐骨神経においてランビエ絞輪はほぼ正常に形成されており,Casprノックアウトマウスと比べ差はみられなかった.また,末梢神経における活動電位の伝導速度もCasprノックアウトマウスと比べ有意な差はなかった.したがって,末梢神経において細胞外マトリックスタンパク質は単独でもランビエ絞輪をほぼ正常に形成しうることがわかった.
おわりに
この研究では,中枢神経におけるランビエ絞輪の細胞外マトリックスの構成タンパク質(図2),さらに,3つの機序が相互に関連しながらランビエ絞輪においてNa+チャネルを集積すること(図3)を明らかにした.第1の機序として,細胞外マトリックスに局在するタンパク質(中枢神経ではBrevican,Versican V2,Bral1,NrCAM,末梢神経ではGliomedin,NrCAM)が軸索膜に存在するNF186と結合し,そのランビエ絞輪への集積を促す2,4,5).末梢神経におけるランビエ絞輪の形成ではこの機序が主体としてはたらいている.第2に,傍絞輪部において軸索のタンパク質CasprおよびContactinが髄鞘のNF155と結合することにより軸索とグリア細胞とのあいだに傍絞輪部ジャンクションが形成され,ランビエ絞輪の軸索膜に局在するタンパク質の拡散を制限するバリアとしてはたらく2,11).中枢神経におけるランビエ絞輪の形成ではこの機序が主体としてはたらいている.第3に,軸索の細胞骨格のAnkyrinGおよびβIV spectrinを介したアクチンへの結合により,ランビエ絞輪においてタンパク質複合体がさらに安定化される.有髄神経の跳躍伝導に不可欠なランビエ絞輪におけるNa+チャネルの集積をより確実に形成するため,これら3つの相互に補完しうる機序が存在するものと考えられた.
文 献
- Salzer, J. L.: Polarized domains of myelinated axons. Neuron, 40, 297-318 (2003)[PubMed]
- Feinberg, K., Eshed-Eisenbach, Y., Frechter, S. et al.: A glial signal consisting of gliomedin and NrCAM clusters axonal Na+ channels during the formation of nodes of Ranvier. Neuron, 65, 490-502 (2010)[PubMed]
- Susuki, K. & Rasband, M. N.: Molecular mechanisms of node of Ranvier formation. Curr. Opin. Cell Biol., 20, 616-623 (2008)[PubMed]
- Kaplan, M. R., Meyer-Franke, A., Lambert, S. et al.: Induction of sodium channel clustering by oligodendrocytes. Nature, 386, 724-728 (1997)[PubMed]
- Eshed, Y., Feinberg, K., Poliak, S. et al.: Gliomedin mediates schwann cell-axon interaction and the molecular assembly of the nodes of Ranvier. Neuron, 47, 215-229 (2005)[PubMed]
- Brakebusch, C., Seidenbecher, C. I., Asztely, F. et al.: Brevican-deficient mice display impaired hippocampal CA1 long-term potentiation but show no obvious deficits in learning and memory. Mol. Cell. Biol., 22, 7417-7427 (2002)[PubMed]
- Dours-Zimmerman, M. T., Maurer, K., Rauch, U. et al.: Versican V2 assembles the extracellular matrix surrounding the nodes of Ranvier in the central nervous system. J. Neurosci., 29, 7731-7742 (2009)[PubMed]
- Bekku, Y., Vargova, L., Goto, Y. et al.: Bral1: its role in diffusion barrier formation and conduction velocity in the CNS. J. Neurosci., 30, 3113-3123 (2010)[PubMed]
- Gollan, L., Salomon, D., Salzer, J. L. et al.: Caspr regulates the processing of contactin and inhibits its binding to neurofascin. J. Cell Biol., 163, 1213-1218 (2003)[PubMed]
- Parkinson, N. J., Olsson, C. L., Hallows, J. L. et al.: Mutant β-spectrin 4 causes auditory and motor neuropathies in quivering mice. Nat. Genet., 29, 61-65 (2001)[PubMed]
- Rios, J. C., Rubin, M., St Martin, M. et al.: Paranodal interactions regulate expression of sodium channel subtypes and provide a diffusion barrier for the node of Ranvier. J. Neurosci., 23, 7001-7011 (2003)[PubMed]
著者プロフィール
略歴:2001年 横浜市立大学大学院医学研究科にて博士号取得,2005年 米国Connecticut大学 研究員,2007年 米国Baylor College of Medicine研究員を経て,2008年より同Assistant Professor.
研究テーマ:有髄神経の形成,維持,傷害,再生の機序.
抱負:基礎科学と病態生理との橋わたしから,神経疾患の治療へと結びつけたい.
Matthew N. Rasband
米国Baylor College of MedicineにてProfessor.
研究室URL:http://neuro.bcm.edu/rasbandlab/
© 2013 薄 敬一郎・Matthew N. Rasband Licensed under CC 表示 2.1 日本