ヒストンのアセチル化によるスイッチはクロマチンリモデリング酵素によるヒストンH2A.Zの蓄積を制御する
渡邉慎也・Craig L. Peterson
(米国Massachusetts大学Medical School,Program in Molecular Medicine)
email:渡邉慎也
DOI: 10.7875/first.author.2013.069
A histone acetylation switch regulates H2A.Z deposition by the SWR-C remodeling enzyme.
Shinya Watanabe, Marta Radman-Livaja, Oliver J. Rando, Craig L. Peterson
Science, 340, 195-199 (2013)
ヒストンH2AのバリアントであるヒストンH2A.Zは,遺伝子発現,DNA修復,セントロメアの機能などにおいて重要な役割をはたしている.ヒストンH2A.Zのクロマチンへの蓄積は,遊離のヒストンH2A.ZとヌクレオソームにあるヒストンH2Aとの交換反応を触媒するクロマチンリモデリング酵素SWR-Cにより制御されている.今回,筆者らは,ヒストンH3の56番目のLysのアセチル化はSWR-Cの基質特異性を変化させ,無秩序なヒストン交換反応をひき起こすことを報告した.また,SWR-Cの広く保存されたサブユニットであるSwc2pは,ヒストンH2A.Zをヌクレオソームから放出するSWR-Cの活性を阻害する機能をもつことを見い出した.さらに,ChIP-seq法を用いたヒストンH2A.Zのゲノム全領域にわたる解析により,56番目のLysが過剰にアセチル化されたヒストンH3をもつ出芽酵母の変異株では,クロマチンにおいてヒストンH2A.Zが広範囲にわたり減少していることが明らかになり,細胞においても同様の現象が確認された.筆者らの研究成果は,クロマチンリモデリングを制御するヒストン修飾を同定するとともに,ヌクレオソームのターンオーバーの制御機構を理解するうえで新たな知見をあたえるものであった.
ヒストンH2AのバリアントであるヒストンH2A.Zは,とりわけRNAポリメラーゼIIにより転写される遺伝子のプロモーター領域の両側に位置するヌクレオソームに局在しており,また,クロマチン境界領域,セントロメア,DNA複製起点の両側に位置するヌクレオソームにも局在している1,2).これらのヌクレオソームはホットヌクレオソームとよばれ,DNA複製に非依存的に迅速にターンオーバーされるという特徴をもつ3).ヌクレオソームのターンオーバーはダイナミックな過程であり,遺伝子発現の制御,ならびに,ヒストン修飾を消去することでエピゲノムの可塑性に寄与していると考えられている3,4).ヒストンH2A.Zはこうしたヌクレオソームの迅速なターンオーバーを促進していると思われる3).また,これら迅速にターンオーバーされるヌクレオソームには56番目のLysのアセチル化したヒストンH3が局在しており5),このヒストンH3のアセチル化はヌクレオソームの迅速なターンオーバーに必要不可欠であることが報告されている6).ヒストンH3の56番目のLysのアセチル化は新しく合成されたヒストンに付加されるマークであり,新しく形成されたヌクレオソームにみられる7).最近の研究では,脊椎動物において,遺伝子プロモーター領域のヌクレオソームにもヒストンH2A.Zおよび56番目のLysのアセチル化したヒストンH3が局在していることが示されており,これらの特徴はよく保存されていると思われる.しかしながら,ヒストンH2A.Zと56番目のLysのアセチル化したヒストンH3がどのように協調してヌクレオソームのターンオーバーを制御しているのか,その分子機構は不明のままであった.
ヒストンH2A.Zと56番目のLysのアセチル化したヒストンH3の両方を含むヌクレオソームは,安定性が低下しターンオーバーが促進されているのではないかと仮説をたてこれを検証した.出芽酵母に由来する組換えヒストンからヌクレオソーム単量体を再構成し,ストレプトアビジンビーズに固定化し,溶液の塩濃度を上昇させてヌクレオソームの安定性を分析した.ヒストンH2A-ヒストンH2B二量体あるいはヒストンH2A.Z-ヒストンH2B二量体と,56番目の残基がLysである野生型ヒストンH3あるいはアセチル化を模倣して56番目の残基をGlnに置換したヒストンH3から,4種類のヌクレオソームを再構成した.その結果,56番目の残基をGlnに置換したヒストンH3はヌクレオソームの塩濃度に対する安定性にほとんど影響をあたえなかった.この結果は,56番目の残基をGlnに置換したヒストンH3を含むヌクレオソームの結晶構造解析の結果と矛盾はしなかった8).対照的に,ヒストンH2A.Z-ヒストンH2B二量体の導入により,野生型ヒストンH3を含むヌクレオソームおよび56番目の残基をGlnに置換したヒストンH3を含むヌクレオソームはともに塩濃度に対する安定性が低下した.しかしながら,ヒストンH2A.Zと56番目の残基をGlnに置換したヒストンH3の組合せによる相乗的な安定性の低下はみられなかった.これらの結果により,56番目のLysのアセチル化したヒストンH3自体はヌクレオソームの著しい不安定化はひき起こさないことが示唆された.
ヒストンH2A.Zのクロマチンへの蓄積は,遊離のヒストンH2A.ZとヌクレオソームにあるヒストンH2Aとの交換反応を触媒するクロマチンリモデリング酵素SWR-Cにより制御されている9,10).そこで,ヒストンH3の56番目のLysのアセチル化は,SWR-Cによるヒストン交換反応に影響をあたえているのではないかと考えこれを検証した.ヒストンH2Aおよび野生型ヒストンH3あるいは56番目の残基をGlnに置換することでアセチル化を模倣したヒストンH3からなるヌクレオソーム単量体を,精製したSWR-C,遊離のヒストンH2A.Z-ヒストンH2B二量体,ATPと反応させ,ウェスタンブロッティング法によりヒストン交換反応を定量的に分析した11).野生型ヒストンH3を含むヌクレオソームとSWR-Cを反応させると,既知のとおり10),ヒストンH2A.Zのヌクレオソームへの蓄積が観察された.興味深いことに,56番目の残基をGlnに置換したヒストンH3を含むヌクレオソームとSWR-Cを反応させると,ヒストンH2A.Zのヌクレオソームへの蓄積は大幅に減少した.
この結果はヒストンH3の56番目のLysのアセチル化がSWR-Cによるヒストン交換反応における逆反応を活性化したためではないかと考え,ヒストンH2A.Zを含むヌクレオソーム単量体を,精製したSWR-C,遊離のヒストンH2A-ヒストンH2B二量体,ATPと反応させた.ヒストンH2A.Zおよび野生型ヒストンH3からなるヌクレオソームではヒストン交換反応は起こらなかったが,驚いたことに,ヒストンH2A.Zおよび56番目の残基をGlnに置換したヒストンH3からなるヌクレオソームでは,ヌクレオソームからのヒストンH2A.Zの放出,および,ヒストンH2Aの蓄積が観察された.
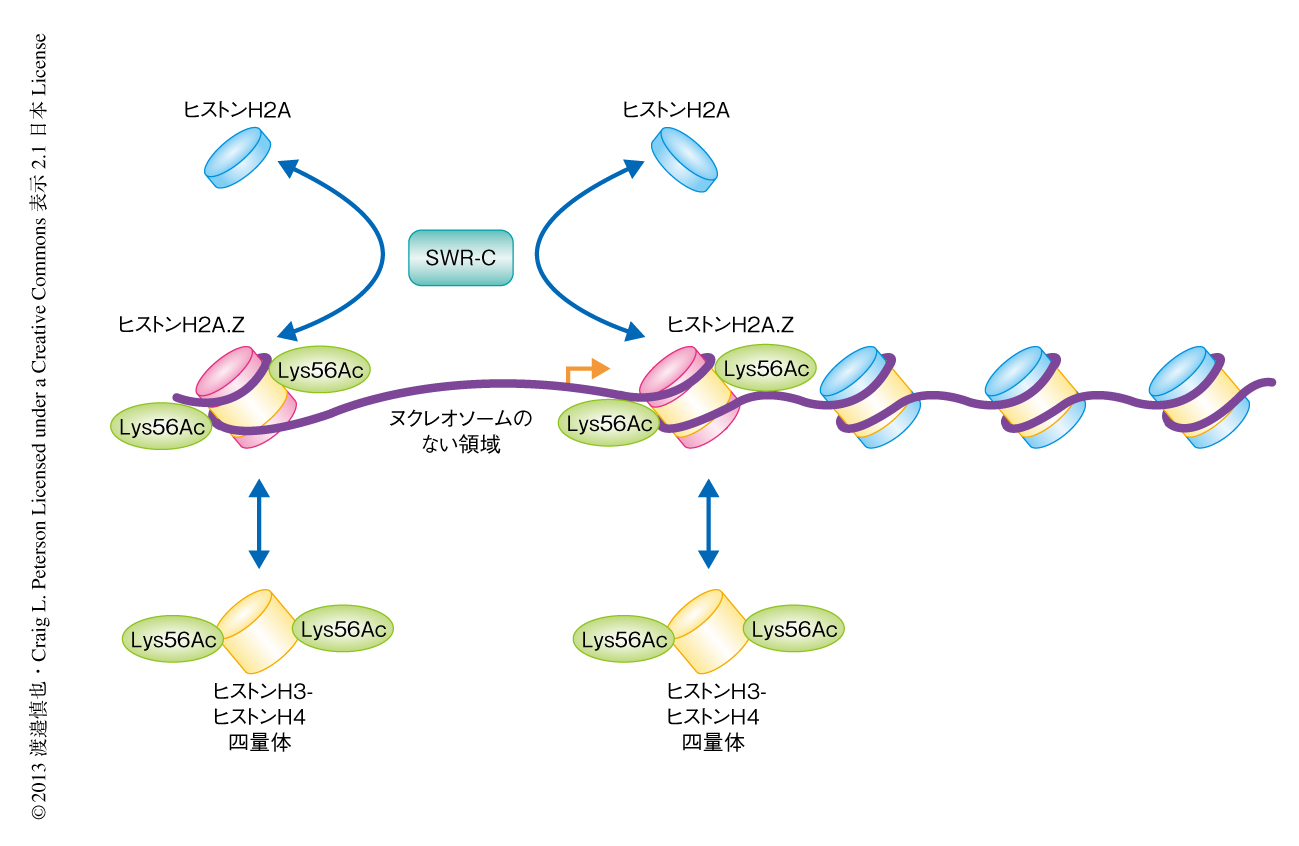
この結果をさらに確認するため,精製したヒストンアセチル化酵素Rtt109を用いて組換えヒストンH3をアセチル化し,ヒストンH2A.Zおよび56番目のLysが確かにアセチル化されたヒストンH3からなるヌクレオソーム単量体を再構成した.このヌクレオソーム単量体を,精製したSWR-C,遊離のヒストンH2A-ヒストンH2B二量体,ATPと反応させたところ,56番目の残基をGlnに置換したヒストンH3を含むヌクレオソームを用いたときと同様に,ヒストンH2Aの蓄積が観察された.これらの実験結果より,モデルを提唱した(図1).
SWR-CのサブユニットであるSwc2pはヒストンH2A.Zの結合タンパク質であり,ヒストンH2A.Zのヌクレオソームへの蓄積に必要不可欠である12).Swc2pはSWR-Cによるヒストン交換反応において,ヒストンH2A.Zに結合しヌクレオソームに輸送する役割をはたしていると考えられているが,さらに,Swc2pは反応サイクルの最終ステップにおいてはたらき,新たにヌクレオソームに蓄積されたヒストンH2A.ZがSWR-Cにより放出されるのを防ぐ“ロック”のように機能しているのではないかと仮説をたてた.
Swc2pを欠損した出芽酵母の変異株からSWR-Cを精製し,そのヒストン交換反応を調べた.その結果,Swc2pを欠損したSWR-CはヒストンH2Aを含むヌクレオソームにヒストンH2A.Zを蓄積することはできなかったが,ヒストンH2A.Zを含むヌクレオソームからヒストンH2A.Zを放出しヒストンH2Aを蓄積する反応を示した.このSwc2pを欠損したSWR-Cによるヒストン交換反応は,56番目の残基をGlnに置換することでアセチル化を模倣したヒストンH3を含むヌクレオソームにおけるヒストン交換反応と類似していた.これらの結果より,Swc2pはSWR-Cの基質特異性において重要な役割をはたしており,SWR-CによるヒストンH2A.Zを含むヌクレオソームのリモデリングを阻害し,ヒストンH2Aを含むヌクレオソームのリモデリングを促進させていることが示唆された.Swc2pはヒストンH2A.ZのC末端ドメインに結合し,このドメインはヌクレオソームにおいてヒストンH3の56番目のLysに近接していることから,ヒストンH3の56番目のLysのアセチル化はSwc2pの“ロック”としての機能を阻害し,ヒストンH2A.Zを含むヌクレオソームのSWR-Cによるリモデリングを可能にしていると考えられた.
これらin vitroでの実験結果から,細胞におけるヒストンH3の56番目のLysの恒常的なアセチル化はヒストンH2A.Zのターンオーバーを促進し,結果として,クロマチンにおいてヒストンH2A.Zの定常状態での蓄積量の減少が予想された.そこで,56番目の残基をGlnに置換することでアセチル化を模倣したヒストンH3を発現した出芽酵母の変異株と,ヒストンH3の56番目のLysのアセチル化に対する脱アセチル化酵素であるHst3pおよびHst4pを欠損した出芽酵母の変異株を用い,ChIP-seq(chromatin immunoprecipitation-sequencing,クロマチン免疫沈降-シークエンス)法によりゲノム全領域におけるヒストンH2A.Zの分布を解析した.その結果,これらの変異株ではヒストンH2A.Zが広範囲にわたり減少しており,とくに,ヒストンH2A.Zの局在する遺伝子プロモーターの+1位ならびに-1位のヌクレオソームにおいてヒストンH2A.Zが大幅に減少していることが観察された.また,このヒストンH2A.Zの減少量はSWR-Cの局在量に依存していた.
これら細胞における観察結果より,ヒストンH3の56番目をGlnに置換することでアセチル化を模倣した変異株の遺伝子発現プロファイルは,ヒストンH2A.Zを欠損した変異株の遺伝子発現プロファイルと類似しているのではないかと考え,マイクロアレイを用いてこれらの変異株の遺伝子発現を解析した.その結果,この2つの変異株において,発現の変化した遺伝子は顕著に重複していることがわかった.また,全mRNAの変化量において両者のあいだに正の相関関係が認められた.これらの結果は,ヒストンH3の56番目をGlnに置換した変異株においてクロマチンへのヒストンH2A.Zの蓄積量が減少していることをさらに裏づけるものであった.
ヒストン修飾は一般的に“ヒストンコード”とよばれているように,下流のタンパク質の結合する骨格として機能すると考えられている.しかし,ヒストンH4の16番目のLysのアセチル化に代表されるように,いくつかのヒストン修飾はクロマチンの構造を直接に変化させることが報告されている13).今回,筆者らは,ヒストンH3の56番目のLysのアセチル化がSWR-Cによるヒストン交換反応における基質特異性を変化させ,本来,ヒストンH2A.Zをヌクレオソームに蓄積させる酵素であるSWR-Cを,ヌクレオソームから放出する酵素へと変化させる“スイッチ”として機能していることを示した.ヒストン修飾がATP依存性のクロマチンリモデリング酵素にあたえる影響については,すでにいくつかの報告があるが,筆者らは,ヒストン修飾のまったく新しい機能を見い出した.
筆者らは,また,Swc2pがヒストンH2A.Zをヌクレオソームに閉じ込めて放出されるのを防ぐ“ロック”として機能していることを示した.Swc2pは酵母からヒトまで保存されており,後生動物における類似タンパク質であるYL-1はヒストンH2A.Zに対する結合能をもちショウジョウバエやヒトにおいてSWR-Cのサブユニットとして同定されている12).したがって,ここで示したSwc2pの“ロック”機能とヒストンH3の56番目のLysのアセチル化の機能は,高等真核生物においても保存されているものと推察された.
ヒストンH3の56番目のLysのアセチル化により活性化されたヒストンH2AとヒストンH2A.Zとの交換反応は,ヒストンH3-ヒストンH4四量体の解離を促進しヌクレオソームのターンオーバーを上昇させると考えられる(図2).筆者らの研究成果は,ヌクレオソームの迅速なターンオーバーを制御する分子機構を理解するうえで新たな知見をあたえるものであった.
ヒストンH3の56番目のLysのアセチル化は新しく合成されたヒストンH3に付加されるマークであり,すべてのヒストンH3はヌクレオソームを形成するまえにすでにアセチル化されていることから,じつは,ヒストンH3の56番目のLysのアセチル化に対する脱アセチル化が,遺伝子発現やヌクレオソームのターンオーバーを制御するうえで非常に重要な過程であると考えられる.したがって,ヒストンH3の56番目のLysのアセチル化に対する脱アセチル化酵素であるHst3pとHst4pについて,その詳細な制御機構の解明が今後の課題である.
略歴:2002年 創価大学大学院工学研究科博士課程 修了,同年 米国Massachusetts大学Medical School博士研究員を経て,2009年より同 専任講師.
研究テーマ:クロマチンの制御における分子機構の解明.
抱負:研究をとおして,医学に,そして,社会に貢献したい.
Craig L. Peterson
米国Massachusetts大学Medical School教授.
研究室URL:http://www.umassmed.edu/petersonlab/index.aspx
© 2013 渡邉慎也・Craig L. Peterson Licensed under CC 表示 2.1 日本
(米国Massachusetts大学Medical School,Program in Molecular Medicine)
email:渡邉慎也
DOI: 10.7875/first.author.2013.069
A histone acetylation switch regulates H2A.Z deposition by the SWR-C remodeling enzyme.
Shinya Watanabe, Marta Radman-Livaja, Oliver J. Rando, Craig L. Peterson
Science, 340, 195-199 (2013)
要 約
ヒストンH2AのバリアントであるヒストンH2A.Zは,遺伝子発現,DNA修復,セントロメアの機能などにおいて重要な役割をはたしている.ヒストンH2A.Zのクロマチンへの蓄積は,遊離のヒストンH2A.ZとヌクレオソームにあるヒストンH2Aとの交換反応を触媒するクロマチンリモデリング酵素SWR-Cにより制御されている.今回,筆者らは,ヒストンH3の56番目のLysのアセチル化はSWR-Cの基質特異性を変化させ,無秩序なヒストン交換反応をひき起こすことを報告した.また,SWR-Cの広く保存されたサブユニットであるSwc2pは,ヒストンH2A.Zをヌクレオソームから放出するSWR-Cの活性を阻害する機能をもつことを見い出した.さらに,ChIP-seq法を用いたヒストンH2A.Zのゲノム全領域にわたる解析により,56番目のLysが過剰にアセチル化されたヒストンH3をもつ出芽酵母の変異株では,クロマチンにおいてヒストンH2A.Zが広範囲にわたり減少していることが明らかになり,細胞においても同様の現象が確認された.筆者らの研究成果は,クロマチンリモデリングを制御するヒストン修飾を同定するとともに,ヌクレオソームのターンオーバーの制御機構を理解するうえで新たな知見をあたえるものであった.
はじめに
ヒストンH2AのバリアントであるヒストンH2A.Zは,とりわけRNAポリメラーゼIIにより転写される遺伝子のプロモーター領域の両側に位置するヌクレオソームに局在しており,また,クロマチン境界領域,セントロメア,DNA複製起点の両側に位置するヌクレオソームにも局在している1,2).これらのヌクレオソームはホットヌクレオソームとよばれ,DNA複製に非依存的に迅速にターンオーバーされるという特徴をもつ3).ヌクレオソームのターンオーバーはダイナミックな過程であり,遺伝子発現の制御,ならびに,ヒストン修飾を消去することでエピゲノムの可塑性に寄与していると考えられている3,4).ヒストンH2A.Zはこうしたヌクレオソームの迅速なターンオーバーを促進していると思われる3).また,これら迅速にターンオーバーされるヌクレオソームには56番目のLysのアセチル化したヒストンH3が局在しており5),このヒストンH3のアセチル化はヌクレオソームの迅速なターンオーバーに必要不可欠であることが報告されている6).ヒストンH3の56番目のLysのアセチル化は新しく合成されたヒストンに付加されるマークであり,新しく形成されたヌクレオソームにみられる7).最近の研究では,脊椎動物において,遺伝子プロモーター領域のヌクレオソームにもヒストンH2A.Zおよび56番目のLysのアセチル化したヒストンH3が局在していることが示されており,これらの特徴はよく保存されていると思われる.しかしながら,ヒストンH2A.Zと56番目のLysのアセチル化したヒストンH3がどのように協調してヌクレオソームのターンオーバーを制御しているのか,その分子機構は不明のままであった.
1.ヒストンH3の56番目のLysのアセチル化はヌクレオソームの安定性に影響しない
ヒストンH2A.Zと56番目のLysのアセチル化したヒストンH3の両方を含むヌクレオソームは,安定性が低下しターンオーバーが促進されているのではないかと仮説をたてこれを検証した.出芽酵母に由来する組換えヒストンからヌクレオソーム単量体を再構成し,ストレプトアビジンビーズに固定化し,溶液の塩濃度を上昇させてヌクレオソームの安定性を分析した.ヒストンH2A-ヒストンH2B二量体あるいはヒストンH2A.Z-ヒストンH2B二量体と,56番目の残基がLysである野生型ヒストンH3あるいはアセチル化を模倣して56番目の残基をGlnに置換したヒストンH3から,4種類のヌクレオソームを再構成した.その結果,56番目の残基をGlnに置換したヒストンH3はヌクレオソームの塩濃度に対する安定性にほとんど影響をあたえなかった.この結果は,56番目の残基をGlnに置換したヒストンH3を含むヌクレオソームの結晶構造解析の結果と矛盾はしなかった8).対照的に,ヒストンH2A.Z-ヒストンH2B二量体の導入により,野生型ヒストンH3を含むヌクレオソームおよび56番目の残基をGlnに置換したヒストンH3を含むヌクレオソームはともに塩濃度に対する安定性が低下した.しかしながら,ヒストンH2A.Zと56番目の残基をGlnに置換したヒストンH3の組合せによる相乗的な安定性の低下はみられなかった.これらの結果により,56番目のLysのアセチル化したヒストンH3自体はヌクレオソームの著しい不安定化はひき起こさないことが示唆された.
2.ヒストンH3の56番目のLysのアセチル化はSWR-Cによるヒストン交換反応の基質特異性を変化させる
ヒストンH2A.Zのクロマチンへの蓄積は,遊離のヒストンH2A.ZとヌクレオソームにあるヒストンH2Aとの交換反応を触媒するクロマチンリモデリング酵素SWR-Cにより制御されている9,10).そこで,ヒストンH3の56番目のLysのアセチル化は,SWR-Cによるヒストン交換反応に影響をあたえているのではないかと考えこれを検証した.ヒストンH2Aおよび野生型ヒストンH3あるいは56番目の残基をGlnに置換することでアセチル化を模倣したヒストンH3からなるヌクレオソーム単量体を,精製したSWR-C,遊離のヒストンH2A.Z-ヒストンH2B二量体,ATPと反応させ,ウェスタンブロッティング法によりヒストン交換反応を定量的に分析した11).野生型ヒストンH3を含むヌクレオソームとSWR-Cを反応させると,既知のとおり10),ヒストンH2A.Zのヌクレオソームへの蓄積が観察された.興味深いことに,56番目の残基をGlnに置換したヒストンH3を含むヌクレオソームとSWR-Cを反応させると,ヒストンH2A.Zのヌクレオソームへの蓄積は大幅に減少した.
この結果はヒストンH3の56番目のLysのアセチル化がSWR-Cによるヒストン交換反応における逆反応を活性化したためではないかと考え,ヒストンH2A.Zを含むヌクレオソーム単量体を,精製したSWR-C,遊離のヒストンH2A-ヒストンH2B二量体,ATPと反応させた.ヒストンH2A.Zおよび野生型ヒストンH3からなるヌクレオソームではヒストン交換反応は起こらなかったが,驚いたことに,ヒストンH2A.Zおよび56番目の残基をGlnに置換したヒストンH3からなるヌクレオソームでは,ヌクレオソームからのヒストンH2A.Zの放出,および,ヒストンH2Aの蓄積が観察された.
この結果をさらに確認するため,精製したヒストンアセチル化酵素Rtt109を用いて組換えヒストンH3をアセチル化し,ヒストンH2A.Zおよび56番目のLysが確かにアセチル化されたヒストンH3からなるヌクレオソーム単量体を再構成した.このヌクレオソーム単量体を,精製したSWR-C,遊離のヒストンH2A-ヒストンH2B二量体,ATPと反応させたところ,56番目の残基をGlnに置換したヒストンH3を含むヌクレオソームを用いたときと同様に,ヒストンH2Aの蓄積が観察された.これらの実験結果より,モデルを提唱した(図1).
3.SWR-CのサブユニットSwc2pはヌクレオソームからのヒストンH2A.Zの放出をさまたげる
SWR-CのサブユニットであるSwc2pはヒストンH2A.Zの結合タンパク質であり,ヒストンH2A.Zのヌクレオソームへの蓄積に必要不可欠である12).Swc2pはSWR-Cによるヒストン交換反応において,ヒストンH2A.Zに結合しヌクレオソームに輸送する役割をはたしていると考えられているが,さらに,Swc2pは反応サイクルの最終ステップにおいてはたらき,新たにヌクレオソームに蓄積されたヒストンH2A.ZがSWR-Cにより放出されるのを防ぐ“ロック”のように機能しているのではないかと仮説をたてた.
Swc2pを欠損した出芽酵母の変異株からSWR-Cを精製し,そのヒストン交換反応を調べた.その結果,Swc2pを欠損したSWR-CはヒストンH2Aを含むヌクレオソームにヒストンH2A.Zを蓄積することはできなかったが,ヒストンH2A.Zを含むヌクレオソームからヒストンH2A.Zを放出しヒストンH2Aを蓄積する反応を示した.このSwc2pを欠損したSWR-Cによるヒストン交換反応は,56番目の残基をGlnに置換することでアセチル化を模倣したヒストンH3を含むヌクレオソームにおけるヒストン交換反応と類似していた.これらの結果より,Swc2pはSWR-Cの基質特異性において重要な役割をはたしており,SWR-CによるヒストンH2A.Zを含むヌクレオソームのリモデリングを阻害し,ヒストンH2Aを含むヌクレオソームのリモデリングを促進させていることが示唆された.Swc2pはヒストンH2A.ZのC末端ドメインに結合し,このドメインはヌクレオソームにおいてヒストンH3の56番目のLysに近接していることから,ヒストンH3の56番目のLysのアセチル化はSwc2pの“ロック”としての機能を阻害し,ヒストンH2A.Zを含むヌクレオソームのSWR-Cによるリモデリングを可能にしていると考えられた.
4.細胞におけるヒストンH3の56番目のLysの過剰なアセチル化はヒストンH2A.Zの蓄積を減少させる
これらin vitroでの実験結果から,細胞におけるヒストンH3の56番目のLysの恒常的なアセチル化はヒストンH2A.Zのターンオーバーを促進し,結果として,クロマチンにおいてヒストンH2A.Zの定常状態での蓄積量の減少が予想された.そこで,56番目の残基をGlnに置換することでアセチル化を模倣したヒストンH3を発現した出芽酵母の変異株と,ヒストンH3の56番目のLysのアセチル化に対する脱アセチル化酵素であるHst3pおよびHst4pを欠損した出芽酵母の変異株を用い,ChIP-seq(chromatin immunoprecipitation-sequencing,クロマチン免疫沈降-シークエンス)法によりゲノム全領域におけるヒストンH2A.Zの分布を解析した.その結果,これらの変異株ではヒストンH2A.Zが広範囲にわたり減少しており,とくに,ヒストンH2A.Zの局在する遺伝子プロモーターの+1位ならびに-1位のヌクレオソームにおいてヒストンH2A.Zが大幅に減少していることが観察された.また,このヒストンH2A.Zの減少量はSWR-Cの局在量に依存していた.
5.ヒストンH3の56番目をGlnに置換した変異株とヒストンH2A.Zを欠損した変異株の遺伝子発現プロファイルは類似している
これら細胞における観察結果より,ヒストンH3の56番目をGlnに置換することでアセチル化を模倣した変異株の遺伝子発現プロファイルは,ヒストンH2A.Zを欠損した変異株の遺伝子発現プロファイルと類似しているのではないかと考え,マイクロアレイを用いてこれらの変異株の遺伝子発現を解析した.その結果,この2つの変異株において,発現の変化した遺伝子は顕著に重複していることがわかった.また,全mRNAの変化量において両者のあいだに正の相関関係が認められた.これらの結果は,ヒストンH3の56番目をGlnに置換した変異株においてクロマチンへのヒストンH2A.Zの蓄積量が減少していることをさらに裏づけるものであった.
おわりに
ヒストン修飾は一般的に“ヒストンコード”とよばれているように,下流のタンパク質の結合する骨格として機能すると考えられている.しかし,ヒストンH4の16番目のLysのアセチル化に代表されるように,いくつかのヒストン修飾はクロマチンの構造を直接に変化させることが報告されている13).今回,筆者らは,ヒストンH3の56番目のLysのアセチル化がSWR-Cによるヒストン交換反応における基質特異性を変化させ,本来,ヒストンH2A.Zをヌクレオソームに蓄積させる酵素であるSWR-Cを,ヌクレオソームから放出する酵素へと変化させる“スイッチ”として機能していることを示した.ヒストン修飾がATP依存性のクロマチンリモデリング酵素にあたえる影響については,すでにいくつかの報告があるが,筆者らは,ヒストン修飾のまったく新しい機能を見い出した.
筆者らは,また,Swc2pがヒストンH2A.Zをヌクレオソームに閉じ込めて放出されるのを防ぐ“ロック”として機能していることを示した.Swc2pは酵母からヒトまで保存されており,後生動物における類似タンパク質であるYL-1はヒストンH2A.Zに対する結合能をもちショウジョウバエやヒトにおいてSWR-Cのサブユニットとして同定されている12).したがって,ここで示したSwc2pの“ロック”機能とヒストンH3の56番目のLysのアセチル化の機能は,高等真核生物においても保存されているものと推察された.
ヒストンH3の56番目のLysのアセチル化により活性化されたヒストンH2AとヒストンH2A.Zとの交換反応は,ヒストンH3-ヒストンH4四量体の解離を促進しヌクレオソームのターンオーバーを上昇させると考えられる(図2).筆者らの研究成果は,ヌクレオソームの迅速なターンオーバーを制御する分子機構を理解するうえで新たな知見をあたえるものであった.
ヒストンH3の56番目のLysのアセチル化は新しく合成されたヒストンH3に付加されるマークであり,すべてのヒストンH3はヌクレオソームを形成するまえにすでにアセチル化されていることから,じつは,ヒストンH3の56番目のLysのアセチル化に対する脱アセチル化が,遺伝子発現やヌクレオソームのターンオーバーを制御するうえで非常に重要な過程であると考えられる.したがって,ヒストンH3の56番目のLysのアセチル化に対する脱アセチル化酵素であるHst3pとHst4pについて,その詳細な制御機構の解明が今後の課題である.
文 献
- Raisner, R. M., Hartley, P. D., Meneghini, M. D. et al.: Histone variant H2A.Z marks the 5' ends of both active and inactive genes in euchromatin. Cell, 123, 233-248 (2005)[PubMed]
- Albert, I., Mavrich, T. N., Tomsho, L. P. et al.: Translational and rotational settings of H2A.Z nucleosomes across the Saccharomyces cerevisiae genome. Nature, 446, 572-576 (2007)[PubMed]
- Dion, M. F., Kaplan, T., Kim, M. et al.: Dynamics of replication-independent histone turnover in budding yeast. Science, 315, 1405-1408 (2007)[PubMed]
- Deal, R. B., Henikoff, J. G. & Henikoff, S.: Genome-wide kinetics of nucleosome turnover determined by metabolic labeling of histones. Science, 328, 1161-1164 (2010)[PubMed]
- Rufiange, A., Jacques, P. E., Bhat, W. et al.: Genome-wide replication-independent histone H3 exchange occurs predominantly at promoters and implicates H3 K56 acetylation and Asf1. Mol. Cell, 27, 393-405 (2007)[PubMed]
- Kaplan, T., Liu, C. L., Erkmann, J. A. et al.: Cell cycle- and chaperone-mediated regulation of H3K56ac incorporation in yeast. PLoS Genet., 4, e1000270 (2008)[PubMed]
- Masumoto, H., Hawke, D., Kobayashi, R. et al.: A role for cell-cycle-regulated histone H3 lysine 56 acetylation in the DNA damage response. Nature, 436, 294-298 (2005)[PubMed]
- Watanabe, S., Resch, M., Lilyestrom, W. et al.: Structural characterization of H3K56Q nucleosomes and nucleosomal arrays. Biochim. Biophys. Acta, 1799, 480-486 (2010)[PubMed]
- Krogan, N. J., Keogh, M. C., Datta, N. et al.: A Snf2 family ATPase complex required for recruitment of the histone H2A variant Htz1. Mol. Cell, 12, 1565-1576 (2003)[PubMed]
- Mizuguchi, G., Shen, X., Landry, J. et al.: ATP-driven exchange of histone H2AZ variant catalyzed by SWR1 chromatin remodeling complex. Science, 303, 343-348 (2004)[PubMed]
- Papamichos-Chronakis, M., Watanabe, S., Rando, O. J. et al.: Global regulation of H2A.Z localization by the INO80 chromatin-remodeling enzyme is essential for genome integrity. Cell, 144, 200-213 (2011)[PubMed]
- Wu, W. H., Alami, S., Luk, E. et al.: Swc2 is a widely conserved H2AZ-binding module essential for ATP-dependent histone exchange. Nat. Struct. Mol. Biol., 12, 1064-1071 (2005)[PubMed]
- Shogren-Knaak, M., Ishii, H., Sun, J. M. et al.: Histone H4-K16 acetylation controls chromatin structure and protein interactions. Science, 311, 844-847 (2006)[PubMed]
著者プロフィール
略歴:2002年 創価大学大学院工学研究科博士課程 修了,同年 米国Massachusetts大学Medical School博士研究員を経て,2009年より同 専任講師.
研究テーマ:クロマチンの制御における分子機構の解明.
抱負:研究をとおして,医学に,そして,社会に貢献したい.
Craig L. Peterson
米国Massachusetts大学Medical School教授.
研究室URL:http://www.umassmed.edu/petersonlab/index.aspx
© 2013 渡邉慎也・Craig L. Peterson Licensed under CC 表示 2.1 日本