ヒトのDicerの基質に特異的な構造変化
重松 秀樹
(米国Yale大学School of Medicine,Department of Cellular and Molecular Physiology)
email:重松秀樹
DOI: 10.7875/first.author.2013.066
Substrate-specific structural rearrangements of human Dicer.
David W. Taylor, Enbo Ma, Hideki Shigematsu, Michael A. Cianfrocco, Cameron L. Noland, Kuniaki Nagayama, Eva Nogales, Jennifer A. Doudna, Hong-Wei Wang
Nature Structural & Molecular Biology, 20, 662-670 (2013)
DicerはRNAサイレンシングの初期の過程において二本鎖RNAを切断する.ヒトのDicerの特長として,長い二本鎖RNAをsiRNAに,そして,ヘアピン構造をもつRNAをmiRNAにと,ひとつのタンパク質が構造の異なる2種類の基質RNAを一定の長さの短い二本鎖RNAに切断することがあげられる.これまで,ヒトのDicerはmiRNA前駆体をsiRNA前駆体に比べはるかに速く切断することがin vitroにおける実験により確かめられていた.筆者らは,透過型電子顕微鏡と単粒子解析法によりヒトのDicerとRNAとの複合体の構造を解析し,その基質特異性について考察した.その結果,siRNA前駆体はDicerの中央の切断活性のあるRNase IIIドメインから離れた位置にトラップされる一方で,miRNA前駆体はRNaseIIIドメインによりそうかたちで結合していることが明らかになった.また,二本鎖RNA結合ドメインをもつタンパク質を共役させるとDicerがその構造を大きく変化させることが示され,Dicerと基質RNAとの反応には,結合と切断に共役したDicer自体の構造変化が大きくかかわっていることが明らかになった.
Dicerは一般に複数のドメインからなるRNase III型酵素として分類され,二本鎖RNA前駆体を21塩基対からなる短い二本鎖RNAへと切断する.この短い二本鎖RNAは最終的にRNAサイレンシングによる遺伝子発現制御を行う1,2).後生動物のDicerでは,2つの連続したRNase IIIドメインにくわえ,N末端にヘリカーゼドメイン(DExH/Dドメイン),DUF283ドメイン,PAZドメイン,二本鎖RNA結合ドメインをもつ.RNAの切断においては,PAZドメインが基質RNAの5’末端のリン酸基と3’末端側の2塩基のオーバーハングを認識し,RNA切断活性をもつRNase IIIドメインまでの距離を利用して特異的な長さで基質RNAを切断する.実際には,Dicerは2種類の二本鎖RNAを基質として認識して切断する3).ひとつはヘアピン構造をもつmiRNA前駆体であり,もうひとつは長い二本鎖構造をもつsiRNA前駆体である.生物種によっては2つあるいはそれ以上の異なるDicerを発現するものもあるが,ヒトのDicerは1種類である.ヒトのDicerはin vitroにおいて2種類のRNA基質を切断するが,哺乳類細胞においてDicerによる主要なRNA切断産物はmiRNAである.in vitroにおける系ではDicerによる基質RNAの切断はmiRNA前駆体のほうがsiRNA前駆体に比べ2桁のオーダーで速く,また,N末端のヘリカーゼドメインが抑制的な効果を発揮していることも明らかになっている.また,ヒトではDicerはほかの二本鎖RNA結合タンパク質であるTRBPやPACTと共役してはたらいていることがわかっている.これらのタンパク質は,基質RNAとの結合,配置,さらには,つぎのステップとして切断により生じる短い二本鎖RNAをRNA-タンパク質複合体であるRISCへと導入する過程にかかわっている.また,機能解析の結果,N末端のヘリカーゼドメインが二本鎖RNAの末端の認識,あるいは,ヘアピンRNAの末端のループ構造の認識にかかわっていることが示されている4).こういった個々のドメインの機能が明らかにされつつある現状ではあるが,ヒトのDicerはいかにmiRNA前駆体とsiRNA前駆体とを区別しているのか,そして,N末端のヘリカーゼドメインの機能はいまだに明らかになっていない(RNAサイレンシングの分子機構については,佐々木 浩・泊 幸秀, 領域融合レビュー, 1, e001, 2012 も参照されたい).
これまで,ヒトのDicerに対する構造生物学的なアプローチはネガティブ染色により得た電子顕微鏡の画像を単粒子解析法により解像したものにかぎられている.おもに2つのグループにより行われた過去の研究では,ヒトのDicerはL字型をしていること,おのおのおのドメインの欠損変異体や抗体による標識などによるL字型のドメイン配置の解釈にとどまっている.ネガティブ染色ではDNAやRNAといった領域は均一に染色できず,単粒子解析法では解像がむずかしいといわれており,実際に,Dicerと基質RNAの構造は明らかになっておらず,ヒトのDicerによる基質RNAの認識や結合に関する構造的な知見は得られていない.ヒトのDicerは220 kDaと,染色せずに直接に分子構造を観察するクライオ電子顕微鏡の試料としては小さい.筆者らは,高いコントラストで解像できるゼルニケ位相コントラストクライオ電子顕微鏡法を用いることにより5),ヒトのDicerおよびその基質との複合体の結合の過程における構造を単粒子解析法により明らかにすることに成功した.また,ヒトのDicerと基質RNAの切断の過程における構造変化を,二本鎖RNA結合ドメインをもつ共役タンパク質の存在下においてネガティブ染色により定量的に解析した.これらの結果から,1種類のタンパク質で異なる構造をもつ複数の基質と反応するヒトのDicerの基質選択性について,理解を深めることができた.
ヒトのDicerに対するこれまでの構造生物学的な研究では,その全体構造がL字型であること,N末端のヘリカーゼドメインの欠損体の解析により,このドメインがL字型の基底部にあることが示されている6).さらなるドメインの配置を決定するため,抗体による標識を試みた.抗体そのものはそれほど大きくなく,さらにY字型のフレキシブルな構造をもつため,一般に,抗体による標識にはネガティブ染色を用い,3次元の立体構造ではなく2次元の投影像を解析する.単粒子解析法では,投影像として撮影された目的の分子の粒子像をひとつずつ切り出して大量に集める.それらの粒子像をおのおの比較し,同じ向きをむいたものを探し出して重ね合わせ,これをいくつかの群に分類する作業を行う.この作業により,粒子のかたちや,ときには内部構造までをよりくっきりとみることが可能になる.RNase IIIドメインを認識するモノクローナル抗体mAb77と,PAZおよびDUF283ドメインを認識するモノクローナル抗体mAb83を用い,その結果をもとに,それぞれのドメインと相同性の高い結晶構造を,のちに述べるヒトのDicerの3次元モデルに重ねた.
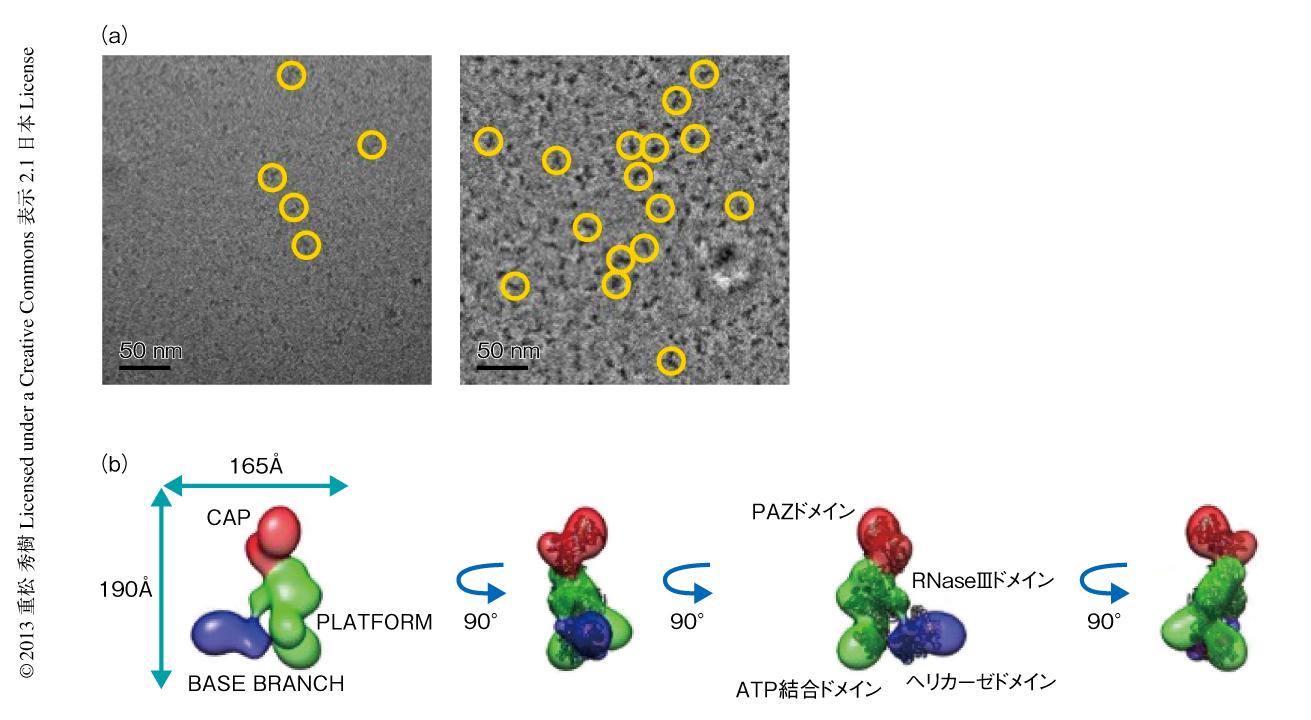
ヒトのDicerは220 kDaとクライオ電子顕微鏡の試料としては小さく,そのかたちをはっきりとみることはむずかしい(図1a).そこで,近年になり開発された透過型電子顕微鏡用の位相板を用いたゼルニケ位相コントラストクライオ電子顕微鏡法を用いて単粒子像の取得を試みた(図1a).一般に,光学顕微鏡法においても透明な物体の結像にはボケを導入するデフォーカスコントラスト法が用いられ,細胞の観察などにおいても位相板を利用した位相差顕微鏡法が一般的になっている.電子顕微鏡においても同じ原理の位相板は提唱されていたが,電子線と位相板の相互作用により生じる帯電の問題のため実用化はされていなかった.現在でもこの問題は完全には解決されておらず,さらなる発展が望まれている.しかしながら,ゼルニケ位相コントラストクライオ電子顕微鏡法では最小で100 kDaの分子の直接観察が報告されており7),小さな分子の観察にはとくに期待がよせられている.ゼルニケ位相コントラストクライオ電子顕微鏡法により取得された粒子像から構築された3次元立体構造モデルは分解能が26Åであった(図1b).全体の構造はネガティブ染色像より得られたモデルとよく一致しており,抗体による標識の結果とあわせて,既知の相同性の高い結晶構造を重ね合わせた.PAZドメインおよびRNase IIIドメインはGiardia intestinalisのDicerの構造(PDB ID:2QVW)を,PAZドメインをヒトのDicerのCAP領域に,そして,残りをPLATFORM領域に重ね合わせ,ヘリカーゼドメインにはヒトのヘリカーゼであるRIG-I(PDB ID:2YKG)をBASE BRANCH領域に重ね合わせた(図1b).
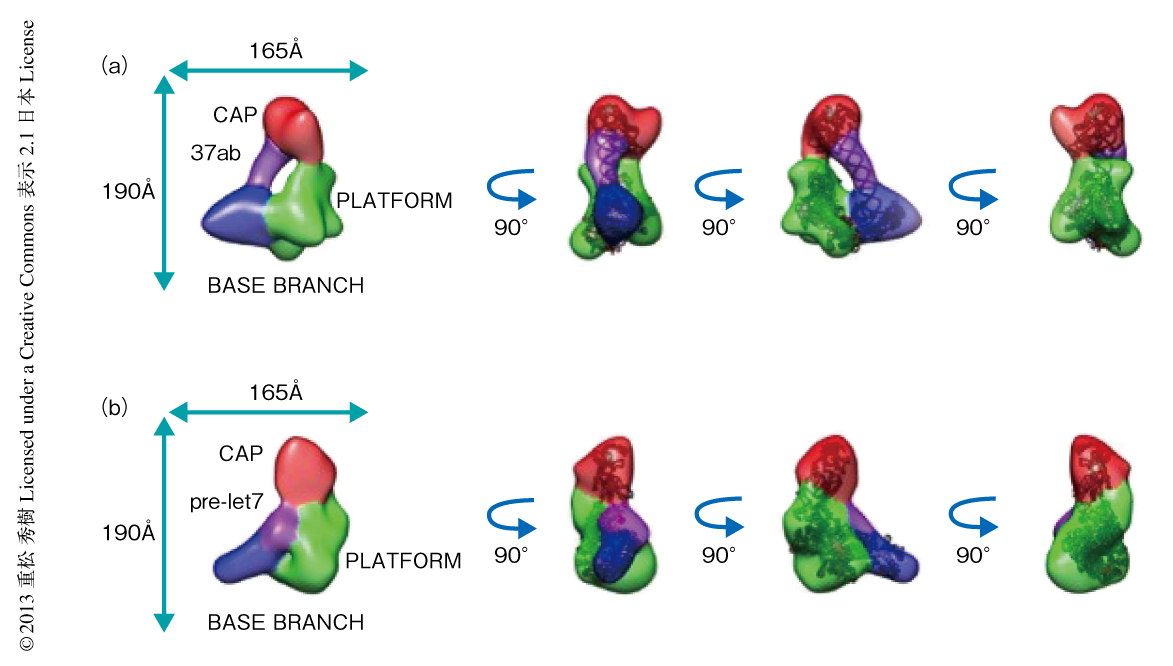
in vitroにおけるヒトのDicerの切断活性は,37塩基対からなるsiRNA前駆体37abではmiRNA前駆体pre-let7より2桁ほど低かったが,結合活性そのものはほぼ同等であった8).これは,これらの2つの基質RNAとDicerとの相互作用が違う,もしくは,基質に特異的な構造変化のあることを示していた.そこで,EDTAの存在下においてDicerを基質RNAと反応させることにより,切断活性を阻害して反応を結合状態において停止させた状態でゼルニケ位相コントラストクライオ電子顕微鏡法により粒子像を取得した.画像解析の結果,この試料には複数の構造の混在していることが示されたため,それらのなかから基質RNAとおぼしき領域の存在するモデルを選び,さらなる構造モデルの最適化を行った.最終的に得られた3次元立体構造モデルの分解能は,ヒトのDicerと37abとの複合体が29Å,ヒトのDicerとpre-let7との複合体が31Åであった(図2).Dicer-37ab複合体はDicerのL字をCAPからBASE BRANCHまで斜めにつなぐような棒状の領域をもっていた.この領域の直径は二本鎖RNAの直径と一致した.また,この領域にくわえ,CAPやBASE BRANCHはその位置をひねるようなかたちに変化していた.これらはおそらく37abとの結合によりひき起こされた構造変化と考えられた.その一方で,Dicer-pre-let7複合体はDicerのL字型のPLATFORMとBASE BRANCHとの交点にあたる部分に球状の領域が追加されていた.これは切断活性部位とされるRNase IIIドメインの近傍であった.また,CAPやBASE BRANCHについてもその位置が変化しており,とくに,BASE BRANCHはそのL字をさらに90度以上に押し開くような方向に動いていた.
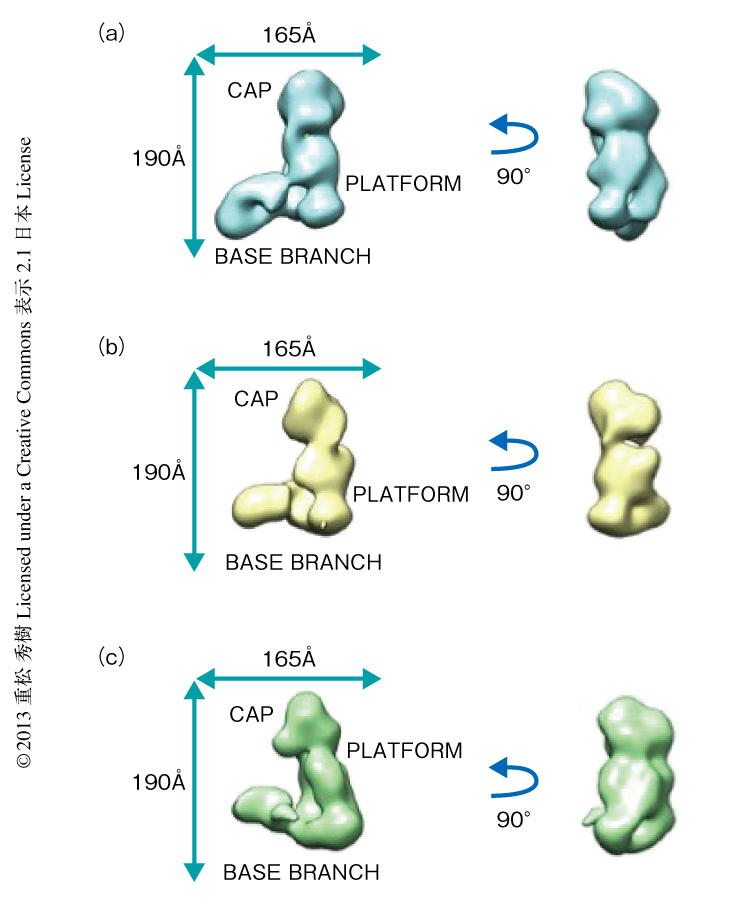
ヒトのDicerとその基質RNAとの複合体の構造において示された違いは,in vivoにおける切断活性の差をよく説明できた.すなわち,Dicer-37ab複合体では37abはヘリカーゼドメインとPAZドメインにより切断活性をもつRNase IIIドメインから大きく離れた位置に固定されていた.その一方で,Dicer-pre-let7複合体ではpre-let7はRNase IIIドメインの近傍に結合していた.また,ヘリカーゼドメインが大きく開いてpre-let7を切断活性部位に送り込むよう構造変化している可能性が示唆された.そこで,ヒトのDicerと2種類の基質RNA,および,二本鎖RNA結合ドメインをもちDicerと共役的にはたらくTRBPとPACTを共存させた状態において,氷上で反応させたうえでネガティブ染色を行った.得られた粒子像に2次元での画像解析を行い,L字型に近いものをあつめてCAPからBASE BRANCHまでの距離を指標として分類した.その結果,pre-let7あるいはPACTの存在下においては距離がDicerのみに比べ長くなるもの(開構造)が増え,37abあるいはTRBPの存在下においては短くなるもの(閉構造)が増える傾向がみられた.しかしながら,37abおよびTRBPの存在下においては開構造が増え,閉構造はほとんどみられなくなった.実際に,Dicer-TRBP複合体はDicer単独に比べ37abの切断活性が500倍になる一方で,結合活性は変わらないという結果がある8).すなわち,TRBPの存在は結合ではなく,結合から切断への反応を加速する,すなわち,開構造を誘発して37abを切断部位に導くはたらきのあるものと考えられた.その一方で,PACTに関しては生化学的な解析はあまりなされていないものの,Dicerのみの構造,閉構造,開構造を一定の割合で含んでおり,この3種類がDicer単独,Dicerと37abの存在下,Dicerとpre-let7の存在下の構造を示唆するものと思われた.そこで,PACTの存在下においてDicerのネガティブ染色を行い,ランダム円錐傾斜(random-conical-tilt)再構成法という方法により,それぞれの2次元での画像解析により得られたDicerのみの構造,閉構造,開構造に属する3次元構造モデルの再構成を行った(図3).このモデルにおいてもこれら3つの構造の違いは明らかであり,ヒトのDicerではBASE BRANCHの構造がダイナミックに変化し,これが構造の異なる2種類の基質RNAに対する反応速度の違いを生み出すものと考えられた.
ヒトのDicerとその基質RNAとの複合体の構造モデルは,いずれの場合もDicerのヘリカーゼドメインの存在するBASE BRANCHの構造が変化することを示唆していた.また,TRBPあるいはPACTの存在がこの構造変化をひき起こすことも示された.すなわち,ヘリカーゼドメインが基質RNAを選別するセンサーとしてはたらくことで,Dicerの基質特異性を担保しているといえた.今回,使用した2つの二本鎖RNA基質とDicerのCAPおよびBASE BRANCHまでの距離を考えると,以前に報告されている27塩基対以上の長さをもつ2本鎖RNAがヒトのDicerの基質として低い反応性をもつことがうまく説明された9).また,ミスマッチがなくループ領域をもつ二本鎖RNAはヒトのDicerの基質としてpre-let7に相当する反応性をもつことも示されている10).ヘリカーゼドメインが基質RNAを認識するセンサーだとすれば,pre-let7にみられるループ領域がヘリカーゼドメインと相互作用することが,反応性の高い基質に有利な構造変化を起こすとも考えられた.
略歴:1999年 東京工業大学大学院生命理工学研究科にて博士号取得,同年 工業技術院生命工学工業技術研究所 研究員,2000年 キリンビール医薬探索研究所 研究員,2002年 東京工業大学大学院生命理工学研究科 研究員,2003年 同 特任助手,2005年 岡崎統合バイオサイエンスセンター 研究員を経て,2010年より米国Yale大学School of Medicine研究員.
研究テーマ:クライオ電子顕微鏡による生体分子複合体の機能構造の解明.
関心事:イメージング技術全般,最後は1分子,1原子を観察できる透過型電子顕微鏡にたどりつきました.タンパク質の機能する環境をつくりだし,機能するかたちを解き明かすことをめざしています.
© 2013 重松 秀樹 Licensed under CC 表示 2.1 日本
(米国Yale大学School of Medicine,Department of Cellular and Molecular Physiology)
email:重松秀樹
DOI: 10.7875/first.author.2013.066
Substrate-specific structural rearrangements of human Dicer.
David W. Taylor, Enbo Ma, Hideki Shigematsu, Michael A. Cianfrocco, Cameron L. Noland, Kuniaki Nagayama, Eva Nogales, Jennifer A. Doudna, Hong-Wei Wang
Nature Structural & Molecular Biology, 20, 662-670 (2013)
要 約
DicerはRNAサイレンシングの初期の過程において二本鎖RNAを切断する.ヒトのDicerの特長として,長い二本鎖RNAをsiRNAに,そして,ヘアピン構造をもつRNAをmiRNAにと,ひとつのタンパク質が構造の異なる2種類の基質RNAを一定の長さの短い二本鎖RNAに切断することがあげられる.これまで,ヒトのDicerはmiRNA前駆体をsiRNA前駆体に比べはるかに速く切断することがin vitroにおける実験により確かめられていた.筆者らは,透過型電子顕微鏡と単粒子解析法によりヒトのDicerとRNAとの複合体の構造を解析し,その基質特異性について考察した.その結果,siRNA前駆体はDicerの中央の切断活性のあるRNase IIIドメインから離れた位置にトラップされる一方で,miRNA前駆体はRNaseIIIドメインによりそうかたちで結合していることが明らかになった.また,二本鎖RNA結合ドメインをもつタンパク質を共役させるとDicerがその構造を大きく変化させることが示され,Dicerと基質RNAとの反応には,結合と切断に共役したDicer自体の構造変化が大きくかかわっていることが明らかになった.
はじめに
Dicerは一般に複数のドメインからなるRNase III型酵素として分類され,二本鎖RNA前駆体を21塩基対からなる短い二本鎖RNAへと切断する.この短い二本鎖RNAは最終的にRNAサイレンシングによる遺伝子発現制御を行う1,2).後生動物のDicerでは,2つの連続したRNase IIIドメインにくわえ,N末端にヘリカーゼドメイン(DExH/Dドメイン),DUF283ドメイン,PAZドメイン,二本鎖RNA結合ドメインをもつ.RNAの切断においては,PAZドメインが基質RNAの5’末端のリン酸基と3’末端側の2塩基のオーバーハングを認識し,RNA切断活性をもつRNase IIIドメインまでの距離を利用して特異的な長さで基質RNAを切断する.実際には,Dicerは2種類の二本鎖RNAを基質として認識して切断する3).ひとつはヘアピン構造をもつmiRNA前駆体であり,もうひとつは長い二本鎖構造をもつsiRNA前駆体である.生物種によっては2つあるいはそれ以上の異なるDicerを発現するものもあるが,ヒトのDicerは1種類である.ヒトのDicerはin vitroにおいて2種類のRNA基質を切断するが,哺乳類細胞においてDicerによる主要なRNA切断産物はmiRNAである.in vitroにおける系ではDicerによる基質RNAの切断はmiRNA前駆体のほうがsiRNA前駆体に比べ2桁のオーダーで速く,また,N末端のヘリカーゼドメインが抑制的な効果を発揮していることも明らかになっている.また,ヒトではDicerはほかの二本鎖RNA結合タンパク質であるTRBPやPACTと共役してはたらいていることがわかっている.これらのタンパク質は,基質RNAとの結合,配置,さらには,つぎのステップとして切断により生じる短い二本鎖RNAをRNA-タンパク質複合体であるRISCへと導入する過程にかかわっている.また,機能解析の結果,N末端のヘリカーゼドメインが二本鎖RNAの末端の認識,あるいは,ヘアピンRNAの末端のループ構造の認識にかかわっていることが示されている4).こういった個々のドメインの機能が明らかにされつつある現状ではあるが,ヒトのDicerはいかにmiRNA前駆体とsiRNA前駆体とを区別しているのか,そして,N末端のヘリカーゼドメインの機能はいまだに明らかになっていない(RNAサイレンシングの分子機構については,佐々木 浩・泊 幸秀, 領域融合レビュー, 1, e001, 2012 も参照されたい).
これまで,ヒトのDicerに対する構造生物学的なアプローチはネガティブ染色により得た電子顕微鏡の画像を単粒子解析法により解像したものにかぎられている.おもに2つのグループにより行われた過去の研究では,ヒトのDicerはL字型をしていること,おのおのおのドメインの欠損変異体や抗体による標識などによるL字型のドメイン配置の解釈にとどまっている.ネガティブ染色ではDNAやRNAといった領域は均一に染色できず,単粒子解析法では解像がむずかしいといわれており,実際に,Dicerと基質RNAの構造は明らかになっておらず,ヒトのDicerによる基質RNAの認識や結合に関する構造的な知見は得られていない.ヒトのDicerは220 kDaと,染色せずに直接に分子構造を観察するクライオ電子顕微鏡の試料としては小さい.筆者らは,高いコントラストで解像できるゼルニケ位相コントラストクライオ電子顕微鏡法を用いることにより5),ヒトのDicerおよびその基質との複合体の結合の過程における構造を単粒子解析法により明らかにすることに成功した.また,ヒトのDicerと基質RNAの切断の過程における構造変化を,二本鎖RNA結合ドメインをもつ共役タンパク質の存在下においてネガティブ染色により定量的に解析した.これらの結果から,1種類のタンパク質で異なる構造をもつ複数の基質と反応するヒトのDicerの基質選択性について,理解を深めることができた.
1.ヒトのDicerの3次元構造モデルとおのおののドメインの配置
ヒトのDicerに対するこれまでの構造生物学的な研究では,その全体構造がL字型であること,N末端のヘリカーゼドメインの欠損体の解析により,このドメインがL字型の基底部にあることが示されている6).さらなるドメインの配置を決定するため,抗体による標識を試みた.抗体そのものはそれほど大きくなく,さらにY字型のフレキシブルな構造をもつため,一般に,抗体による標識にはネガティブ染色を用い,3次元の立体構造ではなく2次元の投影像を解析する.単粒子解析法では,投影像として撮影された目的の分子の粒子像をひとつずつ切り出して大量に集める.それらの粒子像をおのおの比較し,同じ向きをむいたものを探し出して重ね合わせ,これをいくつかの群に分類する作業を行う.この作業により,粒子のかたちや,ときには内部構造までをよりくっきりとみることが可能になる.RNase IIIドメインを認識するモノクローナル抗体mAb77と,PAZおよびDUF283ドメインを認識するモノクローナル抗体mAb83を用い,その結果をもとに,それぞれのドメインと相同性の高い結晶構造を,のちに述べるヒトのDicerの3次元モデルに重ねた.
ヒトのDicerは220 kDaとクライオ電子顕微鏡の試料としては小さく,そのかたちをはっきりとみることはむずかしい(図1a).そこで,近年になり開発された透過型電子顕微鏡用の位相板を用いたゼルニケ位相コントラストクライオ電子顕微鏡法を用いて単粒子像の取得を試みた(図1a).一般に,光学顕微鏡法においても透明な物体の結像にはボケを導入するデフォーカスコントラスト法が用いられ,細胞の観察などにおいても位相板を利用した位相差顕微鏡法が一般的になっている.電子顕微鏡においても同じ原理の位相板は提唱されていたが,電子線と位相板の相互作用により生じる帯電の問題のため実用化はされていなかった.現在でもこの問題は完全には解決されておらず,さらなる発展が望まれている.しかしながら,ゼルニケ位相コントラストクライオ電子顕微鏡法では最小で100 kDaの分子の直接観察が報告されており7),小さな分子の観察にはとくに期待がよせられている.ゼルニケ位相コントラストクライオ電子顕微鏡法により取得された粒子像から構築された3次元立体構造モデルは分解能が26Åであった(図1b).全体の構造はネガティブ染色像より得られたモデルとよく一致しており,抗体による標識の結果とあわせて,既知の相同性の高い結晶構造を重ね合わせた.PAZドメインおよびRNase IIIドメインはGiardia intestinalisのDicerの構造(PDB ID:2QVW)を,PAZドメインをヒトのDicerのCAP領域に,そして,残りをPLATFORM領域に重ね合わせ,ヘリカーゼドメインにはヒトのヘリカーゼであるRIG-I(PDB ID:2YKG)をBASE BRANCH領域に重ね合わせた(図1b).
2.ヒトのDicerにおける2種類の基質RNAの結合構造
in vitroにおけるヒトのDicerの切断活性は,37塩基対からなるsiRNA前駆体37abではmiRNA前駆体pre-let7より2桁ほど低かったが,結合活性そのものはほぼ同等であった8).これは,これらの2つの基質RNAとDicerとの相互作用が違う,もしくは,基質に特異的な構造変化のあることを示していた.そこで,EDTAの存在下においてDicerを基質RNAと反応させることにより,切断活性を阻害して反応を結合状態において停止させた状態でゼルニケ位相コントラストクライオ電子顕微鏡法により粒子像を取得した.画像解析の結果,この試料には複数の構造の混在していることが示されたため,それらのなかから基質RNAとおぼしき領域の存在するモデルを選び,さらなる構造モデルの最適化を行った.最終的に得られた3次元立体構造モデルの分解能は,ヒトのDicerと37abとの複合体が29Å,ヒトのDicerとpre-let7との複合体が31Åであった(図2).Dicer-37ab複合体はDicerのL字をCAPからBASE BRANCHまで斜めにつなぐような棒状の領域をもっていた.この領域の直径は二本鎖RNAの直径と一致した.また,この領域にくわえ,CAPやBASE BRANCHはその位置をひねるようなかたちに変化していた.これらはおそらく37abとの結合によりひき起こされた構造変化と考えられた.その一方で,Dicer-pre-let7複合体はDicerのL字型のPLATFORMとBASE BRANCHとの交点にあたる部分に球状の領域が追加されていた.これは切断活性部位とされるRNase IIIドメインの近傍であった.また,CAPやBASE BRANCHについてもその位置が変化しており,とくに,BASE BRANCHはそのL字をさらに90度以上に押し開くような方向に動いていた.
3.ヒトのDicerはその酵素活性の発現に大きな構造変化をともなう
ヒトのDicerとその基質RNAとの複合体の構造において示された違いは,in vivoにおける切断活性の差をよく説明できた.すなわち,Dicer-37ab複合体では37abはヘリカーゼドメインとPAZドメインにより切断活性をもつRNase IIIドメインから大きく離れた位置に固定されていた.その一方で,Dicer-pre-let7複合体ではpre-let7はRNase IIIドメインの近傍に結合していた.また,ヘリカーゼドメインが大きく開いてpre-let7を切断活性部位に送り込むよう構造変化している可能性が示唆された.そこで,ヒトのDicerと2種類の基質RNA,および,二本鎖RNA結合ドメインをもちDicerと共役的にはたらくTRBPとPACTを共存させた状態において,氷上で反応させたうえでネガティブ染色を行った.得られた粒子像に2次元での画像解析を行い,L字型に近いものをあつめてCAPからBASE BRANCHまでの距離を指標として分類した.その結果,pre-let7あるいはPACTの存在下においては距離がDicerのみに比べ長くなるもの(開構造)が増え,37abあるいはTRBPの存在下においては短くなるもの(閉構造)が増える傾向がみられた.しかしながら,37abおよびTRBPの存在下においては開構造が増え,閉構造はほとんどみられなくなった.実際に,Dicer-TRBP複合体はDicer単独に比べ37abの切断活性が500倍になる一方で,結合活性は変わらないという結果がある8).すなわち,TRBPの存在は結合ではなく,結合から切断への反応を加速する,すなわち,開構造を誘発して37abを切断部位に導くはたらきのあるものと考えられた.その一方で,PACTに関しては生化学的な解析はあまりなされていないものの,Dicerのみの構造,閉構造,開構造を一定の割合で含んでおり,この3種類がDicer単独,Dicerと37abの存在下,Dicerとpre-let7の存在下の構造を示唆するものと思われた.そこで,PACTの存在下においてDicerのネガティブ染色を行い,ランダム円錐傾斜(random-conical-tilt)再構成法という方法により,それぞれの2次元での画像解析により得られたDicerのみの構造,閉構造,開構造に属する3次元構造モデルの再構成を行った(図3).このモデルにおいてもこれら3つの構造の違いは明らかであり,ヒトのDicerではBASE BRANCHの構造がダイナミックに変化し,これが構造の異なる2種類の基質RNAに対する反応速度の違いを生み出すものと考えられた.
おわりに
ヒトのDicerとその基質RNAとの複合体の構造モデルは,いずれの場合もDicerのヘリカーゼドメインの存在するBASE BRANCHの構造が変化することを示唆していた.また,TRBPあるいはPACTの存在がこの構造変化をひき起こすことも示された.すなわち,ヘリカーゼドメインが基質RNAを選別するセンサーとしてはたらくことで,Dicerの基質特異性を担保しているといえた.今回,使用した2つの二本鎖RNA基質とDicerのCAPおよびBASE BRANCHまでの距離を考えると,以前に報告されている27塩基対以上の長さをもつ2本鎖RNAがヒトのDicerの基質として低い反応性をもつことがうまく説明された9).また,ミスマッチがなくループ領域をもつ二本鎖RNAはヒトのDicerの基質としてpre-let7に相当する反応性をもつことも示されている10).ヘリカーゼドメインが基質RNAを認識するセンサーだとすれば,pre-let7にみられるループ領域がヘリカーゼドメインと相互作用することが,反応性の高い基質に有利な構造変化を起こすとも考えられた.
文 献
- Bernstein, E., Caudy, A. A., Hammond, S. M. et al.: Role for a bidentate ribonuclease in the initiation step of RNA interference. Nature, 409, 363-366 (2001)[PubMed]
- Carmell, M. A. & Hannon, G. J.: RNase III enzymes and the initiation of gene silencing. Nat. Struct. Mol. Biol., 11, 214-218 (2004)[PubMed]
- Ma, E., MacRae, I. J., Kirsch, J. F. et al.: Autoinhibition of human Dicer by its internal helicase domain. J. Mol. Biol., 380, 237-243 (2008)[PubMed]
- Welker, N. C., Maity, T. S., Ye, X. et al.: Dicer's helicase domain discriminates dsRNA termini to promote an altered reaction mode. Mol. Cell, 41, 589-599 (2011)[PubMed]
- Danev, R. & Nagayama, K. .: Transmission electron microscopy with Zernike phase plate. Ultramicroscopy, 88, 243-252 (2001)[PubMed]
- Wang, H. -W., Noland, C., Siridechadilok, B. et al.: Structural insights into RNA processing by the human RISC-loading complex. Nat. Struct. Mol. Biol., 16, 1148-1153 (2009)[PubMed]
- Danev, R., Glaeser, R. M. & Nagayama, K.: Practical factors affecting the performance of a thin-film phase plate for transmission electron microscopy. Ultramicroscopy, 109, 312-325 (2009)[PubMed]
- Chakravarthy, S., Sternberg, S. H., Kellenberger, C. A. et al.: Substrate-specific kinetics of Dicer-catalyzed RNA processing. J. Mol. Biol., 404, 392-402 (2010)[PubMed]
- Kim, D. -H., Behlke, M. A., Rose, S. D. et al.: Synthetic dsRNA Dicer substrates enhance RNAi potency and efficacy. Nat. Biotechnol., 23, 222-226 (2005)[PubMed]
- Ma, E., Zhou, K., Kidwell, M. A. et al.: Coordinated activities of human dicer domains in regulatory RNA processing. J. Mol. Biol., 422, 466-476 (2012)[PubMed]
著者プロフィール
略歴:1999年 東京工業大学大学院生命理工学研究科にて博士号取得,同年 工業技術院生命工学工業技術研究所 研究員,2000年 キリンビール医薬探索研究所 研究員,2002年 東京工業大学大学院生命理工学研究科 研究員,2003年 同 特任助手,2005年 岡崎統合バイオサイエンスセンター 研究員を経て,2010年より米国Yale大学School of Medicine研究員.
研究テーマ:クライオ電子顕微鏡による生体分子複合体の機能構造の解明.
関心事:イメージング技術全般,最後は1分子,1原子を観察できる透過型電子顕微鏡にたどりつきました.タンパク質の機能する環境をつくりだし,機能するかたちを解き明かすことをめざしています.
© 2013 重松 秀樹 Licensed under CC 表示 2.1 日本