ビタミンE輸送タンパク質とホスファチジルイノシトールリン酸との相互作用の不全が家族性ビタミンE欠乏症の原因となる
河野 望・新井洋由
(東京大学大学院薬学系研究科 衛生化学教室)
email:河野 望,新井洋由
DOI: 10.7875/first.author.2013.064
Impaired α-TTP-PIPs interaction underlies familial vitamin E deficiency.
Nozomu Kono, Umeharu Ohto, Tatsufumi Hiramatsu, Michiko Urabe, Yasunori Uchida, Yoshinori Satow, Hiroyuki Arai
Science, 340, 1106-1110 (2013)
ビタミンEに特異的な結合タンパク質であるα-TTPは肝細胞におけるビタミンEの輸送タンパク質であり,先天性ビタミンE欠乏症の原因遺伝子産物である.ビタミンE欠乏症をもたらすα-TTPにおける変異のうち,3つのArgのミスセンス変異はビタミンEの結合部位とは異なる表面に位置しており,α-TTPの機能におけるこれらArgの役割は不明であった.今回,筆者らは,α-TTPがこれらのArgを介しホスファチジルイノシトールリン酸と相互作用していることを見い出した.また,in vitroにおいて,α-TTPのビタミンEの膜間輸送能は受容側のリポソームにホスファチジルイノシトールリン酸をくわえることにより大きく促進されることがわかった.さらに,α-TTPとホスファチジルイノシトールリン酸との複合体のX線結晶構造解析により,先天性ビタミンE欠乏症において変異のみられるArgはホスファチジルイノシトールリン酸のもつリン酸基と相互作用していること,ホスファチジルイノシトールリン酸との結合はα-TTPのビタミンE結合ポケットを開状態へと導くことが明らかになった.以上の結果から,ホスファチジルイノシトールリン酸はα-TTPの細胞膜へのターゲティングおよびビタミンEの膜移行を促進しており,α-TTPとホスファチジルイノシトールリン酸との相互作用の不全がビタミンE欠乏症の原因となることが強く示唆された.
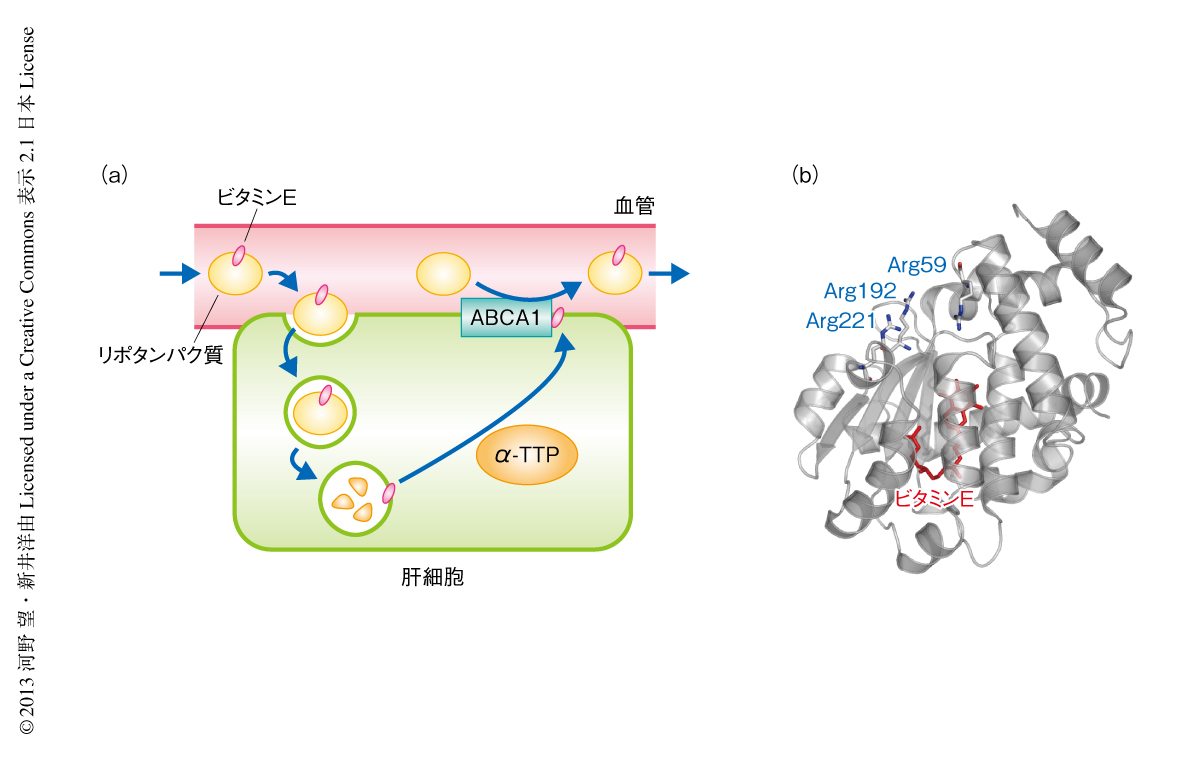
α-TTP(α-tocopherol transfer protein)はビタミンE(α-tocopherol)と特異的に結合する脂質結合タンパク質のひとつであり,おもに肝細胞の細胞質に存在する.ビタミンEはリポタンパク質と結合して血中を循環しており,リポタンパク質とともに肝臓に取り込まれたビタミンEは,ふたたび肝臓の外へと放出される.この過程において,α-TTPは肝細胞におけるビタミンEの輸送を媒介することにより体内のビタミンEのレベルを一定に保つ機能を担う1)(図1a).しかし,肝細胞におけるα-TTPによるビタミンEの輸送機構はよくわかっていない.α-TTPは先天性ビタミンE欠乏症の原因遺伝子産物であり,これまでに20種類以上の変異が報告されている.興味深いことに,9つのミスセンス変異のうち3つはArg(Arg59,Arg192,Arg221)に変異が起こっており,それらはビタミンEの結合部位とは異なるα-TTPの表面に位置している(図1b).Arg59やArg221における変異は重篤な臨床症状をもたらすことから,α-TTPの機能にこれらのArgが重要であることが考えられるが,その分子機構は明らかになっていなかった.今回,筆者らは,これら先天性ビタミンE欠乏症の原因となるArgの変異に着目し,細胞内におけるα-TTPによるビタミンEの輸送機構の解明を試みた.
in vitroにおいてArg59がTrpに変異したα-TTPの機能を調べたところ,意外なことに,この変異α-TTPは野生型α-TTPと同等のビタミンEとの結合能をもっていた.一方で,ラット肝がん細胞に野生型α-TTPを発現させたときにみられる細胞外へのビタミンE放出の促進効果は,この変異α-TTPにはまったくみられなかった.これらの結果から,Arg59がTrpに変異したα-TTPは,ビタミンE結合能以外のα-TTPの機能の異常により,細胞内におけるビタミンEの輸送を障害していると考えられた.
PI(3,4)P2(ホスファチジルイノシトール3,4-ビスリン酸)の誘導体を固定化したビーズを用いたPI(3,4)P2結合タンパク質の網羅的な探索から,α-TTPはPI(3,4)P2固定化ビーズに結合することが報告されていた2).このことに着目し同様の実験を行ったところ,野生型α-TTPはPI(3,4)P2固定化ビーズと結合したが,Arg59がTrpに変異したα-TTPはPI(3,4)P2固定化ビーズとはほとんど結合しないことが判明した.そこで,α-TTPとホスファチジルイノシトールリン酸との相互作用をネイティブポリアクリルアミドゲル電気泳動法によりさらに検討したところ,野生型α-TTPはPI(3,4)P2のみならずPI(4,5)P2(ホスファチジルイノシトール4,5-ビスリン酸)とも強く相互作用した.一方で,Arg59変異α-TTPはどのホスファチジルイノシトールリン酸との相互作用も消失していた.また,放射性同位体により標識したPI(4,5)P2とα-TTPとの混合物をゲルろ過法により分析したところ,PI(4,5)P2はα-TTPとともに溶出された.以上の結果から,α-TTPはPIP2(ホスファチジルイノシトールビスリン酸)と結合すること,Arg59がTrpに変異したα-TTPはPIP2との結合能を失っていることが明らかになった.
α-TTPにはPHドメインのような既知のホスファチジルイノシトールリン酸との結合ドメインは存在しない.そこで,α-TTPとPIP2との結合をより詳細に調べるため,α-TTPとPIP2との複合体のX線結晶構造解析を試みた.その結果,ビタミンEとPI(4,5)P2,あるいは,ビタミンEとPI(3,4)P2とが結合したα-TTPの結晶が得られ,PI(4,5)P2の結合したα-TTPは分解能2.0Å(PDB ID:3W68),PI(3,4)P2の結合したα-TTPは分解能2.6Å(PDB ID:3W67)で構造を決定した.すでに報告されているα-TTPとビタミンEとの複合体の結晶構造(PDB ID:1OIP,1R5L )と同様に3,4),ビタミンEはα-TTPの疎水性ポケットに結合していた.一方,PIP2はビタミンEとは異なる部位に結合しており,その極性頭部は先天性ビタミンE欠乏症患者においてミスセンス変異のみられるArg59,Arg192,Arg221を含む塩基性残基のクラスター領域に結合していた(図2a).Arg59,Arg192,Arg221の側鎖はPIP2のリン酸基と相互作用しており,これらの残基がα-TTPとPIP2との結合に重要であることが構造的にも確かめられた(図2b).Lys217はArg59,Arg192,Arg221と同様にPIP2のリン酸基との相互作用がみられたが,先天性ビタミンE欠乏症において変異の報告はない.そこで,Lys217をAlaに置換したところ,この変異α-TTPはArg59がTrpに変異したα-TTPと同様に,PIP2との結合能,および,細胞外へのビタミンE放出能が失われていた.
これまでに,α-TTPとビタミンEとの複合体,および,α-TTPとTriton X-100との複合体の構造が明らかになっており,それぞれ,ビタミンE結合ポケットの閉状態,および,開状態を表わしていると考えられている3,4).この2つの構造では,lid(ふた)とよばれるα10ヘリックスのコンフォメーションが大きく異なっており,それにより閉状態および開状態が規定されている.興味深いことに,α-TTPとPIP2との複合体において,PIP2の脂肪酸鎖はおそらくα9ヘリックスとlidとのあいだの疎水性の溝に結合しており,α-TTPとPIP2との複合体において,lidは閉状態と開状態との中間のコンフォメーションをとっていることがわかった(図2c).すなわち,PIP2がα-TTPに結合すると,α-TTPを開状態へと導き,ビタミンEの放出が促進されることが示唆された.
構造解析から得られた仮説を検証するため,α-TTPによるビタミンEの輸送におけるPIP2の役割を調べた.in vitroにおいて,α-TTPによるビタミンEの膜間輸送は,受容側のリポソームにPIP2をくわえることにより顕著に促進された.この効果は,Arg59がTrpに変異したα-TTPあるいはLys217がAlaに変異したα-TTPを用いたときにはみられず,また,PIP2の代わりにほかの酸性リン脂質をくわえても同様の効果は得られなかった.さらに,α-TTPによる培養肝細胞からのビタミンEの放出は,PI(4,5)P2に強い結合活性をもつネオマイシンの存在下において顕著に阻害された.これらの結果から,受容側の膜に存在するPIP2はα-TTPによるビタミンEの輸送を促進することが明らかになった.
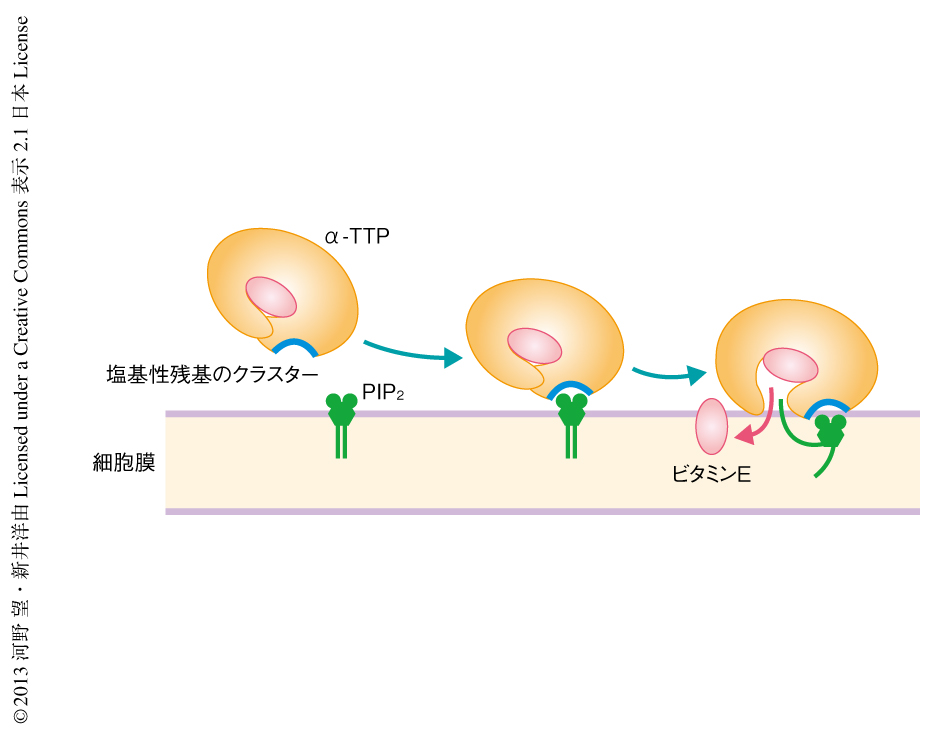
この研究では,α-TTPによる肝細胞でのビタミンEの輸送過程における,α-TTPとホスファチジルイノシトールリン酸との相互作用の重要性を明らかにした.また,Argのミスセンス変異により起こる先天性ビタミンE欠乏症は,α-TTPのビタミンE結合能の異常ではなく,ホスファチジルイノシトールリン酸との結合能の異常によりひき起こされていることが明らかになった.肝細胞においてα-TTPにより輸送されたビタミンEは,細胞膜に存在するABCトランスポーターにより細胞の外へと放出される5).PI(4,5)P2やPI(3,4)P2はおもに細胞膜に存在することから,α-TTPがこれらPIP2の極性頭部を認識することにより細胞膜へとターゲッティングし,さらに,細胞膜においてこれらPIP2と結合することによりα-TTPを開状態へと導き,α-TTPに結合していたビタミンEを細胞膜へと放出する,という機構が考えられた(図3).このように,α-TTPの細胞膜へのターゲティングとビタミンEの膜移行の促進の両方において,α-TTPとPIP2との結合が必要であることを提唱した.
α-TTPは出芽酵母の脂質結合タンパク質Sec14pに代表されるSec14タンパク質ファミリーに属しており,哺乳動物には約20種類のSec14ファミリータンパク質が存在する6).α-TTPとPIP2との相互作用に重要な塩基性残基はほかのSec14ファミリータンパク質にも保存されており,ホスファチジルイノシトールリン酸との相互作用がほかのSec14ファミリータンパク質の機能や関連する疾患にも寄与している可能性がある.また,α-TTPとはまったく構造の異なる出芽酵母のステロール輸送タンパク質Osh4pにおいても,最近,α-TTPと類似したホスファチジルイノシトールリン酸の役割が報告された7).これまで,細胞内脂質輸送タンパク質による膜における脂質の積み降ろしについて,その分子機構はほとんど不明であった.脂質輸送タンパク質とホスファチジルイノシトールリン酸との結合は細胞内脂質輸送における基本原理のひとつなのかもしれない.
略歴:2007年 東京大学大学院薬学系研究科修了,同年より同 助教.
研究テーマ:生体膜における脂肪酸環境の恒常性の維持機構.
抱負:膜リン脂質とタンパク質との相互作用という視点から,医学および薬学に貢献したい.
新井 洋由(Hiroyuki Arai)
東京大学大学院薬学系研究科 教授.
研究室URL:https://sites.google.com/site/eiseikagaku/
© 2013 河野 望・新井洋由 Licensed under CC 表示 2.1 日本
(東京大学大学院薬学系研究科 衛生化学教室)
email:河野 望,新井洋由
DOI: 10.7875/first.author.2013.064
Impaired α-TTP-PIPs interaction underlies familial vitamin E deficiency.
Nozomu Kono, Umeharu Ohto, Tatsufumi Hiramatsu, Michiko Urabe, Yasunori Uchida, Yoshinori Satow, Hiroyuki Arai
Science, 340, 1106-1110 (2013)
要 約
ビタミンEに特異的な結合タンパク質であるα-TTPは肝細胞におけるビタミンEの輸送タンパク質であり,先天性ビタミンE欠乏症の原因遺伝子産物である.ビタミンE欠乏症をもたらすα-TTPにおける変異のうち,3つのArgのミスセンス変異はビタミンEの結合部位とは異なる表面に位置しており,α-TTPの機能におけるこれらArgの役割は不明であった.今回,筆者らは,α-TTPがこれらのArgを介しホスファチジルイノシトールリン酸と相互作用していることを見い出した.また,in vitroにおいて,α-TTPのビタミンEの膜間輸送能は受容側のリポソームにホスファチジルイノシトールリン酸をくわえることにより大きく促進されることがわかった.さらに,α-TTPとホスファチジルイノシトールリン酸との複合体のX線結晶構造解析により,先天性ビタミンE欠乏症において変異のみられるArgはホスファチジルイノシトールリン酸のもつリン酸基と相互作用していること,ホスファチジルイノシトールリン酸との結合はα-TTPのビタミンE結合ポケットを開状態へと導くことが明らかになった.以上の結果から,ホスファチジルイノシトールリン酸はα-TTPの細胞膜へのターゲティングおよびビタミンEの膜移行を促進しており,α-TTPとホスファチジルイノシトールリン酸との相互作用の不全がビタミンE欠乏症の原因となることが強く示唆された.
はじめに
α-TTP(α-tocopherol transfer protein)はビタミンE(α-tocopherol)と特異的に結合する脂質結合タンパク質のひとつであり,おもに肝細胞の細胞質に存在する.ビタミンEはリポタンパク質と結合して血中を循環しており,リポタンパク質とともに肝臓に取り込まれたビタミンEは,ふたたび肝臓の外へと放出される.この過程において,α-TTPは肝細胞におけるビタミンEの輸送を媒介することにより体内のビタミンEのレベルを一定に保つ機能を担う1)(図1a).しかし,肝細胞におけるα-TTPによるビタミンEの輸送機構はよくわかっていない.α-TTPは先天性ビタミンE欠乏症の原因遺伝子産物であり,これまでに20種類以上の変異が報告されている.興味深いことに,9つのミスセンス変異のうち3つはArg(Arg59,Arg192,Arg221)に変異が起こっており,それらはビタミンEの結合部位とは異なるα-TTPの表面に位置している(図1b).Arg59やArg221における変異は重篤な臨床症状をもたらすことから,α-TTPの機能にこれらのArgが重要であることが考えられるが,その分子機構は明らかになっていなかった.今回,筆者らは,これら先天性ビタミンE欠乏症の原因となるArgの変異に着目し,細胞内におけるα-TTPによるビタミンEの輸送機構の解明を試みた.
1.Arg59に変異をもつα-TTPはホスファチジルイノシトールリン酸との結合能が失われている
in vitroにおいてArg59がTrpに変異したα-TTPの機能を調べたところ,意外なことに,この変異α-TTPは野生型α-TTPと同等のビタミンEとの結合能をもっていた.一方で,ラット肝がん細胞に野生型α-TTPを発現させたときにみられる細胞外へのビタミンE放出の促進効果は,この変異α-TTPにはまったくみられなかった.これらの結果から,Arg59がTrpに変異したα-TTPは,ビタミンE結合能以外のα-TTPの機能の異常により,細胞内におけるビタミンEの輸送を障害していると考えられた.
PI(3,4)P2(ホスファチジルイノシトール3,4-ビスリン酸)の誘導体を固定化したビーズを用いたPI(3,4)P2結合タンパク質の網羅的な探索から,α-TTPはPI(3,4)P2固定化ビーズに結合することが報告されていた2).このことに着目し同様の実験を行ったところ,野生型α-TTPはPI(3,4)P2固定化ビーズと結合したが,Arg59がTrpに変異したα-TTPはPI(3,4)P2固定化ビーズとはほとんど結合しないことが判明した.そこで,α-TTPとホスファチジルイノシトールリン酸との相互作用をネイティブポリアクリルアミドゲル電気泳動法によりさらに検討したところ,野生型α-TTPはPI(3,4)P2のみならずPI(4,5)P2(ホスファチジルイノシトール4,5-ビスリン酸)とも強く相互作用した.一方で,Arg59変異α-TTPはどのホスファチジルイノシトールリン酸との相互作用も消失していた.また,放射性同位体により標識したPI(4,5)P2とα-TTPとの混合物をゲルろ過法により分析したところ,PI(4,5)P2はα-TTPとともに溶出された.以上の結果から,α-TTPはPIP2(ホスファチジルイノシトールビスリン酸)と結合すること,Arg59がTrpに変異したα-TTPはPIP2との結合能を失っていることが明らかになった.
2.α-TTPは先天性ビタミンE欠乏症の原因となるArgを含む塩基性残基のクラスター領域を介しホスファチジルイノシトールリン酸と結合する
α-TTPにはPHドメインのような既知のホスファチジルイノシトールリン酸との結合ドメインは存在しない.そこで,α-TTPとPIP2との結合をより詳細に調べるため,α-TTPとPIP2との複合体のX線結晶構造解析を試みた.その結果,ビタミンEとPI(4,5)P2,あるいは,ビタミンEとPI(3,4)P2とが結合したα-TTPの結晶が得られ,PI(4,5)P2の結合したα-TTPは分解能2.0Å(PDB ID:3W68),PI(3,4)P2の結合したα-TTPは分解能2.6Å(PDB ID:3W67)で構造を決定した.すでに報告されているα-TTPとビタミンEとの複合体の結晶構造(PDB ID:1OIP,1R5L )と同様に3,4),ビタミンEはα-TTPの疎水性ポケットに結合していた.一方,PIP2はビタミンEとは異なる部位に結合しており,その極性頭部は先天性ビタミンE欠乏症患者においてミスセンス変異のみられるArg59,Arg192,Arg221を含む塩基性残基のクラスター領域に結合していた(図2a).Arg59,Arg192,Arg221の側鎖はPIP2のリン酸基と相互作用しており,これらの残基がα-TTPとPIP2との結合に重要であることが構造的にも確かめられた(図2b).Lys217はArg59,Arg192,Arg221と同様にPIP2のリン酸基との相互作用がみられたが,先天性ビタミンE欠乏症において変異の報告はない.そこで,Lys217をAlaに置換したところ,この変異α-TTPはArg59がTrpに変異したα-TTPと同様に,PIP2との結合能,および,細胞外へのビタミンE放出能が失われていた.
3.ホスファチジルイノシトールリン酸との結合はα-TTPを開状態へと導く
これまでに,α-TTPとビタミンEとの複合体,および,α-TTPとTriton X-100との複合体の構造が明らかになっており,それぞれ,ビタミンE結合ポケットの閉状態,および,開状態を表わしていると考えられている3,4).この2つの構造では,lid(ふた)とよばれるα10ヘリックスのコンフォメーションが大きく異なっており,それにより閉状態および開状態が規定されている.興味深いことに,α-TTPとPIP2との複合体において,PIP2の脂肪酸鎖はおそらくα9ヘリックスとlidとのあいだの疎水性の溝に結合しており,α-TTPとPIP2との複合体において,lidは閉状態と開状態との中間のコンフォメーションをとっていることがわかった(図2c).すなわち,PIP2がα-TTPに結合すると,α-TTPを開状態へと導き,ビタミンEの放出が促進されることが示唆された.
4.ホスファチジルイノシトールリン酸はα-TTPによるビタミンEの輸送を促進する
構造解析から得られた仮説を検証するため,α-TTPによるビタミンEの輸送におけるPIP2の役割を調べた.in vitroにおいて,α-TTPによるビタミンEの膜間輸送は,受容側のリポソームにPIP2をくわえることにより顕著に促進された.この効果は,Arg59がTrpに変異したα-TTPあるいはLys217がAlaに変異したα-TTPを用いたときにはみられず,また,PIP2の代わりにほかの酸性リン脂質をくわえても同様の効果は得られなかった.さらに,α-TTPによる培養肝細胞からのビタミンEの放出は,PI(4,5)P2に強い結合活性をもつネオマイシンの存在下において顕著に阻害された.これらの結果から,受容側の膜に存在するPIP2はα-TTPによるビタミンEの輸送を促進することが明らかになった.
おわりに
この研究では,α-TTPによる肝細胞でのビタミンEの輸送過程における,α-TTPとホスファチジルイノシトールリン酸との相互作用の重要性を明らかにした.また,Argのミスセンス変異により起こる先天性ビタミンE欠乏症は,α-TTPのビタミンE結合能の異常ではなく,ホスファチジルイノシトールリン酸との結合能の異常によりひき起こされていることが明らかになった.肝細胞においてα-TTPにより輸送されたビタミンEは,細胞膜に存在するABCトランスポーターにより細胞の外へと放出される5).PI(4,5)P2やPI(3,4)P2はおもに細胞膜に存在することから,α-TTPがこれらPIP2の極性頭部を認識することにより細胞膜へとターゲッティングし,さらに,細胞膜においてこれらPIP2と結合することによりα-TTPを開状態へと導き,α-TTPに結合していたビタミンEを細胞膜へと放出する,という機構が考えられた(図3).このように,α-TTPの細胞膜へのターゲティングとビタミンEの膜移行の促進の両方において,α-TTPとPIP2との結合が必要であることを提唱した.
α-TTPは出芽酵母の脂質結合タンパク質Sec14pに代表されるSec14タンパク質ファミリーに属しており,哺乳動物には約20種類のSec14ファミリータンパク質が存在する6).α-TTPとPIP2との相互作用に重要な塩基性残基はほかのSec14ファミリータンパク質にも保存されており,ホスファチジルイノシトールリン酸との相互作用がほかのSec14ファミリータンパク質の機能や関連する疾患にも寄与している可能性がある.また,α-TTPとはまったく構造の異なる出芽酵母のステロール輸送タンパク質Osh4pにおいても,最近,α-TTPと類似したホスファチジルイノシトールリン酸の役割が報告された7).これまで,細胞内脂質輸送タンパク質による膜における脂質の積み降ろしについて,その分子機構はほとんど不明であった.脂質輸送タンパク質とホスファチジルイノシトールリン酸との結合は細胞内脂質輸送における基本原理のひとつなのかもしれない.
文 献
- Traber, M. G. & Arai, H.: Molecular mechanisms of vitamin E transport. Annu. Rev. Nutr., 19, 343-355 (1999)[PubMed]
- Krugmann, S., Anderson, K. E., Ridley, S. H. et al.: Identification of ARAP3, a novel PI3K effector regulating both Arf and Rho GTPases, by selective capture on phosphoinositide affinity matrices. Mol. Cell, 9, 95-108 (2002)[PubMed]
- Min, K. C., Kovall, R. A. & Hendrickson, W. A.: Crystal structure of human α-tocopherol transfer protein bound to its ligand: implications for ataxia with vitamin E deficiency. Proc. Natl. Acad. Sci. USA, 100, 14713-14718 (2003)[PubMed]
- Meier, R., Tomizaki, T., Schulze-Briese, C. et al.: The molecular basis of vitamin E retention: structure of human α-tocopherol transfer protein. J. Mol. Biol., 331, 725-734 (2003)[PubMed]
- Takada, T. & Suzuki, H.: Molecular mechanisms of membrane transport of vitamin E. Mol. Nutr. Food Res., 54, 616-622 (2010)[PubMed]
- Saito, K., Tautz, L. & Mustelin, T.: The lipid-binding SEC14 domain. Biochim. Biophys. Acta, 1771, 719-726 (2007)[PubMed]
- de Saint-Jean, M., Delfosse, V., Douguet, D. et al.: Osh4p exchanges sterols for phosphatidylinositol 4-phosphate between lipid bilayers. J. Cell Biol., 195, 965-978 (2011)[PubMed]
著者プロフィール
略歴:2007年 東京大学大学院薬学系研究科修了,同年より同 助教.
研究テーマ:生体膜における脂肪酸環境の恒常性の維持機構.
抱負:膜リン脂質とタンパク質との相互作用という視点から,医学および薬学に貢献したい.
新井 洋由(Hiroyuki Arai)
東京大学大学院薬学系研究科 教授.
研究室URL:https://sites.google.com/site/eiseikagaku/
© 2013 河野 望・新井洋由 Licensed under CC 表示 2.1 日本