ADAR1はDicerと複合体を形成しmiRNAのプロセシングおよびmiRNAに依存するRNAサイレンシングを促進する
太田博允・櫻井雅之・西倉和子
(米国Wistar Institute,Gene Expression and Regulation Program)
email:太田博允,櫻井雅之,西倉和子
DOI: 10.7875/first.author.2013.062
ADAR1 forms a complex with Dicer to promote microRNA processing and RNA-induced gene silencing.
Hiromitsu Ota, Masayuki Sakurai, Ravi Gupta, Louis Valente, Bjorn-Erik Wulff, Kentaro Ariyoshi, Hisashi Iizasa, Ramana V. Davuluri, Kazuko Nishikura
Cell, 153, 575-589 (2013)
ADARは二本鎖RNAにおいてアデノシンをイノシンに特異的に脱アミノ化するRNA編集を行う.この研究では,ADAR1がこれまで知られてきたRNA編集能のほか,Dicerとヘテロ二量体を形成してmiRNAのプロセシングを加速しRISCの形成を促進するRNAi促進能をもつことを証明した.ADAR1を欠損したマウスの胚では,ADAR1のもつRNAi促進能の不全のためmiRNAの発現がグローバルに阻害され,miRNAにより抑制されるべき遺伝子の発現上昇が観察された.ADAR1ノックアウトマウスが胎生致死となるのは,このRNAi促進能の不全に起因するものと思われた.
ADAR(adenosine deaminases acting on RNA)は二本鎖RNAに含まれるアデノシンをイノシンへと塩基修飾するRNA編集酵素である.mRNAに存在するイノシンは翻訳の際にグアノシンとして認識されるため,いくつかの遺伝子においてはRNA編集により翻訳産物のアミノ酸配列に変化が生じる1).しかし,このような遺伝子は少数であり,RNA編集の多くはLINEやAluなどくり返し配列をもつ非コードRNA領域に起こる2).哺乳類では3種類のADAR遺伝子が知られており,そのうち,ADAR1遺伝子はインターフェロン誘導型のp150と,恒常発現型でありN末端を欠失しているp110の2つのアイソフォームをコードする.ADAR1ノックアウトマウスは胎生致死を示すが,その原因はいまだ解明されていない3).
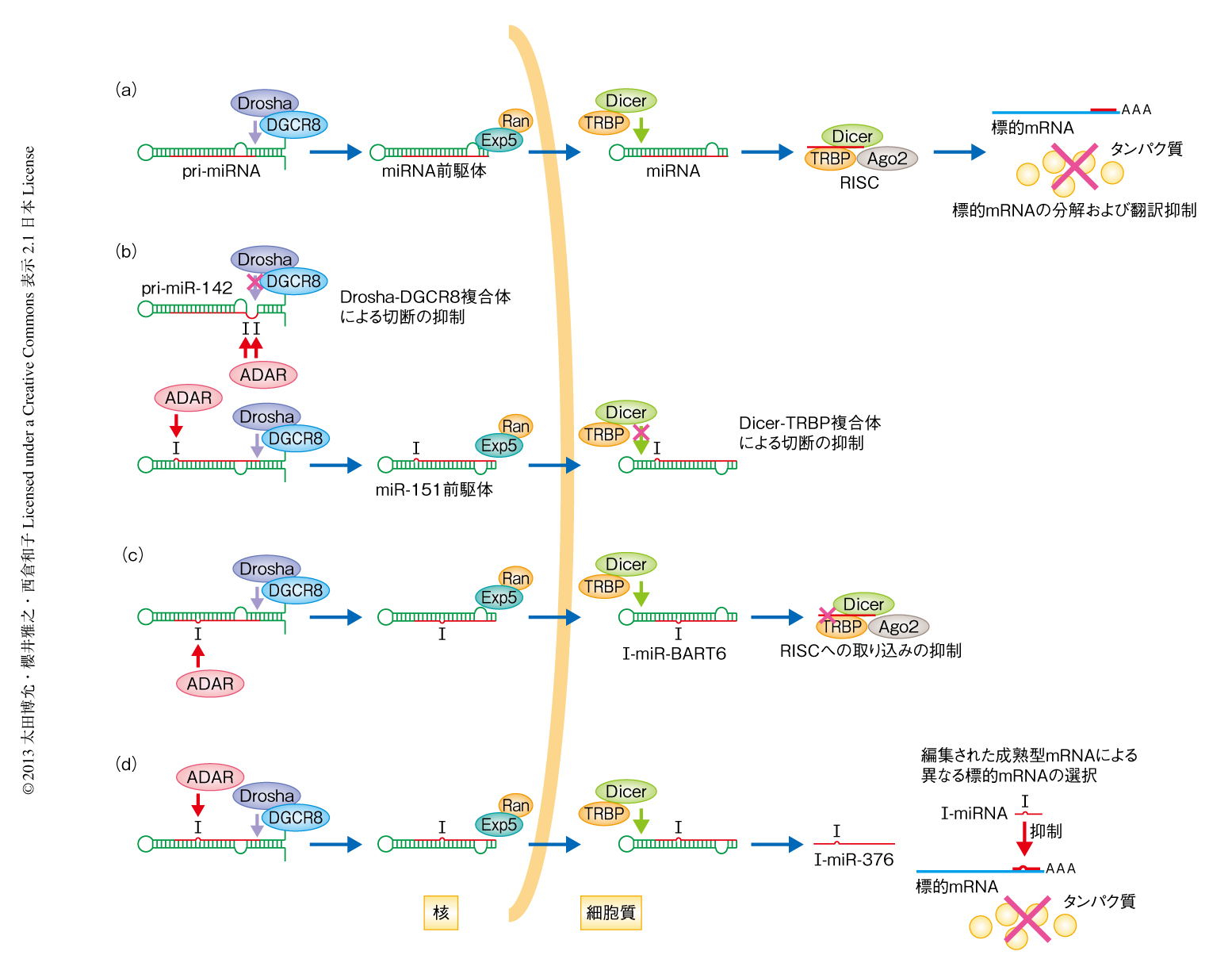
DicerはRNase IIIグループに属し,miRNA(microRNA,マイクロRNA)の産生において重要なはたらきをしている.ゲノムから転写された1次前駆体であるpri-miRNAは核においてDrosha-DGCR8複合体により切断され2次前駆体であるmiRNA前駆体となる.miRNA前駆体は細胞質へと輸送され,Dicerによる切断をうけて成熟型のmiRNAとなる(図1a).二本鎖RNA結合タンパク質であるTRBPはDicerと複合体を形成し,DicerのもつmiRNA前駆体の切断活性を促進する4).さらに,Dicer-TRBP複合体はAgo2(Ago:Argonaute)への成熟miRNAの取り込みを促進し,RISC(RNA-induced silencing complex)の形成にも関与する5).Ago2は成熟型miRNAのガイドにより標的遺伝子の転写産物に対し翻訳阻害や切断を行う(RNAサイレンシングの分子機構については,佐々木 浩・泊 幸秀, 領域融合レビュー, 1, e001, 2012 も参照されたい).
線虫では内在性の二本鎖RNAがADARによりRNA編集をうけることでRNAi(RNA interference,RNA干渉)経路に進むことが阻害され6),また,ヒトおよびマウスではpri-miRNAがADARの基質となることが報告されている.RNA編集により,miRNAの成熟過程の阻害7,8)(図1b),miRNAの標的遺伝子の変換9)(図1c),miRNAのRISCへの取り込みの阻害10)(図1d),などの影響があることが知られている.
このような最近の研究が示唆するように,RNA編集はRNAiに対し拮抗的に作用していると考えられてきた.しかし,この研究では,これまでの知見とはまったく異なる,RNAiに促進的なADAR1の機能を明らかにした.
ADARとRNAi機構との関係を調べるため,RISCを構成するタンパク質であるDicer,TRBP,Ago2とADAR1の組換え体をそれぞれ培養細胞HEK293T細胞において発現させ,免疫共沈実験を行った.その結果,ADAR1はこれらのRISC構成タンパク質と共沈することが観察されたが,とくに,Dicerとの強い相互作用が観察された.このADAR1とRISC構成タンパク質との相互作用をさらにくわしく確認するため,昆虫培養細胞Sf9細胞においてADAR1とRISC構成タンパク質をそれぞれ共発現させ,その相互作用を調べた.その結果,ADAR1はDicerとは直接に複合体を形成する一方,Ago2とはDicerを介し間接的に相互作用していることが明らかになった.さらに,ゲルろ過クロマトグラフィーを使った解析により,Dicer-ADAR1複合体はDicerとADAR1とが1対1で構成されるヘテロ二量体を形成していることが明らかになった.DicerおよびADAR1の欠失変異体を使った実験により,ADAR1では2つ目の二本鎖RNA結合ドメインが,また,DicerではDEADボックスRNAヘリカーゼドメインとDUF283ドメインが,この相互作用にかかわっていることがわかった.
ADAR1との相互作用がDicerにどのような影響をあたえているのかを調べるため,Dicerのみ,Dicer-TRBP複合体,Dicer-ADAR1複合体をそれぞれ調製し,in vitroにおいてmiRNAあるいはsiRNAの産生反応を解析した.その結果,TRBPと同じく,ADAR1の2つのアイソフォームp150とp110とも,miRNAおよびsiRNAの産生においてDicerの活性を促進することがわかった.つぎに,ADAR1のもつ二本鎖RNA結合能とRNA編集能のどちらがDicerを活性化しているかを特定するため,それぞれの機能を担う部位に変異を導入してこれを不活性化したADAR1変異体とDicerとの複合体を調製し,その酵素活性を調べた.その結果,どちらの部位の変異体も野生型のADAR1と同じ程度にDicerの活性を促進することが確認された.これらの結果から,ADAR1はDicerに結合すること自体によって,Dicerの活性を促進していると考えられた.Dicerに対するADAR1の影響をより詳細に調べるため,Dicer-ADAR1 p110複合体によるsiRNAおよびmiRNAの産生においてMichaelis-Menten式を用いた酵素反応解析を行った.その結果,Dicer-ADAR 1p110複合体ではDicer単独のときと比べ,最大反応速度Vmaxが4倍に増加していることがわかった.
Dicer-ADAR1複合体により産生されたsiRNAやmiRNAがRISCへと取り込まれるかどうか調べた.miRNA前駆体であるlet-7a前駆体およびAgo2を,Dicer,Dicer-TRBP複合体,Dicer-ADAR1複合体のそれぞれと反応させたのち,let-7aの標的となるRNAをくわえてその切断を観察した.その結果,Dicer-ADAR1複合体により産生されたlet-7aはAgo2を含むRISCに取り込まれ機能することが判明した.さらに,標的RNAに対する切断効率はDicer単独のときと比べ2倍以上も亢進しており,これはDicer-TRBP複合体の活性に匹敵することが判明した.つぎに,Dicer-ADAR1複合体によるmiRNAのAgo2への取り込み能をさらにくわしく調べるため,let-7a前駆体の代わりに,Dicerによりすでに切断された二本鎖let-7aおよび一本鎖のガイド鎖let-7aを用いてRISCへの取り込みを解析した.その結果,Dicer-ADAR1複合体ではどちらの場合も,Ago2単独,あるいは,DicerとAgo2の組合せのみに比較して,より高い効率で標的RNAを切断することが判明した.これらの結果から,ADAR1はDicerによるmiRNA前駆体あるいはsiRNA前駆体の切断だけでなく,Ago2を含むRISCへのガイド鎖RNAの取り込みも促進することが示された.
ADAR1はどのようにしてRNA編集能とRNAi促進能とを使い分けているのだろうか? miRNAのうちmiR-151の+3位と-1位のアデノシンは高い効率でイノシンへと変換されることが報告されている7).そこで,Dicer-ADAR1複合体のRNA編集能をmiR-151前駆体を基質として解析した.miR-151前駆体をDicer-ADAR1複合体により切断したのち,切断されていないmiR-151前駆体と切断されたmiR-151を調べたところ,どちらにもRNA編集は検出されなかった.このことから,Dicer-ADAR1ヘテロ二量体はRNA編集能をもたないことがわかった.ADAR1は単独でホモ二量体を形成するか,あるいは,Dicerとヘテロ二量体を形成するかを選択することにより,RNA編集酵素とRNAi促進タンパク質としての機能を使い分けているものと推測された.
ADAR1ノックアウトマウスでは胎生12日ごろに全身にアポトーシスが生じ死にいたる3).in vivoでのmiRNA産生機構におけるADAR1の寄与の程度をはかるため,胎生11日および胎生11.5日の野生型マウスおよびADAR1ノックアウトマウスの胚においてmiRNA発現プロファイルを次世代シークエンサーにより解析した.その結果,胎生11.5日においてはADAR1ノックアウトマウスおよび野生型マウスともに変化はなかったが,胎生11.5日のADAR1ノックアウトマウスにおいてmiRNA量のグローバルな減少がみられた.また,野生型マウスでは胎生11日から胎生11.5日にかけてmiRNA量の顕著な増加がみられた.また,定量RT-PCR法による解析の結果,野生型マウスでは胎生11日から胎生11.5日にかけてmiRNAの産生が2~3倍も増加したが,ADAR1ノックアウトマウスではそのようなmiRNA産生の増加は観察されなかった.
野生型マウスの胚において胎生11日から胎生11.5日にかけてmiRNAが増加していたことから,とくにこの時期において,miRNA産生機構が活性化しているのではないかと推測された.そこで,胎生9日から胎生12日にかけて野生型マウスの胚においてDicer,ADAR1,TRBP,PACTの発現量を比較したところ,胎生11日から胎生12日にかけてDicerの発現量は3~5倍に増加しており,さらに,ADAR1 p110もDicerの増加にともない4~5倍に増加していることが判明した.一方,TRBPおよびPACTは胎生9日から胎生11日にかけて変化なく,胎生12日において1.5倍ほど増加しただけであった.この結果は,胎生11日から胎生12日にかけてのmiRNAのグローバルな発現量の上昇は,DicerおよびADAR1 p110の発現量の増加により促進されていることを示唆しており,少なくとも,マウスの胎生11日から胎生12日における胚発生の過程においては,ADAR1はPACTやTRBPよりも,Dicerの補因子としてmiRNAの産生に寄与していると考えられた.
減少の確認されたmiRNAであるmiR-1,miR-103-3p,miR-181aの標的遺伝子産物として知られるFOXP1,IRX5,Dicer,c-FOSのタンパク質発現量を解析した結果,これらは胎生11.5日のADAR1ノックアウトマウスでは2~2.5倍に増加しており,これらmiRNAの発現量の減少がターゲット遺伝子の発現の上昇をひき起こしていることが確認された.そこで,胎生11.5日のADAR1ノックアウトマウスにおいて,次世代シークエンサーを用いてポリAをもつRNAのグローバルな遺伝子発現プロファイルを解析した.その結果,発現が2倍以上も上昇したmRNAの大部分は,ADAR1ノックアウトマウスにおいて発現の低下がみられたmiRNAの標的遺伝子と予測されることが,in silicoでの解析により判明した.遺伝子の傾向として,細胞死,血球新生,心臓発生に関与するものが多くみられ,ADAR1ノックアウトマウスではADAR1の欠損によりmiRNAが十分に供給されなかったため,胚の正常な発生に必要な遺伝子発現抑制が起こらなかったことが示唆された.
ADAR1が培養細胞においてもmiRNA産生機構に関与しているかどうか検証するため,HeLa細胞においてRNAi法を用いてADAR1およびTRBPのノックダウン,および,ADAR1とTRBPの二重ノックダウンを行い,miRNAとしてlet-7e,let-7c,miR-103-3p,miR-181b-5pの発現量を定量RT-PCR法により解析した.その結果,TRBPのノックダウンによりmiRNAの産生量が40~70%ほど低下するのに対し,ADAR1のノックダウンでも30~40%の低下が観察された.さらに,TRBPとADAR1をともにノックダウンすると,TRBP単独でのノックダウンよりさらに10%~20%ほどmiRNAの産生量は低下した.また,次世代シークエンサーを用いた解析でも,ADAR1をノックダウンすることによりグローバルなmiRNAの減少が起こっていることが確認された.以上の結果から,発生している胎仔のみならず,培養細胞においてもADAR1がmiRNAの産生に寄与していることが示された.
これまで,アデノシンからイノシンへのRNA編集がRNAi機構やmiRNA産生機構に対し拮抗作用をもつことが報告されてきた.しかし,この研究では,RNA編集酵素としてよく知られるADAR1が,Dicerと複合体を形成しmiRNAの産生およびRISCへの取り込みを活性化するRNAi促進能をもつことが発見された(図2).この2つの機能は,ADAR1がADAR1ホモ二量体を形成するかADAR1-Dicer二量体を形成するかを選択する過程において制御されているものと考えられた.マウスの胎生11日から胎生12日の胚ではADAR1によるRNA編集の効率は全体的に非常に低く,ごくかぎられたmiRNAやmRNAのみが低頻度でRNA編集されていることが知られており,胚発生の過程ではADAR1はADAR1-Dicerヘテロ二量体として,miRNA産生機構の補因子としておもにRNAi機構に関与していると思われた.ADAR1ノックアウトマウスの胎生致死という表現型は,TRBPノックアウトマウスの表現型(生育遅滞および雄の不妊)やPACTノックアウトマウスの表現型(難聴)に比べ劇的であることからも,胚発生の過程におけるmiRNA産生機構において,ADAR1の寄与がもっとも重要であることがうかがえた.以上の知見から,Dicerとのヘテロ二量体としてADAR1のもつRNAi促進能の欠失が,ADAR1ノックアウトマウスの胎生致死をひき起こす大きな要因となっていると推察された.
略歴:2008年 九州大学大学院理学府博士課程 修了,同年 九州大学大学院システム生命科学府 特別研究員を経て,2009年より米国Wistar Instituteポストドクトラルフェロー.
研究テーマ:ADAR1と相互作用するタンパク質の同定と機能解析.
櫻井 雅之(Masayuki Sakurai)
略歴:2006年 東京大学大学院新領域創成科学研究科博士課程 修了,同年 東京大学大学院工学系研究科 特別研究員,2010年 米国Wistar Instituteポストドクトラルフェローを経て,2012年より同Staff Scientist.
研究テーマ:ADAR1およびRNA編集の介する遺伝子発現の制御機構.
西倉 和子(Kazuko Nishikura)
米国Wistar Institute教授.
研究室URL:http://www.wistar.org/lab/kazuko-nishikura-phd
© 2013 太田博允・櫻井雅之・西倉和子 Licensed under CC 表示 2.1 日本
(米国Wistar Institute,Gene Expression and Regulation Program)
email:太田博允,櫻井雅之,西倉和子
DOI: 10.7875/first.author.2013.062
ADAR1 forms a complex with Dicer to promote microRNA processing and RNA-induced gene silencing.
Hiromitsu Ota, Masayuki Sakurai, Ravi Gupta, Louis Valente, Bjorn-Erik Wulff, Kentaro Ariyoshi, Hisashi Iizasa, Ramana V. Davuluri, Kazuko Nishikura
Cell, 153, 575-589 (2013)
要 約
ADARは二本鎖RNAにおいてアデノシンをイノシンに特異的に脱アミノ化するRNA編集を行う.この研究では,ADAR1がこれまで知られてきたRNA編集能のほか,Dicerとヘテロ二量体を形成してmiRNAのプロセシングを加速しRISCの形成を促進するRNAi促進能をもつことを証明した.ADAR1を欠損したマウスの胚では,ADAR1のもつRNAi促進能の不全のためmiRNAの発現がグローバルに阻害され,miRNAにより抑制されるべき遺伝子の発現上昇が観察された.ADAR1ノックアウトマウスが胎生致死となるのは,このRNAi促進能の不全に起因するものと思われた.
はじめに
ADAR(adenosine deaminases acting on RNA)は二本鎖RNAに含まれるアデノシンをイノシンへと塩基修飾するRNA編集酵素である.mRNAに存在するイノシンは翻訳の際にグアノシンとして認識されるため,いくつかの遺伝子においてはRNA編集により翻訳産物のアミノ酸配列に変化が生じる1).しかし,このような遺伝子は少数であり,RNA編集の多くはLINEやAluなどくり返し配列をもつ非コードRNA領域に起こる2).哺乳類では3種類のADAR遺伝子が知られており,そのうち,ADAR1遺伝子はインターフェロン誘導型のp150と,恒常発現型でありN末端を欠失しているp110の2つのアイソフォームをコードする.ADAR1ノックアウトマウスは胎生致死を示すが,その原因はいまだ解明されていない3).
DicerはRNase IIIグループに属し,miRNA(microRNA,マイクロRNA)の産生において重要なはたらきをしている.ゲノムから転写された1次前駆体であるpri-miRNAは核においてDrosha-DGCR8複合体により切断され2次前駆体であるmiRNA前駆体となる.miRNA前駆体は細胞質へと輸送され,Dicerによる切断をうけて成熟型のmiRNAとなる(図1a).二本鎖RNA結合タンパク質であるTRBPはDicerと複合体を形成し,DicerのもつmiRNA前駆体の切断活性を促進する4).さらに,Dicer-TRBP複合体はAgo2(Ago:Argonaute)への成熟miRNAの取り込みを促進し,RISC(RNA-induced silencing complex)の形成にも関与する5).Ago2は成熟型miRNAのガイドにより標的遺伝子の転写産物に対し翻訳阻害や切断を行う(RNAサイレンシングの分子機構については,佐々木 浩・泊 幸秀, 領域融合レビュー, 1, e001, 2012 も参照されたい).
線虫では内在性の二本鎖RNAがADARによりRNA編集をうけることでRNAi(RNA interference,RNA干渉)経路に進むことが阻害され6),また,ヒトおよびマウスではpri-miRNAがADARの基質となることが報告されている.RNA編集により,miRNAの成熟過程の阻害7,8)(図1b),miRNAの標的遺伝子の変換9)(図1c),miRNAのRISCへの取り込みの阻害10)(図1d),などの影響があることが知られている.
このような最近の研究が示唆するように,RNA編集はRNAiに対し拮抗的に作用していると考えられてきた.しかし,この研究では,これまでの知見とはまったく異なる,RNAiに促進的なADAR1の機能を明らかにした.
1.DicerはADAR1と複合体を形成する
ADARとRNAi機構との関係を調べるため,RISCを構成するタンパク質であるDicer,TRBP,Ago2とADAR1の組換え体をそれぞれ培養細胞HEK293T細胞において発現させ,免疫共沈実験を行った.その結果,ADAR1はこれらのRISC構成タンパク質と共沈することが観察されたが,とくに,Dicerとの強い相互作用が観察された.このADAR1とRISC構成タンパク質との相互作用をさらにくわしく確認するため,昆虫培養細胞Sf9細胞においてADAR1とRISC構成タンパク質をそれぞれ共発現させ,その相互作用を調べた.その結果,ADAR1はDicerとは直接に複合体を形成する一方,Ago2とはDicerを介し間接的に相互作用していることが明らかになった.さらに,ゲルろ過クロマトグラフィーを使った解析により,Dicer-ADAR1複合体はDicerとADAR1とが1対1で構成されるヘテロ二量体を形成していることが明らかになった.DicerおよびADAR1の欠失変異体を使った実験により,ADAR1では2つ目の二本鎖RNA結合ドメインが,また,DicerではDEADボックスRNAヘリカーゼドメインとDUF283ドメインが,この相互作用にかかわっていることがわかった.
2.ADAR1はDicerに結合しsiRNAやmiRNAの産生を促進する
ADAR1との相互作用がDicerにどのような影響をあたえているのかを調べるため,Dicerのみ,Dicer-TRBP複合体,Dicer-ADAR1複合体をそれぞれ調製し,in vitroにおいてmiRNAあるいはsiRNAの産生反応を解析した.その結果,TRBPと同じく,ADAR1の2つのアイソフォームp150とp110とも,miRNAおよびsiRNAの産生においてDicerの活性を促進することがわかった.つぎに,ADAR1のもつ二本鎖RNA結合能とRNA編集能のどちらがDicerを活性化しているかを特定するため,それぞれの機能を担う部位に変異を導入してこれを不活性化したADAR1変異体とDicerとの複合体を調製し,その酵素活性を調べた.その結果,どちらの部位の変異体も野生型のADAR1と同じ程度にDicerの活性を促進することが確認された.これらの結果から,ADAR1はDicerに結合すること自体によって,Dicerの活性を促進していると考えられた.Dicerに対するADAR1の影響をより詳細に調べるため,Dicer-ADAR1 p110複合体によるsiRNAおよびmiRNAの産生においてMichaelis-Menten式を用いた酵素反応解析を行った.その結果,Dicer-ADAR 1p110複合体ではDicer単独のときと比べ,最大反応速度Vmaxが4倍に増加していることがわかった.
3.ADAR1はmiRNAのRISCへの取り込みと標的RNAの切断を促進する
Dicer-ADAR1複合体により産生されたsiRNAやmiRNAがRISCへと取り込まれるかどうか調べた.miRNA前駆体であるlet-7a前駆体およびAgo2を,Dicer,Dicer-TRBP複合体,Dicer-ADAR1複合体のそれぞれと反応させたのち,let-7aの標的となるRNAをくわえてその切断を観察した.その結果,Dicer-ADAR1複合体により産生されたlet-7aはAgo2を含むRISCに取り込まれ機能することが判明した.さらに,標的RNAに対する切断効率はDicer単独のときと比べ2倍以上も亢進しており,これはDicer-TRBP複合体の活性に匹敵することが判明した.つぎに,Dicer-ADAR1複合体によるmiRNAのAgo2への取り込み能をさらにくわしく調べるため,let-7a前駆体の代わりに,Dicerによりすでに切断された二本鎖let-7aおよび一本鎖のガイド鎖let-7aを用いてRISCへの取り込みを解析した.その結果,Dicer-ADAR1複合体ではどちらの場合も,Ago2単独,あるいは,DicerとAgo2の組合せのみに比較して,より高い効率で標的RNAを切断することが判明した.これらの結果から,ADAR1はDicerによるmiRNA前駆体あるいはsiRNA前駆体の切断だけでなく,Ago2を含むRISCへのガイド鎖RNAの取り込みも促進することが示された.
4.ADAR1の機能はヘテロ二量体とホモ二量体の選択的な形成により決定される
ADAR1はどのようにしてRNA編集能とRNAi促進能とを使い分けているのだろうか? miRNAのうちmiR-151の+3位と-1位のアデノシンは高い効率でイノシンへと変換されることが報告されている7).そこで,Dicer-ADAR1複合体のRNA編集能をmiR-151前駆体を基質として解析した.miR-151前駆体をDicer-ADAR1複合体により切断したのち,切断されていないmiR-151前駆体と切断されたmiR-151を調べたところ,どちらにもRNA編集は検出されなかった.このことから,Dicer-ADAR1ヘテロ二量体はRNA編集能をもたないことがわかった.ADAR1は単独でホモ二量体を形成するか,あるいは,Dicerとヘテロ二量体を形成するかを選択することにより,RNA編集酵素とRNAi促進タンパク質としての機能を使い分けているものと推測された.
5.ADAR1の欠損はマウスの胚発生の過程においてグローバルなmiRNA産生量の低下をひき起こす
ADAR1ノックアウトマウスでは胎生12日ごろに全身にアポトーシスが生じ死にいたる3).in vivoでのmiRNA産生機構におけるADAR1の寄与の程度をはかるため,胎生11日および胎生11.5日の野生型マウスおよびADAR1ノックアウトマウスの胚においてmiRNA発現プロファイルを次世代シークエンサーにより解析した.その結果,胎生11.5日においてはADAR1ノックアウトマウスおよび野生型マウスともに変化はなかったが,胎生11.5日のADAR1ノックアウトマウスにおいてmiRNA量のグローバルな減少がみられた.また,野生型マウスでは胎生11日から胎生11.5日にかけてmiRNA量の顕著な増加がみられた.また,定量RT-PCR法による解析の結果,野生型マウスでは胎生11日から胎生11.5日にかけてmiRNAの産生が2~3倍も増加したが,ADAR1ノックアウトマウスではそのようなmiRNA産生の増加は観察されなかった.
野生型マウスの胚において胎生11日から胎生11.5日にかけてmiRNAが増加していたことから,とくにこの時期において,miRNA産生機構が活性化しているのではないかと推測された.そこで,胎生9日から胎生12日にかけて野生型マウスの胚においてDicer,ADAR1,TRBP,PACTの発現量を比較したところ,胎生11日から胎生12日にかけてDicerの発現量は3~5倍に増加しており,さらに,ADAR1 p110もDicerの増加にともない4~5倍に増加していることが判明した.一方,TRBPおよびPACTは胎生9日から胎生11日にかけて変化なく,胎生12日において1.5倍ほど増加しただけであった.この結果は,胎生11日から胎生12日にかけてのmiRNAのグローバルな発現量の上昇は,DicerおよびADAR1 p110の発現量の増加により促進されていることを示唆しており,少なくとも,マウスの胎生11日から胎生12日における胚発生の過程においては,ADAR1はPACTやTRBPよりも,Dicerの補因子としてmiRNAの産生に寄与していると考えられた.
減少の確認されたmiRNAであるmiR-1,miR-103-3p,miR-181aの標的遺伝子産物として知られるFOXP1,IRX5,Dicer,c-FOSのタンパク質発現量を解析した結果,これらは胎生11.5日のADAR1ノックアウトマウスでは2~2.5倍に増加しており,これらmiRNAの発現量の減少がターゲット遺伝子の発現の上昇をひき起こしていることが確認された.そこで,胎生11.5日のADAR1ノックアウトマウスにおいて,次世代シークエンサーを用いてポリAをもつRNAのグローバルな遺伝子発現プロファイルを解析した.その結果,発現が2倍以上も上昇したmRNAの大部分は,ADAR1ノックアウトマウスにおいて発現の低下がみられたmiRNAの標的遺伝子と予測されることが,in silicoでの解析により判明した.遺伝子の傾向として,細胞死,血球新生,心臓発生に関与するものが多くみられ,ADAR1ノックアウトマウスではADAR1の欠損によりmiRNAが十分に供給されなかったため,胚の正常な発生に必要な遺伝子発現抑制が起こらなかったことが示唆された.
6.培養細胞においてもADAR1はmiRNAの産生に寄与する
ADAR1が培養細胞においてもmiRNA産生機構に関与しているかどうか検証するため,HeLa細胞においてRNAi法を用いてADAR1およびTRBPのノックダウン,および,ADAR1とTRBPの二重ノックダウンを行い,miRNAとしてlet-7e,let-7c,miR-103-3p,miR-181b-5pの発現量を定量RT-PCR法により解析した.その結果,TRBPのノックダウンによりmiRNAの産生量が40~70%ほど低下するのに対し,ADAR1のノックダウンでも30~40%の低下が観察された.さらに,TRBPとADAR1をともにノックダウンすると,TRBP単独でのノックダウンよりさらに10%~20%ほどmiRNAの産生量は低下した.また,次世代シークエンサーを用いた解析でも,ADAR1をノックダウンすることによりグローバルなmiRNAの減少が起こっていることが確認された.以上の結果から,発生している胎仔のみならず,培養細胞においてもADAR1がmiRNAの産生に寄与していることが示された.
おわりに
これまで,アデノシンからイノシンへのRNA編集がRNAi機構やmiRNA産生機構に対し拮抗作用をもつことが報告されてきた.しかし,この研究では,RNA編集酵素としてよく知られるADAR1が,Dicerと複合体を形成しmiRNAの産生およびRISCへの取り込みを活性化するRNAi促進能をもつことが発見された(図2).この2つの機能は,ADAR1がADAR1ホモ二量体を形成するかADAR1-Dicer二量体を形成するかを選択する過程において制御されているものと考えられた.マウスの胎生11日から胎生12日の胚ではADAR1によるRNA編集の効率は全体的に非常に低く,ごくかぎられたmiRNAやmRNAのみが低頻度でRNA編集されていることが知られており,胚発生の過程ではADAR1はADAR1-Dicerヘテロ二量体として,miRNA産生機構の補因子としておもにRNAi機構に関与していると思われた.ADAR1ノックアウトマウスの胎生致死という表現型は,TRBPノックアウトマウスの表現型(生育遅滞および雄の不妊)やPACTノックアウトマウスの表現型(難聴)に比べ劇的であることからも,胚発生の過程におけるmiRNA産生機構において,ADAR1の寄与がもっとも重要であることがうかがえた.以上の知見から,Dicerとのヘテロ二量体としてADAR1のもつRNAi促進能の欠失が,ADAR1ノックアウトマウスの胎生致死をひき起こす大きな要因となっていると推察された.
文 献
- Hood, J. L. & Emeson, R. B.: Editing of neurotransmitter receptor and ion channel RNAs in the nervous system. Curr. Top. Microbiol. Immunol., 353, 61-90 (2012)[PubMed]
- Ramaswami, G., Lin, W., Piskol, R. et al.: Accurate identification of human Alu and non-AluRNA editing sites. Nat. Methods, 9, 579-581 (2012)[PubMed]
- Wang, Q., Miyakoda, M., Yang, W. et al.: Stress-induced apoptosis associated with null mutation of ADAR1 RNA editing deaminase gene. J. Biol. Chem., 279, 4952-4961 (2004)[PubMed]
- Chakravarthy, S., Sternberg, S. H., Kellenberger, C. A. et al.: Substrate-specific kinetics of Dicer-catalyzed RNA processing. J. Mol. Biol., 404, 392-402 (2010)[PubMed]
- Chendrimada, T. P., Gregory, R. I., Kumaraswamy, E. et al.: TRBP recruits the Dicer complex to Ago2 for microRNA processing and gene silencing. Nature, 436, 740-744 (2005)[PubMed]
- Wu, D., Lamm, A. T. & Fire, A. Z.: Competition between ADAR and RNAi pathways for an extensive class of RNA targets. Nat. Struct. Mol. Biol., 18, 1094-1101 (2011)[PubMed]
- Kawahara, Y., Zinshteyn, B., Chendrimada, T. P. et al.: RNA editing of the microRNA-151 precursor blocks cleavage by the Dicer-TRBP complex. EMBO Rep., 8, 763-769 (2007)[PubMed]
- Yang, W., Chendrimada, T. P., Wang, Q. et al.: Modulation of microRNA processing and expression through RNA editing by ADAR deaminases. Nat. Struct. Mol. Biol., 13, 13-21 (2006)[PubMed]
- Kawahara, Y., Zinshteyn, B., Sethupathy, P. et al.: Redirection of silencing targets by adenosine-to-inosine editing of miRNAs. Science, 315, 1137-1140 (2007)[PubMed]
- Iizasa, H., Wulff, B. E., Alla, N. R. et al.: Editing of Epstein-Barr virus-encoded BART6 microRNAs controls their dicer targeting and consequently affects viral latency. J. Biol. Chem., 285, 33358-33370 (2010)[PubMed]
著者プロフィール
略歴:2008年 九州大学大学院理学府博士課程 修了,同年 九州大学大学院システム生命科学府 特別研究員を経て,2009年より米国Wistar Instituteポストドクトラルフェロー.
研究テーマ:ADAR1と相互作用するタンパク質の同定と機能解析.
櫻井 雅之(Masayuki Sakurai)
略歴:2006年 東京大学大学院新領域創成科学研究科博士課程 修了,同年 東京大学大学院工学系研究科 特別研究員,2010年 米国Wistar Instituteポストドクトラルフェローを経て,2012年より同Staff Scientist.
研究テーマ:ADAR1およびRNA編集の介する遺伝子発現の制御機構.
西倉 和子(Kazuko Nishikura)
米国Wistar Institute教授.
研究室URL:http://www.wistar.org/lab/kazuko-nishikura-phd
© 2013 太田博允・櫻井雅之・西倉和子 Licensed under CC 表示 2.1 日本