Tam41はミトコンドリアにおけるカルジオリピンの合成に必要なCDP-ジアシルグリセロール合成酵素である
田村 康・遠藤斗志也
(名古屋大学大学院理学研究科 物質理学専攻生物化学研究室)
email:田村 康,遠藤斗志也
DOI: 10.7875/first.author.2013.061
Tam41 is a CDP-diacylglycerol synthase required for cardiolipin biosynthesis in mitochondria.
Yasushi Tamura, Yoshihiro Harada, Shuh-ichi Nishikawa, Koji Yamano, Megumi Kamiya, Takuya Shiota, Takuya Kuroda, Osamu Kuge, Hiromi Sesaki, Kenichiro Imai, Kentaro Tomii, Toshiya Endo
Cell Metabolism, 17, 709-718 (2013)
真核生物のオルガネラが正しく機能するためには,おのおののオルガネラ膜のもつ独自のリン脂質組成が維持されることが重要である.カルジオリピンはミトコンドリアの機能に必須のリン脂質であり,ミトコンドリアにおいてその量が適性に保たれる必要がある.真核生物においてカルジオリピン合成の鍵をにぎる中間体リン脂質,CDP-ジアシルグリセロールを合成する酵素としてはCds1のみが知られており,この酵素が小胞体とミトコンドリアの両方で機能すると考えられてきた.しかし,今回,Cds1が小胞体のみに局在すること,ミトコンドリア内膜タンパク質であるTam41がミトコンドリアにおけるCDP-ジアシルグリセロール合成酵素であることが明らかになった.Tam41は真核生物に広く保存され,アミノ酸配列の解析からミトコンドリアの祖先とされるαプロテオバクテリアに由来することが示唆された.同じ酵素活性をもつCds1とTam41が真核生物の進化の過程において保存され,細胞内の異なる区画において機能しつづけてきたという事実は,細胞におけるリン脂質の輸送機構を考えるうえでも重要なポイントである.
生体反応の主役であるタンパク質の生合成や細胞内輸送に関しては研究が進み,多くの知見が蓄積されている.その一方で,生体膜を構成するリン脂質がどのような酵素により合成され,どのような分子機構によりおのおのの生体膜へと輸送また分配されるのかについては不明な点が多い.とくに,小胞輸送による脂質輸送系をもたないミトコンドリアを介したリン脂質の輸送や合成には多くの謎が残されている.ミトコンドリアにおける脂質の代謝異常がヒトにおいて疾患をひき起こすことからも,ミトコンドリアを介したリン脂質の生合成機構は,近年,注目のあつまる重要な研究分野である.
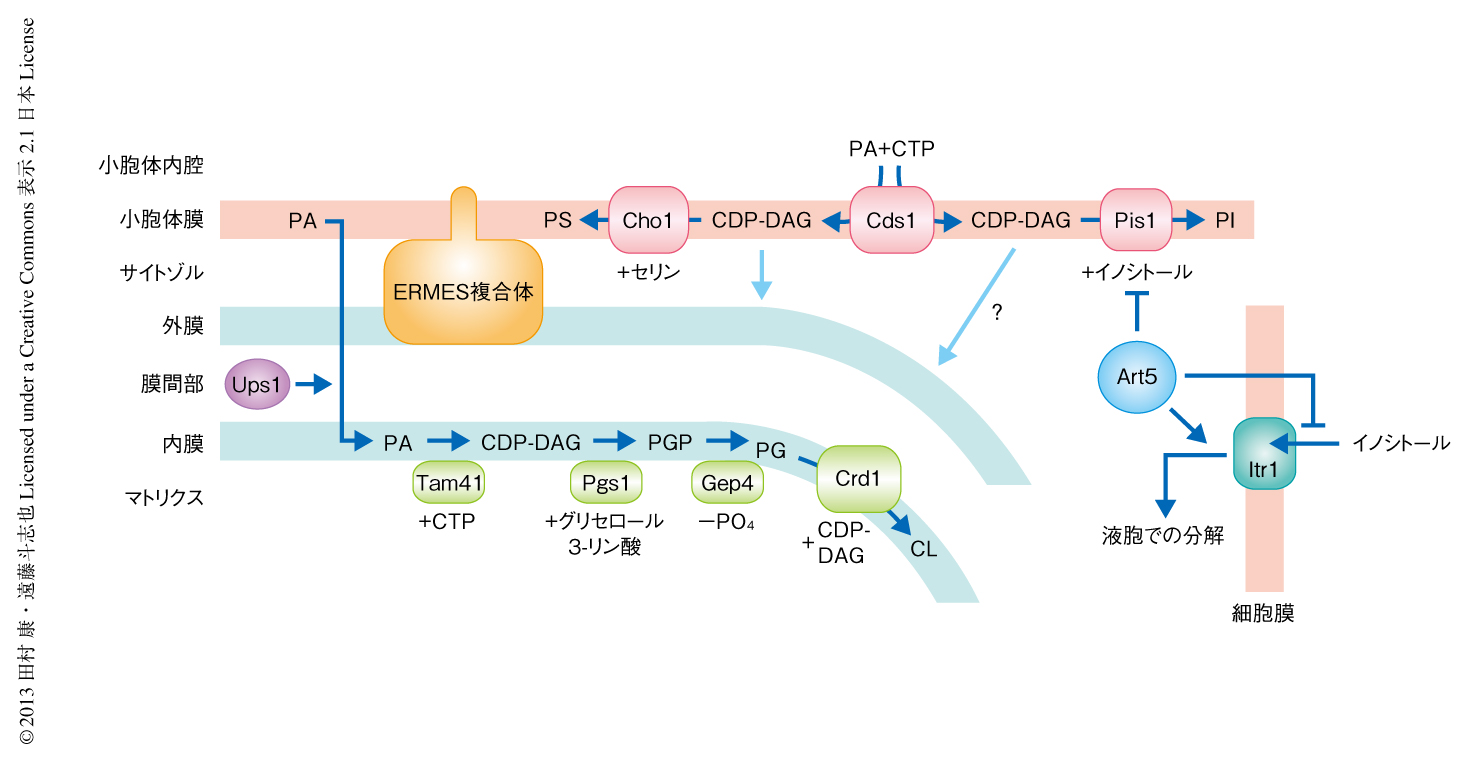
リン脂質の多くはホスファチジン酸の修飾反応により合成される.小胞体膜において合成されたホスファチジン酸は,そのまま小胞体膜で,もしくは,ミトコンドリア内膜へと輸送され1),CTPと反応してCDP-ジアシルグリセロールに変換される.CDP-ジアシルグリセロールは小胞体膜においてホスファチジルイノシトールやホスファチジルセリンに,ミトコンドリア内膜においてはカルジオリピンに変換される非常に重要な中間体リン脂質である2)(図1).このCDP-ジアシルグリセロールの合成をつかさどる酵素としてCds1が知られており,これまで,この酵素が小胞体膜とミトコンドリア内膜の両方で機能すると考えられてきた.ひとつのタンパク質が小胞体膜とミトコンドリア内膜の両方に局在する例はほとんどないにもかかわらず,Cds1の酵素活性が小胞体とミトコンドリア内膜の両方に存在するという1986年の報告ののち3),Cds1の細胞内局在がくわしく検討されることはなかった.さらに,Cds1以外のCDP-ジアシルグリセロール合成酵素の存在が報告されることもなかった.そこで,筆者らは,モデル真核生物である出芽酵母を用いてCds1の細胞内局在を再検討することにした.
出芽酵母の細胞からミトコンドリアと小胞体を含む膜画分を単離し,この膜画分をさらにスクロース密度勾配遠心もしくはOptiPrep密度勾配遠心にかけることにより純度の高いミトコンドリア画分を精製した.さらに,膜画分を沈殿として回収したのちの上清を超遠心して純度の高い小胞体画分を回収した.Cds1がこれらのどの画分に含まれるかを,抗Cds1抗体もしくはCds1に付加したFLAGタグを認識する抗体を用いたウェスタンブロッティング法により検討した.その結果,Cds1のシグナルは小胞体画分において強く検出される一方で,ミトコンドリア画分においてはほとんど検出されなかった.したがって,Cds1は小胞体タンパク質であること,さらに,Cds1とは異なるCDP-ジアシルグリセロール合成酵素がミトコンドリアに存在することが示唆された.しかし,この実験ではごく少量のCds1がミトコンドリアにおいて機能している可能性を排除することはできなかった.
ミトコンドリアにはCds1とは異なるCDP-ジアシルグリセロール合成酵素が存在するのか,それとも,ごく少量のCds1がミトコンドリア内膜において機能しているのか.この2つの可能性を区別するため,Cds1の発現量をドキシサイクリンの存在下において抑制した出芽酵母の細胞からミトコンドリア画分と小胞体画分を精製し,これら膜画分におけるCDP-ジアシルグリセロール合成酵素の活性を野生型の場合と比較した.その結果,Cds1の発現を抑制した場合,小胞体画分のCDP-ジアシルグリセロール合成酵素活性は野生型の出芽酵母の細胞に比べ著しく低下したが,ミトコンドリア画分のCDP-ジアシルグリセロール合成酵素活性は変化しなかった.この結果から,ミトコンドリアにはCds1とは異なるCDP-ジアシルグリセロール合成酵素の存在することが示された.
ミトコンドリアに存在するCDP-ジアシルグリセロール合成酵素はいったいどんなタンパク質なのだろうか.ミトコンドリア型CDP-ジアシルグリセロール合成酵素が欠損すれば,CDP-ジアシルグリセロールを前駆体リン脂質とするカルジオリピンの合成が減少すると考えられた.また,CDP-ジアシルグリセロールの合成ができなければ,その前駆体であるホスファチジン酸が蓄積するはずであった.さらに,Cds1の欠損は細胞の増殖に必須であることから,ミトコンドリア型CDP-ジアシルグリセロール合成酵素を欠損した場合にも細胞の増殖に阻害の生じることが考えられた.これらの条件にあてはまるタンパク質として,Tam41を選択した.Tam41は,以前,筆者らの研究室において,ミトコンドリア内膜に存在するタンパク質複合体のメンテナンス因子として同定されたタンパク質である4).そののち,Tam41が欠損するとミトコンドリアにおいてカルジオリピンが減少し,ミトコンドリア内膜のタンパク質複合体が不安定化すること,また,ホスファチジン酸が蓄積することが報告されている5).
ヒスチジンタグを付加したTam41を出芽酵母において大量発現させ,Ni-NTAアフィニティクロマトグラフィーおよびイオン交換クロマトグラフィーによりTam41を精製した.そして,精製Tam41がCDP-ジアシルグリセロール合成酵素活性をもつかどうかを試験管内における酵素活性アッセイにより検討した.NBDにより蛍光標識したホスファチジン酸をCTPの存在下において精製Tam41と一定時間インキュベーションしたのち,有機溶媒により脂質成分を抽出し,薄層クロマトグラフィーにより展開した.野生型Tam41とCTPの存在下においてNBD-ホスファチジン酸はすみやかに消費され,薄層クロマトグラフィーにおいて移動度の小さい脂質に変換された.野生型Tam41の代わりにtam41欠損株の増殖を相補できないTam41変異体を用いた場合や,CTPの非存在下においては,NBD-ホスファチジン酸はまったく消費されなかった.
もし,この野生型Tam41とCTPの存在下において合成された脂質がCDP-ジアシルグリセロールであるなら,この脂質はCDP-ジアシルグリセロールを前駆体とするリン脂質,たとえば,ホスファチジルセリンに変換されうるはずである.そこでまず,低濃度のNBD-ホスファチジン酸と高濃度のCTPとをTam41存在下において反応させることでNBD-ホスファチジン酸を完全に消費させ,薄層クロマトグラフィーにおいて移動度の小さい脂質へと変換した.そののち,この脂質をホスファチジルセリン合成酵素を含む小胞体抽出液とセリンの存在においてさらにインキュベーションすると,NBDにより標識されたホスファチジルセリンとまったく同じ移動度を示す脂質に変換された.小胞体抽出液もしくはセリンの非存在下においてはこの反応は進まなかった.以上の結果から,野生型Tam41とCTPの存在下においてNBD-ホスファチジン酸から変換された脂質はNBDにより標識されたCDP-ジアシルグリセロールであり,Tam41がホスファチジン酸とCTPからCDP-ジアシルグリセロールを合成するミトコンドリア型CDP-ジアシルグリセロール合成酵素であることが示された.
筆者らは,以前,過剰発現した際にtam41欠損株の増殖を回復させるマルチコピーサプレッサーとしてArt5を同定していた6).Art5はART(Arrestin-related trafficking adaptor)ファミリーに属し,細胞外のイノシトールの量に応じて細胞膜に存在するイノシトール輸送体Itr1の分解を制御するタンパク質である7).細胞内のイノシトール量の低下は,多くのリン脂質合成酵素関連遺伝子の転写やリン脂質合成酵素の活性を上昇させることがわかっている(Cds1をコードする遺伝子の転写もイノシトールの枯渇により上昇する2,8)).Art5の過剰発現によりItr1の分解が促進され,細胞内のイノシトール量が低下したことによりリン脂質の生合成が活性化され,その結果,Tam41の欠損は相補されるのかもしれない.この可能性を検証するため,tam41欠損株においてITR1遺伝子を破壊し,得られた二重欠損株の増殖をtam41単独欠損株と比較した.その結果,ITR1遺伝子を欠損させるとtam41欠損株の増殖能は回復することが明らかになった.また,イノシトールを完全に除いた栄養培地において培養した場合もtam41欠損株の増殖能は回復した.興味深いことに,小胞体型CDP-ジアシルグリセロール合成酵素であるCds1を過剰発現した場合もtam41欠損株の増殖は部分的に回復し,さらに,Cds1とArt5の両方を同時に過剰発現するとtam41欠損株の増殖はほぼ野生型と同じ程度にまで回復した.
Art5やCds1の過剰発現がなぜTam41の欠損を相補できるのだろうか.いちばん単純なモデルは,Art5やCds1の過剰発現により小胞体のCds1が合成するCDP-ジアシルグリセロールの量が増加し,その一部がミトコンドリアへと輸送されてカルジオリピンの合成量が回復するというものである.しかし,Art5とCds1の過剰発現がTam41の欠損を相補する分子機構は予想より複雑であった.たとえば,Cds1を過剰発現しても細胞内のCDP-ジアシルグリセロールやカルジオリピンの量はまったく増加しなかった.Cds1単独での過剰発現よりも強くtam41欠損株の増殖阻害を回復させるArt5を過剰発現した場合でも,通常は検出されないCDP-ジアシルグリセロールが蓄積し,ホスファチジン酸とホスファチジルエタノールアミンの量はやや増加するものの,tam41欠損株では検出されないカルジオリピンがごく少量(野生型の10%程度)検出されるのみであった.さらに,Cds1とArt5を同時に過剰発現した場合でも,tam41欠損株のカルジオリピンの量は野生型の15%ほどしかなかった(小胞体で合成されたCDP-ジアシルグリセロールはミトコンドリアに輸送にされるかもしれないが,その輸送効率は非常に低いと考えられた).また,Cds1とArt5の共過剰発現はTam41の欠損だけでなく,カルジオリピン合成酵素のひとつでありTam41の下流においてはたらくPgs1を欠損させたtam41 pgs1二重欠損株の増殖も回復させることができた.この二重欠損株では,たとえCDP-ジアシルグリセロールがミトコンドリア内膜に輸送されても,通常の経路でそれを使ってカルジオリピンを合成することはできない.これらの結果から,細胞の増殖能とカルジオリピンの量とは必ずしも相関しないことが示された.Cds1とArt5の過剰発現は,カルジオリピンと同じ酸性リン脂質であるCDP-ジアシルグリセロールやホスファチジン酸,カルジオリピンと同様にヘキサゴナル相をつくりやすいホスファチジルエタノールアミンの増加などをひき起こし,それらの複合的な影響によりTam41の欠損は相補されるのかもしれない.
Tam41とCds1はまったく同じ酵素活性をもつタンパク質であるにもかかわらず,これらのアミノ酸配列を比較しても共通したドメイン構造をみつけることはできなかった.Cds1もTam41も真核生物においてよく保存されていたが,Cds1は原核生物にも広く保存されていたのに対し,Tam41のホモログはプロテオバクテリア以外の原核生物にはほとんど見い出せなかった.Tam41のホモログタンパク質の存在するαプロテオバクテリアはミトコンドリアの起源とされる原核生物に近いと考えられている.Tam41はミトコンドリアの起源となったαプロテオバクテリアに由来するのに対し,Cds1はかつてミトコンドリアの起源となる好気性細菌を取り込んだ宿主細胞のほうに由来するのかもしれない.これら2つのタンパク質がまったく同じ機能をもつにもかかわらず,真核生物は進化の過程においてそれらを小胞体とミトコンドリアという異なる細胞内区画に別々に維持しつづける必要があったことは興味深い.
この研究により,ミトコンドリアにおけるカルジオリピン合成の最初のステップ,ホスファチジン酸からCDP-ジアシルグリセロールの合成を直接に触媒する酵素としてTam41を同定することができた.これで,ミトコンドリアにおいてカルジオリピン合成経路にかかわる主要な酵素はすべて同定されたことになった(図1).真核生物ではCds1とTam41という2つのCDP-ジアシルグリセロール合成酵素が細胞内の異なる区画,小胞体とミトコンドリアにおいて機能する必要のあることになるが,これはなぜだろうか.比較的大きな親水的な頭部をもつCDP-ジアシルグリセロールを小胞体膜からミトコンドリア外膜を介してミトコンドリア内膜まで輸送する経路は,ホスファチジン酸などほかの脂質の輸送経路(そのほとんどは,未解明)に比べエネルギー障壁が高いのかもしれない.カルジオリピンはミトコンドリアの機能に必須のリン脂質であるが,興味深いことに,細胞はTam41の欠損を補うための分子機構をもっていた.tam41欠損株をイノシトールの枯渇した条件で培養したりCds1の量を上げたりすることにより,カルジオリピンの量はほとんど回復しないにもかかわらず細胞の増殖能は野生型と同じ程度まで回復したのである.現時点で,イノシトールの枯渇がどのようにTam41の欠損を相補するのかは解明できていないが,今後,その分子機構が明らかになれば,カルジオリピン生合成の異常によりひき起こされる疾患の治療に貢献できるかもしれない.
略歴:2007年 名古屋大学大学院理学研究科 修了,同年 米国Johns Hopkins大学School of Medicine博士研究員,2012年 名古屋大学高等研究院 特任助教を経て,2013年より名古屋大学物質科学国際研究センター 准教授.
研究テーマ:オルガネラ膜の形成におけるリン脂質の輸送分配系.
関心事:ダイエット.
遠藤 斗志也(Toshiya Endo)
名古屋大学大学院理学研究科 教授.
研究室URL:http://biochem.chem.nagoya-u.ac.jp/index.html
© 2013 田村 康・遠藤斗志也 Licensed under CC 表示 2.1 日本
(名古屋大学大学院理学研究科 物質理学専攻生物化学研究室)
email:田村 康,遠藤斗志也
DOI: 10.7875/first.author.2013.061
Tam41 is a CDP-diacylglycerol synthase required for cardiolipin biosynthesis in mitochondria.
Yasushi Tamura, Yoshihiro Harada, Shuh-ichi Nishikawa, Koji Yamano, Megumi Kamiya, Takuya Shiota, Takuya Kuroda, Osamu Kuge, Hiromi Sesaki, Kenichiro Imai, Kentaro Tomii, Toshiya Endo
Cell Metabolism, 17, 709-718 (2013)
要 約
真核生物のオルガネラが正しく機能するためには,おのおののオルガネラ膜のもつ独自のリン脂質組成が維持されることが重要である.カルジオリピンはミトコンドリアの機能に必須のリン脂質であり,ミトコンドリアにおいてその量が適性に保たれる必要がある.真核生物においてカルジオリピン合成の鍵をにぎる中間体リン脂質,CDP-ジアシルグリセロールを合成する酵素としてはCds1のみが知られており,この酵素が小胞体とミトコンドリアの両方で機能すると考えられてきた.しかし,今回,Cds1が小胞体のみに局在すること,ミトコンドリア内膜タンパク質であるTam41がミトコンドリアにおけるCDP-ジアシルグリセロール合成酵素であることが明らかになった.Tam41は真核生物に広く保存され,アミノ酸配列の解析からミトコンドリアの祖先とされるαプロテオバクテリアに由来することが示唆された.同じ酵素活性をもつCds1とTam41が真核生物の進化の過程において保存され,細胞内の異なる区画において機能しつづけてきたという事実は,細胞におけるリン脂質の輸送機構を考えるうえでも重要なポイントである.
はじめに
生体反応の主役であるタンパク質の生合成や細胞内輸送に関しては研究が進み,多くの知見が蓄積されている.その一方で,生体膜を構成するリン脂質がどのような酵素により合成され,どのような分子機構によりおのおのの生体膜へと輸送また分配されるのかについては不明な点が多い.とくに,小胞輸送による脂質輸送系をもたないミトコンドリアを介したリン脂質の輸送や合成には多くの謎が残されている.ミトコンドリアにおける脂質の代謝異常がヒトにおいて疾患をひき起こすことからも,ミトコンドリアを介したリン脂質の生合成機構は,近年,注目のあつまる重要な研究分野である.
リン脂質の多くはホスファチジン酸の修飾反応により合成される.小胞体膜において合成されたホスファチジン酸は,そのまま小胞体膜で,もしくは,ミトコンドリア内膜へと輸送され1),CTPと反応してCDP-ジアシルグリセロールに変換される.CDP-ジアシルグリセロールは小胞体膜においてホスファチジルイノシトールやホスファチジルセリンに,ミトコンドリア内膜においてはカルジオリピンに変換される非常に重要な中間体リン脂質である2)(図1).このCDP-ジアシルグリセロールの合成をつかさどる酵素としてCds1が知られており,これまで,この酵素が小胞体膜とミトコンドリア内膜の両方で機能すると考えられてきた.ひとつのタンパク質が小胞体膜とミトコンドリア内膜の両方に局在する例はほとんどないにもかかわらず,Cds1の酵素活性が小胞体とミトコンドリア内膜の両方に存在するという1986年の報告ののち3),Cds1の細胞内局在がくわしく検討されることはなかった.さらに,Cds1以外のCDP-ジアシルグリセロール合成酵素の存在が報告されることもなかった.そこで,筆者らは,モデル真核生物である出芽酵母を用いてCds1の細胞内局在を再検討することにした.
1.Cds1は小胞体タンパク質である
出芽酵母の細胞からミトコンドリアと小胞体を含む膜画分を単離し,この膜画分をさらにスクロース密度勾配遠心もしくはOptiPrep密度勾配遠心にかけることにより純度の高いミトコンドリア画分を精製した.さらに,膜画分を沈殿として回収したのちの上清を超遠心して純度の高い小胞体画分を回収した.Cds1がこれらのどの画分に含まれるかを,抗Cds1抗体もしくはCds1に付加したFLAGタグを認識する抗体を用いたウェスタンブロッティング法により検討した.その結果,Cds1のシグナルは小胞体画分において強く検出される一方で,ミトコンドリア画分においてはほとんど検出されなかった.したがって,Cds1は小胞体タンパク質であること,さらに,Cds1とは異なるCDP-ジアシルグリセロール合成酵素がミトコンドリアに存在することが示唆された.しかし,この実験ではごく少量のCds1がミトコンドリアにおいて機能している可能性を排除することはできなかった.
2.ミトコンドリアにはCds1とは異なるCDP-ジアシルグリセロール合成酵素が存在する
ミトコンドリアにはCds1とは異なるCDP-ジアシルグリセロール合成酵素が存在するのか,それとも,ごく少量のCds1がミトコンドリア内膜において機能しているのか.この2つの可能性を区別するため,Cds1の発現量をドキシサイクリンの存在下において抑制した出芽酵母の細胞からミトコンドリア画分と小胞体画分を精製し,これら膜画分におけるCDP-ジアシルグリセロール合成酵素の活性を野生型の場合と比較した.その結果,Cds1の発現を抑制した場合,小胞体画分のCDP-ジアシルグリセロール合成酵素活性は野生型の出芽酵母の細胞に比べ著しく低下したが,ミトコンドリア画分のCDP-ジアシルグリセロール合成酵素活性は変化しなかった.この結果から,ミトコンドリアにはCds1とは異なるCDP-ジアシルグリセロール合成酵素の存在することが示された.
3.ミトコンドリア内膜タンパク質のTam41はミトコンドリアにおけるCDP-ジアシルグリセロール合成酵素である
ミトコンドリアに存在するCDP-ジアシルグリセロール合成酵素はいったいどんなタンパク質なのだろうか.ミトコンドリア型CDP-ジアシルグリセロール合成酵素が欠損すれば,CDP-ジアシルグリセロールを前駆体リン脂質とするカルジオリピンの合成が減少すると考えられた.また,CDP-ジアシルグリセロールの合成ができなければ,その前駆体であるホスファチジン酸が蓄積するはずであった.さらに,Cds1の欠損は細胞の増殖に必須であることから,ミトコンドリア型CDP-ジアシルグリセロール合成酵素を欠損した場合にも細胞の増殖に阻害の生じることが考えられた.これらの条件にあてはまるタンパク質として,Tam41を選択した.Tam41は,以前,筆者らの研究室において,ミトコンドリア内膜に存在するタンパク質複合体のメンテナンス因子として同定されたタンパク質である4).そののち,Tam41が欠損するとミトコンドリアにおいてカルジオリピンが減少し,ミトコンドリア内膜のタンパク質複合体が不安定化すること,また,ホスファチジン酸が蓄積することが報告されている5).
ヒスチジンタグを付加したTam41を出芽酵母において大量発現させ,Ni-NTAアフィニティクロマトグラフィーおよびイオン交換クロマトグラフィーによりTam41を精製した.そして,精製Tam41がCDP-ジアシルグリセロール合成酵素活性をもつかどうかを試験管内における酵素活性アッセイにより検討した.NBDにより蛍光標識したホスファチジン酸をCTPの存在下において精製Tam41と一定時間インキュベーションしたのち,有機溶媒により脂質成分を抽出し,薄層クロマトグラフィーにより展開した.野生型Tam41とCTPの存在下においてNBD-ホスファチジン酸はすみやかに消費され,薄層クロマトグラフィーにおいて移動度の小さい脂質に変換された.野生型Tam41の代わりにtam41欠損株の増殖を相補できないTam41変異体を用いた場合や,CTPの非存在下においては,NBD-ホスファチジン酸はまったく消費されなかった.
もし,この野生型Tam41とCTPの存在下において合成された脂質がCDP-ジアシルグリセロールであるなら,この脂質はCDP-ジアシルグリセロールを前駆体とするリン脂質,たとえば,ホスファチジルセリンに変換されうるはずである.そこでまず,低濃度のNBD-ホスファチジン酸と高濃度のCTPとをTam41存在下において反応させることでNBD-ホスファチジン酸を完全に消費させ,薄層クロマトグラフィーにおいて移動度の小さい脂質へと変換した.そののち,この脂質をホスファチジルセリン合成酵素を含む小胞体抽出液とセリンの存在においてさらにインキュベーションすると,NBDにより標識されたホスファチジルセリンとまったく同じ移動度を示す脂質に変換された.小胞体抽出液もしくはセリンの非存在下においてはこの反応は進まなかった.以上の結果から,野生型Tam41とCTPの存在下においてNBD-ホスファチジン酸から変換された脂質はNBDにより標識されたCDP-ジアシルグリセロールであり,Tam41がホスファチジン酸とCTPからCDP-ジアシルグリセロールを合成するミトコンドリア型CDP-ジアシルグリセロール合成酵素であることが示された.
4.イノシトールの枯渇がtam41欠損株の増殖を回復させる
筆者らは,以前,過剰発現した際にtam41欠損株の増殖を回復させるマルチコピーサプレッサーとしてArt5を同定していた6).Art5はART(Arrestin-related trafficking adaptor)ファミリーに属し,細胞外のイノシトールの量に応じて細胞膜に存在するイノシトール輸送体Itr1の分解を制御するタンパク質である7).細胞内のイノシトール量の低下は,多くのリン脂質合成酵素関連遺伝子の転写やリン脂質合成酵素の活性を上昇させることがわかっている(Cds1をコードする遺伝子の転写もイノシトールの枯渇により上昇する2,8)).Art5の過剰発現によりItr1の分解が促進され,細胞内のイノシトール量が低下したことによりリン脂質の生合成が活性化され,その結果,Tam41の欠損は相補されるのかもしれない.この可能性を検証するため,tam41欠損株においてITR1遺伝子を破壊し,得られた二重欠損株の増殖をtam41単独欠損株と比較した.その結果,ITR1遺伝子を欠損させるとtam41欠損株の増殖能は回復することが明らかになった.また,イノシトールを完全に除いた栄養培地において培養した場合もtam41欠損株の増殖能は回復した.興味深いことに,小胞体型CDP-ジアシルグリセロール合成酵素であるCds1を過剰発現した場合もtam41欠損株の増殖は部分的に回復し,さらに,Cds1とArt5の両方を同時に過剰発現するとtam41欠損株の増殖はほぼ野生型と同じ程度にまで回復した.
5.カルジオリピン量の回復のみが細胞の増殖を回復させるわけではない
Art5やCds1の過剰発現がなぜTam41の欠損を相補できるのだろうか.いちばん単純なモデルは,Art5やCds1の過剰発現により小胞体のCds1が合成するCDP-ジアシルグリセロールの量が増加し,その一部がミトコンドリアへと輸送されてカルジオリピンの合成量が回復するというものである.しかし,Art5とCds1の過剰発現がTam41の欠損を相補する分子機構は予想より複雑であった.たとえば,Cds1を過剰発現しても細胞内のCDP-ジアシルグリセロールやカルジオリピンの量はまったく増加しなかった.Cds1単独での過剰発現よりも強くtam41欠損株の増殖阻害を回復させるArt5を過剰発現した場合でも,通常は検出されないCDP-ジアシルグリセロールが蓄積し,ホスファチジン酸とホスファチジルエタノールアミンの量はやや増加するものの,tam41欠損株では検出されないカルジオリピンがごく少量(野生型の10%程度)検出されるのみであった.さらに,Cds1とArt5を同時に過剰発現した場合でも,tam41欠損株のカルジオリピンの量は野生型の15%ほどしかなかった(小胞体で合成されたCDP-ジアシルグリセロールはミトコンドリアに輸送にされるかもしれないが,その輸送効率は非常に低いと考えられた).また,Cds1とArt5の共過剰発現はTam41の欠損だけでなく,カルジオリピン合成酵素のひとつでありTam41の下流においてはたらくPgs1を欠損させたtam41 pgs1二重欠損株の増殖も回復させることができた.この二重欠損株では,たとえCDP-ジアシルグリセロールがミトコンドリア内膜に輸送されても,通常の経路でそれを使ってカルジオリピンを合成することはできない.これらの結果から,細胞の増殖能とカルジオリピンの量とは必ずしも相関しないことが示された.Cds1とArt5の過剰発現は,カルジオリピンと同じ酸性リン脂質であるCDP-ジアシルグリセロールやホスファチジン酸,カルジオリピンと同様にヘキサゴナル相をつくりやすいホスファチジルエタノールアミンの増加などをひき起こし,それらの複合的な影響によりTam41の欠損は相補されるのかもしれない.
6.Tam41の起源はミトコンドリアの祖先であるαプロテオバクテリアかもしれない
Tam41とCds1はまったく同じ酵素活性をもつタンパク質であるにもかかわらず,これらのアミノ酸配列を比較しても共通したドメイン構造をみつけることはできなかった.Cds1もTam41も真核生物においてよく保存されていたが,Cds1は原核生物にも広く保存されていたのに対し,Tam41のホモログはプロテオバクテリア以外の原核生物にはほとんど見い出せなかった.Tam41のホモログタンパク質の存在するαプロテオバクテリアはミトコンドリアの起源とされる原核生物に近いと考えられている.Tam41はミトコンドリアの起源となったαプロテオバクテリアに由来するのに対し,Cds1はかつてミトコンドリアの起源となる好気性細菌を取り込んだ宿主細胞のほうに由来するのかもしれない.これら2つのタンパク質がまったく同じ機能をもつにもかかわらず,真核生物は進化の過程においてそれらを小胞体とミトコンドリアという異なる細胞内区画に別々に維持しつづける必要があったことは興味深い.
おわりに
この研究により,ミトコンドリアにおけるカルジオリピン合成の最初のステップ,ホスファチジン酸からCDP-ジアシルグリセロールの合成を直接に触媒する酵素としてTam41を同定することができた.これで,ミトコンドリアにおいてカルジオリピン合成経路にかかわる主要な酵素はすべて同定されたことになった(図1).真核生物ではCds1とTam41という2つのCDP-ジアシルグリセロール合成酵素が細胞内の異なる区画,小胞体とミトコンドリアにおいて機能する必要のあることになるが,これはなぜだろうか.比較的大きな親水的な頭部をもつCDP-ジアシルグリセロールを小胞体膜からミトコンドリア外膜を介してミトコンドリア内膜まで輸送する経路は,ホスファチジン酸などほかの脂質の輸送経路(そのほとんどは,未解明)に比べエネルギー障壁が高いのかもしれない.カルジオリピンはミトコンドリアの機能に必須のリン脂質であるが,興味深いことに,細胞はTam41の欠損を補うための分子機構をもっていた.tam41欠損株をイノシトールの枯渇した条件で培養したりCds1の量を上げたりすることにより,カルジオリピンの量はほとんど回復しないにもかかわらず細胞の増殖能は野生型と同じ程度まで回復したのである.現時点で,イノシトールの枯渇がどのようにTam41の欠損を相補するのかは解明できていないが,今後,その分子機構が明らかになれば,カルジオリピン生合成の異常によりひき起こされる疾患の治療に貢献できるかもしれない.
文 献
- Connerth, M., Tatsuta, T., Haag, M. et al.: Intramitochondrial transport of phosphatidic acid in yeast by a lipid transfer protein. Science, 337, 815-818 (2012)[PubMed]
- Henry, S. A., Kohlwein, S. D. & Carman, G. M.: Metabolism and regulation of glycerolipids in the yeast Saccharomyces cerevisiae. Genetics, 190, 317-349 (2012)[PubMed]
- Kuchler, K., Daum, G. & Paltauf, F.: Subcellular and submitochondrial localization of phospholipid-synthesizing enzymes in Saccharomyces cerevisiae. J. Bacteriol., 165, 901-910 (1986)[PubMed]
- Tamura, Y., Harada, Y., Yamano, K. et al.: Identification of Tam41 maintaining integrity of the TIM23 protein translocator complex in mitochondria. J. Cell Biol., 174, 631-637 (2006)[PubMed]
- Kutik, S., Rissler, M., Guan, X. L. et al.: The translocator maintenance protein Tam41 is required for mitochondrial cardiolipin biosynthesis. J. Cell Biol., 183, 1213-1221 (2008)[PubMed]
- Harada, Y., Tamura, Y. & Endo, T.: Identification of yeast Art5 as a multicopy suppressor for the mitochondrial translocator maintenance protein Tam41. Biochem. Biophys. Res. Commun., 392, 228-233 (2010)[PubMed]
- Nikko, E. & Pelham, H. R.: Arrestin-mediated endocytosis of yeast plasma membrane transporters. Traffic, 10, 1856-1867 (2009)[PubMed]
- He, Q. & Greenberg, M. L.: Post-translational regulation of phosphatidylglycerolphosphate synthase in response to inositol. Mol. Microbiol., 53, 1243-1249 (2004)[PubMed]
著者プロフィール
略歴:2007年 名古屋大学大学院理学研究科 修了,同年 米国Johns Hopkins大学School of Medicine博士研究員,2012年 名古屋大学高等研究院 特任助教を経て,2013年より名古屋大学物質科学国際研究センター 准教授.
研究テーマ:オルガネラ膜の形成におけるリン脂質の輸送分配系.
関心事:ダイエット.
遠藤 斗志也(Toshiya Endo)
名古屋大学大学院理学研究科 教授.
研究室URL:http://biochem.chem.nagoya-u.ac.jp/index.html
© 2013 田村 康・遠藤斗志也 Licensed under CC 表示 2.1 日本