III型分泌性ホスホリパーゼA2-プロスタグランジンD2経路はマスト細胞の成熟を制御する
村上 誠・武富芳隆
(東京都医学総合研究所 脂質代謝プロジェクト)
email:村上 誠
DOI: 10.7875/first.author.2013.056
Mast cell maturation is driven via a group III phospholipase A2-prostaglandin D2-DP1 receptor paracrine axis.
Yoshitaka Taketomi, Noriko Ueno, Takumi Kojima, Hiroyasu Sato, Remi Murase, Kei Yamamoto, Satoshi Tanaka, Mariko Sakanaka, Masanori Nakamura, Yasumasa Nishito, Momoko Kawana, Naotomo Kambe, Kazutaka Ikeda, Ryo Taguchi, Satoshi Nakamizo, Kenji Kabashima, Michael H. Gelb, Makoto Arita, Takehiko Yokomizo, Motonao Nakamura, Kikuko Watanabe, Hiroyuki Hirai, Masataka Nakamura, Yoshimichi Okayama, Chisei Ra, Kosuke Aritake, Yoshihiro Urade, Kazushi Morimoto, Yukihiko Sugimoto, Takao Shimizu, Shuh Narumiya, Shuntaro Hara, Makoto Murakami
Nature Immunology, 14, 554-563 (2013)
組織の微小環境に応じたマスト細胞の分化および成熟はアナフィラキシー感受性に影響するが,この成熟の過程を制御する分子機構は不明であった.筆者らは,強力なアナフィラキシー誘発物質であるハチ毒ホスホリパーゼA2の哺乳動物ホモログであるIII型分泌性ホスホリパーゼA2がこの過程にかかわることを見い出した.III型分泌性ホスホリパーゼA2はマスト細胞より分泌され,近隣の線維芽細胞に発現しているL型プロスタグランジンD2合成酵素を介して脂質メディエーターであるプロスタグランジンD2を産生した.このプロスタグランジンD2はマスト細胞に存在するプロスタグランジンD2受容体であるDP1に作用してマスト細胞の成熟を促進した.III型分泌性ホスホリパーゼA2あるいはDP1を欠損したマスト細胞は未成熟であり,また,L型プロスタグランジンD2合成酵素を欠損した線維芽細胞はマスト細胞の成熟を支持することができずアナフィラキシーに低応答となった.この研究により,マスト細胞の成熟が細胞間相互作用により作動する特殊な脂質代謝サーキットにより制御されることがはじめて明らかになった.
アナフィラキシーは外因性の抗原(アレルゲン)に対する全身性の即時的アレルギー応答であり,ときに多臓器に深刻な影響を及ぼし生命をおびやかす.マスト細胞はアレルギーにおいて中心的な役割を担う細胞であり,細胞の表面にある高親和性免疫グロブリンE受容体が免疫グロブリンEを介して抗原と結合すると活性化し,ヒスタミンなどの炎症性物質を放出する1).組織の微小環境に応じたマスト細胞の多様な亜群への分化および成熟は,アレルギー感受性を規定する重要な要素のひとつである.マスト細胞は骨髄幹細胞より生まれたのち,未成熟な前駆細胞として血管外組織に定着し,SCF(stem cell factor,幹細胞因子)とよばれる線維芽細胞に由来するサイトカインに応答して増殖する2).しかしながら,SCFは単独ではマスト細胞の成熟を十分に支持することはできず,マスト細胞と線維芽細胞とのあいだになんらかの補助因子が介在するものと考えられてきた.これまでに幾多のサイトカインや増殖因子がその候補としてあげられてきたが,その実体は依然として不明であった.
プロスタグランジンやロイコトリエンなどの脂質メディエーターは多様な生命応答にかかわっている3).脂質メディエーターの生合成は細胞膜のリン脂質からホスホリパーゼA2によりアラキドン酸が遊離されることで始動する.ホスホリパーゼA2には多くの分子種が存在するが,このうち細胞質に存在するPLA2G4Aはマスト細胞を含む多くの細胞においてアラキドン酸の代謝に必須であり,PLA2G4Aノックアウトマウスではアレルギー喘息が寛解する4).一方,細胞外に放出される分泌性ホスホリパーゼA2については,典型的なアイソザイムであるPLA2G5やPLA2G10のノックアウトマウスにおいて喘息が改善することが報告されているが5,6),総じて,分泌性ホスホリパーゼA2の存在意義や作用機構は混沌とした状況にあった.
ハチ毒に含まれる主要なアナフィラキシー誘発物質はハチ毒ホスホリパーゼA2とよばれ,哺乳動物にはその唯一のホモログであるIII型分泌性ホスホリパーゼA2(PLA2G3)が存在する7,8).この研究において,筆者らは,III型分泌性ホスホリパーゼA2を起点とする組織の微小環境における脂質サーキットがマスト細胞の成熟を規定する鍵であることを明らかにした.
マウスの皮下にハチ毒ホスホリパーゼA2またはIII型分泌性ホスホリパーゼA2を投与すると,酵素活性に依存的にマスト細胞の激しい脱顆粒がみられた.免疫組織染色の結果,内因性のIII型分泌性ホスホリパーゼA2はマスト細胞の分泌顆粒に局在しており,免疫グロブリンE-抗原の刺激によるマスト細胞の脱顆粒にともなって分泌された.
III型分泌性ホスホリパーゼA2ノックアウトマウスでは全身性および局所性のアナフィラキシーが劇的に改善し,逆に,III型分泌性ホスホリパーゼA2過剰発現マウスではこれらが増悪した.III型分泌性ホスホリパーゼA2ノックアウトマウスの皮下には正常な数のマスト細胞が存在していたが,脱顆粒したマスト細胞の数は著減していた.ほかの分泌性ホスホリパーゼA2アイソザイムのノックアウトマウスではアナフィラキシー反応の低減は認められなかった.以上の結果から,III型分泌性ホスホリパーゼA2はマスト細胞に依存的なアナフィラキシーにかかわる唯一の分泌性ホスホリパーゼA2アイソザイムであることが明らかになった.
III型分泌性ホスホリパーゼA2ノックアウトマウスの複数の組織のマスト細胞を電子顕微鏡により観察したところ,脱顆粒像はほとんどみられず,また,分泌顆粒は小さくまばらで,明らかに未成熟の形態を示した.これと合致して,III型分泌性ホスホリパーゼA2ノックアウトマウスのマスト細胞では顆粒の内容物であるヒスタミンやプロテアーゼの含量が著しく少なく,ヒスタミン合成酵素やプロテアーゼの発現が低下し,さらに細胞の表面の高親和性免疫グロブリンE受容体が減少していた.逆に,III型分泌性ホスホリパーゼA2過剰発現マウスのマスト細胞ではヒスタミン合成酵素の発現は上昇していた.したがって,III型分泌性ホスホリパーゼA2の欠損はマスト細胞の初期の分化や組織への定着には影響を及ぼさないが,最終の成熟を乱すものと考えられた.III型分泌性ホスホリパーゼA2ノックアウトマウスから調製した骨髄由来マスト細胞を,マスト細胞を欠損したKitW-sh/W-shマウスに移植して再構成し,野生型マウスから調製した骨髄由来マスト細胞を移植したKitW-sh/W-shマウスと比較した結果,野生型のマスト細胞を移植したマウスではマスト細胞の成熟およびアナフィラキシー応答は十分に回復したが,III型分泌性ホスホリパーゼA2を欠損したマスト細胞を移植したマウスではこれらの回復はほとんど認められなかった.このことから,マスト細胞のIII型分泌性ホスホリパーゼA2がマスト細胞の成熟にかかわることが強く示唆された.
III型分泌性ホスホリパーゼA2ノックアウトマウスから調製した骨髄由来マスト細胞では,野生型マウスから調製した骨髄由来マスト細胞と比べ,免疫グロブリンE-抗原の刺激によるヒスタミンの遊離および脂質メディエーターであるプロスタグランジンD2およびロイコトリエンC4の産生が有意に低下していた.逆に,III型分泌性ホスホリパーゼA2過剰発現マウスから調製した骨髄由来マスト細胞ではこれらの応答はいずれも上昇した.野生型の骨髄由来マスト細胞を線維芽細胞と共培養するとより成熟したマスト細胞に分化し,このとき,III型分泌性ホスホリパーゼA2はSCFの刺激によりマスト細胞から分泌された.この共培養系において,III型分泌性ホスホリパーゼA2を欠損した骨髄由来マスト細胞では,成熟にともなうヒスタミンの合成やプロテアーゼの発現,高親和性免疫グロブリンE受容体の細胞の表面での発現,プロスタグランジンD2の産生などの上昇が損なわれており,この異常は組換えIII型分泌性ホスホリパーゼA2の補充により回復した.マイクロアレイ解析の結果,マスト細胞の成熟にともない発現が上昇する約3600の遺伝子のうち,III型分泌性ホスホリパーゼA2を欠損した細胞ではその1/3にあたる約1400の遺伝子しか誘導されなかった.一方,PLA2G4Aを欠損した骨髄由来マスト細胞は脂質メディエーターをまったく産生しなかったが,ヒスタミンの遊離や線維芽細胞に依存的な成熟は正常であった.したがって,III型分泌性ホスホリパーゼA2の欠損によりマスト細胞は成熟に障害を生じるが,マスト細胞に由来する脂質メディエーターの産生の低下がその要因ではないと考えられた.
III型分泌性ホスホリパーゼA2の下流で機能する脂質メディエーターを同定する目的で,脂質メディエーターの合成酵素と受容体のノックアウトマウス,合計17種類に対し包括的にアナフィラキシーモデルを施行した.その結果,プロスタグランジンD2受容体のひとつであるDP1のノックアウトマウスがIII型分泌性ホスホリパーゼA2ノックアウトマウスと類似の表現型を示すことを見い出した.すなわち,DP1ノックアウトマウスはアナフィラキシーに低応答であり,組織におけるマスト細胞の数は正常であったが形態的に未成熟で,ヒスタミンの含量が低下していた.DP1を欠損した骨髄由来マスト細胞をマスト細胞を欠損したマウスに再構成してもアナフィラキシー応答の回復はみられず,マスト細胞のDP1が重要であることがわかった.野生型の骨髄由来マスト細胞におけるDP1の発現は線維芽細胞との共培養により誘導されたが,III型分泌性ホスホリパーゼA2を欠損した骨髄由来マスト細胞ではこのDP1の発現の誘導は消失した.DP1を欠損した骨髄由来マスト細胞あるいはDP1のアンタゴニストを添加した野生型の骨髄由来マスト細胞では線維芽細胞に依存したヒスタミン合成酵素の発現の誘導は起こらず,これはDP1のシグナル伝達(cAMP経路)を活性化するフォルスコリンの添加により回復した.以上の結果から,マスト細胞の成熟において,III型分泌性ホスホリパーゼA2の下流にはプロスタグランジンD2-DP1経路が位置することが明らかになった.
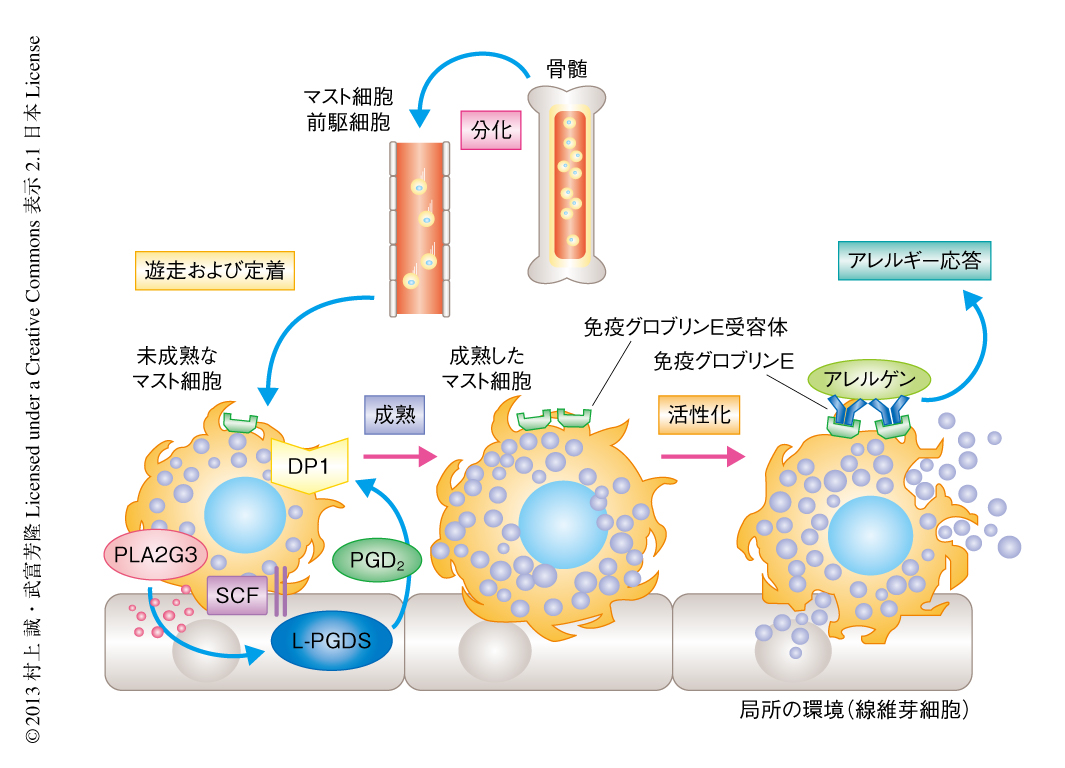
ホスホリパーゼA2により切り出されたアラキドン酸をプロスタグランジンD2に変換するプロスタグランジンD2合成酵素にはH型とL型の2種類があり,H型プロスタグランジンD2合成酵素はマスト細胞に,L型プロスタグランジンD2合成酵素は線維芽細胞に発現していた.H型プロスタグランジンD2合成酵素ノックアウトマウスではアナフィラキシー応答が増悪したのに対し,L型プロスタグランジンD2合成酵素ノックアウトマウスでは改善がみられた.L型プロスタグランジンD2合成酵素ノックアウトマウスの組織のマスト細胞は数は正常であったが形態的に未熟であり,III型分泌性ホスホリパーゼA2またはDP1の欠損と類似の表現型を示した.しかしながら,L型プロスタグランジンD2合成酵素ノックアウトマウスから調製した骨髄由来マスト細胞に異常はみられず,これをマスト細胞を欠損したマウスに移植して再構成するとアナフィラキシー応答は正常に回復した.一方で,線維芽細胞のL型プロスタグランジンD2合成酵素の発現をsiRNAにより抑制,または,共培養系にL型プロスタグランジンD2合成酵素の阻害剤を添加すると,野生型の骨髄由来マスト細胞の成熟は顕著に阻害された.L型プロスタグランジンD2合成酵素の阻害剤は野生型の骨髄由来マスト細胞の共培養系における持続的なプロスタグランジンD2の産生を遮断したが,III型分泌性ホスホリパーゼA2を欠損した骨髄由来マスト細胞の共培養系ではこの持続的なプロスタグランジンD2の産生は起こらなかった.また,L型プロスタグランジンD2合成酵素ノックアウトマウスに由来する線維芽細胞は野生型の骨髄由来マスト細胞の成熟を支持できなかった.さらに,線維芽細胞におけるL型プロスタグランジンD2合成酵素の発現は野生型の骨髄由来マスト細胞との共培養により誘導されたが,III型分泌性ホスホリパーゼA2を欠損した骨髄由来マスト細胞との共培養ではこの誘導はみられなかった.以上の結果から,SCFの刺激によりマスト細胞から分泌されたIII型分泌性ホスホリパーゼA2は,線維芽細胞のL型プロスタグランジンD2合成酵素と連関してプロスタグランジンD2を産生し,このプロスタグランジンD2がマスト細胞のDP1を活性化して,マスト細胞を最終の成熟に導くものと結論した(図1).
III型分泌性ホスホリパーゼA2はヒトにおいても組織のマスト細胞に発現していた.ヒトの肺に由来するマスト細胞と線維芽細胞とを共培養すると,マスト細胞の成熟(ヒスタミン合成酵素の発現の誘導)は顕著に誘導された.この共培養系にIII型分泌性ホスホリパーゼA2の中和抗体,L型プロスタグランジンD2合成酵素の阻害剤,または,DP1のアンタゴニストを添加すると,ヒスタミン合成酵素の発現の誘導は顕著に抑制された.このことから,ヒトのマスト細胞の成熟にもIII型分泌性ホスホリパーゼA2→L型プロスタグランジンD2合成酵素→プロスタグランジンD2→DP1経路がかかわっていることが確かめられた.
この研究には,以下のような学術的な意義があった.1)これまで未解明であったマスト細胞の繊維芽細胞に依存的な成熟を制御する分子機構の一端を解明した.この過程を制御する分子は,これまで想定されていたサイトカインでも増殖因子でも接着分子でもなく,脂質メディエーターであるプロスタグランジンD2であった.2)DP1の欠損は喘息を改善することが知られていたが9),その分子機構は不明であった.今回の結果は,DP1がマスト細胞の成熟を介しアレルギー応答に促進的にかかわることを示すものであった.3)マスト細胞の成熟にかかわるプロスタグランジンD2のプールは,マスト細胞のもつH型プロスタグランジンD2合成酵素から瞬時に供給されるのではなく,隣接する線維芽細胞のL型プロスタグランジンD2合成酵素から持続的に供給されていた.この持続性が分化および成熟という長期の過程に重要と考えられた.また,このことは,異なる細胞集団に発現している2種類のプロスタグランジンD2合成酵素の機能的な役割分担をはじめて示したものであった.4)従来,分泌性ホスホリパーゼA2は隣接する細胞にパラクリン的に作用して脂質メディエーターの産生を増強する役割をもつものと推察されていたが10),実際にin vivoにおいて証明された例はなかった.この研究の成果は,マスト細胞から分泌されるIII型分泌性ホスホリパーゼA2がその役割を担うことをはじめて実証したものであり,長いあいだ漠然としていた分泌性ホスホリパーゼA2の存在意義がついに明らかにされた.最後に,この研究において発見されたマスト細胞の成熟を制御する脂質経路を標的とした創薬は,アレルギーの新しい治療薬あるいは予防薬の開発に結びつきうる.とくに,III型分泌性ホスホリパーゼA2はゲノムに類縁の遺伝子が存在せず,また,特異的な阻害剤が存在しないことから,新規の抗アレルギー薬の創薬標的として有望である.
略歴:1991年 東京大学大学院薬学系研究科博士課程 修了,1993年 米国Harvard大学 研究員,1995年 昭和大学薬学部 講師,1997年 同 准教授,2005年 東京都臨床医学総合研究所 副参事研究員(2010年 東京都医学総合研究所に改組)を経て,2013年より同 参事研究員.
研究テーマ:ホスホリパーゼA2の分子細胞生物学.
抱負:脂質研究のおもしろさと重要性を広く世の中に訴えたい.
研究室URL:http://www.igakuken.or.jp/research/project/res_prj23.html
武富 芳隆(Yoshitaka Taketomi)
東京都医学総合研究所 主任研究員.
© 2013 村上 誠・武富芳隆 Licensed under CC 表示 2.1 日本
(東京都医学総合研究所 脂質代謝プロジェクト)
email:村上 誠
DOI: 10.7875/first.author.2013.056
Mast cell maturation is driven via a group III phospholipase A2-prostaglandin D2-DP1 receptor paracrine axis.
Yoshitaka Taketomi, Noriko Ueno, Takumi Kojima, Hiroyasu Sato, Remi Murase, Kei Yamamoto, Satoshi Tanaka, Mariko Sakanaka, Masanori Nakamura, Yasumasa Nishito, Momoko Kawana, Naotomo Kambe, Kazutaka Ikeda, Ryo Taguchi, Satoshi Nakamizo, Kenji Kabashima, Michael H. Gelb, Makoto Arita, Takehiko Yokomizo, Motonao Nakamura, Kikuko Watanabe, Hiroyuki Hirai, Masataka Nakamura, Yoshimichi Okayama, Chisei Ra, Kosuke Aritake, Yoshihiro Urade, Kazushi Morimoto, Yukihiko Sugimoto, Takao Shimizu, Shuh Narumiya, Shuntaro Hara, Makoto Murakami
Nature Immunology, 14, 554-563 (2013)
要 約
組織の微小環境に応じたマスト細胞の分化および成熟はアナフィラキシー感受性に影響するが,この成熟の過程を制御する分子機構は不明であった.筆者らは,強力なアナフィラキシー誘発物質であるハチ毒ホスホリパーゼA2の哺乳動物ホモログであるIII型分泌性ホスホリパーゼA2がこの過程にかかわることを見い出した.III型分泌性ホスホリパーゼA2はマスト細胞より分泌され,近隣の線維芽細胞に発現しているL型プロスタグランジンD2合成酵素を介して脂質メディエーターであるプロスタグランジンD2を産生した.このプロスタグランジンD2はマスト細胞に存在するプロスタグランジンD2受容体であるDP1に作用してマスト細胞の成熟を促進した.III型分泌性ホスホリパーゼA2あるいはDP1を欠損したマスト細胞は未成熟であり,また,L型プロスタグランジンD2合成酵素を欠損した線維芽細胞はマスト細胞の成熟を支持することができずアナフィラキシーに低応答となった.この研究により,マスト細胞の成熟が細胞間相互作用により作動する特殊な脂質代謝サーキットにより制御されることがはじめて明らかになった.
はじめに
アナフィラキシーは外因性の抗原(アレルゲン)に対する全身性の即時的アレルギー応答であり,ときに多臓器に深刻な影響を及ぼし生命をおびやかす.マスト細胞はアレルギーにおいて中心的な役割を担う細胞であり,細胞の表面にある高親和性免疫グロブリンE受容体が免疫グロブリンEを介して抗原と結合すると活性化し,ヒスタミンなどの炎症性物質を放出する1).組織の微小環境に応じたマスト細胞の多様な亜群への分化および成熟は,アレルギー感受性を規定する重要な要素のひとつである.マスト細胞は骨髄幹細胞より生まれたのち,未成熟な前駆細胞として血管外組織に定着し,SCF(stem cell factor,幹細胞因子)とよばれる線維芽細胞に由来するサイトカインに応答して増殖する2).しかしながら,SCFは単独ではマスト細胞の成熟を十分に支持することはできず,マスト細胞と線維芽細胞とのあいだになんらかの補助因子が介在するものと考えられてきた.これまでに幾多のサイトカインや増殖因子がその候補としてあげられてきたが,その実体は依然として不明であった.
プロスタグランジンやロイコトリエンなどの脂質メディエーターは多様な生命応答にかかわっている3).脂質メディエーターの生合成は細胞膜のリン脂質からホスホリパーゼA2によりアラキドン酸が遊離されることで始動する.ホスホリパーゼA2には多くの分子種が存在するが,このうち細胞質に存在するPLA2G4Aはマスト細胞を含む多くの細胞においてアラキドン酸の代謝に必須であり,PLA2G4Aノックアウトマウスではアレルギー喘息が寛解する4).一方,細胞外に放出される分泌性ホスホリパーゼA2については,典型的なアイソザイムであるPLA2G5やPLA2G10のノックアウトマウスにおいて喘息が改善することが報告されているが5,6),総じて,分泌性ホスホリパーゼA2の存在意義や作用機構は混沌とした状況にあった.
ハチ毒に含まれる主要なアナフィラキシー誘発物質はハチ毒ホスホリパーゼA2とよばれ,哺乳動物にはその唯一のホモログであるIII型分泌性ホスホリパーゼA2(PLA2G3)が存在する7,8).この研究において,筆者らは,III型分泌性ホスホリパーゼA2を起点とする組織の微小環境における脂質サーキットがマスト細胞の成熟を規定する鍵であることを明らかにした.
1.III型分泌性ホスホリパーゼA2はマスト細胞に局在しその活性化を促進する
マウスの皮下にハチ毒ホスホリパーゼA2またはIII型分泌性ホスホリパーゼA2を投与すると,酵素活性に依存的にマスト細胞の激しい脱顆粒がみられた.免疫組織染色の結果,内因性のIII型分泌性ホスホリパーゼA2はマスト細胞の分泌顆粒に局在しており,免疫グロブリンE-抗原の刺激によるマスト細胞の脱顆粒にともなって分泌された.
2.III型分泌性ホスホリパーゼA2ノックアウトマウスはアナフィラキシーに不応答である
III型分泌性ホスホリパーゼA2ノックアウトマウスでは全身性および局所性のアナフィラキシーが劇的に改善し,逆に,III型分泌性ホスホリパーゼA2過剰発現マウスではこれらが増悪した.III型分泌性ホスホリパーゼA2ノックアウトマウスの皮下には正常な数のマスト細胞が存在していたが,脱顆粒したマスト細胞の数は著減していた.ほかの分泌性ホスホリパーゼA2アイソザイムのノックアウトマウスではアナフィラキシー反応の低減は認められなかった.以上の結果から,III型分泌性ホスホリパーゼA2はマスト細胞に依存的なアナフィラキシーにかかわる唯一の分泌性ホスホリパーゼA2アイソザイムであることが明らかになった.
3.III型分泌性ホスホリパーゼA2ノックアウトマウスの組織のマスト細胞は未成熟である
III型分泌性ホスホリパーゼA2ノックアウトマウスの複数の組織のマスト細胞を電子顕微鏡により観察したところ,脱顆粒像はほとんどみられず,また,分泌顆粒は小さくまばらで,明らかに未成熟の形態を示した.これと合致して,III型分泌性ホスホリパーゼA2ノックアウトマウスのマスト細胞では顆粒の内容物であるヒスタミンやプロテアーゼの含量が著しく少なく,ヒスタミン合成酵素やプロテアーゼの発現が低下し,さらに細胞の表面の高親和性免疫グロブリンE受容体が減少していた.逆に,III型分泌性ホスホリパーゼA2過剰発現マウスのマスト細胞ではヒスタミン合成酵素の発現は上昇していた.したがって,III型分泌性ホスホリパーゼA2の欠損はマスト細胞の初期の分化や組織への定着には影響を及ぼさないが,最終の成熟を乱すものと考えられた.III型分泌性ホスホリパーゼA2ノックアウトマウスから調製した骨髄由来マスト細胞を,マスト細胞を欠損したKitW-sh/W-shマウスに移植して再構成し,野生型マウスから調製した骨髄由来マスト細胞を移植したKitW-sh/W-shマウスと比較した結果,野生型のマスト細胞を移植したマウスではマスト細胞の成熟およびアナフィラキシー応答は十分に回復したが,III型分泌性ホスホリパーゼA2を欠損したマスト細胞を移植したマウスではこれらの回復はほとんど認められなかった.このことから,マスト細胞のIII型分泌性ホスホリパーゼA2がマスト細胞の成熟にかかわることが強く示唆された.
4.III型分泌性ホスホリパーゼA2の欠損は培養マスト細胞の線維芽細胞に依存的な成熟をさまたげる
III型分泌性ホスホリパーゼA2ノックアウトマウスから調製した骨髄由来マスト細胞では,野生型マウスから調製した骨髄由来マスト細胞と比べ,免疫グロブリンE-抗原の刺激によるヒスタミンの遊離および脂質メディエーターであるプロスタグランジンD2およびロイコトリエンC4の産生が有意に低下していた.逆に,III型分泌性ホスホリパーゼA2過剰発現マウスから調製した骨髄由来マスト細胞ではこれらの応答はいずれも上昇した.野生型の骨髄由来マスト細胞を線維芽細胞と共培養するとより成熟したマスト細胞に分化し,このとき,III型分泌性ホスホリパーゼA2はSCFの刺激によりマスト細胞から分泌された.この共培養系において,III型分泌性ホスホリパーゼA2を欠損した骨髄由来マスト細胞では,成熟にともなうヒスタミンの合成やプロテアーゼの発現,高親和性免疫グロブリンE受容体の細胞の表面での発現,プロスタグランジンD2の産生などの上昇が損なわれており,この異常は組換えIII型分泌性ホスホリパーゼA2の補充により回復した.マイクロアレイ解析の結果,マスト細胞の成熟にともない発現が上昇する約3600の遺伝子のうち,III型分泌性ホスホリパーゼA2を欠損した細胞ではその1/3にあたる約1400の遺伝子しか誘導されなかった.一方,PLA2G4Aを欠損した骨髄由来マスト細胞は脂質メディエーターをまったく産生しなかったが,ヒスタミンの遊離や線維芽細胞に依存的な成熟は正常であった.したがって,III型分泌性ホスホリパーゼA2の欠損によりマスト細胞は成熟に障害を生じるが,マスト細胞に由来する脂質メディエーターの産生の低下がその要因ではないと考えられた.
5.プロスタグランジンD2受容体であるDP1を欠損したマスト細胞は未成熟である
III型分泌性ホスホリパーゼA2の下流で機能する脂質メディエーターを同定する目的で,脂質メディエーターの合成酵素と受容体のノックアウトマウス,合計17種類に対し包括的にアナフィラキシーモデルを施行した.その結果,プロスタグランジンD2受容体のひとつであるDP1のノックアウトマウスがIII型分泌性ホスホリパーゼA2ノックアウトマウスと類似の表現型を示すことを見い出した.すなわち,DP1ノックアウトマウスはアナフィラキシーに低応答であり,組織におけるマスト細胞の数は正常であったが形態的に未成熟で,ヒスタミンの含量が低下していた.DP1を欠損した骨髄由来マスト細胞をマスト細胞を欠損したマウスに再構成してもアナフィラキシー応答の回復はみられず,マスト細胞のDP1が重要であることがわかった.野生型の骨髄由来マスト細胞におけるDP1の発現は線維芽細胞との共培養により誘導されたが,III型分泌性ホスホリパーゼA2を欠損した骨髄由来マスト細胞ではこのDP1の発現の誘導は消失した.DP1を欠損した骨髄由来マスト細胞あるいはDP1のアンタゴニストを添加した野生型の骨髄由来マスト細胞では線維芽細胞に依存したヒスタミン合成酵素の発現の誘導は起こらず,これはDP1のシグナル伝達(cAMP経路)を活性化するフォルスコリンの添加により回復した.以上の結果から,マスト細胞の成熟において,III型分泌性ホスホリパーゼA2の下流にはプロスタグランジンD2-DP1経路が位置することが明らかになった.
6.線維芽細胞のもつL型プロスタグランジンD2合成酵素はマスト細胞の成熟に重要である
ホスホリパーゼA2により切り出されたアラキドン酸をプロスタグランジンD2に変換するプロスタグランジンD2合成酵素にはH型とL型の2種類があり,H型プロスタグランジンD2合成酵素はマスト細胞に,L型プロスタグランジンD2合成酵素は線維芽細胞に発現していた.H型プロスタグランジンD2合成酵素ノックアウトマウスではアナフィラキシー応答が増悪したのに対し,L型プロスタグランジンD2合成酵素ノックアウトマウスでは改善がみられた.L型プロスタグランジンD2合成酵素ノックアウトマウスの組織のマスト細胞は数は正常であったが形態的に未熟であり,III型分泌性ホスホリパーゼA2またはDP1の欠損と類似の表現型を示した.しかしながら,L型プロスタグランジンD2合成酵素ノックアウトマウスから調製した骨髄由来マスト細胞に異常はみられず,これをマスト細胞を欠損したマウスに移植して再構成するとアナフィラキシー応答は正常に回復した.一方で,線維芽細胞のL型プロスタグランジンD2合成酵素の発現をsiRNAにより抑制,または,共培養系にL型プロスタグランジンD2合成酵素の阻害剤を添加すると,野生型の骨髄由来マスト細胞の成熟は顕著に阻害された.L型プロスタグランジンD2合成酵素の阻害剤は野生型の骨髄由来マスト細胞の共培養系における持続的なプロスタグランジンD2の産生を遮断したが,III型分泌性ホスホリパーゼA2を欠損した骨髄由来マスト細胞の共培養系ではこの持続的なプロスタグランジンD2の産生は起こらなかった.また,L型プロスタグランジンD2合成酵素ノックアウトマウスに由来する線維芽細胞は野生型の骨髄由来マスト細胞の成熟を支持できなかった.さらに,線維芽細胞におけるL型プロスタグランジンD2合成酵素の発現は野生型の骨髄由来マスト細胞との共培養により誘導されたが,III型分泌性ホスホリパーゼA2を欠損した骨髄由来マスト細胞との共培養ではこの誘導はみられなかった.以上の結果から,SCFの刺激によりマスト細胞から分泌されたIII型分泌性ホスホリパーゼA2は,線維芽細胞のL型プロスタグランジンD2合成酵素と連関してプロスタグランジンD2を産生し,このプロスタグランジンD2がマスト細胞のDP1を活性化して,マスト細胞を最終の成熟に導くものと結論した(図1).
7.III型分泌性ホスホリパーゼA2-プロスタグランジンD2経路はヒトにおいてもマスト細胞の成熟にかかわる
III型分泌性ホスホリパーゼA2はヒトにおいても組織のマスト細胞に発現していた.ヒトの肺に由来するマスト細胞と線維芽細胞とを共培養すると,マスト細胞の成熟(ヒスタミン合成酵素の発現の誘導)は顕著に誘導された.この共培養系にIII型分泌性ホスホリパーゼA2の中和抗体,L型プロスタグランジンD2合成酵素の阻害剤,または,DP1のアンタゴニストを添加すると,ヒスタミン合成酵素の発現の誘導は顕著に抑制された.このことから,ヒトのマスト細胞の成熟にもIII型分泌性ホスホリパーゼA2→L型プロスタグランジンD2合成酵素→プロスタグランジンD2→DP1経路がかかわっていることが確かめられた.
おわりに
この研究には,以下のような学術的な意義があった.1)これまで未解明であったマスト細胞の繊維芽細胞に依存的な成熟を制御する分子機構の一端を解明した.この過程を制御する分子は,これまで想定されていたサイトカインでも増殖因子でも接着分子でもなく,脂質メディエーターであるプロスタグランジンD2であった.2)DP1の欠損は喘息を改善することが知られていたが9),その分子機構は不明であった.今回の結果は,DP1がマスト細胞の成熟を介しアレルギー応答に促進的にかかわることを示すものであった.3)マスト細胞の成熟にかかわるプロスタグランジンD2のプールは,マスト細胞のもつH型プロスタグランジンD2合成酵素から瞬時に供給されるのではなく,隣接する線維芽細胞のL型プロスタグランジンD2合成酵素から持続的に供給されていた.この持続性が分化および成熟という長期の過程に重要と考えられた.また,このことは,異なる細胞集団に発現している2種類のプロスタグランジンD2合成酵素の機能的な役割分担をはじめて示したものであった.4)従来,分泌性ホスホリパーゼA2は隣接する細胞にパラクリン的に作用して脂質メディエーターの産生を増強する役割をもつものと推察されていたが10),実際にin vivoにおいて証明された例はなかった.この研究の成果は,マスト細胞から分泌されるIII型分泌性ホスホリパーゼA2がその役割を担うことをはじめて実証したものであり,長いあいだ漠然としていた分泌性ホスホリパーゼA2の存在意義がついに明らかにされた.最後に,この研究において発見されたマスト細胞の成熟を制御する脂質経路を標的とした創薬は,アレルギーの新しい治療薬あるいは予防薬の開発に結びつきうる.とくに,III型分泌性ホスホリパーゼA2はゲノムに類縁の遺伝子が存在せず,また,特異的な阻害剤が存在しないことから,新規の抗アレルギー薬の創薬標的として有望である.
文 献
- Galli, S. J. & Tsai, M.: IgE and mast cells in allergic disease. Nat. Med., 18, 693-704 (2012)[PubMed]
- Gurish, M. F. & Austen, K. F.: Developmental origin and functional specialization of mast cell subsets. Immunity, 37, 25-33 (2012)[PubMed]
- Shimizu, T.: Lipid mediators in health and disease: enzymes and receptors as therapeutic targets for the regulation of immunity and inflammation. Annu. Rev. Pharmacol. Toxicol., 49, 123-150 (2009)[PubMed]
- Uozumi, N., Kume, K., Nagase, T. et al.: Role of cytosolic phospholipase A2 in allergic response and parturition. Nature, 390, 618-622 (1997)[PubMed]
- Munoz, N. M., Meliton, A. Y., Arm, J. P. et al.: Deletion of secretory group V phospholipase A2 attenuates cell migration and airway hyperresponsiveness in immunosensitized mice. J. Immunol., 179, 4800-4807 (2007)[PubMed]
- Henderson, W. R. Jr., Chi, E. Y., Bollinger, J. G. et al.: Importance of group X-secreted phospholipase A2 in allergen-induced airway inflammation and remodeling in a mouse asthma model. J. Exp. Med., 204, 865-877 (2007)[PubMed]
- Valentin, E., Ghomashchi, F., Gelb, M. H. et al.: Novel human secreted phospholipase A2 with homology to the group III bee venom enzyme. J. Biol. Chem., 275, 7492-7496 (2000)[PubMed]
- Murakami, M., Masuda, S., Shimbara, S. et al.: Cellular distribution, post-translational modification, and tumorigenic potential of human group III secreted phospholipase A2. J. Biol. Chem., 280, 24987-24998 (2005)[PubMed]
- Matsuoka, T., Hirata, M., Tanaka, H. et al.: Prostaglandin D2 as a mediator of allergic asthma. Science, 287, 2013-2017 (2000)[PubMed]
- Murakami, M., Taketomi, Y., Miki, Y. et al.: Recent progress in phospholipase A2 research: From cells to animals to humans. Prog. Lipid Res., 50, 152-192 (2011)[PubMed]
著者プロフィール
略歴:1991年 東京大学大学院薬学系研究科博士課程 修了,1993年 米国Harvard大学 研究員,1995年 昭和大学薬学部 講師,1997年 同 准教授,2005年 東京都臨床医学総合研究所 副参事研究員(2010年 東京都医学総合研究所に改組)を経て,2013年より同 参事研究員.
研究テーマ:ホスホリパーゼA2の分子細胞生物学.
抱負:脂質研究のおもしろさと重要性を広く世の中に訴えたい.
研究室URL:http://www.igakuken.or.jp/research/project/res_prj23.html
武富 芳隆(Yoshitaka Taketomi)
東京都医学総合研究所 主任研究員.
© 2013 村上 誠・武富芳隆 Licensed under CC 表示 2.1 日本